Osmoza


Osmoza(premagrč.ὠσμός:guranje, tiskanje) jedifuzijakojom se izjednačujukoncentracijauotopiniiotapalu,odnosno koncentracije dviju otopina različitih koncentracija, međusobno odijeljenihpolupropusnom membranom,to jest takvom koja propušta otapalo, ali zaustavlja otopljenutvar.U novonastaloj otopini, odnosno u otopini veće koncentracije, nastaje pri osmozi povišenjetlakakoje se naziva osmotski tlak; njegova je jačina proporcionalna koncentraciji otopine. Osmoza se javlja u biljnim i životinjskim organizmima, gdje stanične membrane imaju svojstvo polupropusnosti, a postoji razlika u koncentraciji otopine unutar i izvanstanice.[1]
Osmozaje proces u kojem polupropusnamembranaodvaja dvije otopine različitih koncentracija. Polupropusna membrana propuštamolekuleotapala dok ne propušta čestice otopljenih tvari (ioneili molekule). Molekule otapala se zbog razlike ukoncentracijamaotopina gibaju s mjesta manje koncentracije prema mjestu veće koncentracije. Proces ima težnju odvijanja sve do izjednačenja koncentracija s obje strane membrane; manje koncentrirana otopina postaje koncentriranija, više koncentriranoj otopini se smanjuje koncentracija. Pojava se može najjednostavnije objasnitikinetičkom teorijomi činjenicom da na strani otopine s manjom koncentracijom otopljenih tvari ima više molekula otapala (vode) koje zato prelaze na stranu s manje molekula otapala.
Pri prolasku molekula otapala kroz membranu dolazi do porastavolumenaotopine na jednoj strani membrane i smanjenja volumena otopine na drugoj strani. Porast volumena otopine na jednoj strani stvarahidrostatski tlakkoji se suprotstavlja osmozi, to jest osmotskom tlaku koji djeluje na membranu. Kada se ova dva tlaka izjednače, uspostavit će se dinamična ravnoteža, to jest više neće doći do podizanja razine otopine, dok molekule otapala i dalje prolaze kroz membranu ali u oba smjera jednako intenzivno. Tlak pri kome se uspostavlja ova ravnoteža naziva se efektivni osmotski tlak. Osmotski je tlak veći što je razlika koncentracija otopina veća, i obrnuto. Molekule otapala se gibaju iz otopine s nižom (hipotonična otopina) u otopinu s višom koncentracijom otopljene tvari (hipertonična otopina). Osmozu možemo promatrati kao poseban slučajdifuzije.Osmolaritet je relativna koncentracija otopljene tvari u sredini u kojoj se nađestanica.
Difuzija se ne zbiva samo između kemijskih tvari koje se dodiruju, nego također između tvari koje su odijeljene nekom pregradom, odnosnomembranom.Osim toga, difuzija tekućine može postojati i kroz pregrade nasuprotsili teži,i to s izvjesnimtlakomkoji se naziva osmotski tlak. Ako na primjer odijelimo otopinumodre galicei vodu nekom membranom (na primjer životinjskim mjehurom) vidjet ćemo da voda mnogo brže prodire kroz membranu u modru galicu nego modra galica u vodu.Vodaće dotle prodirati dok ne nastupi ravnoteža izmeđuhidrostatskogi osmotskog tlaka.
Difuzija kroz propusne ili polupropusne membrane (stijenke) naziva se osmoza. Tlak koji zbog različite koncentracije otopina tjera tekućinu u smjeru veće koncentracije naziva se osmotski tlak. Pri dodiru dviju tekućina različitih koncentracija tekućine nastoje svoju koncentraciju izjednačiti difuzijom. Budući da molekule modre galice ne mogu tako brzo prolaziti kroz polupropusnu membranu u vodu, to se koncentracija izjednačuje na taj način da voda prodire u otopinu modre galice i njezinu koncentraciju izjednačuje.
Osmotski tlak je kod nekih otopina vrlo velik, tako je na primjer kodšećerneotopine60 000N/mm2(0,6bar). Osmoza je važna za žive organizme. Stijenke stanica su opne koje propuštaju samo one tvari koje su organizmu potrebne za hranu.[2]
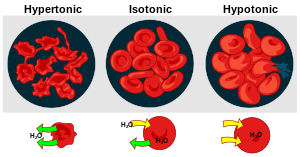
Osmoza ustanicinastupa zbog razlike u osmolaritetucitoplazmes unutrašnje, i otopine s vanjske strane membrane, što dovodi do smežuravanja ili bubrenja stanice. Češća pojava bubrenja ilizestanice nastupa zbog veće koncentracije otopljenih iona i malihorganskihmolekula u stanici, zbog čega je ona hipertonična u odnosu na svoju okolinu, pa voda ulazi u stanicu. Stanice se problemu visokog osmolariteta prilagođavaju, ovisno ocarstvukojem pojedini organizam pripada:
- Stanicebiljaka,alga,gljiva,i većinebakterijaobavijene sustaničnom stijenkomkoja je dovoljno čvrsta da spriječi rasprsnuće stanice u hiptonočnoj otopini. U njima se, zbog ulaska vode, stvaraturgorski tlakkoji onu količinu vode koja uđe tjera van, pa su biljna tkiva iznimno jaka. U hipetoničnoj otopini izlazak vode uzrokuje odvajanje membrane od stanične stijenke, te dovodi do procesaplazmolizei uvenuća biljke.
- Životinjskestanice problem osmolariteta rješavaju aktivnim izbacivanjemanorganskihiona i smanjivanjem razlike u koncentracijama otopljenih tvari (prvenstvenonatrija) između stanice i njezine okoline (natrij-kalijeva crpka ili Na|K crpka). Pri tome troše značajne količine energije.

1:Ulazmorske vode,
2:Izlazslatke vode(40%),
3:Otpadnavoda (60%),
4:Protokmorske vode (60%),
5:Koncentrirani odvod (gušći od morske vode),
A:Protočnacrpka(40%),
B:Protočna crpka,
C:Uređaj za povratnu osmozu s polupropusnom membranom,
D:Izmjenjivač tlaka.
Povratna osmoza,obrnuta osmozailireverzna osmozaje metoda koja služi za dobivanjepitke vodeizslane vode.Postupak koristi polupropusnu membranu kroz koju prolazi čista voda a zaostajusoli.Tlakslane vode mora biti oko 25bar,što ovu metodu čini skupom za proizvodnju većih količina svježe vode. Kloridi,amonijakiugljikov dioksidsu malemolekulepa prolaze polupropusnu membranu, te ih treba naknadno uklonitiaktivnim ugljenom.Nekebakterijeivirusitakoder prolaze polupropusnu membranu, pa i njih treba dezinficirati (kloriranje,ozon,UVsvjetiljka,sunčeva dezinfekcija).[3]
Povratna osmoza ili reverzna osmoza je skoro savršen procesfiltriranjavode. Ovaj proces omogućuje odstranjivanje najsitnijih čestica iz vode. Povratna osmoza se koristi zapročišćavanje vodei odstranjivanje neorganskihminerala,solii ostalih nečistoća u cilju poboljšanja izgleda, ukusa i ostalih svojstava vode. Tako se dobiva kvalitet voda za piće koji zadovoljava svestandardevoda za piće. Nakon poznatih načina prečišćavanje vode industrijskom filtracijom (gradski vodovod i tvornice), prokuhavanjem i kloriranjem, došlo se do tehnički skoro savršenog načina filtriranja vode, koji gotovo od svake zagađene vode može načiniti zdravu pitku voda. Osmotske membrane koje se koriste u ovom postupku imaju toliko sitne otvore da kroz njih mogu proći gotovo samomolekulečiste vode, a sve nečistoće ostaju na membrani i izbacuju se preko odvoda kao tehnička otpadna voda. Ovakvim načinom filtracije vode dobiva se voda za piće visoke kvalitete, koja se može koristiti i umedicinskesvrhe (voda za bebe).[4]
- ↑osmoza,[1]"Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, enciklopedija.hr, 2017.
- ↑Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
- ↑[2]"Reverzna osmoza", Englesko-hrvatski kemijski rječnik & glosar, glossary.periodni, 2012.
- ↑[3][neaktivna poveznica]"Kondicioniranje vode", grad.unizg.hr, 2012.