Nitrit
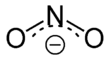

Anitritionszervetlenanion,képleteNO2−.A benne található N–O kötések egyenlő hosszúak, és egymással nagyjából 120°-os szöget zárnak be. Egy proton hozzáadásával jön belőle létre a nem stabilsalétromossav,mely gyenge sav. A nitritet oxidálni és redukálni is lehet. A reakció terméke a használt oxidáló- vagy redukálószer anyagi minőségtől és erősségétől is függ. A nitrition ambidentátligandum,a komplexekben legalább öt különböző módon koordinálódhat.[1]A nitrition a biokémiában is fontos szerepet játszik, az erős értágító hatásúnitrogén-monoxidkiindulási anyaga. A nitritet húsok besózásához, füstöléséhez is használják. A szerves kémiában a NO2-csoport a salétromsavas észterekben és anitrovegyületekbenszerepel.
A nitrition
[szerkesztés]Nitritsók
[szerkesztés]Anátrium-nitritetiparilag úgy állítják elő, hogy „nitrózus gázokat” vezetneknátrium-hidroxidvagynátrium-karbonátvizes oldatába.[1]
- NO + NO2+ 2NaOH (vagy Na2CO3) → 2NaNO2+H2O (vagy CO2)
A terméket átkristályosítással tisztítják. Az alkálifémek nitritjei olvadáspontjukig (a KNO2-é 441 °C) vagy annál magasabb hőmérsékletig is stabilak. Azammónium-nitritelőállíthatódinitrogén-trioxidból,mely formálisan a salétromossavanhidridje:
- 2NH3+ H2O +N2O3→ 2NH4NO2
Melegítés hatására ez a vegyület robbanásszerűen bomolhat.
A szerves kémiában a nitriteketdiazotálásireakciókban alkalmazzák.
Szerkezete
[szerkesztés]
A nitrition szimmetrikus felépítésű (a C2vpontcsoportba tartozik), a két N–O kötése egyenlő hosszúságú. Avegyértékkötés-elméletleírása szerint olyan rezonáns hibrid, melynek két kanonikus alakja egymás tükörképe. Amolekulapálya-elméletszerint mindkét oxigénatomszigma-kötésselkapcsolódik a nitrogénatomhoz, továbbá a nitrogén- és az oxigénatomoknak a molekula síkjára merőleges p-pályáiból delokalizáltpi-kötésalakul ki. Az ion negatív töltése egyenlő mértékben oszlik meg a két oxigénatom között. A nitrogén- és a két oxigénatom is egy-egy nemkötő elektronpárral rendelkeznek, így a nitritionLewis-bázis.A fémionokkal szemben így ambidentát ligandumként viselkedhet: akár az oxigén-, akár a nitrogénatom képes a nemkötő elektronpárjával koordinálódni.
Sav-bázis tulajdonságok
[szerkesztés]
Vizes oldatokban asalétromossavgyenge savnak számít.
A salétromossav nagyon illékony – gázfázisban leginkább a sík szerkezetű transz-formában fordul elő. Oldatban instabil, az alábbi diszproporcionálódási reakció játszódik le:
- 3HNO2(aq) ⇌ H3O++ NO3-+ 2NO
0 °C-on ez a reakció lassan játszódik le.[1]Anitrogén-monoxidegyik laboratóriumi előállítási módja az, hogy nitrites oldathoz redukálószer – például vas(II) – jelenlétében savat engednek.
Oxidáció és redukció
[szerkesztés]A nitrogénatom oxidációs száma a nitritben +3. Ez azt jelenti, hogy oxidációval +4 vagy +5 is lehet ez az érték, de redukcióval akár −3-ig is csökkenthető. Az alábbi táblázat néhány, a salétromossavat közvetlenül tartalmazó reakció redoxpotenciálját adja meg.[3]
Félreakció E0/V NO3-+ 3H++ 2e-⇌ HNO2+ H2O +0,94 2HNO2+ 4H++ 4e-⇌ H2N2O2+ 2H2O +0,86 N2O4+ 2H++ 2e-⇌ 2HNO2 +1,065 2HNO2+ 4H++ 4e-⇌ N2O + 3H2O +1,29
Az adatokat ki lehet bővíteni, hogy alacsonyabb oxidációs számú termékeket is mutasson. Például:
- H2N2O2+ 2H++ 2e-⇌ N2+ 2H2O; E0= 2,65 V
Az oxidációs folyamatok végén általábannitrátionjön létre, melyben a nitrogén oxidációs száma +5. Apermanganáttaltörténő oxidáció például felhasználható a nitrit (titrálással történő) mennyiségi elemzéshez.
- 5NO2-+ 2MnO4-+ 6H+→ 5NO3-+ Mn2++ 3H2O
A redukciós folyamatok terméke attól függ, milyen és mennyire erélyes redukálószert használunk. Hakén-dioxidothasználnak, a termék NO és N2O; ón(II) alkalmazásával H2N2O2hiposalétromossav jön létre;hidrogén-szulfidothasználva egészenammóniáigmegy a redukció. Ha N2H5+hidraziniumkationnal végezve a redukciót a robbanékonyhidrogén-azid(HN3) keletkezik:
- HNO2+ N2H5+→ HN3+ H2O + H3O+
Mely tovább reagálhat nitrittel:.
- HNO2+ HN3→ N2O + N2+ H2O
Ez a reakció annyiban szokatlan, hogy négyféle oxidációs számú nitrogént tartalmazó vegyületek szerepelnek benne.[1]
Koordinációs komplexek
[szerkesztés]A nitrition legalább öt különféle úton tud kötéseket kialakítani.[1]
- Ha a nitrogén a központi fémionhoz kapcsolódik, akkornitro-komplex jön létre.
- Ha az egyik oxigén koordinálódik a központi ionhoz, akkor nitrito- komplex alakul ki.
- Ha mindkét oxigénatom egy központhoz kapcsolódik, akkor kelát komplex keletkezik.
- A nitrition aszimmetrikus hídként is kapcsolódhat két fémionhoz: az egyikkel a nitrogén, a másikkal az egyik oxigén létesít kapcsolatot.
- Egy oxigénatom hídként kapcsol össze két fémiont.
Alfred Wernerbehatóan tanulmányozta a nitro-nitroizomériát(1. és 2. kötési mód). A kobalt-pentaminnak nitrittel létrehozott vörös izomere nitrito komplex, [Co(NH3)5(ONO)]2+;ezmetastabil,és átizomerizálódik a sárga nitrovegyületté: [Co(NH3)5(NO2)]2+. Nitritet tartalmazó kelát komplexre (3-as kötési mód) példa: [Cu(bipy)2(O2N)]NO3,ahol a „bipy” a2,2'-bipiridilbidentát ligandum. Ebben a komplexben a két bipy ligandum a rézion négy koordinációs helyét foglalja el, így a nitritnek két helyen kell kötődnie, hogy a rézion körül oktaéderes elrendeződés alakuljon ki.
Nitrit a biokémiában
[szerkesztés]Ahúsokbesózásához nátrium-nitritet használnak, mivel ez megakadályozza a baktériumok elszaporodását, és a húsban lévőmioglobinnalvonzó sötétvörös színt kölcsönöz neki. A nitrit viszonylag erősen mérgező volta miatt a húsokban csak 200milliomod résznyi(ppm) nitrit lehet. A halálos dózis ember esetén 1 kg testtömegre vetítve 22 mg. Bizonyos körülmények között – ilyen például a főzés – a húsban lévő nitritek azaminosavakbomlástermékeivel ismert rákkeltő anyagokká,nitrózaminokkáalakulhatnak.[4]
A nitrit jelenlétét aGriess-teszttellehet kimutatni és elemezni. A reakció során a NO2−tartalmú mintábólszulfanilsavés naftil-1-amin hatására savas közegben mélyvörös azovegyület keletkezik.[5]A nitritet számosbaktériumképesammóniávávagynitrogén-monoxiddáredukálni. Oxigénhiányos környezetben a nitritből nitrogén-monoxid alakulhat ki, mely értágítóként viselkedik. Több mechanizmust is leírtak a nitrit-NO átalakulásra: xantin-oxidoreduktáz, nitrit-reduktáz vagy NO-szintáz hatására végbemenő enzimatikus redukció, illetve savas közegben végbemenő nem enzimatikus diszproporciós reakció.
Szerves nitritek és nitrovegyületek
[szerkesztés]

Aszerves kémiábana nitritek a salétromossavészterei,melyek nitrozoxifunkciós csoportottartalmaznak. A nitrovegyületekben C-NO2csoport található. A nitritek általános képlete RONO, ahol Raril-vagyalkilcsoport.Amil-nitritetvagy más alkil-nitritet szívbetegségekre ható gyógyszerekben alkalmaznak. Alkil-nitriteket általában a Meyer-szintézissel állítanak elő,[6][7]melynek soránalkil-halogenidés fém-nitrit reakciójában nitroalkánok és nitritek keveréke keletkezik.
Anitrovegyületekegyik egyszerű példája anitrobenzol.Az aromásnitrálásireakcióban egy C−H kötés felhasad, és a kötő elektronpár a szénatomon marad. Ez a két elektron addícionál a nitróniumionra.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben aNitritecímű angol Wikipédia-szócikkezen változatánakfordításán alapul.Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑abcdeGreenwood, pp 461-464
- ↑IUPAC SC-DatabaseArchiválva2017. június 19-idátummal aWayback Machine-ben A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ↑Greenwood, p 431
- ↑Jakszyn P, Gonzalez CA (2006. július 21.). „Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence”.World J Gastroenterol12(27), 4296–4303. o.PMID16865769.
- ↑V. M. Ivanov (2004). „The 125th Anniversary of the Griess Reagent”.Journal of Analytical Chemistry59(10), 1002–1005. o.DOI:10.1023/B:JANC.0000043920.77446.d7.Translated fromV. M. Ivanov (2004). „”.Zhurnal Analiticheskoi Khimii59(10), 1109–1112. o.
- ↑Victor Meyer(1872). „Ueber die Nitroverbindungen der Fettreihe”.Justus Liebig's Annalen der Chemie171(1), 1–56. o.DOI:10.1002/jlac.18741710102.;Victor Meyer, J. Locher (1876). „Ueber die Pseudonitrole, die Isomeren der Nitrolsäuren”.Justus Liebig's Annalen der Chemie180(1-2), 133–155. o.DOI:10.1002/jlac.18761800113.;V. Meyer and Stüber (1872). „Vorläufige Mittheilung”.Chemische Berichte5,203–205. o.DOI:10.1002/cber.18720050165.;Victor Meyer, O. Stüber (1872). „Ueber die Nitroverbindungen der Fettreihe”.Chemische Berichte5,399. o.DOI:10.1002/cber.187200501121.;Victor Meyer, A. Rilliet (1872). „Ueber die Nitroverbindungen der Fettreiche. Dritte Mittheilung”.Chemische Berichte5,1029–1034. o.DOI:10.1002/cber.187200502133.;Victor Meyer, C. Chojnacki (1872). „Ueber die Nitroverbindungen der Fettreihe. Vierte Mittheilung”.Chemische Berichte5,1034–1038. o.DOI:10.1002/cber.187200502134.
- ↑Robert B. Reynolds, Homer Adkins (1929). „The Relationship of the Constitution of Certain Alky Halides to the Formation of Nitroparaffins and Alkyl Nitrites”.Journal of the American Chemical Society51(1), 279–287. o.DOI:10.1021/ja01376a037.
