Atomfizika

Azatomfizikaafizikaegyik alapvető ága, amely az anyagatomosszerkezetével, annak törvényszerűségeivel, a makroszkopikus anyagjellemzők mikroszkopikus magyarázataival foglalkozik.
Az atomfizika szoros kapcsolatban áll többek között akémiával,azanyagtudománnyal,aszilárdtestfizikával,elméleteit akvantummechanikaposztulátumaira alapozza. Elméletei, illetve kísérleti módszerei összefüggnek amolekulafizikáéival.Az atomfizika továbbá kapcsolatban áll azoptikával,mivel egyrészt magyarázza annak sok fontos alapjelenségét, továbbá az optika fontos kísérleti eszközöket biztosít az anyag szerkezetének megismerésére.[1]
Legismertebb művelői közé tartozikDalton,Thomson,Rutherford,Bohr,Born,Fermi,illetveHartree.A 20. század kiemelkedő magyar atomfizikusai példáulKovács IstvánésBay Zoltán.
Elnevezése[szerkesztés]
Bár sok atomfizikai szakkönyvben közölnek kitekintésszerűmagfizikaibevezetőt, az atomfizika tárgyköréhez nem tartozik szorosan az atommagok jellemzése. Annak módszerei, modelljei, témái az atomfizikáéitól eltérnek.
Továbbá megjegyzendő, hogy egyes magfizikával kapcsolatos szakkifejezések magyar köznyelvben élő változata is utal nevében az atomfizikára, mely félreértéshez vezethet. Ilyen kifejezés például anukleáris fegyverreazatombomba,de például a szaknyelvben isatomerőműneknevezik amaghasadásonalapuló energiatermelő létesítményt,atomreaktornakpedig ezen létesítmény fő elemét, továbbá sok magfizikusra (pl.Teller Ede,Szilárd Leó) a köznyelvben atomfizikusként hivatkoznak.
Témái[szerkesztés]
Izolált atomok modelljei[szerkesztés]
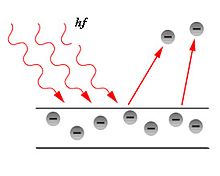
Az atomfizika elsődleges témája az anyag építőköveinek, az atomoknak a leírása. Elméleteivel ezek felépítését éselektronszerkezeténekenergiaállapotait magyarázza. Bár nem elsődleges célja az atomi kölcsönhatások leírása, fontos alapul szolgál azatomi kötésekettárgyaló molekulafizika és a tömbi anyag jellemzőit leírószilárdtestfizikaszámára. Azonban az izolált atomok modelljeinek vannak közvetlenül észlelhető következményei is, például jól jellemzik a gázok vonalasszínképvonalait,afényelektromos jelenséget,azAuger-effektuststb. Azelektronhéjakjellemzésével lehetőséget ad a fény és az anyag kölcsönhatásainak megértésére, a szerkezetre vonatkozó modellek pedig például aszóráskísérletek,például aCompton- és aThomson-szórásmagyarázatára születtek.
Az anyag atomos szerkezete[szerkesztés]
Azanyagotfelépítő atomokelektronjaiáltal képviselt karakterisztikus energiaszinteket az atommodellek adják meg. Ezek segítségével bizonyos anyagi folyamatok és jelenségek magyarázhatók, így az atomfizika nem csak az izolált atom kölcsönhatásainak leírásához nyújt alapot, de a tömbi anyag egyes jelenségeit is atomfizikai elvekből lehet levezetni.
Az atomi elektronpályák leírása során az atomfizika definiálja az alapállapot, a kötött, és a gerjesztett állapot fogalmát, melyekkel értelmezi azionizációt,a legerjesztődést, egyes kémiai folyamatokat stb. Az atomi átmenetek tárgyalásánál meghatároz megengedett és tiltott átmeneteket, melyek aspektroszkópiaivizsgálatok során alapvető jelentőségű anyagjellemzők.
Története[szerkesztés]
Atomizmus az ókorban[szerkesztés]
Az elv, hogy az anyagot apró részecskék építik fel, igen régi: az ókorban Indiában és Görögországban is megjelent. Maga az atom kifejezésLeukipposztól,ésDémokritosztólszármazik, ahogy agörög atomizmuselve is. Ez még nem a mai értelemben vett, kísérleteken és elméleteken alapuló atomfizikai elképzelés volt, inkább filozófiai-teológiai érvrendszer. A 19. századi atomelméletek ennek megfelelően alig kapcsolódtak az ókori atomizmushoz.
A modern atommodellek előzményei[szerkesztés]
Az atomelmélet egyik legfontosabb hipotézisétAvogadro(1811) tette, eszerint azonos hőmérsékletű és nyomású gázok azonos térfogatai egy azon számú molekulát foglalják magukban. Hőtani összefüggés szerint a Boltzmann-állandó és az Avogadro-állandó közti összefüggés:,így R (univerzális gázállandó - 8,31 J/mol·K) ismeretében NAkiszámítható.
1827-benRobert Brownfigyelte meg folyadékban szuszpendált pollenszemcsék jellegzetes véletlenszerű mozgását, s bár a megfigyelteket fizikailag nem magyarázta, a jelenséget róla neveztékBrown-mozgásnak.Egy évszázaddal később Einstein egy dolgozatában magyarázatot adott a Brown-mozgásra, egészen egzaktul azonban Wiener írta le (1918) valószínűségszámítási módszerekkel (néha ezért a Brown-mozgást Wiener-folyamatnak is nevezik).
Thomson-atommodell[szerkesztés]
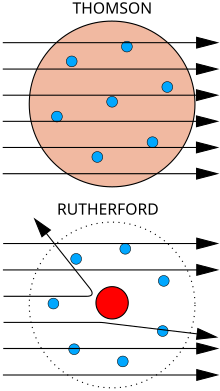
AThomson-féle atommodellazt feltételezte, hogy az atom teljes térfogatát egy pozitív töltésű térrész alkotja, melyben pontszerűen találhatók az elektronok. Ez ugyan megmagyarázta, hogy az atom kívülről semleges töltésű, de számos hiányosságot mutatott, egyes szóráskísérletek sem voltak magyarázhatóak ezen modell alapján.
Rutherford-atommodell[szerkesztés]
1911-ben Rutherford olyan kísérletet mutatott be, mely szerint az atom az addig feltételezett kompakt szerkezeti elképzelésétől teljesen eltér. A kísérletbenalfa-részecskearanyfólián való szóródását vizsgálta, melynek eredményeképpen megállapítható volt, hogy az α-részecskék csak igen kis hányada szenvedett nagy mértékű elhajlást (visszaszórást), nagyobb hányaduk irányváltoztatás nélkül haladt át a fólián. Ez arra utalt, hogy az atom belsejében a töltések elrendeződése a Thomson-modellel ellentétben igen egyenetlen: egy kicsi, pozitív töltésű magot egy nagy térrész vesz körül, melyben negatív elektronok találhatók. Feltételezte, hogy a mag csupán mintegy 3000-ed része a teljes atomsugárnak, az elektronok pedig aCoulomb-vonzásrévén kerülnek pályájukra.
Bohr-modell[szerkesztés]
1913-ban Bohr új alapra helyezte az atommodelljét. Az akkor még nem teljesen tisztázott kvantumelmélet posztulátumaira alapozva dolgozta ki elméletét a legegyszerűbb atom esetére. Ekkor jött létre ahidrogénatommodellje, mely választ adott többek közt a hidrogén vonalas színképének létrejöttére, illetve a színképben látható frekvenciák által reprezentált energiaszintek eredetére. Eredményei sok ellentmondást oldottak fel, például az elektronpályák és az atommag közti energetikai viszonyt illetően.
Sommerfeld-sorfejtés[szerkesztés]
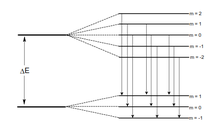
A Sommerfeld-féle atommodell létrejöttének előzményei aZeeman- és aStark-effektusértelmezése iránti igény volt. 1914-ben J. Stark egyik dolgozatában számolt be kísérleti eredményeiről, melyek a hidrogén színképvonalainakelektromos erőtérbentörténő felhasadását tanulmányozta. Ezen megfigyelésre támaszkodva Sommerfeld továbbfejlesztette a Bohr-modellt, a körpályákon kívül ellipszispályákat is megengedett. Az állapotokat itt már három kvantumszám jellemezte, s alkalmasnak látszott magasabb rendszámú elemek leírására is.
De Broglie-hipotézis[szerkesztés]
Az 1920-as évekre a fizikusok rájöttek, hogy a Bohr-elmélet számos hiányosságot mutat: például hogyan lehet magyarázni, hogy csak bizonyos energiaszintek lehetségesek, vagy miért vannak egy elem minden atomjának ugyanazon tulajdonságai, annak ellenére, hogy egy atomban lévő elektronok elvileg végtelen variációs számú helyzettel és hozzá tartozó sebességgel rendelkezhetnek. Nem adott választ többek között a több elektronnal rendelkező atomok abszorpciós és emissziós tulajdonságaira, valamint túlhangsúlyozta az anyag részecske mivoltát.
Az elemi részek kettős természetére vonatkozó hipotézist először de Broglie vetette fel 1924-ben, és dolgozatában már akkor feltette, hogy ez valószínűleg általános érvényű lehet minden anyagi részecskére: De Broglie szerint minden anyagra és sugárzásra is igaz, hogy a részecske E energiája és annak f frekvenciája közötti kapcsolatot az Einstein által a fotonra felírt, majd Planck által általánosított
összefüggés írja le.
E szerint a részecske p impulzusa és λ hullámhossza közötti kapcsolatot a
de Broglie egyenlet fejezi ki, ahol h aPlanck-állandó.

aholEa teljesrelativisztikusenergia,ha Planck állandó (6,63·10−34Js). Később elektronnyalábbal végzettinterferométeresvizsgálatokkal igazolták de Broglie-hipotézisének helyességét, sőt kimutatták, hogy proton- és atomnyalábokkal is hasonló jelenség játszódik le.
A de Broglie-hipotézistDavisson és Germerelektronnyaláb nikkel egykristályon történő diffrakciójával vizsgálták, ez hasonló alapkoncepción alapul, mint a röntgensugarak kristályrácson való elhajlása. A kísérletben az intenzitás változását vizsgálták a gyorsítófeszültség függvényében, és azt találták, hogy azelektronhullámokegymással interferálnak, ezzel igazolták az anyaghullám elméletet.
A részecske-hullám dualizmus egyik következménye és akvantummechanikalegfontosabb aspektusa, amit de Broglie publikációi nyománHeisenbergdolgozott ki (1927), az ún.határozatlansági reláció.Ebben a modellben tulajdonképpen a Bohr-féle atommodell továbbfejlesztéséről van szó, amely Heisenberg és t szimultán tetszőleges pontossággal nem lehet meghatározni, ennek mértéke,,.
Kvantummechanikai atommodell[szerkesztés]
A de Broglie-féle modell továbbfejlesztésére irányuló törekvések 1926-ban értek célba, ekkor jelent megSchrödingerúj, hullámmechanikai alapvetéseiről szóló tanulmánya ésHeisenbergmátrix mechanikai elmélete. Sokan úgy gondolják, hogy e két rendszer egyesítése hozta létre a kvantummechanikát mint tudományágat. Az új modell nem vett figyelembe számos akkor már létező jelenséget, többek között az elektronspin létezését, és nem számolt a relativitáselmélet posztulátumaival sem. Később ezt a hiányosságotDiracpótolta anemrelativisztikus kvantumelmélettel, melyben a legtöbb ellentmondás feloldódott. A klasszikus tárgyalásmód mégis a Schrödinger-féle interpretáció. Ebben azUkülső potenciáltérben mozgómtömegű elemi részecskéhez egy olyan Ψ (x,y,z,t)hullámfüggvénytrendelünk, mely kielégíti a
egyenletet. Ez az időtől függő Schrödinger-egyenlet. Azállapotfüggvénybőlképzett ΨΨ* mennyiség az elektron tömegsűrűségét jelenti, ennek értelmében az egyes elemi részecskét nem pontszerűnek tekintjük, hanem egy tömeg-sűrűségfüggvénnyel leírt tömegkontinuumnak. Ennek értelmében Schrödinger az atomot az atommagként és az akörül folytonosan eloszlatott elektronfelhő rendszereként írja le. A Schrödinger-egyenletből - a kontinuitási tételhez hasonlóan - amegmaradási tételvezethető le, mely a következő alakban írható le:,
ittJaz áramlás sűrűségére jellemző mennyiség. Noha ezen értelmezés számos fizikai problémára magyarázatot ad, néhány meggondolás arra enged következtetni, hogy az elemi részek oszthatatlanságára vonatkozó tapasztalati tény ellentmondásba kerülhet, ily módon az elmélet egyes interpretációival.
Az egyik legfontosabb kvantummechanikai modell alineáris harmonikus oszcillátor,amely molekulák vibrációs tulajdonságait, afononviselkedését és több fizikai rendszer leírását könnyíti meg. Itt nem részletezendő számítások során azt kapjuk, hogy atomi (elemi) rendszereknél az energia kvantáltságának legkisebb értéke arányos az (elemi) frekvenciával:,
amely azérusponti energia,ami összhangban van a kísérleti számított értékekkel, mely szerint a fény intenzitása a hőmérséklet csökkenésével nem zérushoz, hanem egy véges értékhez tart.
Neves atomfizikusok[szerkesztés]
- A klasszikus atomfizika képviselői
- Modern atomfizikusok
Szakfolyóiratok[szerkesztés]
Az alkalmazott fizikai kutatásban és alapkutatásban használatos szakfolyóiratok közül az alábbiaknak kiemelt témája az atomfizika:
Jegyzetek[szerkesztés]
Források[szerkesztés]
- Kiss Dezső:Kísérleti atomfizika: Egyetemi tankönyv.Budapest: ELTE Eötvös Kiadó. 1998.ISBN 978-963-463-166-8
- Hevesi:Bevezetés az atomfizikába: Atomhéjfizika [egyetemi tankönyv].Szeged: JATEPress. 2013.ISBN 978-963-315-114-3
- Lecture schedule and course notes.physics.bu.edu.(Hozzáférés: 2017. április 24.)
- Dr. Budó Ágoston – Dr. Mátrai Tibor – Hornyák László:Kísérleti fizika III. kötet: Optika és atomfizika.Budapest: Nemzeti Tankönyvkiadó. 1999.ISBN 963 19 0309 5Hozzáférés: 2017. április 25.
További információk[szerkesztés]
- ELTE Fizikai Intézet.fizika.elte.hu.[2017. február 28-i dátummal azeredetibőlarchiválva]. (Hozzáférés: 2017. április 24.)









