Atom
| Atom helium | |
|---|---|
 Ilustrasi atomheliumyang memperlihatkaninti atom(merah muda) dan distribusiawan elektron(hitam). Inti atom (kanan atas) berbentuk simetris bulat, walaupun untuk inti atom yang lebih rumit ia tidaklah selalu demikian. | |
| Klasifikasi | |
| Satuan terkecil unsur kimia | |
| Sifat-sifat | |
| Kisaran massa | 1,67 × 10−27sampai dengan 4,52 × 10−25kg |
| Muatan listrik | nol (netral) ataupun muatanion |
| Kisarandiameter | 62pm(He) sampai dengan 520 pm (Cs) |
| Komponen | Elektrondaninti atomyang terdiri dariprotondanneutron |
Atomadalah bagian yang sangat kecil dari segala sesuatu di alam semesta (materi), yang terdiri atasinti atomsertaelektron-elektron yang mengelilingi inti atom. Inti atom terdiri atasneutrondanproton(di mana jumlah proton dalam atom menentukanjenis dari sebuah atom,misal atom oksigen terdiri dari 8 proton, dan atom karbon terdiri dari 6 proton). Elektron-elektron pada sebuah atom terikat pada inti atom olehgaya elektromagnetikdi mana proton yang bermuatan positif di inti atom menarik elektron yang bermuatan negatif di sekelilingnya (sama seperti magnet yang menarik magnet yang lain). Inti atom juga terdiri darineutronyang bermuatannetral(kecuali pada inti atomHidrogen-1,yang tidak mempunyai neutron). Atom-atom bisa berikatan satu sama lain yang mana atom-atom berikatan itu kemudian dinamakanmolekul). Sebuah molekul bisa terdiri dari atom dengan jenis yang sama (misal sebuah atom oksigen berikatan dengan satu atom oksigen lain untuk membentuk molekul oksigen / O2) atau atom-atom dengan jenis yang berbeda (misal sebuah atom oksigen dengan 2 buah atom hidrogen bergabung untuk membentuk molekul air / H2O). Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan disebut sebagaiion.Atom dikelompokkan berdasarkan jumlah proton dan neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom menentukanunsur kimiaatom tersebut, dan jumlahneutronmenentukanisotopunsur tersebut.
Istilah atom berasal dari kata sifatBahasa Yunaniἄτομος (átomos, "tak terbagi” ) sehingga atom berarti sesuatu yang tidak dapat dipotong atau dibagi-bagi lagi. Konsep atom sebagai komponen yang tak dapat dibagi-bagi lagi pertama kali diajukan oleh para filsufIndiadanYunani.Pada abad ke-17 dan ke-18, parakimiawanmeletakkan dasar-dasar pemikiran ini dengan menunjukkan bahwa zat-zat tertentu tidak dapat dibagi-bagi lebih jauh lagi menggunakan metode-metode kimia. Selama akhir abad ke-19 dan awal abad ke-20, parafisikawanberhasil menemukan struktur dan komponen-komponen subatom di dalam atom, membuktikan bahwa 'atom' tidaklah tak dapat dibagi-bagi lagi. Prinsip-prinsipmekanika kuantumyang digunakan para fisikawan kemudian berhasil memodelkan atom.[1]
Dalam pengamatan sehari-hari, secara relatif atom dianggap sebuah objek yang sangat kecil yang memiliki massa yang secara proporsional kecil pula. Atom hanya dapat dipantau dengan menggunakan peralatan khusus sepertimikroskop gaya atom.Lebih dari 99,9% massa atom berpusat pada inti atom,[catatan 1]dengan proton dan neutron yang bermassa hampir sama. Setiap unsur paling tidak memiliki satu isotop dengan inti yang tidak stabil, yang dapat mengalamipeluruhan radioaktif.Hal ini dapat mengakibatkantransmutasi,yang mengubah jumlah proton dan neutron pada inti.[2]Elektron yang terikat pada atom mengandung sejumlaharas energi,ataupunorbital,yang stabil dan dapat mengalami transisi di antara aras tersebut dengan menyerap ataupun memancarkanfotonyang sesuai dengan perbedaan energi antara aras. Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur, dan memengaruhi sifat-sifatmagnetisatom tersebut.
Sejarah
Konsep bahwa materi terdiri dari satuan-satuan terpisah yang tidak dapat dibagi lagi menjadi satuan yang lebih kecil telah ada selama satumilenium.Namun, pemikiran tersebut masihlah bersifat abstrak dan filosofis, daripada berdasarkan pengamatanempirisdaneksperimen.Secara filosofis, deskripsi sifat-sifat atom bervariasi tergantung pada budaya dan aliran filosofi tersebut, dan sering kali pula mengandung unsur-unsur spiritual di dalamnya. Walaupun demikian, pemikiran dasar mengenai atom dapat diterima oleh para ilmuwan ribuan tahun kemudian, karena ia secara elegan dapat menjelaskan penemuan-penemuan baru pada bidang kimia.[3]
Referensi paling awal mengenai konsep atom dapat ditilik kembali kepada zamanIndia kunopada tahun 800 sebelum masehi,[4]yang dijelaskan dalam naskah filsafatJainismesebagaianudanparamanu.[4][5]Aliran mazhabNyayadanVaisesikamengembangkan teori yang menjelaskan bagaimana atom-atom bergabung menjadi benda-benda yang lebih kompleks.[6]Satu abad kemudian muncul Referensi mengenai atom di dunia Barat olehLeukippos,yang kemudian oleh muridnyaDemokritospandangan tersebut disistematiskan. Kira-kira pada tahun 450 SM, Demokritos menciptakan istilahátomos(bahasa Yunani:ἄτομος), yang berarti "tidak dapat dipotong" ataupun "tidak dapat dibagi-bagi lagi". Teori Demokritos mengenai atom bukanlah usaha untuk menjabarkan suatu fenomena fisis secara rinci, melainkan suatu filosofi yang mencoba untuk memberikan jawaban atas perubahan-perubahan yang terjadi pada alam.[1]Filosofi serupa juga terjadi di India, namun demikian ilmu pengetahuan modern memutuskan untuk menggunakan istilah "atom" yang dicetuskan oleh Demokritos.[3]Demokritos juga mengatakan bahwa atom dalam air sangat licin sehingga air bisa mengalir ke mana-mana sementara atom dalam garam ditutupi duri-duri tajam sehingga terasa asin dilidah.
Kemajuan lebih jauh pada pemahaman mengenai atom dimulai dengan berkembangnya ilmukimia.Pada tahun 1661,Robert Boylemempublikasikan bukuThe Sceptical Chymistyang berargumen bahwa materi-materi di dunia ini terdiri dari berbagai kombinasi"corpuscules",yaitu atom-atom yang berbeda. Hal ini berbeda dengan pandangan klasik yang berpendapat bahwa materi terdiri dari unsur-unsur udara, tanah, api, dan air.[7]Pada tahun 1789, istilahelement(unsur) didefinisikan oleh seorang bangsawan dan peneliti Prancis,Antoine Lavoisier,sebagai bahan dasar yang tidak dapat dibagi-bagi lebih jauh lagi dengan menggunakan metode-metode kimia.[8]
Aristotelesmengatakan bahwa ada 4 elemen dasar dibumi dan bila semuanya digabungkan akan menjadi senyawa-senyawa yang kita lihat. Saat itu muridnya bertanya: "Apakah bisa kita membuat emas bila menggabungkan semua elemen dasar tadi?" Aristoteles menjawab "Iya". Itu membuat penasaran para ilmuwan semana 200 tahun setelah itu. Pada tahun 1669, ahli kimia JermanHennig Brandmenyuling 60 ember air kencing karena ia mengira di dalamnya ada emas betulan (karena air kencing berwarna kuning keemasan) dan hasilnya peralatan kimianya perpendar dalam gelap. Dia menamainya Fosforus (Fosfor) yang diambil dari kata Yunani "Fosforos" yang berarti bintang senja. Dia adalah orang pertama pada era Masehi, yang sebelumya adalah penemuanArsenik300 SM.[9]

Pada tahun 1803,John Daltonmenggunakan konsep atom untuk menjelaskan mengapa unsur-unsur selalu bereaksi dalam perbandingan yang bulat dan tetap, serta mengapa gas-gas tertentu lebih larut dalam air dibandingkan dengan gas-gas lainnya. Ia mengajukan pendapat bahwa setiap unsur mengandung atom-atom tunggal unik, dan atom-atom tersebut selanjutnya dapat bergabung untuk membentuk senyawa-senyawa kimia.[10][11]
Teori partikel ini kemudian dikonfirmasikan lebih jauh lagi pada tahun 1827, yaitu ketikabotaniwanRobert Brownmenggunakanmikroskopuntuk mengamati debu-debu yang mengambang di atas air dan menemukan bahwa debu-debu tersebut bergerak secara acak. Fenomena ini kemudian dikenal sebagai "Gerak Brown".Pada tahun 1877, J. Desaulx mengajukan pendapat bahwa fenomena ini disebabkan oleh gerak termal molekul air, dan pada tahun 1905Albert Einsteinmembuat analisis matematika terhadap gerak ini.[12][13][14]Fisikawan PrancisJean Perrinkemudian menggunakan hasil kerja Einstein untuk menentukan massa dan dimensi atom secara eksperimen, yang kemudian dengan pasti menjadi verifikasi atas teori atom Dalton.[15]
Berdasarkan hasil penelitiannya terhadapsinar katode,pada tahun 1897J. J. Thomsonmenemukan elektron dan sifat-sifat subatomiknya. Hal ini meruntuhkan konsep atom sebagai satuan yang tidak dapat dibagi-bagi lagi.[16]Thomson percaya bahwa elektron-elektron terdistribusi secara merata di seluruh atom, dan muatan-muatannya diseimbangkan oleh keberadaan lautan muatan positif (model puding prem).
Namun pada tahun 1909, para peneliti di bawah arahanErnest Rutherfordmenembakkan ion helium ke lembaran tipis emas, dan menemukan bahwa sebagian kecil ion tersebut dipantulkan dengan sudut pantulan yang lebih tajam dari yang apa yang diprediksikan oleh teori Thomson. Rutherford kemudian mengajukan pendapat bahwa muatan positif suatu atom dan kebanyakan massanya terkonsentrasi pada inti atom, dengan elektron yang mengitari inti atom seperti planet mengitari matahari. Muatan positif ion helium yang melewati inti padat ini haruslah dipantulkan dengan sudut pantulan yang lebih tajam. Pada tahun 1913, ketika bereksperimen dengan hasil prosespeluruhan radioaktif,Frederick Soddymenemukan bahwa terdapat lebih dari satu jenis atom pada setiap posisi tabel periodik.[17]Istilahisotopkemudian diciptakan olehMargaret Toddsebagai nama yang tepat untuk atom-atom yang berbeda namun merupakan satu unsur yang sama. J.J. Thomson selanjutnya menemukan teknik untuk memisahkan jenis-jenis atom tersebut melalui hasil kerjanya pada gas yang terionisasi.[18]
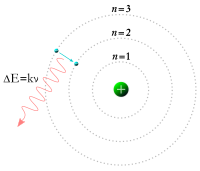
Sementara itu, pada tahun 1913 fisikawanNiels Bohrmengkaji ulang model atom Rutherford dan mengajukan pendapat bahwa elektron-elektron terletak pada orbit-orbit yang terkuantisasi serta dapat meloncat dari satu orbit ke orbit lainnya, meskipun demikian tidak dapat dengan bebas berputar spiral ke dalam maupun keluar dalam keadaan transisi.[19]Suatu elektron haruslah menyerap ataupun memancarkan sejumlah energi tertentu untuk dapat melakukan transisi antara orbit-orbit yang tetap ini. Apabilacahayadari materi yang dipanaskan memancar melalui prisma, ia menghasilkan suatuspektrummultiwarna. Penampakan garis-garis spektrum tertentu ini berhasil dijelaskan oleh teori transisi orbital ini.[20]
Ikatan kimiaantar atom kemudian pada tahun 1916 dijelaskan olehGilbert Newton Lewissebagai interaksi antara elektron-elektron atom tersebut.[21]Atas adanya keteraturan sifat-sifat kimiawi dalam tabel periode kimia,[22]kimiawan AmerikaIrving Langmuirtahun 1919 berpendapat bahwa hal ini dapat dijelaskan apabila elektron-elektron pada sebuah atom saling berhubungan atau berkumpul dalam bentuk-bentuk tertentu. Sekelompok elektron diperkirakan menduduki satu setkelopak elektrondi sekitar inti atom.
Percobaan Stern-Gerlachpada tahun 1922 memberikan bukti lebih jauh mengenai sifat-sifat kuantum atom. Ketika seberkas atom perak ditembakkan melalui medan magnet, berkas tersebut terpisah-pisah sesuai dengan arah momentum sudut atom (spin). Oleh karena arah spin adalah acak, berkas ini diharapkan menyebar menjadi satu garis. Namun pada kenyataannya berkas ini terbagi menjadi dua bagian, tergantung dari apakah spin atom tersebut berorientasi ke atas ataupun ke bawah.[23]
Pada tahun 1926, dengan menggunakan pemikiranLouis de Brogliebahwa partikel berperilaku seperti gelombang, Erwin Schrödinger mengembangkan suatu model atom matematis yang menggambarkan elektron sebagaigelombangtiga dimensi daripada sebagai titik-titik partikel. Konsekuensi penggunaan bentuk gelombang untuk menjelaskan elektron ini adalah bahwa adalah tidak mungkin untuk secara matematis menghitungposisidanmomentumpartikel secara bersamaan. Hal ini kemudian dikenal sebagaiprinsip ketidakpastian,yang dirumuskan olehWerner Heisenbergpada 1926. Menurut konsep ini, untuk setiap pengukuran suatu posisi, seseorang hanya bisa mendapatkan kisaran nilai-nilai probabilitas momentum, demikian pula sebaliknya. Walaupun model ini sulit untuk divisualisasikan, ia dapat dengan baik menjelaskan sifat-sifat atom yang terpantau yang sebelumnya tidak dapat dijelaskan oleh teori mana pun. Oleh sebab itu, model atom yang menggambarkan elektron mengitari inti atom seperti planet mengitari matahari digugurkan dan digantikan oleh modelorbital atomdi sekitar inti di mana elektron paling berkemungkinan berada.[24][25]

Perkembangan padaspektrometri massamengizinkan dilakukannya pengukuran massa atom secara tepat. Peralatan spektrometer ini menggunakan magnet untuk membelokkan trayektori berkas ion, dan banyaknya defleksi ditentukan dengan rasio massa atom terhadap muatannya. KimiawanFrancis William Astonmenggunakan peralatan ini untuk menunjukkan bahwa isotop mempunyai massa yang berbeda. Perbedaan massa antar isotop ini berupa bilangan bulat, dan ia disebut sebagaikaidah bilangan bulat.[26]Penjelasan pada perbedaan massa isotop ini berhasil dipecahkan setelah ditemukannyaneutron,suatu partikel bermuatan netral dengan massa yang hampir sama denganproton,yaitu olehJames Chadwickpada tahun 1932. Isotop kemudian dijelaskan sebagai unsur dengan jumlah proton yang sama, namun memiliki jumlah neutron yang berbeda dalam inti atom.[27]
Pada tahun 1950-an, perkembanganpemercepat partikeldandetektor partikelmengizinkan para ilmuwan mempelajari dampak-dampak dari atom yang bergerak dengan energi yang tinggi.[28]Neutron dan proton kemudian diketahui sebagaihadron,yaitu komposit partikel-partikel kecil yang disebut sebagaikuark.Model-model standar fisika nuklir kemudian dikembangkan untuk menjelaskan sifat-sifat inti atom dalam hal interaksi partikel subatom ini.[29]
Sekitar tahun 1985,Steven Chudkk. diBell Labsmengembangkan sebuah teknik untuk menurunkan temperatur atom menggunakanlaser.Pada tahun yang sama, sekelompok ilmuwan yang diketuai olehWilliam D. Phillipsberhasil memerangkap atom natrium dalamperangkap magnet.Claude Cohen-Tannoudjikemudian menggabungkan kedua teknik tersebut untuk mendinginkan sejumlah kecil atom sampai beberapamikrokelvin.Hal ini mengizinkan ilmuwan mempelajari atom dengan presisi yang sangat tinggi, yang pada akhirnya membawa para ilmuwan menemukankondensasi Bose-Einstein.[30]
Dalam sejarahnya, sebuah atom tunggal sangatlah kecil untuk digunakan dalam aplikasi ilmiah. Namun baru-baru ini, berbagai peranti yang menggunakan sebuah atom tunggal logam yang dihubungkan denganligan-ligan organik (transistor elektron tunggal) telah dibuat.[31]Berbagai penelitian telah dilakukan untuk memerangkap dan memperlambat laju atom menggunakanpendinginan laseruntuk mendapatkan pemahaman yang lebih baik mengenai sifat-sifat atom.[32]
Komponen-komponen atom
Partikel subatom
Walaupun awalnya kataatomberarti suatu partikel yang tidak dapat dipotong-potong lagi menjadi partikel yang lebih kecil, dalam terminologi ilmu pengetahuan modern, atom tersusun atas berbagaipartikel subatom.Partikel-partikel penyusun atom ini adalahelektron,proton,danneutron.Namunhidrogen-1tidak mempunyai neutron. Demikian pula halnya padaion hidrogenpositif H+.
Dari kesemua partikel subatom ini, elektron adalah yang paling ringan, dengan massa elektron sebesar 9,11 × 10−31kg dan mempunyai muatan negatif. Ukuran elektron sangatlah kecil sedemikiannya tiada teknik pengukuran yang dapat digunakan untuk mengukur ukurannya.[33]Proton memiliki muatan positif dan massa 1.836 kali lebih berat daripada elektron (1,6726 × 10−27kg). Neutron tidak bermuatan listrik dan bermassa bebas 1.839 kali massa elektron[34]atau (1,6929 × 10−27kg).
Dalam model standar fisika, baik proton dan neutron terdiri daripartikel elementeryang disebutkuark.Kuark termasuk ke dalam golongan partikelfermiondan merupakan salah satu dari dua bahan penyusun materi dasar (yang lainnya adalahlepton). Terdapat enam jenis kuark dan tiap-tiap kuark tersebut memiliki muatan listrik pecahan sebesar +2/3 ataupun −1/3. Proton terdiri dari duakuark naikdan satukuark turun,manakala neutron terdiri dari satu kuark naik dan dua kuark turun. Perbedaan komposisi kuark ini memengaruhi perbedaan massa dan muatan antara dua partikel tersebut. Kuark terikat bersama olehgaya nuklir kuatyang diperantarai olehgluon.Gluon adalah anggota dariboson tolokyang merupakan perantara gaya-gaya fisika.[35][36]
Inti atom

Inti atom terdiri atasprotondanneutronyang terikat bersama pada pusat atom. Secara kolektif, proton dan neutron tersebut disebut sebagainukleon(partikel penyusun inti). Diameter inti atom berkisar antara 10−15hingga 10−14m.[37]Jari-jari inti diperkirakan sama dengan fm,denganAadalah jumlah nukleon.[38]Hal ini sangatlah kecil dibandingkan dengan jari-jari atom. Nukleon-nukleon tersebut terikat bersama oleh gaya tarik-menarik potensial yang disebutgaya kuat residual.Pada jarak lebih kecil daripada 2,5 fm, gaya ini lebih kuat daripadagaya elektrostatikyang menyebabkan proton saling tolak menolak.[39]
Atom dariunsur kimiayang sama memiliki jumlah proton yang sama, disebutnomor atom.Inti atom yang mempunyai nomor atom, nomor massa, dan waktu paruh tertentu disebutnuklida.Suatu unsur dapat memiliki jumlah neutron yang bervariasi. Variasi ini disebut sebagaiisotop.Isobaradalah unsur-unsur yang mempunyai nomor massa sama tetapi nomor atom berbeda.Isotonunsur-unsur yang mempunyai jumlah elektron yang sama tetapi nomor massa dan nomor atom berbeda. Jumlah proton dan neutron suatu atom akan menentukannuklidaatom tersebut, sedangkan jumlah neutron relatif terhadap jumlah proton akan menentukan stabilitas inti atom, dengan isotop unsur tertentu akan menjalankanpeluruhan radioaktif.[40]
Neutron dan proton adalah dua jenisfermionyang berbeda.Asas pengecualian Paulimelarang adanya keberadaan fermion yangidentik(seperti misalnya proton berganda) menduduki suatu keadaan fisik kuantum yang sama pada waktu yang sama. Oleh karena itu, setiapprotondalam inti atom harusnya menduduki keadaan kuantum yang berbeda dengan aras energinya masing-masing. Asas Pauli ini juga berlaku untuk neutron. Pelarangan ini tidak berlaku bagi proton dan neutron yang menduduki keadaan kuantum yang sama.[41]
Untuk atom dengan nomor atom yang rendah, inti atom yang memiliki jumlah proton lebih banyak daripada neutron berpotensi jatuh ke keadaan energi yang lebih rendah melalui peluruhan radioaktif yang menyebabkan jumlah proton dan neutron seimbang. Oleh karena itu, atom dengan jumlah proton dan neutron yang berimbang lebih stabil dan cenderung tidak meluruh. Namun, dengan meningkatnya nomor atom, gaya tolak-menolak antar proton membuat inti atom memerlukan proporsi neutron yang lebih tinggi lagi untuk menjaga stabilitasnya. Pada inti yang paling berat, rasio neutron per proton yang diperlukan untuk menjaga stabilitasnya akan meningkat menjadi 1,5.[41]
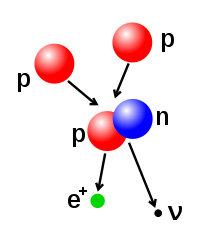
Jumlah proton dan neutron pada inti atom dapat diubah, walaupun hal ini memerlukan energi yang sangat tinggi oleh karena gaya atraksinya yang kuat.Fusi nuklirterjadi ketika banyak partikel atom bergabung membentuk inti yang lebih berat. Sebagai contoh, pada inti Matahari, proton memerlukan energi sekitar 3–10 keV untuk mengatasi gaya tolak-menolak antar sesamanya dan bergabung menjadi satu inti.[42]Fisi nuklirmerupakan kebalikan dari proses fusi. Pada fisi nuklir, inti dipecah menjadi dua inti yang lebih kecil. Hal ini biasanya terjadi melalui peluruhan radioaktif. Inti atom juga dapat diubah melalui penembakan partikel subatom berenergi tinggi. Apabila hal ini mengubah jumlah proton dalam inti, atom tersebut akan berubah unsurnya.[43][44]
Jika massa inti setelah terjadinya reaksi fusi lebih kecil daripada jumlah massa partikel awal penyusunnya, maka perbedaan ini disebabkan oleh pelepasan pancaran energi (misalnyasinar gama), sebagaimana yang ditemukan pada rumuskesetaraan massa-energiEinstein,E=mc2,denganmadalah massa yang hilang dancadalahkecepatan cahaya.Defisit ini merupakan bagian darienergi pengikataninti yang baru.[45]
Fusi dua inti yang menghasilkan inti yang lebih besar dengan nomor atom lebih rendah daripadabesidannikel(jumlah total nukleon sama dengan 60) biasanya bersifateksotermik,yang berarti bahwa proses ini melepaskan energi.[46]Adalah proses pelepasan energi inilah yang membuat fusi nuklir padabintangdapat dipertahankan. Untuk inti yang lebih berat, energi pengikatan pernukleondalam inti mulai menurun. Ini berarti bahwa proses fusi akan bersifatendotermik.[41]
Awan elektron
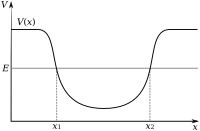
Elektron dalam suatu atom ditarik oleh proton dalam inti atom melaluigaya elektromagnetik.Gaya ini mengikat elektron dalam sumur potensi elektrostatik di sekitar inti. Hal ini berarti bahwa energi luar diperlukan agar elektron dapat lolos dari atom. Semakin dekat suatu elektron dalam inti, semakin besar gaya atraksinya, sehingga elektron yang berada dekat dengan pusat sumur potensi memerlukan energi yang lebih besar untuk lolos.
Elektron, sama seperti partikel lainnya, memiliki sifat seperti partikel maupun seperti gelombang (dualisme gelombang-partikel). Awan elektron adalah suatu daerah dalam sumur potensi di mana tiap-tiap elektron menghasilkan sejenis gelombang diam (yaitu gelombang yang tidak bergerak relatif terhadap inti) tiga dimensi. Perilaku ini ditentukan olehorbital atom,yakni suatu fungsi matematika yang menghitung probabilitas suatu elektron akan muncul pada suatu lokasi tertentu ketika posisinya diukur.[47]Hanya akan ada satu himpunan orbital tertentu yang berada di sekitar inti, karena pola-pola gelombang lainnya akan dengan cepat meluruh menjadi bentuk yang lebih stabil.[48]

Tiap-tiap orbital atom berkoresponden terhadaparas energielektron tertentu. Elektron dapat berubah keadaannya ke aras energi yang lebih tinggi dengan menyerap sebuahfoton.Selain dapat naik menuju aras energi yang lebih tinggi, suatu elektron dapat pula turun ke keadaan energi yang lebih rendah dengan memancarkan energi yang berlebih sebagai foton.[48]
Energi yang diperlukan untuk melepaskan ataupun menambah satu elektron (energi pengikatan elektron) adalah lebih kecil daripada energi pengikatan nukleon. Sebagai contohnya, hanya diperlukan 13,6 eV untuk melepaskan elektron dari atom hidrogen.[49]Bandingkan dengan energi sebesar 2,3 MeV yang diperlukan untuk memecah intideuterium.[50]Atom bermuatan listrik netral oleh karena jumlah proton dan elektronnya yang sama. Atom yang kekurangan ataupun kelebihan elektron disebut sebagaiion.Elektron yang terletak paling luar dari inti dapat ditransfer ataupun dibagi ke atom terdekat lainnya. Dengan cara inilah, atom dapat salingberikatanmembentukmolekul.[51]
Sifat-sifat
Sifat-sifat nuklir
Berdasarkan definisi, dua atom dengan jumlahprotonyang identik dalam intinya termasuk ke dalamunsur kimiayang sama. Atom dengan jumlah proton sama namun dengan jumlahneutronberbeda adalah dua isotop berbeda dari satu unsur yang sama. Sebagai contohnya, semua hidrogen memiliki satu proton, namun terdapat satu isotop hidrogen yang tidak memiliki neutron (hidrogen-1), satu isotop yang memiliki satu neutron (deuterium), dua neutron (tritium), dll. Hidrogen-1 adalah bentuk isotop hidrogen yang paling umum. Kadang-kadang ia disebut sebagai protium.[52]Semua isotop unsur yang bernomor atom lebih besar daripada 82 bersifat radioaktif.[53][54]
Dari sekitar 339 nuklida yang terbentuk secara alami diBumi,269 di antaranya belum pernah terpantau meluruh.[55]Pada unsur kimia, 80 dari unsur yang diketahui memiliki satu atau lebihisotop stabil.Unsur43,63,dan semua unsur lebih tinggi dari83tidak memiliki isotop stabil. Dua puluh tujuh unsur hanya memiliki satu isotop stabil, manakala jumlah isotop stabil yang paling banyak terpantau pada unsurtimahdengan 10 jenis isotop stabil.[56]
Massa
Karena mayoritas massa atom berasal dari proton dan neutron, jumlah keseluruhan partikel ini dalam atom disebut sebagainomor massa.Massa atom pada keadaan diam sering diekspresikan menggunakansatuan massa atom(u) yang juga disebut dalton (Da). Satuan ini didefinisikan sebagai seperduabelas massa atomkarbon-12netral, yang kira-kira sebesar 1,66 × 10−27kg.[57]Hidrogen-1yang merupakan isotop teringan hidrogen memiliki bobot atom 1,007825 u.[58]Atom memiliki massa yang kira-kira sama dengan nomor massanya dikalikan satuan massa atom.[59]Atom stabil yang paling berat adalah timbal-208,[53]dengan massa sebesar 207,9766521 u.[60]
Para kimiawan biasanya menggunakan satuanmoluntuk menyatakan jumlah atom. Satu mol didefinisikan sebagai jumlah atom yang terdapat pada 12 gram persis karbon-12. Jumlah ini adalah sekitar 6,022 × 1023,yang dikenal pula dengan namatetapan Avogadro.Dengan demikian suatu unsur dengan massa atom 1 u akan memiliki satu mol atom yang bermassa 0,001 kg. Sebagai contohnya,Karbonmemiliki massa atom 12 u, sehingga satu mol karbon atom memiliki massa 0,012 kg.[57]
Ukuran
Atom tidak memiliki batasan luar yang jelas, sehingga dimensi atom biasanya dideskripsikan sebagai jarak antara dua inti atom ketika dua atom bergabung bersama dalamikatan kimia.Jari-jari ini bervariasi tergantung pada jenis atom, jenis ikatan yang terlibat, jumlah atom di sekitarnya, dan spin atom.[61]Padatabel periodikunsur-unsur, jari-jari atom akan cenderung meningkat seiring dengan meningkatnya periode (atas ke bawah). Sebaliknya jari-jari atom akan cenderung meningkat seiring dengan menurunnya nomor golongan (kanan ke kiri).[62]Oleh karena itu, atom yang terkecil adalah helium dengan jari-jari 32pm,manakala yang terbesar adalahsesiumdengan jari-jari 225 pm.[63]Dimensi ini ribuan kali lebih kecil daripada gelombangcahaya(400–700nm), sehingga atom tidak dapat dilihat menggunakan mikroskop optik biasa. Namun, atom dapat dipantau menggunakanmikroskop gaya atom.
Ukuran atom sangatlah kecil, sedemikian kecilnya lebar satu helai rambut dapat menampung sekitar 1 juta atom karbon.[64]Satu tetes air pula mengandung sekitar 2 × 1021atom oksigen.[65]Intansatu karat dengan massa 2 × 10-4kg mengandung sekitar 1022atom karbon.[catatan 2]Jika sebuah apel diperbesar sampai seukuran besarnya Bumi, maka atom dalam apel tersebut akan terlihat sebesar ukuran apel awal tersebut.[66]
Peluruhan radioaktif

Setiap unsur mempunyai satu atau lebih isotop berinti tak stabil yang akan mengalami peluruhan radioaktif, menyebabkan inti melepaskan partikel ataupun radiasi elektromagnetik. Radioaktivitas dapat terjadi ketika jari-jari inti sangat besar dibandingkan dengan jari-jari gaya kuat (hanya bekerja pada jarak sekitar 1 fm).[67]
Bentuk-bentuk peluruhan radioaktif yang paling umum adalah:[68][69]
- Peluruhan alfa,terjadi ketika suatu inti memancarkan partikel alfa (inti helium yang terdiri dari dua proton dan dua neutron). Hasil peluruhan ini adalah unsur baru dengannomor atomyang lebih kecil.
- Peluruhan beta,diatur olehgaya lemah,dan dihasilkan oleh transformasi neutron menjadi proton, ataupun proton menjadi neutron. Transformasi neutron menjadi proton akan diikuti oleh emisi satu elektron dan satuantineutrino,manakala transformasi proton menjadi neutron diikuti oleh emisi satupositrondan satuneutrino.Emisi elektron ataupun emisi positron disebut sebagai partikel beta. Peluruhan beta dapat meningkatkan maupun menurunkan nomor atom inti sebesar satu.
- Peluruhan gama,dihasilkan oleh perubahan pada aras energi inti ke keadaan yang lebih rendah, menyebabkan emisi radiasi elektromagnetik. Hal ini dapat terjadi setelah emisi partikel alfa ataupun beta dari peluruhan radioaktif.
Jenis-jenispeluruhan radioaktiflainnya yang lebih jarang meliputi pelepasan neutron dan proton dari inti, emisi lebih dari satupartikel beta,ataupun peluruhan yang mengakibatkan produksi elektron berkecepatan tinggi yang bukan sinar beta, dan produksi foton berenergi tinggi yang bukan sinar gama
Tiap-tiap isotop radioaktif mempunyai karakteristik periode waktu peluruhan (waktu paruh) yang merupakan lamanya waktu yang diperlukan oleh setengah jumlah sampel untuk meluruh habis. Proses peluruhan bersifat eksponensial, sehingga setelah dua waktu paruh, hanya akan tersisa 25% isotop.[67]
Momen magnetik
Setiap partikel elementer mempunyai sifat mekanika kuantum intrinsik yang dikenal dengan namaspin.Spin beranalogi denganmomentum sudutsuatu objek yang berputar padapusat massanya,walaupun secara kaku partikel tidaklah berperilaku seperti ini. Spin diukur dalam satuantetapan Plancktereduksi (ħ), dengan elektron, proton, dan neutron semuanya memiliki spin ½ ħ, atau "spin-½". Dalam atom, elektron yang bergerak di sekitarinti atomselain memilikispinjuga memilikimomentum sudut orbital,manakala inti atom memiliki momentum sudut pula oleh karena spin nuklirnya sendiri.[70]
Medan magnetyang dihasilkan oleh suatu atom (disebutmomen magnetik) ditentukan oleh kombinasi berbagai macam momentum sudut ini. Namun, kontribusi yang terbesar tetap berasal dari spin. Oleh karena elektron mematuhiasas pengecualian Pauli,yakni tiada dua elektron yang dapat ditemukan padakeadaan kuantumyang sama, pasangan elektron yang terikat satu sama lainnya memiliki spin yang berlawanan, dengan satu berspin naik, dan yang satunya lagi berspin turun. Kedua spin yang berlawanan ini akan saling menetralkan, sehingga momen dipol magnetik totalnya menjadi nol pada beberapa atom berjumlah elektron genap.[71]
Pada atom berelektron ganjil sepertibesi,adanya keberadaan elektron yang tak berpasangan menyebabkan atom tersebut bersifatferomagnetik.Orbital-orbital atom di sekeliling atom tersebut saling bertumpang tindih dan penurunan keadaan energi dicapai ketika spin elektron yang tak berpasangan tersusun saling berjajar. Proses ini disebut sebagaiinteraksi pertukaran.Ketika momen magnetik atom feromagnetik tersusun berjajaran, bahan yang tersusun oleh atom ini dapat menghasilkan medan makroskopis yang dapat dideteksi. Bahan-bahan yang bersifatparamagnetikmemiliki atom dengan momen magnetik yang tersusun acak, sehingga tiada medan magnet yang dihasilkan. Namun, momen magnetik tiap-tiap atom individu tersebut akan tersusun berjajar ketika diberikan medan magnet.[71][72]
Inti atom juga dapat memiliki spin. Biasanya spin inti tersusun secara acak oleh karenakesetimbangan termal.Namun, untuk unsur-unsur tertentu (sepertixenon-129), adalah mungkin untuk memolarisasi keadaan spin nuklir secara signifikan sehingga spin-spin tersebut tersusun berjajar dengan arah yang sama. Kondisi ini disebut sebagai hiperpolarisasi. Fenomena ini memiliki aplikasi yang penting dalampencitraan resonansi magnetik.[73][74]
Aras-aras energi
Ketika suatu elektron terikat pada sebuah atom, ia memilikienergi potensialyang berbanding terbalik terhadap jarak elektron terhadap inti. Hal ini diukur oleh besarnya energi yang diperlukan untuk melepaskan elektron dari atom dan biasanya diekspresikan dengan satuanelektronvolt(eV). Dalam model mekanika kuantum, elektron-elektron yang terikat hanya dapat menduduki satu set keadaan yang berpusat pada inti, dan tiap-tiap keadaan berkorespondensi terhadap aras energi tertentu. Keadaan energi terendah suatu elektron yang terikat disebut sebagai keadaan dasar, manakala keadaan energi yang lebih tinggi disebut sebagai keadaan tereksitasi.[75]
Agar suatu elektron dapat meloncat dari satu keadaan ke keadaan lainnya, ia haruslah menyerap ataupun memancarkanfotonpada energi yang sesuai dengan perbedaan energi potensial antar dua aras tersebut. Energi foton yang dipancarkan adalah sebanding denganfrekuensinya.[76]Tiap-tiap unsur memiliki spektrum karakteristiknya masing-masing. Hal ini bergantung pada muatan inti, subkelopak yang terisi dengan elektron, interaksi elektromagnetik antar elektron, dan faktor-faktor lainnya.[77]

Ketika suatu spektrum energi yang berkelanjutan dipancarkan melalui suatu gas ataupun plasma, beberapa foton diserap oleh atom, menyebabkan elektron berpindah aras energi. Elektron yang tereksitasi akan secara spontan memancarkan energi ini sebagai foton dan jatuh kembali ke aras energi yang lebih rendah. Oleh karena itu, atom berperilaku seperti bahan penyaring yang akan membentuk sederetanpita absorpsi.Pengukuranspektroskopiterhadap kekuatan dan lebarpita spektrummengizinkan penentuan komposisi dan sifat-sifat fisika suatu zat.[78]
Pemantauan cermat pada garis-garis spektrum menunjukkan bahwa beberapa memperlihatkan adanya pemisahan halus. Hal ini terjadi karenakopling spin-orbityang merupakan interaksi antara spin dengan gerak elektron terluar.[79]Ketika suatu atom berada dalam medan magnet eksternal, garis-garis spektrum terpisah menjadi tiga atau lebih komponen. Hal ini disebut sebagaiefek Zeeman.Efek Zeeman disebabkan oleh interaksi medan magnet dengan momen magnetik atom dan elektronnya. Beberapa atom dapat memiliki banyakkonfigurasi elektrondengan aras energi yang sama, sehingga akan tampak sebagai satu garis spektrum. Interaksi medan magnet dengan atom akan menggeser konfigurasi-konfigurasi elektron menuju aras energi yang sedikit berbeda, menyebabkan garis spektrum berganda.[80]Keberadaanmedan listrikeksternal dapat menyebabkan pemisahan dan pergeseran garis spektrum dengan mengubah aras energi elektron. Fenomena ini disebut sebagaiefek Stark.[81]
Valensi dan perilaku ikatan
Kelopak atau kulit elektron terluar suatu atom dalam keadaan yang tak terkombinasi disebut sebagai kelopak valensi dan elektron dalam kelopak tersebut disebutelektron valensi.Jumlah elektron valensi menentukan perilakuikatanatom tersebut dengan atom lainnya. Atom cenderung bereaksi dengan satu sama lainnya melalui pengisian (ataupun pengosongan) elektron valensi terluar atom.[82]Ikatan kimia dapat dilihat sebagai transfer elektron dari satu atom ke atom lainnya, seperti yang terpantau padanatrium kloridadan garam-garam ionik lainnya. Namun, banyak pula unsur yang menunjukkan perilaku valensi berganda, atau kecenderungan membagi elektron dengan jumlah yang berbeda pada senyawa yang berbeda. Sehingga,ikatan kimiaantara unsur-unsur ini cenderung berupa pembagian elektron daripada transfer elektron. Contohnya meliputi unsur karbon dalamsenyawa organik.[83]
Unsur-unsur kimiasering ditampilkan dalamtabel periodikyang menampilkan sifat-sifat kimia suatu unsur yang berpola. Unsur-unsur dengan jumlah elektron valensi yang sama dikelompokkan secara vertikel (disebut golongan). Unsur-unsur pada bagian terkanan tabel memiliki kelopak terluarnya terisi penuh, menyebabkan unsur-unsur tersebut cenderung bersifat inert (gas mulia).[84][85]
Keadaan

Sejumlah atom ditemukan dalam keadaan materi yang berbeda-beda tergantung pada kondisi fisik benda, yaknisuhudantekanan.Dengan mengubah kondisi tersebut, materi dapat berubah-ubah menjadi bentukpadat,cair,gas,danplasma.[86]Dalam tiap-tiap keadaan tersebut pula materi dapat memiliki berbagai fase. Sebagai contohnya pada karbon padat, ia dapat berupagrafitmaupunintan.[87]
Pada suhu mendekatinol mutlak,atom dapat membentukkondensat Bose-Einstein,di mana efek-efek mekanika kuantum yang biasanya hanya terpantau pada skala atom terpantau secara makroskopis.[88][89]Kumpulan atom-atom yang dilewat-dinginkan ini berperilaku seperti satuatom super.[90]
Identifikasi

Mikroskop penerowongan payaran(scanning tunneling microscope) adalah suatu mikroskop yang digunakan untuk melihat permukaan suatu benda pada tingkat atom. Alat ini menggunakan fenomenapenerowongan kuantumyang mengizinkan partikel-partikel menembus sawar yang biasanya tidak dapat dilewati.
Sebuah atom dapat diionisasidengan melepaskan satu elektronnya.Muatan yang adamenyebabkan trayektori atom melengkung ketika ia melalui sebuahmedan magnet.Jari-jari trayektori ion tersebut ditentukan oleh massa atom.Spektrometer massamenggunakan prinsip ini untuk menghitung rasio massa terhadap muatan ion. Apabila sampel tersebut mengandung sejumlah isotop, spektrometer massa dapat menentukan proporsi tiap-tiap isotop dengan mengukur intensitas berkas ion yang berbeda. Teknik untuk menguapkan atom meliputiplasma gandeng induktif-spektroskopi emisi atom(inductively coupled plasma-atomic emission spectroscopy,ICP-AES) danplasma gandeng induktif-spektrometri massa(inductively coupled plasma-mass spectrometry,ICP-MS), keduanya menggunakan plasma untuk menguapkan sampel analisis.[91]
Metode lainnya yang lebih selektif adalahspektroskopi pelepasan energi elektron(electron energy loss spectroscopy), yang mengukur pelepasan energiberkas elektrondalam suatumikroskop elektron transmisiketika ia berinteraksi dengan sampel. Tomografi kuar atom memiliki resolusi sub-nanometer dalam 3-D dan dapat secara kimiawi mengidentifikasi atom-atom individu menggunakanspektrometri massa waktu lintas.[92]
Spektrumkeadaan tereksitasidapat digunakan untuk menganalisis komposisi atombintangyang jauh. Panjang gelombang cahaya tertentu yang dipancarkan oleh bintang dapat dipisahkan dan dicocokkan dengan transisi terkuantisasi atom gas bebas. Warna bintang kemudian dapat direplikasi menggunakanlampu lucutan gasyang mengandung unsur yang sama.[93]Heliumpada Matahari ditemukan dengan menggunakan cara ini 23 tahun sebelum ia ditemukan di Bumi.[94]
Asal usul dan kondisi sekarang
Atom menduduki sekitar 4% densitas energi total yang ada dalamalam semestaterpantau, dengan densitas rata-rata sekitar 0,25 atom/m3.[95]Dalam galaksiBima Sakti,atom memiliki konsentrasi yang lebih tinggi, dengan densitas materi dalammedium antarbintangberkisar antara 105sampai dengan 109atom/m3.[96]Matahari sendiri dipercayai berada dalamGelembung Lokal,yaitu suatu daerah yang mengandung banyak gas ion, sehingga densitas di sekelilingnya adalah sekitar 103atom/m3.[97]Bintang membentuk awan-awan padat dalam medium antarbintang, dan proses evolusioner bintang akan menyebabkan peningkatan kandungan unsur yang lebih berat daripada hidrogen dan helium dalam medium antarbintang. Sampai dengan 95% atom Bima Sakti terkonsentrasi dalam bintang-bintang, dan massa total atom ini membentuk sekitar 10% massa galaksi.[98]Massa sisanya adalahmateri gelapyang tidak diketahui dengan jelas.[99]
Nukleosintesis
Proton dan elektron yang stabil muncul satu detik setelah kejadianDentuman Besar.Dalam masa waktu tiga menit sesudahnya,nukleosintesis Dentuman Besarkebanyakan menghasilkanhelium,litium,dandeuterium,dan mungkin juga beberapaberiliumdanboron.[100][101][102]Atom pertama (dengan elektron yang terikat dengannya) secara teoretis tercipta 380.000 tahun sesudah Dentuman Besar, yaitu ketika alam semesta yang mengembang cukup dingin untuk mengizinkan elektron-elektron terikat pada inti atom.[103]Sejak saat itulah, inti atom mulai bergabung dalambintang-bintang melalui prosesfusi nuklirdan menghasilkan unsur-unsur yang lebih berat sampai dengan besi.[104]
Isotop seperti litium-6 dihasilkan di ruang angkasa melaluispalasi sinar kosmis.[105]Hal ini terjadi ketika sebuah proton berenergi tinggi menumbuk inti atom, menyebabkan sejumlah besar nukleon berhamburan. Unsur yang lebih berat daripada besi dihasilkan disupernovamelaluiproses rdan dibintang-bintang AGBmelaluiproses s.Kedua-duanya melibatkan penangkapan neutron oleh inti atom.[106]Unsur-unsur sepertitimbalkebanyakan dibentuk melalui peluruhan radioaktif unsur-unsur lain yang lebih berat.[107]
Bumi
Kebanyakan atom yang menyusunBumidan termasuk pula seluruh makhluk hidupnya pernah berada dalam bentuk yang sekarang dinebulayang runtuh dariawan molekuldan membentukTata Surya.Sisanya merupakan akibat dari peluruhan radioaktif dan proporsinya dapat digunakan untuk menentukanusia Bumimelaluipenanggalan radiometrik.[108][109]Kebanyakanheliumdalam kerak Bumi merupakan produkpeluruhan alfa.[110]
Terdapat sekelumit atom di Bumi yang pada awal pembentukannya tidak ada dan juga bukan merupakan akibat dari peluruhan radioaktif.Karbon-14secara berkesinambungan dihasilkan oleh sinar kosmik di atmosfer.[111]Beberapa atom di Bumi secara buatan dihasilkan oleh reaktor ataupun senjata nuklir.[112][113]Dari semuaUnsur-unsur transuraniumyang bernomor atom lebih besar daripada 92, hanyaplutoniumdanneptuniumsajalah yang terdapat di Bumi secara alami.[114][115]Unsur-unsur transuranium memiliki waktu paruh radioaktif yang lebih pendek daripada umur Bumi,[116]sehingga unsur-unsur ini telah lama meluruh. Pengecualian terdapat padaplutonium-244yang kemungkinan tersimpan dalam debu kosmik.[108]Kandungan alami plutonium dan neptunium dihasilkan dari penangkapan neutron dalam bijih uranium.[117]
Bumi mengandung sekitar 1,33 × 1050atom.[118]Pada atmosfer planet, terdapat sejumlah kecil atomgas muliasepertiargondanneon.Sisa 99% atom pada atmosfer bumi terikat dalam bentuk molekul, misalnyakarbon dioksida,oksigendiatomik,dannitrogendiatomik. Pada permukaan Bumi, atom-atom saling berikatan membentuk berbagai macam senyawa, meliputiair,garam,silikat,danoksida.Atom juga dapat bergabung membentuk bahan-bahan yang tidak terdiri dari molekul, contohnyakristaldanlogampadat ataupun cair.[119][120]
Bentuk teoretis dan bentuk langka
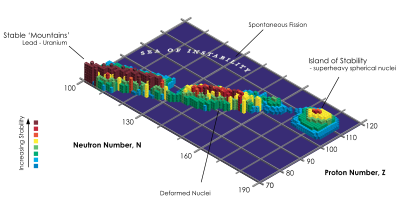
Manakala isotop dengan nomor atom yang lebih tinggi daripadatimbal(62) bersifat radioaktif, terdapat suatu "pulau stabilitas"yang diajukan untuk beberapa unsur dengan nomor atom di atas 103. Unsur-unsur super berat ini kemungkinan memiliki inti yang secara relatif stabil terhadap peluruhan radioaktif.[121]Atom super berat yang stabil ini kemungkinan besar adalahunbiheksium,dengan 126 proton 184 neutron.[122]
Tiap-tiap partikel materi memiliki partikelantimaterinyamasing-masing dengan muatan listrik yang berlawanan. Sehingga,positronadalah antielektron yang bermuatan positif, dan antiproton adalah proton yang bermuatan negatif, Ketika materi dan antimateri bertemu, keduanya akan saling memusnahkan. Terdapat ketidakseimbangan antara jumlah partikel materi dan antimateri. Ketidakseimbangan ini masih belum dipahami secara menyeluruh, walaupun terdapat teoribariogenesisyang memberikan penjelasan yang memungkinkan. Antimateri tidak pernah ditemukan secara alami.[123][124]Namun, pada tahun 1996,antihidrogenberhasil disintesis di laboratoriumCERNdiJenewa.[125][126]
Terdapat pula atom-atom langka lainnya yang dibuat dengan menggantikan satu proton, neutron, ataupun elektron dengan partikel lain yang bermuatan sama. Sebagai contoh, elektron dapat digantikan denganmuonyang lebih berat, membentukatom muon.Jenis atom ini dapat digunakan untuk menguji prediksi fisika.[127][128][129]
Lihat pula
Catatan
- ^Kebanyakan isotop mempunyai jumlah nukleon lebih banyak dari jumlah elektron. Dalam kasus hydrogen-1, yang mempunyai satu elektron and satu nukleon, protonnya,atau 99,95% dari total massa atom.
- ^Satu karat sama dengan 200 miligram. Berdasarkan definisi, karbon-12 memiliki 0,012 kg per mol.Tetapan Avogadrosekitar 6 × 1023atom per mol.
Referensi
- ^abHaubold, Hans (1998)."Microcosmos: From Leucippus to Yukawa".Structure of the Universe.Common Sense Science. Diarsipkan dariversi aslitanggal 2008-10-01.Diakses tanggal2008-01-17.
- ^Staff (2007-08-01)."Radioactive Decays".Stanford Linear Accelerator Center, Stanford University.Diarsipkandari versi asli tanggal 2009-06-07.Diakses tanggal2007-01-02.
- ^abPonomarev (1993:14-15).
- ^ab(Inggris)A. Pablo Iannone.Dictionary of World Philosophy.hlm. 62.ISBN0-415-17995-5.Diarsipkandari versi asli tanggal 2023-03-27.Diakses tanggal2010-06-09.
- ^(Inggris)Hajime Nakamura (1992).A comparative history of ideas.Shri Jainendra Press. hlm. 145.ISBN81-208-1004-xPeriksa nilai: invalid character
|isbn=(bantuan).Diakses tanggal2010-06-09. - ^(Inggris)Ben-Ami Scharfstein (1998).A comparative history of world philosophy: from the Upanishads to Kant.State University of New York Press. hlm. 189.ISBN0-7914-3683-7.Diarsipkandari versi asli tanggal 2023-03-27.Diakses tanggal2010-06-09.
- ^Siegfried (2002:42–55).
- ^"Lavoisier's Elements of Chemistry".Elements and Atoms.Le Moyne College, Department of Chemistry.Diarsipkandari versi asli tanggal 2007-05-01.Diakses tanggal2007-12-18.
- ^"Periodic Table Database | Chemogenesis".www.meta-synthesis.com.Diarsipkandari versi asli tanggal 2019-05-02.Diakses tanggal2019-03-25.
- ^Wurtz (1881:1–2).
- ^Dalton (1808).
- ^Einstein, Albert (1905)."Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen"(PDF).Annalen der Physik(dalam bahasa German).322(8): 549–560.doi:10.1002/andp.19053220806.Diarsipkan dariversi asli(PDF)tanggal 2006-03-18.Diakses tanggal2007-02-04.
- ^Mazo (2002:1–7).
- ^Lee, Y. K. (1995)."Brownian Motion".Imperial College, London. Diarsipkan dariversi aslitanggal 2007-12-18.Diakses tanggal2007-12-18.
- ^Patterson, Gary (2007)."Jean Perrin and the triumph of the atomic doctrine".Endeavour.31(2): 50–53.doi:10.1016/j.endeavour.2007.05.003.Diarsipkandari versi asli tanggal 2008-12-18.Diakses tanggal2008-11-07.
- ^The Nobel Foundation (1906)."J.J. Thomson".Nobelprize.org.Diarsipkandari versi asli tanggal 2013-05-07.Diakses tanggal2007-12-20.
- ^"Frederick Soddy, The Nobel Prize in Chemistry 1921".Nobel Foundation.Diarsipkandari versi asli tanggal 2008-04-09.Diakses tanggal2008-01-18.
- ^Thomson, Joseph John (1913)."Rays of positive electricity".Proceedings of the Royal Society.A 89:1–20.Diarsipkandari versi asli tanggal 2019-03-08.Diakses tanggal2007-01-18.
- ^Stern, David P. (May 16, 2005)."The Atomic Nucleus and Bohr's Early Model of the Atom".NASA Goddard Space Flight Center. Diarsipkan dariversi aslitanggal 2007-08-20.Diakses tanggal2007-12-20.
- ^Bohr, Niels (December 11, 1922)."Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture".The Nobel Foundation.Diarsipkandari versi asli tanggal 2008-04-15.Diakses tanggal2008-02-16.
- ^Lewis, Gilbert N. (1916). "The Atom and the Molecule".Journal of the American Chemical Society.38(4): 762–786.doi:10.1021/ja02261a002.
- ^Scerri, Eric R. (2007).The Periodic Table.Oxford University Press US. hlm.205–226.ISBN0195305736.
- ^Scully, Marlan O. (1987). "On the theory of the Stern-Gerlach apparatus".Foundations of Physics.17(6): 575–583.doi:10.1007/BF01882788.
- ^Brown, Kevin (2007)."The Hydrogen Atom".MathPages.Diarsipkandari versi asli tanggal 2008-05-13.Diakses tanggal2007-12-21.
- ^Harrison, David M. (2000)."The Development of Quantum Mechanics".University of Toronto.Diarsipkandari versi asli tanggal 2007-12-25.Diakses tanggal2007-12-21.
- ^Aston, Francis W. (1920). "The constitution of atmospheric neon".Philosophical Magazine.39(6): 449–55.
- ^Chadwick, James (December 12, 1935)."Nobel Lecture: The Neutron and Its Properties".Nobel Foundation.Diarsipkandari versi asli tanggal 2007-10-12.Diakses tanggal2007-12-21.
- ^Kullander, Sven (August 28, 2001)."Accelerators and Nobel Laureates".The Nobel Foundation.Diarsipkandari versi asli tanggal 2008-04-13.Diakses tanggal2008-01-31.
- ^Staff (October 17, 1990)."The Nobel Prize in Physics 1990".The Nobel Foundation.Diarsipkandari versi asli tanggal 2008-05-14.Diakses tanggal2008-01-31.
- ^Staff (October 15, 1997)."The Nobel Prize in Physics 1997".Nobel Foundation.Diarsipkandari versi asli tanggal 2008-04-09.Diakses tanggal2008-02-10.
- ^Park, Jiwoong; et al. (2002)."Coulomb blockade and the Kondo effect in single-atom transistors".Nature.417(6890): 722–25.doi:10.1038/nature00791.Diarsipkandari versi asli tanggal 2008-01-12.Diakses tanggal2008-01-03.
- ^Domokos, P. (1994)."Single-atom interference method for generating Fock states".Physical Review a.50:3340–44.doi:10.1103/PhysRevA.50.3340.Diarsipkandari versi asli tanggal 2018-10-05.Diakses tanggal2008-01-03.
- ^Demtröder (2002:39–42).
- ^Woan (2000:8).
- ^Particle Data Group (2002)."The Particle Adventure".Lawrence Berkeley Laboratory.Diarsipkandari versi asli tanggal 2007-01-04.Diakses tanggal2007-01-03.
- ^Schombert, James (April 18, 2006)."Elementary Particles".University of Oregon.Diarsipkandari versi asli tanggal 2011-08-30.Diakses tanggal2007-01-03.
- ^(Inggris)Basic Knowledge of Radiation and Radioisotopes (Scientific Basis, Safe Handling of Radioisotopes and Radiation Protection).Japan Radioisotope Association. 2005.ISBN 4-89073-170-9C2040.
- ^Jevremovic (2005:63).
- ^Pfeffer (2000:330–336).
- ^Wenner, Jennifer M. (October 10, 2007)."How Does Radioactive Decay Work?".Carleton College.Diarsipkandari versi asli tanggal 2008-05-11.Diakses tanggal2008-01-09.
- ^abcRaymond, David (April 7, 2006)."Nuclear Binding Energies".New Mexico Tech. Diarsipkan dariversi aslitanggal 2002-12-01.Diakses tanggal2007-01-03.
- ^Mihos, Chris (July 23, 2002)."Overcoming the Coulomb Barrier".Case Western Reserve University.Diarsipkandari versi asli tanggal 2006-09-12.Diakses tanggal2008-02-13.
- ^Staff (March 30, 2007)."ABC's of Nuclear Science".Lawrence Berkeley National Laboratory. Diarsipkan dariversi aslitanggal 2006-12-05.Diakses tanggal2007-01-03.
- ^Makhijani, Arjun (March 2, 2001)."Basics of Nuclear Physics and Fission".Institute for Energy and Environmental Research.Diarsipkandari versi asli tanggal 2007-01-16.Diakses tanggal2007-01-03.
- ^Shultiset al.(2002:72–6).
- ^Fewell, M. P. (1995)."The atomic nuclide with the highest mean binding energy".American Journal of Physics.63(7): 653–58.doi:10.1119/1.17828.Diarsipkandari versi asli tanggal 2013-07-31.Diakses tanggal2007-02-01.
- ^Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding".Science.157(3784): 13–24.doi:10.1126/science.157.3784.13.PMID5338306.
- ^abBrucat, Philip J. (2008)."The Quantum Atom".University of Florida. Diarsipkan dariversi aslitanggal 2006-12-07.Diakses tanggal2007-01-04.
- ^Herter, Terry (2006)."Lecture 8: The Hydrogen Atom".Cornell University.Diarsipkandari versi asli tanggal 2012-02-22.Diakses tanggal2008-02-14.
- ^Bell, R. E. (1950). "Gamma-Rays from the Reaction H1(n,γ)D2and the Binding Energy of the Deuteron ".Physical Review.79(2): 282–285.doi:10.1103/PhysRev.79.282.
- ^Smirnov (2003:249–72).
- ^Matis, Howard S. (August 9, 2000)."The Isotopes of Hydrogen".Guide to the Nuclear Wall Chart.Lawrence Berkeley National Lab. Diarsipkan dariversi aslitanggal 2007-12-18.Diakses tanggal2007-12-21.
- ^abSills (2003:131–134).
- ^Dumé, Belle (April 23, 2003)."Bismuth breaks half-life record for alpha decay".Physics World.Diarsipkandari versi asli tanggal 2007-12-14.Diakses tanggal2007-12-21.
- ^Lindsay, Don (July 30, 2000)."Radioactives Missing From The Earth".Don Lindsay Archive.Diakses tanggal2007-05-23.
- ^CRC Handbook (2002).
- ^abMillset al.(1993).
- ^Chieh, Chung (January 22, 2001)."Nuclide Stability".University of Waterloo. Diarsipkan dariversi aslitanggal 2007-08-30.Diakses tanggal2007-01-04.
- ^"Atomic Weights and Isotopic Compositions for All Elements".National Institute of Standards and Technology.Diarsipkandari versi asli tanggal 2006-12-31.Diakses tanggal2007-01-04.
- ^Audi, G. (2003)."The Ame2003 atomic mass evaluation (II)".Nuclear Physics A.729:337–676.doi:10.1016/j.nuclphysa.2003.11.003.Diarsipkan dariversi aslitanggal 2008-09-16.Diakses tanggal2008-02-07.
- ^Shannon, R. D. (1976)."Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides".Acta Crystallographica,Section a.32:751.doi:10.1107/S0567739476001551.Diarsipkandari versi asli tanggal 2007-09-30.Diakses tanggal2007-01-03.
- ^Dong, Judy (1998)."Diameter of an Atom".The Physics Factbook. Diarsipkan dariversi aslitanggal 2007-11-04.Diakses tanggal2007-11-19.
- ^Zumdahl (2002).
- ^Staff (2007)."Small Miracles: Harnessing nanotechnology".Oregon State University. Diarsipkan dariversi aslitanggal 2007-12-04.Diakses tanggal2007-01-07.—describes the width of a human hair as 105nm and 10 carbon atoms as spanning 1 nm.
- ^Padillaet al.(2002:32)— "There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ^Feynman (1995).
- ^ab"Radioactivity".Splung.com.Diarsipkandari versi asli tanggal 2007-12-04.Diakses tanggal2007-12-19.
- ^L'Annunziata (2003:3–56).
- ^Firestone, Richard B. (May 22, 2000)."Radioactive Decay Modes".Berkeley Laboratory. Diarsipkan dariversi aslitanggal 2006-09-29.Diakses tanggal2007-01-07.
- ^Hornak, J. P. (2006)."Chapter 3: Spin Physics".The Basics of NMR.Rochester Institute of Technology.Diarsipkandari versi asli tanggal 2007-02-03.Diakses tanggal2007-01-07.
- ^abSchroeder, Paul A. (February 25, 2000)."Magnetic Properties".University of Georgia. Diarsipkan dariversi aslitanggal 2007-04-29.Diakses tanggal2007-01-07.
- ^Goebel, Greg (September 1, 2007)."[4.3] Magnetic Properties of the Atom".Elementary Quantum Physics.In The Public Domain website.Diarsipkandari versi asli tanggal 2011-09-07.Diakses tanggal2007-01-07.
- ^Yarris, Lynn (Spring 1997)."Talking Pictures".Berkeley Lab Research Review.Diarsipkan dariversi aslitanggal 2008-01-13.Diakses tanggal2008-01-09.
- ^Liang and Haacke (1999:412–26).
- ^Zeghbroeck, Bart J. Van (1998)."Energy levels".Shippensburg University. Diarsipkan dariversi aslitanggal 2005-01-15.Diakses tanggal2007-12-23.
- ^Fowles (1989:227–233).
- ^Martin, W. C. (2007)."Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas".National Institute of Standards and Technology.Diarsipkandari versi asli tanggal 2007-02-08.Diakses tanggal2007-01-08.
- ^"Atomic Emission Spectra — Origin of Spectral Lines".Avogadro Web Site. Diarsipkan dariversi aslitanggal 2006-02-28.Diakses tanggal2006-08-10.
- ^Fitzpatrick, Richard (February 16, 2007)."Fine structure".University of Texas at Austin.Diarsipkandari versi asli tanggal 2011-09-27.Diakses tanggal2008-02-14.
- ^Weiss, Michael (2001)."The Zeeman Effect".University of California-Riverside.Diarsipkandari versi asli tanggal 2008-02-02.Diakses tanggal2008-02-06.
- ^Beyer (2003:232–236).
- ^Reusch, William (July 16, 2007)."Virtual Textbook of Organic Chemistry".Michigan State University. Diarsipkan dariversi aslitanggal 2007-10-29.Diakses tanggal2008-01-11.
- ^"Covalent bonding - Single bonds".chemguide. 2000.Diarsipkandari versi asli tanggal 2018-09-25.Diakses tanggal2009-07-27.
- ^Husted, Robert; et al. (December 11, 2003)."Periodic Table of the Elements".Los Alamos National Laboratory.Diarsipkandari versi asli tanggal 2008-01-10.Diakses tanggal2008-01-11.
- ^Baum, Rudy (2003)."It's Elemental: The Periodic Table".Chemical & Engineering News.Diarsipkandari versi asli tanggal 2011-04-06.Diakses tanggal2008-01-11.
- ^Goodstein (2002:436–438).
- ^Brazhkin, Vadim V. (2006). "Metastable phases, phase transformations, and phase diagrams in physics and chemistry".Physics-Uspekhi.49:719–24.doi:10.1070/PU2006v049n07ABEH006013.
- ^Myers (2003:85).
- ^Staff (October 9, 2001)."Bose-Einstein Condensate: A New Form of Matter".National Institute of Standards and Technology. Diarsipkan dariversi aslitanggal 2008-01-03.Diakses tanggal2008-01-16.
- ^Colton, Imogen (February 3, 1999)."Super Atoms from Bose-Einstein Condensation".The University of Melbourne. Diarsipkan dariversi aslitanggal 2007-08-29.Diakses tanggal2008-02-06.
- ^Jakubowski, N. (1998). "Sector field mass spectrometers in ICP-MS".Spectrochimica Acta Part B: Atomic Spectroscopy.53(13): 1739–63.doi:10.1016/S0584-8547(98)00222-5.
- ^Müller, Erwin W.;Panitz, John A.;McLane, S. Brooks(1968). "The Atom-Probe Field Ion Microscope".Review of Scientific Instruments.39(1): 83–86.doi:10.1063/1.1683116.ISSN0034-6748.
- ^Lochner, Jim (April 30, 2007)."What Do Spectra Tell Us?".NASA/Goddard Space Flight Center.Diarsipkandari versi asli tanggal 2008-01-16.Diakses tanggal2008-01-03.
- ^Winter, Mark (2007)."Helium".WebElements.Diarsipkandari versi asli tanggal 2007-12-30.Diakses tanggal2008-01-03.
- ^Hinshaw, Gary (February 10, 2006)."What is the Universe Made Of?".NASA/WMAP.Diarsipkandari versi asli tanggal 2007-12-31.Diakses tanggal2008-01-07.
- ^Choppinet al.(2001).
- ^Davidsen, Arthur F. (1993)."Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission".Science.259(5093): 327–34.doi:10.1126/science.259.5093.327.PMID17832344.Diarsipkandari versi asli tanggal 2008-01-11.Diakses tanggal2008-01-07.
- ^Lequeux (2005:4).
- ^Smith, Nigel (January 6, 2000)."The search for dark matter".Physics World.Diarsipkandari versi asli tanggal 2008-02-16.Diakses tanggal2008-02-14.
- ^Croswell, Ken (1991)."Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium".New Scientist(1794): 42. Diarsipkan dariversi aslitanggal 2008-02-07.Diakses tanggal2008-01-14.
- ^Copi, Craig J. (1995)."Big-Bang Nucleosynthesis and the Baryon Density of the Universe"(PDF).Science.267:192–99.doi:10.1126/science.7809624.PMID7809624.Diarsipkan(PDF)dari versi asli tanggal 2008-02-27.Diakses tanggal2008-01-13.
- ^Hinshaw, Gary (December 15, 2005)."Tests of the Big Bang: The Light Elements".NASA/WMAP.Diarsipkandari versi asli tanggal 2008-01-17.Diakses tanggal2008-01-13.
- ^Abbott, Brian (May 30, 2007)."Microwave (WMAP) All-Sky Survey".Hayden Planetarium.Diarsipkandari versi asli tanggal 2013-02-13.Diakses tanggal2008-01-13.
- ^F. Hoyle (1946)."The synthesis of the elements from hydrogen".Monthly Notices of the Royal Astronomical Society.106:343–83.Diarsipkandari versi asli tanggal 2008-03-05.Diakses tanggal2008-01-13.
- ^Knauth, D. C. (2000). "Newly synthesized lithium in the interstellar medium".Nature.405:656–58.doi:10.1038/35015028.
- ^Mashnik, Stepan G. (2000)."On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes".Cornell University.Diarsipkandari versi asli tanggal 2015-03-19.Diakses tanggal2008-01-14.
- ^Kansas Geological Survey (May 4, 2005)."Age of the Earth".University of Kansas. Diarsipkan dariversi aslitanggal 2008-07-05.Diakses tanggal2008-01-14.
- ^abManuel (2001:407–430,511–519).
- ^Dalrymple, G. Brent (2001)."The age of the Earth in the twentieth century: a problem (mostly) solved".Geological Society, London, Special Publications.190:205–21.doi:10.1144/GSL.SP.2001.190.01.14.Diarsipkandari versi asli tanggal 2007-11-11.Diakses tanggal2008-01-14.
- ^Anderson, Don L.(September 2, 2006)."Helium: Fundamental models".MantlePlumes.org.Diarsipkandari versi asli tanggal 2007-02-08.Diakses tanggal2007-01-14.
- ^Pennicott, Katie (May 10, 2001)."Carbon clock could show the wrong time".PhysicsWeb.Diarsipkandari versi asli tanggal 2007-12-15.Diakses tanggal2008-01-14.
- ^Yarris, Lynn (July 27, 2001)."New Superheavy Elements 118 and 116 Discovered at Berkeley Lab".Berkeley Lab.Diarsipkandari versi asli tanggal 2008-01-09.Diakses tanggal2008-01-14.
- ^Diamond, H.; et al. (1960)."Heavy Isotope Abundances in Mike Thermonuclear Device"(subscription required).Physical Review.119:2000–04.doi:10.1103/PhysRev.119.2000.Diarsipkandari versi asli tanggal 2011-11-12.Diakses tanggal2008-01-14.
- ^Poston Sr., John W. (March 23, 1998)."Do transuranic elements such as plutonium ever occur naturally?".Scientific American.Diarsipkandari versi asli tanggal 2008-10-01.Diakses tanggal2008-01-15.
- ^Keller, C. (1973)."Natural occurrence of lanthanides, actinides, and superheavy elements".Chemiker Zeitung.97(10): 522–30.Diarsipkandari versi asli tanggal 2008-10-01.Diakses tanggal2008-01-15.
- ^Marco (2001:17).
- ^"Oklo Fossil Reactors".Curtin University of Technology. Diarsipkan dariversi aslitanggal 2007-12-18.Diakses tanggal2008-01-15.
- ^Weisenberger, Drew."How many atoms are there in the world?".Jefferson Lab.Diarsipkandari versi asli tanggal 2007-10-22.Diakses tanggal2008-01-16.
- ^Pidwirny, Michael."Fundamentals of Physical Geography".University of British Columbia Okanagan.Diarsipkandari versi asli tanggal 2008-01-21.Diakses tanggal2008-01-16.
- ^Anderson, Don L. (2002)."The inner inner core of Earth".Proceedings of the National Academy of Sciences.99(22): 13966–68.doi:10.1073/pnas.232565899.PMID12391308.Diakses tanggal2008-01-16.
- ^Anonymous (October 2, 2001)."Second postcard from the island of stability".CERN Courier.Diarsipkandari versi asli tanggal 2008-02-03.Diakses tanggal2008-01-14.
- ^Jacoby, Mitch (2006)."As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine".Chemical & Engineering News.84(10): 19.Diarsipkandari versi asli tanggal 2012-07-15.Diakses tanggal2008-01-14.
- ^Koppes, Steve (March 1, 1999)."Fermilab Physicists Find New Matter-Antimatter Asymmetry".University of Chicago.Diarsipkandari versi asli tanggal 2008-07-19.Diakses tanggal2008-01-14.
- ^Cromie, William J. (August 16, 2001)."A lifetime of trillionths of a second: Scientists explore antimatter".Harvard University Gazette.Diarsipkandari versi asli tanggal 2016-03-03.Diakses tanggal2008-01-14.
- ^Hijmans, Tom W. (2002). "Particle physics: Cold antihydrogen".Nature.419:439–40.doi:10.1038/419439a.
- ^Staff (October 30, 2002)."Researchers 'look inside' antimatter".BBC News.Diarsipkandari versi asli tanggal 2007-02-22.Diakses tanggal2008-01-14.
- ^Barrett, Roger (1990)."The Strange World of the Exotic Atom".New Scientist(1728): 77–115. Diarsipkan dariversi aslitanggal 2007-12-21.Diakses tanggal2008-01-04.
- ^Indelicato, Paul (2004). "Exotic Atoms".Physica Scripta.T112:20–26.doi:10.1238/Physica.Topical.112a00020.
- ^Ripin, Barrett H. (1998)."Recent Experiments on Exotic Atoms".American Physical Society.Diarsipkandari versi asli tanggal 2012-07-23.Diakses tanggal2008-02-15.
Referensi buku
- L'Annunziata, Michael F. (2003).Handbook of Radioactivity Analysis.Academic Press.ISBN0124366031.OCLC162129551.
- Beyer, H. F. (2003).Introduction to the Physics of Highly Charged Ions.CRC Press.ISBN0750304812.OCLC47150433.
- Choppin, Gregory R. (2001).Radiochemistry and Nuclear Chemistry.Elsevier.ISBN0750674636.OCLC162592180.
- Dalton, J.(1808).A New System of Chemical Philosophy, Part 1.London and Manchester: S. Russell.
- Demtröder, Wolfgang (2002).Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics(edisi ke-1st). Springer.ISBN3540206310.OCLC181435713.
- Feynman, Richard(1995).Six Easy Pieces.The Penguin Group.ISBN978-0-140-27666-4.OCLC40499574.
- Fowles, Grant R. (1989).Introduction to Modern Optics.Courier Dover Publications.ISBN0486659577.OCLC18834711.
- Gangopadhyaya, Mrinalkanti (1981).Indian Atomism: History and Sources.Atlantic Highlands, New Jersey: Humanities Press.ISBN0-391-02177-X.OCLC10916778.
- Goodstein, David L. (2002).States of Matter.Courier Dover Publications.ISBN 0-486-49506-X.
- Harrison, Edward Robert (2003).Masks of the Universe: Changing Ideas on the Nature of the Cosmos.Cambridge University Press.ISBN0521773512.OCLC50441595.
- Iannone, A. Pablo (2001).Dictionary of World Philosophy.Routledge.ISBN0415179955.OCLC44541769.
- Jevremovic, Tatjana (2005).Nuclear Principles in Engineering.Springer.ISBN0387232842.OCLC228384008.
- Lequeux, James (2005).The Interstellar Medium.Springer.ISBN3540213260.OCLC133157789.
- Levere, Trevor, H. (2001).Transforming Matter – A History of Chemistry for Alchemy to the Buckyball.The Johns Hopkins University Press.ISBN0-8018-6610-3.
- Liang, Z.-P. (1999). Webster, J. G., ed.Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging(PDF).vol. 2. John Wiley & Sons. hlm. 412–26.ISBN0471139467.Diakses tanggal2008-01-09.
- MacGregor, Malcolm H. (1992).The Enigmatic Electron.Oxford University Press.ISBN0195218337.OCLC223372888.
- Manuel, Oliver (2001).Origin of Elements in the Solar System: Implications of Post-1957 Observations.Springer.ISBN0306465620.OCLC228374906.
- Mazo, Robert M. (2002).Brownian Motion: Fluctuations, Dynamics, and Applications.Oxford University Press.ISBN0198515677.OCLC48753074.
- Mills, Ian (1993).Quantities, Units and Symbols in Physical Chemistry(edisi ke-2nd). Oxford:International Union of Pure and Applied Chemistry,Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications.ISBN0-632-03583-8.OCLC27011505.
- Moran, Bruce T. (2005).Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution.Harvard University Press.ISBN0674014952.
- Myers, Richard (2003).The Basics of Chemistry.Greenwood Press.ISBN0313316643.OCLC50164580.
- Padilla, Michael J. (2002).Prentice Hall Science Explorer: Chemical Building Blocks.Upper Saddle River, New Jersey USA: Prentice-Hall, Inc.ISBN0-13-054091-9.OCLC47925884.
- Pauling, Linus (1960).The Nature of the Chemical Bond.Cornell University Press.ISBN0801403332.OCLC17518275.
- Pfeffer, Jeremy I. (2000).Modern Physics: An Introductory Text.Imperial College Press.ISBN1860942504.OCLC45900880.
- Ponomarev, Leonid Ivanovich (1993).The Quantum Dice.CRC Press.ISBN0750302518.OCLC26853108.
- Scerri, Eric R. (2007).The Periodic Table.Oxford University Press.ISBN0195305736.
- Shultis, J. Kenneth (2002).Fundamentals of Nuclear Science and Engineering.CRC Press.ISBN0824708342.OCLC123346507.
- Siegfried, Robert (2002).From Elements to Atoms: A History of Chemical Composition.DIANE.ISBN0871699249.OCLC186607849.
- Sills, Alan D. (2003).Earth Science the Easy Way.Barron's Educational Series.ISBN0764121464.OCLC51543743.
- Smirnov, Boris M. (2003).Physics of Atoms and Ions.Springer.ISBN 0-387-95550-X.
- Teresi, Dick (2003).Lost Discoveries: The Ancient Roots of Modern Science.Simon & Schuster. hlm. 213–214.ISBN074324379X.Diarsipkandari versi asli tanggal 2023-03-27.Diakses tanggal2009-07-28.
- Various (2002). Lide, David R., ed.Handbook of Chemistry & Physics(edisi ke-88th). CRC.ISBN0849304865.OCLC179976746.Diarsipkan dariversi aslitanggal 2017-07-24.Diakses tanggal2008-05-23.
- Woan, Graham (2000).The Cambridge Handbook of Physics.Cambridge University Press.ISBN0521575079.OCLC224032426.
- Wurtz, Charles Adolphe (1881).The Atomic Theory.New York: D. Appleton and company.
- Zaider, Marco (2001).Radiation Science for Physicians and Public Health Workers.Springer.ISBN0306464039.OCLC44110319.
- Zumdahl, Steven S. (2002).Introductory Chemistry: A Foundation(edisi ke-5th). Houghton Mifflin.ISBN0-618-34342-3.OCLC173081482.Diarsipkan dariversi aslitanggal 2008-03-04.Diakses tanggal2008-02-05.
Pranala luar
- Francis, Eden (2002)."Atomic Size".Clackamas Community College. Diarsipkan dariversi aslitanggal 2007-02-04.Diakses tanggal2007-01-09.
- Freudenrich, Craig C."How Atoms Work".How Stuff Works.Diakses tanggal2007-01-09.
- "Atom:The Atom".Free High School Science Texts: Physics.Wikibooks. Diarsipkan dariversi aslitanggal 2006-06-13.Diakses tanggal2007-01-09.
- Anonymous (2007)."The atom".Science aid+.Diakses tanggal2007-01-09.
- Anonymous (2006-01-03)."Atoms and Atomic Structure".BBC.Diakses tanggal2007-01-11.
- Various (2006-01-03)."Physics 2000, Table of Contents".University of Colorado. Diarsipkan dariversi aslitanggal 2008-01-14.Diakses tanggal2008-01-11.
- Various (2006-02-03)."What does an atom look like?".University of Karlsruhe.Diakses tanggal2008-05-12.

![{\displaystyle {\begin{smallmatrix}1,07{\sqrt[{3}]{A}}\end{smallmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73abec12e0273707a961f1ac2a790764a2436904)
