Antibodi
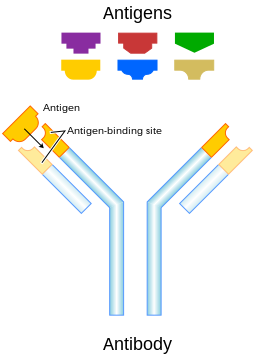
Antibodi(disingkatAb), juga dikenal sebagaiimunoglobulin(disingkatIg),[1]adalahproteinberukuran besar berbentuk huruf Y yang digunakan olehsistem imununtuk mengidentifikasi dan menetralkan benda asing sepertibakteridanviruspatogen.Antibodi mengenali molekul unik milik patogen, yang disebutantigen.[2][3]Setiap ujung "Y" dari antibodi berisiparatop(dianalogikan dengan gembok) yang spesifik untuk satuepitoptertentu (dianalogikan dengan kunci) pada antigen, yang memungkinkan kedua struktur ini berikatan secara presisi. Dengan menggunakan mekanisme pengikatan ini, antibodi dapat menandaimikroorganismeatau sel yang terinfeksi untuk diserang oleh komponen sistem imun lainnya atau dapat menetralkannya secara langsung (misalnya dengan memblokir bagian dari virus yang penting untuk invasi).
Untuk memungkinkan sistem imun mengenali jutaan antigen yang berbeda, situs pengikatan antigen di kedua ujung antibodi juga memiliki variasi yang sama banyaknya. Sementara itu, bagian antibodi sisanya relatif konstan. Antibodi punya beberapa varian yang menentukankelasatauisotipe antibodi,yaituIgA,IgD,IgE,IgG,atauIgM.Di batang tubuh antibodi yang relatif konstan, terdapat situs yang terlibat dalam interaksi dengan komponen sistem imun lainnya. Oleh karena itu, pembagian kelas tersebut menentukan fungsi yang dipicu oleh antibodi setelah mengikat antigen, selain perbedaan karakteristik struktural. Perbedaan kelas antibodi juga memengaruhi perbedaan tempat mereka dilepaskan di dalam tubuh dan pada tahapan respons imun apa.
Bersama dengansel Bdansel T,antibodi merupakan bagian terpenting darisistem imun adaptif.Mereka hadir dalam dua bentuk: melekat pada sel B atau dalam bentuk terlarut dalamcairan ekstraselulersepertiplasma darah.Awalnya, antibodi menempel ke permukaan sel B – mereka disebut sebagaireseptor sel B(BCR). Setelah antigen berikatan dengan BCR, sel B teraktivasi untuk berkembang biak dan berdiferensiasi menjadisel plasma(yang mensekresikan antibodi-yang-dapat-larut dengan paratop yang sama) atau menjadisel B memori(yang bertahan di dalam tubuh untuk mengaktifkan kekebalan jangka panjang terhadap antigen).[4]Antibodi yang larut dilepaskan ke dalamdarahdancairan ekstraseluler,serta banyaksekresi.Karena cairan juga disebut sebagaihumor,imunitas yang dimediasi oleh antibodi kadang-kadang dikenal sebagai, atau dianggap sebagai bagian dari,imunitas humoral.[5]Unit berbentuk Y dapat berdiri sendiri sebagaimonomeratau terangkai dalam kompleks molekul yang terdiri dari dua hingga lima unit.
Antibodi merupakanglikoproteinyang termasuk dalamsuperfamili imunoglobulin.Istilah antibodi dan imunoglobulin sering digunakan secara bergantian,[1]meskipun istilah 'antibodi' kadang-kadang digunakan untuk bentuk yang disekresikan dan larut, dengan kata lain, tidak termasuk reseptor sel B.[6]
Antibodi berperan pada imunitas tubuh sebagai pencegah patogen yang masuk atau merusak sel dengan cara mengikatnya, merangsang penghancuran patogen dengan melapisinya oleh makrofag dan sel lain; dan memicu kerusakan patogen dengan menstimulasi respon imun lain seperti jalurkomplemen.[7]
Struktur[sunting|sunting sumber]
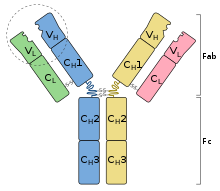
Antibodi merupakan protein yang berat (~150 kDa) dengan ukuran sekitar 10nm.[8]Molekul ini tersusun dalam tiga daerah globular yang secara kasar membentuk huruf Y.
Pada manusia dan kebanyakanmamalia,sebuah unit antibodi terdiri dari empatrantai polipeptida,yaitu duarantai beratyang identik dan duarantai ringanyang identik; mereka dihubungkan olehikatan disulfida.[9]Setiap rantai merupakan serangkaiandomain:urutan yang agak mirip yang masing-masing terdiri atas sekitar 110asam amino.Domain ini biasanya direpresentasikan dalam skema yang disederhanakan sebagai persegi panjang. Rantai ringan terdiri dari satu domain variabel VLdan satu domain konstan CL,sedangkan rantai berat berisi satu domain variabel VHdan tiga sampai empat domain konstan CH1, CH2, dan seterusnya.[10]
Secara struktural, antibodi juga dibagi menjadi dua fragmen pengikat antigen (Fab), yang masing-masing mengandung satu domain VL,VH,CL,dan CH1, serta fragmen yang dapat mengkristal (Fc), yang membentuk bagian batang huruf Y.[11]Di antara mereka terdapat daerah engsel rantai berat yang fleksibilitasnya memungkinkan antibodi untuk mengikat pasangan epitop pada berbagai jarak, untuk membentuk kompleks molekul (dimer,trimer, dll.), serta untuk mengikat molekul efektor dengan lebih mudah.[12]
Kelas[sunting|sunting sumber]
Antibodi memiliki berbagai variasi yang dikenal sebagaiisotipeataukelas.Pada mamaliaberplasenta,terdapat lima kelas antibodi yang dikenal sebagai IgA, IgD, IgE, IgG, dan IgM, yang selanjutnya dibagi lagi menjadi subkelas seperti IgA1, IgA2. Awalan "Ig" adalah singkatan dariimunoglobulin,sedangkan akhirannya menunjukkan jenis rantai berat yang dikandung antibodi: jenis rantai berat α (alfa), γ (gamma), δ (delta), ε (epsilon), dan μ (mu) yang merupakan dasar penamaan bagi IgA, IgG, IgD, IgE, dan IgM. Ciri khas setiap kelas ditentukan oleh bagian dari rantai berat di dalam engsel dan wilayah Fc.[2]
Tiap-tiap kelas memiliki perbedaan dalam sifat biologis, lokasi fungsional, dan kemampuan untuk menangani antigen, seperti yang digambarkan dalam tabel.[9]Misalnya, antibodiIgEbertanggung jawab atas responsalergiyang mencakup pelepasanhistamindarisel mast,yang berkontribusi padaasma.Wilayah variabel antibodi berikatan dengan antigen penyebab alergi, misalnya partikeltungau debu rumah,sedangkan wilayah Fc-nya (dalam rantai berat ε) berikatan denganreseptor Fc εpada sel mast, yang memicudegranulasinya(pelepasan molekul yang disimpan dalam granulanya).[13]
| Kelas | Subkelas | Deskripsi |
|---|---|---|
| IgA | 2 | IgA ditemukan di areamukosa,sepertiusus,saluran pernapasan,dansaluran urogenital,serta mencegah kolonisasi olehpatogen;[14]juga ditemukan dalam air liur, air mata, dan ASI. |
| IgD | 1 | Fungsi IgD terutama sebagai reseptor antigen pada sel B yang belum terpapar antigen,[15]serta mengaktifkanbasofildansel mastuntuk menghasilkan faktorantimikrob.[16] |
| IgE | 1 | IgE mengikatalergendan memicu pelepasanhistamindarisel mastdanbasofil,dan terlibat dalamalergi,serta melindungi daricacing parasitik.[5] |
| IgG | 4 | Dalam empat bentuknya, IgG memberikan sebagian besar kekebalan berbasis antibodi terhadap patogen yang menyerang. Satu-satunya antibodi yang mampu melewatiplasentauntuk memberikan kekebalan pasif padajanin. |
| IgM | 1 | IgM diekspresikan di permukaan sel B (monomer) dan dalam bentuk tersekresi (pentamer) denganaviditasyang sangat tinggi. Menghilangkan patogen pada tahap awal imunitas seluler B (humoral) sebelum IgG mencukupi.[5][15] |
Isotipe antibodi dari sel limfosit B berubah selama perkembangan dan aktivasi sel tersebut. Sel B belum matang, yang tidak pernah terpapar antigen, hanya mengekspresikan isotipe IgM dalam bentuk terikat di permukaan sel. Dalam bentuk yang siap merespons ini, limfosit B dikenal sebagai "limfosit B naif".Limfosit B naif mengekspresikan IgM dan IgD di permukaannya. Koekspresi dari kedua isotipe imunoglobulin ini membuat sel B siap untuk merespons antigen.[17]Aktivasi sel B mengikuti keterlibatan molekul antibodi (yang terikat-sel) dengan antigen, yang menyebabkan sel membelah danberdiferensiasimenjadi sel penghasil antibodi yang disebutsel plasma.Dalam bentuk teraktivasi ini, sel B mulai memproduksi antibodi dalam bentuktersekresikanalih-alih dalam bentuk terikatmembran.Beberapasel anakdari sel B yang teraktivasi mengalamiperalihan isotipe,suatu mekanisme yang menyebabkan produksi antibodi berubah dari IgM atau IgD menjadi isotipe antibodi lain, IgE, IgA, atau IgG, yang memiliki peran tertentu dalam sistem imun.
Penerapan medis[sunting|sunting sumber]
Diagnosa penyakit
Pada akhir abad ke-19, para ilmuwan yang menyelidiki penyakit menular mengembangkan teknik diagnostik baru beserta cara terapinya. Alat baru muncul dari pemahaman yang berkembang tentang sistem kekebalan dan peran antitoksin (antibodi) yang diproduksi tubuh sebagai respons terhadap organisme atau racun (antigen) yang menyerang. Para ilmuwan merancang tes untuk mendeteksi adanya antibodi dalam darah dan menggunakan antigen untuk memicu responsimun.Tes ini memberikan informasi mengenai riwayat penyakit pasien, termasuk infeksi yang sedang dialami serta paparan penyakit sebelumnya. Pengujian dapat mengungkap infeksi sebelum gejala luar muncul dan membantu mengidentifikasi pembawa penyakit atau individu tanpa gejala namun ia terpapar suatu penyakit.[18]
Terapi penyakit
Behring dan Kitasato menemukan terapi antibodi pasif yang dapat melindungi dari racun bakteri. Pada awal 1890-an dan 1930-an terapi serum digunakan secara luas untuk mengobati berbagai penyakit menular. Namun, popularitas terapi serum antibodi terjadi pada waktu yang hampir bersamaan denganantibiotikpertama dikembangkan, dan antibiotik menjadi lebih banyak tersedia, sehingga penggunaan terapi serum menurun. Pada akhir 1940-an sebagian besar telah ditinggalkan.Preparatimunoglobulintersedia untuk mengobati beberapa infeksi, sepertihepatitis B,rabiesdanvirus varicella-zoster,hanya satu antibodi monoklonal (palivizumab) yang telah dilisensikan untuk mencegah penyakit menular.[19]
Antibodi mampu memediasi berbagai efek biologis yang berbeda termasuk tidak bergantung pada komponen lain dari sistem kekebalan tubuh, seperti menetralkan racun dan virus, mengaktifkan komplemen, serta efek yang melibatkan komponen lain dari sistem kekebalan tubuh, sepertisitotoksisitasdanopsonisasiseluler yang bergantung pada antibodi. Selain itu, efek antibodi dapat sinergis dengan efek terapi antimikroba konvensional, dan waktu untuk mengembangkan sediaan antibodi terapeutik akan jauh lebih singkat daripada waktu pengembangan vaksin.[19]
Antibodi dapat dengan mudah dimodifikasi untuk menargetkan sel inang. Salah satu strateginya adalah radioimunoterapi, di mana radionuklida dilekatkan pada molekul antibodi.[19]
Terapi prenatal
Faktor Rhesus (Rh) yang juga disebut sebagai antigen Rh D merupakan antigen yang terdapat pada sel darah merah. Individu dengan Rh-positif (Rh +) memiliki antigen ini pada sel darah merahnya dan individu yang Rh-negatif (Rh–) tidak. Selama persalinan normal, trauma persalinan atau komplikasi selama kehamilan, darah dari janin dapat masuk ke dalam sistem tubuh ibu. Dalam kasus ibu dan anak yang memiliki ketidakcocokan Rh, pencampuran darah konsekuensial dapat membuat ibu Rh-sensitif terhadap antigen Rh pada sel darah anak Rh +, menempatkan sisa kehamilan, dan setiap kehamilan berikutnya bisa berisiko terhadap penyakit hemolitik pada bayi yang baru lahir.[20]
Pengobatan pranatal dengan diberikan Antibodi anti-RhD bertujuan untuk mencegah sensitisasi yang mungkin terjadi ketika ibu dengan Rh-negatif memiliki janin dengan Rh-positif. Pengobatan ibu dengan antibodi Anti-RhD sebelum dan sesaat setelah trauma persalinan menghancurkan antigen Rh dalam sistem ibu dari janin. Pengobatan Rho (D) Immune Globulin mencegah sensitisasi yang dapat menyebabkan penyakit Rh, tetapi tidak mencegah atau mengobati penyakit yang mendasari itu sendiri.[21]
Referensi[sunting|sunting sumber]
- ^abRhoades RA, Pflanzer RG (2002).Human Physiology
 (edisi ke-5th). Thomson Learning. hlm.584.ISBN978-0-534-42174-8.
(edisi ke-5th). Thomson Learning. hlm.584.ISBN978-0-534-42174-8.
- ^abJaneway, Charles (2001).Immunobiology
 (edisi ke-5th). Garland Publishing.ISBN978-0-8153-3642-6.
(edisi ke-5th). Garland Publishing.ISBN978-0-8153-3642-6.
- ^Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT (January 1993). "Phylogenetic diversification of immunoglobulin genes and the antibody repertoire".Molecular Biology and Evolution.10(1): 60–72.doi:10.1093/oxfordjournals.molbev.a040000.PMID8450761.
- ^Borghesi L, Milcarek C (2006). "From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion".Immunologic Research.36(1–3): 27–32.doi:10.1385/IR:36:1:27.PMID17337763.
- ^abcPier GB, Lyczak JB, Wetzler LM (2004).Immunology, Infection, and Immunity.ASM Press.ISBN978-1-55581-246-1.
- ^"MeSH Browser – Immunoglobulins".meshb.nlm.nih.gov.Diakses tanggal2020-10-25.
- ^"Humoral Immune Response | Boundless Anatomy and Physiology".courses.lumenlearning.com.Diakses tanggal2021-03-26.
- ^Reth M (August 2013)."Matching cellular dimensions with molecular sizes"(PDF).Nature Immunology.14(8): 765–7.doi:10.1038/ni.2621.PMID23867923.Diarsipkan dariversi asli(PDF)tanggal 2018-05-02.Diakses tanggal2020-12-23.
- ^abWoof JM, Burton DR (February 2004). "Human antibody-Fc receptor interactions illuminated by crystal structures".Nature Reviews. Immunology.4(2): 89–99.doi:10.1038/nri1266.PMID15040582.
- ^Barclay AN (August 2003). "Membrane proteins with immunoglobulin-like domains—a master superfamily of interaction molecules".Seminars in Immunology.15(4): 215–23.doi:10.1016/S1044-5323(03)00047-2.PMID14690046.
- ^Putnam FW, Liu YS, Low TL (April 1979). "Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain".The Journal of Biological Chemistry.254(8): 2865–74.PMID107164.
- ^Delves, Peter J; Martin, Seamus J; Burton, Dennis R; Roitt, Ivan M (2017).Roitt's essential immunology(dalam bahasa Inggris) (edisi ke-13th). Chichester, West Sussex.ISBN978-1-118-41577-1.OCLC949912256.
- ^Williams CM, Galli SJ (May 2000). "The diverse potential effector and immunoregulatory roles of mast cells in allergic disease".The Journal of Allergy and Clinical Immunology.105(5): 847–59.doi:10.1067/mai.2000.106485.PMID10808163.
- ^Underdown BJ, Schiff JM (1986). "Immunoglobulin A: strategic defense initiative at the mucosal surface".Annual Review of Immunology.4(1): 389–417.doi:10.1146/annurev.iy.04.040186.002133.PMID3518747.
- ^abGeisberger R, Lamers M, Achatz G (August 2006)."The riddle of the dual expression of IgM and IgD".Immunology.118(4): 429–37.doi:10.1111/j.1365-2567.2006.02386.x.PMC1782314
 .PMID16895553.
.PMID16895553.
- ^Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A (August 2009)."Immunoglobulin D enhances immune surveillance by activating antimicrobial, proinflammatory and B cell-stimulating programs in basophils".Nature Immunology.10(8): 889–98.doi:10.1038/ni.1748.PMC2785232
 .PMID19561614.
.PMID19561614.
- ^Goding JW (1978). "Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation".Allotypes of IgM and IgD receptors in the mouse: A probe for lymphocyte differentiation.Contemporary Topics in Immunobiology.8.hlm. 203–43.doi:10.1007/978-1-4684-0922-2_7.ISBN978-1-4684-0924-6.PMID357078.
- ^"Diagnosing Disease with Antibodies".Smithsonian Institution(dalam bahasa Inggris).Diakses tanggal2021-03-25.
- ^abcCasadevall, Arturo; Dadachova, Ekaterina; Pirofski, Liise-anne (2004-09)."Passive antibody therapy for infectious diseases".Nature Reviews Microbiology(dalam bahasa Inggris).2(9): 695–703.doi:10.1038/nrmicro974.ISSN1740-1534.
- ^Urbaniak, S. J.; Greiss, M. A. (2000-03-01)."RhD haemolytic disease of the fetus and the newborn".Blood Reviews(dalam bahasa Inggris).14(1): 44–61.doi:10.1054/blre.1999.0123.ISSN0268-960X.
- ^"Prevention of Rh Alloimmunization".Journal of Obstetrics and Gynaecology Canada(dalam bahasa Inggris).25(9): 765–773. 2003-09-01.doi:10.1016/S1701-2163(16)31006-4.ISSN1701-2163.
Pranala luar[sunting|sunting sumber]
- Mike's Immunoglobulin Structure/Function PageDiarsipkan1997-08-06 diWayback Machine.atUniversity of Cambridge
- Antibodies as the PDB molecule of the monthDiarsipkan2010-04-14 diWayback Machine.Discussion of the structure of antibodies atProtein Data Bank
- Download Post UTME Past Questions and Answers pdfDiarsipkan2020-10-01 diWayback Machine.
- Microbiology and Immunology On-line Textbook
- A hundred years of antibody therapy
- How Lymphocytes Produce Antibodyfrom Cells Alive!
- Antibody applicationsimage library,University of Birmingham
- Images produced using antibodiesDiarsipkan2011-05-10 diWayback Machine.at antibodypatterns.com
- Antibody database, search by reactivity, host species, applications and conjugateat biocompare.com
- Antibody Libraries[pranala nonaktif permanen]at creative-biolabs.com
- http://www.genetex.com/Web/ResearchArea/ResearchArea.aspx?Path=/Cancer&reAreaCode=01/ Cancer antibodies]
