Mangan
25Mn Mangan | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Kubus mangan murni dan potongan mangan teroksidasi | ||||||||||||||||||||||||||||||||
Garis spektrum mangan | ||||||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||||||
| Pengucapan | /mangan/[1] | |||||||||||||||||||||||||||||||
| Penampilan | metalik keperakan | |||||||||||||||||||||||||||||||
| Mangan dalamtabel periodik | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Nomor atom(Z) | 25 | |||||||||||||||||||||||||||||||
| Golongan | golongan 7 | |||||||||||||||||||||||||||||||
| Periode | periode 4 | |||||||||||||||||||||||||||||||
| Blok | blok-d | |||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | |||||||||||||||||||||||||||||||
| Berat atom standar(Ar) |
| |||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Ar] 4s23d5 | |||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 13, 2 | |||||||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||||||
| FasepadaSTS(0 °C dan 101,325kPa) | padat | |||||||||||||||||||||||||||||||
| Titik lebur | 1519K(1246 °C, 2275 °F) | |||||||||||||||||||||||||||||||
| Titik didih | 2334 K (2061 °C, 3742 °F) | |||||||||||||||||||||||||||||||
| Kepadatanmendekatis.k. | 7,21 g/cm3 | |||||||||||||||||||||||||||||||
| saat cair, padat.l. | 5,95 g/cm3 | |||||||||||||||||||||||||||||||
| Kalor peleburan | 12,91kJ/mol | |||||||||||||||||||||||||||||||
| Kalor penguapan | 221 kJ/mol | |||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 26,32 J/(mol·K) | |||||||||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −3, −2, −1, 0, +1,+2,+3,+4,+5,+6,+7(tergantung pada bilangan oksidasinya, oksida asam, basa, atauamfoter) | |||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,55 | |||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 717,3 kJ/mol ke-2: 1509,0 kJ/mol ke-3: 3248 kJ/mol (artikel) | |||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 127pm | |||||||||||||||||||||||||||||||
| Jari-jari kovalen | Spin rendah: 139±5 pm Spin tinggi: 161±8 pm | |||||||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat badan(bcc) | |||||||||||||||||||||||||||||||
| Kecepatan suarabatang ringan | 5150 m/s (suhu 20 °C) | |||||||||||||||||||||||||||||||
| Ekspansi kalor | 21,7 µm/(m·K) (suhu 25 °C) | |||||||||||||||||||||||||||||||
| Konduktivitas termal | 7,81 W/(m·K) | |||||||||||||||||||||||||||||||
| Resistivitas listrik | 1,44 µΩ·m (suhu 20 °C) | |||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik | |||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | (α)+529,0×10−6cm3/mol (293 K)[2] | |||||||||||||||||||||||||||||||
| Modulus Young | 198 GPa | |||||||||||||||||||||||||||||||
| Modulus curah | 120 GPa | |||||||||||||||||||||||||||||||
| Skala Mohs | 6,0 | |||||||||||||||||||||||||||||||
| Skala Brinell | 196 MPa | |||||||||||||||||||||||||||||||
| Nomor CAS | 7439-96-5 | |||||||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||||||
| Penemuan | Carl W. Scheele(1774) | |||||||||||||||||||||||||||||||
| Isolasi pertama | Johann G. Gahn(1774) | |||||||||||||||||||||||||||||||
| Isotop manganyang utama | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
Mangan,batu kawi,ataubekawiadalah sebuahunsur kimiadenganlambangMndannomor atom25. Ia adalah logam yang keras, rapuh, dan berwarna keperakan yang sering ditemukan dalammineralyang dikombinasikan denganbesi.Mangan adalah sebuahlogam transisidengan beragam penggunaan paduan industri, khususnyabaja nirkarat.Ia dapat meningkatkan kekuatan, kemampuan kerja, dan ketahanan aus. Mangan oksida digunakan sebagai zat pengoksidasi; sebagai aditif karet; serta dalam pembuatan kaca, pupuk, dan keramik. Mangan sulfat dapat digunakan sebagaifungisida.
Mangan juga merupakan unsur makanan manusia yang penting, penting dalam metabolisme makronutrien, pembentukan tulang, dan sistem pertahananradikal bebas.Ia adalah komponen penting dalam lusinan protein dan enzim.[3]Sebagian besar mangan ditemukan di tulang, tetapi juga di hati, ginjal, dan otak.[4]Di otak manusia, mangan terikat padametaloproteinmangan, terutamaglutamin sintetasedalamastrosit.
Mangan pertama kali diisolasi pada tahun 1774. Ia dikenal di laboratorium dalam bentuk garamkalium permanganatberwarna lembayung tua. Ia terjadi disisi aktifpada beberapaenzim.[5]Salah satu hal yang menarik adalah penggunaan sebuahgugusMn–O,kompleks yang mengembangkan oksigen,dalam produksi oksigen oleh tumbuhan.
Karakteristik[sunting|sunting sumber]
Sifat fisik[sunting|sunting sumber]
Mangan adalah sebuahlogamberwarna abu-abu keperakan yang menyerupai besi. Logam ini keras dan sangat rapuh, sulit melebur, tetapi mudah teroksidasi.[6]Logam mangan dan ionnya yang umum bersifatparamagnetik.[7]Mangan akan ternoda perlahan di udara dan teroksidasi ( "berkarat" ) seperti besi dalam air yang mengandung oksigen terlarut.[butuh rujukan]
Isotop[sunting|sunting sumber]
Mangan alami terdiri dari satuisotopstabil,55Mn. Beberaparadioisotoptelah diisolasi dan dijelaskan, denganberat atommulai dari 46u(46Mn) hingga 72 u (72Mn). Isotop yang paling stabil adalah53Mn denganwaktu paruh3,7 juta tahun,54Mn dengan waktu paruh 312,2 hari, dan52Mn dengan waktu paruh 5,591 hari. Semua isotopradioaktifyang tersisa memiliki waktu paruh kurang dari 3 jam, dan sebagian besar kurang dari 1 menit.Mode peluruhanutama dari isotop yang lebih ringan daripada isotop stabil yang paling melimpah,55Mn, adalahpenangkapan elektrondan mode utama dari isotop yang lebih berat adalahpeluruhan beta.[8]Mangan juga memiliki tigakeadaan meta.[8]
Mangan adalah bagian dari unsur-unsurgugus besi,yang diperkirakan disintesis dibintangbesar sesaat sebelum ledakansupernova.[9]53Mn meluruh menjadi53Cr dengan waktu paruh 3,7 juta tahun. Karena waktu paruhnya yang relatif pendek,53Mn relatif jarang, dihasilkan oleh tumbukansinar kosmikpadabesi.[10]Kandungan isotop mangan biasanya digabungkan dengan kandungan isotopkromiumdan telah memiliki aplikasi dalamgeologi isotopdanpenanggalan radiometrik.Rasio isotop Mn–Cr memperkuat bukti dari26Aldan107Pduntuk sejarah awalTata Surya.Variasi dalam rasio53Cr/52Cr dan Mn/Cr dari beberapameteoritmenunjukkan rasio awal53Mn/55Mn, yang menunjukkan bahwa komposisi isotop Mn–Cr harus dihasilkan dari peluruhanin situdari53Mn dalam benda planet yang berbeda. Oleh karena itu,53Mn memberikan bukti tambahan untuk prosesnukleosintesissegera sebelum penggabungan Tata Surya.[11][12][13][14]
Alotrop[sunting|sunting sumber]
 |
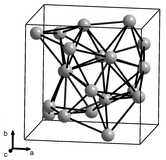 |
Empatalotrop(bentuk struktural) mangan padat telah diketahui, diberi label α, β, γ dan δ, dan terjadi pada peningkatan suhu secara berturut-turut. Semuanya metalik, stabil pada tekanan standar, dan memiliki kisi kristal kubik, tetapi struktur atomnya sangat bervariasi.[15][16][17]
Mangan alfa(Mn-α) adalah fase kesetimbangan pada suhu kamar. Ia memiliki kisikubus berpusat-badandan tidak biasa di antara logam elemental karena memiliki sel unit yang sangat kompleks, dengan 58 atom per sel (29 atom per sel unit sederhana) dalam empat jenis lokasi yang berbeda.[15][18]Ia bersifatparamagnetikpada suhu kamar danantiferomagnetikpada suhu di bawah 95 K (−178 °C).[19]
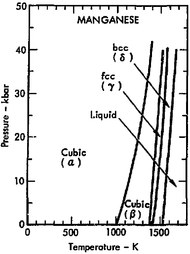 |
Mangan beta(Mn-β) terbentuk ketika dipanaskan di atas suhu transisi (973 K (700 °C; 1.290 °F)). Ia memiliki struktur kubus sederhana dengan 20 atom per sel unit di dua jenis lokasi, yang sama rumitnya dengan logam elemental lainnya.[20]Ia mudah diperoleh sebagai fase metastabil pada suhu kamar melalui pendinginan cepat. Ia tidak menunjukkanpengarahan magnetik,akan tetap bersifat paramagnetik hingga suhu terendah yang diukur (1,1 K).[20][21][22]
Mangan gama(Mn-γ) terbentuk ketika dipanaskan di atas suhu 1.370 K (1.100 °C; 2.010 °F). Ia memiliki strukturkubus berpusat-mukasederhana (empat atom per sel unit). Ketika didinginkan ke suhu kamar, ia akan berubah menjadi Mn-β, tetapi ia dapat distabilkan pada suhu kamar dengan memadukannya dengan setidaknya 5 persen unsur lain (seperti C, Fe, Ni, Cu, Pd atau Au), dan paduan yang distabilkan larutan ini akan terdistorsi menjadi strukturtetragonberpusat-muka.[22][23]
Mangan delta(Mn-δ) terbentuk ketika dipanaskan di atas suhu 1.406 K (1.130 °C; 2.070 °F) dan stabil hingga titik lebur mangan sebesar 1.519 K (1.250 °C; 2.270 °F). Ia memiliki struktur kubus berpusat-badan (dua atom per sel unit kubus).[16][22]
Senyawa[sunting|sunting sumber]

Keadaan oksidasiumum mangan adalah +2, +3, +4, +6, dan +7, meskipun semua keadaan oksidasi dari −3 hingga +7 telah diamati. Mangan dalam keadaan oksidasi +7 diwakili oleh garam dari anion permanganat MnO4−yang berwarna sangat ungu.Kalium permanganatadalah sebuahreagenlaboratorium yang umum digunakan karena sifat pengoksidasinya; ia digunakan sebagai obat topikal (misalnya, dalam pengobatan penyakit ikan). Larutan kalium permanganat adalah salah satu pewarna dan fiksatif pertama yang digunakan dalam persiapan sel dan jaringan biologis untuk mikroskop elektron.[25]
Selain berbagai garam permanganat, Mn(VII) diwakili oleh turunan Mn2O7yang tidak stabil dan bersifat volatil.Oksihalida(MnO3F dan MnO3Cl) adalahoksidator kuat.[6]Contoh paling menonjol dari Mn dalam keadaan oksidasi +6 adalah anionmanganat[MnO4]2-yang berwarna hijau. Garam mangan adalah zat antara dalam ekstraksi mangan dari bijihnya. Senyawa dengan keadaan oksidasi +5 agak sulit dipahami, salah satu contohnya adalah anionhipomanganat[MnO4]3-yang berwarna biru.
Senyawa dengan Mn dalam keadaan oksidasi +5 jarang dijumpai dan sering ditemui berasosiasi dengan ligan oksida (O2-) ataunitrida(N3-).[26][27]
Mn(IV) agak membingungkan karena ia umum di alam tetapi jauh lebih jarang dalam kimia sintetis. Bijih Mn yang paling umum,pirolusit,adalah MnO2.Ia adalah pigmen cokelat tua dari banyaklukisan gua,tetapi juga merupakan bahan umum dalam bateraisel kering.Kompleks Mn(IV) telah dikenal, tetapi mereka membutuhkan ligan yang rumit. Kompleks Mn(IV)-OH merupakan zat antara dalam beberapaenzim,termasuk pusat evolusi oksigen (OEC) pada tumbuhan.[28]
Turunan sederhana Mn+3jarang ditemukan tetapi dapat distabilkan dengan ligan basa yang sesuai.Mangan(III) asetatadalah oksidan yang berguna dalamsintesis organik.Senyawa padat mangan(III) dicirikan oleh warna ungu-merah yang kuat dan preferensi untuk koordinasi oktahedron yang terdistorsi akibatefek Jahn–Teller.[butuh rujukan]

Keadaan oksidasi yang sangat umum untuk mangan dalam larutan berair adalah +2, yang memiliki warna merah muda pucat. Banyak senyawa mangan(II) yang diketahui, sepertikompleks akuoyang diturunkan darimangan(II) sulfat(MnSO4) danmangan(II) klorida(MnCl2). Keadaan oksidasi ini juga terlihat pada mineral rodokrosit (mangan(II) karbonat). Mangan(II) umumnya eksis dengan spin tinggi, S = 5/2 keadaan dasar karena energi pasangan yang tinggi untuk mangan(II). Tidak ada transisi d–d yang diperbolehkan spin dalam mangan(II), yang menjelaskan warnanya yang redup.[29]
| Keadaan oksidasi mangan[30] | |
|---|---|
| 0 | Mn2(CO)10 |
| +1 | MnC5H4CH3(CO)3 |
| +2 | MnCl2,MnCO3,MnO |
| +3 | MnF3,Mn(OAc)3,Mn2O3 |
| +4 | MnO2 |
| +5 | K3MnO4 |
| +6 | K2MnO4 |
| +7 | KMnO4,Mn2O7 |
| Keadaan oksidasi yang umum dicetak tebal. | |
Senyawa organomangan[sunting|sunting sumber]
Mangan membentuk berbagai macam turunan organologam, yaitu senyawa dengan ikatan Mn–C. Turunan organologam mencakup banyak contoh Mn dalam keadaan oksidasi yang lebih rendah, yaitu Mn(-III) hingga Mn(I). Bidang kimia organologam ini dinilai menarik karena Mn tidak mahal dan toksisitasnya relatif rendah.[butuh rujukan]
Minat komersial terbesar adalah "MMT",metilsiklopentadienil mangan trikarbonil,yang digunakan sebagai sebuah senyawaantiketukyang ditambahkan pada bensin di beberapa negara. Ia memiliki Mn(I). Konsisten dengan aspek kimia Mn(II) lainnya,manganosena(Mn(C
5H
5)
2) memiliki spin tinggi. Sebaliknya, logam tetangganya besi membentuk turunan spin rendah yang stabil di udara dalam bentukferosena(Fe(C
5H
5)
2). Ketika dilakukan di bawah atmosferkarbon monoksida,reduksi garam Mn(II) akan menghasilkandimangan dekakarbonilMn
2(CO)
10,sebuah padatan berwarna jingga dan volatil. Stabilitas udara dari senyawa Mn(0) ini (dan banyak turunannya) mencerminkan sifat akseptor elektron yang kuat dari karbon monoksida. Banyakkompleks alkenadankompleks alkunaditurunkan dari Mn
2(CO)
10.[butuh rujukan]
Dalam Mn(CH3)2(dmpe)2,Mn(II) memiliki spin rendah, yang kontras dengan karakter spin tinggi dari prekursornya, MnBr2(dmpe)2(dmpe= (CH3)2PCH2CH2P(CH3)2).[31]Turunan polialkil dan poliaril dari mangan sering berada pada keadaan oksidasi yang lebih tinggi, mencerminkan sifat pelepasan elektron dari ligan alkil dan aril. Salah satu contohnya adalah [Mn(CH3)6]2-.[butuh rujukan]
Sejarah[sunting|sunting sumber]
Asal usul nama mangan memang kompleks. Pada zaman kuno, dua mineral hitam diidentifikasi dari wilayahMagnetes(antaraMagnesia,yang terletak di Yunani modern, atauMagnesia ad Sipylum,yang terletak di Turki modern).[32]Keduanya disebutmagnesdari tempat asalnya, tetapi dianggap berbeda jenis kelamin.Magnesjantan dapat menarik besi, dan bijih besi sekarang dikenal sebagaibatu magnetataumagnetit,dan yang mungkin memberi kita istilahmagnet.Bijihmagnesbetina tidak menarik besi, tetapi digunakan untuk menghilangkan warna kaca.Magnesbetina ini kemudian disebutmagnesia,yang sekarang dikenal di zaman modern sebagaipirolusitataumangan dioksida.[butuh rujukan]Baik mineral maupun mangan elemental ini tidak bersifat magnetis. Pada abad ke-16, mangan dioksida disebutmanganesum(perhatikan adanya dua N, bukan satu) oleh pembuat kaca, mungkin sebagai korupsi dan gabungan dari dua kata, karena ahli alkimia dan pembuat kaca akhirnya harus membedakanmagnesia nigra(bijih hitam) darimagnesia alba(bijih putih, juga dari Magnesia, yang juga berguna dalam pembuatan kaca).Michele Mercatimenyebut magnesia nigra sebagaimanganesa,dan akhirnya logam yang diisolasi darinya dikenal sebagaimanganese(bahasa Indonesia:Mangan). Namamagnesiaakhirnya digunakan untuk merujuk hanya padamagnesia alba(magnesium oksida) putih, yang memberi namamagnesiumuntuk unsur bebasnya ketika diisolasi beberapa waktu kemudian.[33]

Mangan dioksidayang melimpah di alam telah lama digunakan sebagai pigmen. Lukisan gua diGargasyang berusia 30.000 hingga 24.000 tahun terbuat dari mineral berupa pigmen MnO2.[35]
Senyawa mangan digunakan oleh pembuat kaca di Mesir dan Romawi, baik untuk menambah, atau menghilangkan, warna dari kaca.[36]Penggunaannya sebagai "sabun pembuat kaca" berlanjut hinggaAbad Pertengahanhingga zaman modern dan terbukti dalam kaca abad ke-14 dariVenesia.[37]

Karena digunakan dalam pembuatan kaca, mangan dioksida tersedia untuk percobaan oleh beberapa ahli alkimia, kimiawan pertama.Ignatius G. Kaim(1770) danJohann R. Glauber(abad ke-17) menemukan bahwa mangan dioksida dapat diubah menjadipermanganat,sebuah reagen laboratorium yang berguna.[38]Pada pertengahan abad ke-18, kimiawan SwediaCarl W. Scheelemenggunakan mangan dioksida untuk menghasilkanklorin.Pertama,asam klorida,atau campuranasam sulfatencer dannatrium kloridadibuat untuk bereaksi dengan mangan dioksida, dan kemudian asam klorida dariproses Leblancdigunakan, dan mangan dioksida didaur ulang melaluiproses Weldon.Produksi zatpemutihklorin danhipokloritmerupakan konsumen bijih mangan yang besar.[butuh rujukan]
Scheele dan yang lainnya menyadari bahwa pirolusit (bentuk mineral mangan dioksida) mengandung sebuah unsur baru.Johan G. Gahnadalah orang pertama yang mengisolasi sampel logam mangan yang tidak murni pada tahun 1774, yang dilakukannya denganmereduksimangan dioksida dengankarbon.[butuh rujukan]
Kandungan mangan dari beberapa bijih besi yang digunakan di Yunani menimbulkan spekulasi bahwa baja yang dihasilkan dari bijih tersebut mengandung mangan tambahan, membuat bajaSpartasangatlah keras.[39]Sekitar awal abad ke-19, mangan digunakan dalam pembuatan baja dan beberapa paten diberikan. Pada tahun 1816, didokumentasikan bahwa paduan besi dengan mangan lebih keras tetapi tidak lebih rapuh. Pada tahun 1837, akademisi InggrisJames Coupermencatat hubungan antara paparan berat mangan pada penambang dan bentukpenyakit Parkinson.[40]Pada tahun 1912, paten Amerika Serikat diberikan untuk melindungi senjata api dari karat dan korosi dengan pelapisan konversi elektrokimia mangan fosfat, dan proses tersebut telah digunakan secara luas sejak saat itu.[41]
Penemuansel Leclanchépada tahun 1866 dan perbaikan baterai selanjutnya yang mengandung mangan dioksida sebagaidepolarisatorkatodik meningkatkan permintaan mangan dioksida. Hingga pengembangan baterai dengannikel–kadmiumdan litium, sebagian besar baterai mengandung mangan.Baterai seng–karbondanbaterai alkalinbiasanya menggunakan mangan dioksida yang diproduksi secara industri karena mangan dioksida alami mengandung kotoran. Pada abad ke-20, mangan dioksida banyak digunakan sebagai katodik untukbaterai keringsekali pakai komersial baik tipe standar (seng–karbon) maupun alkalin.[42]
Keterjadian[sunting|sunting sumber]
Mangan menyusun sekitar 1000ppm(0,1%)kerak Bumi,menjadi unsur kerak Bumi yang paling melimpah ke-12.[4]Tanah mengandung 7–9000 ppm mangan dengan rata-rata 440 ppm.[4]Atmosfer mengandung 0,01 μg/m3.[4]Mangan terjadi terutama sebagaipirolusit(MnO2),braunit(Mn2+Mn3+6)SiO12),[43]psilomelan(Ba,H
2O)
2Mn
5O
10,dan pada tingkat yang lebih rendah sebagairodokrosit(MnCO3).
 |
 |
 |
 |
 |
| Bijih mangan | Psilomelan (bijih mangan) | Spiegeleisenadalah sebuah paduan besi dengan kandungan mangan sekitar 15% | Dendrit mangan oksida pada batu gamping dariSolnhofen,Jerman – sejenispseudofosil.Skala dalam mm | Mineral rodokrosit (mangan(II) karbonat) |

Bijih mangan yang paling penting adalah pirolusit (MnO2). Bijih mangan lain yang penting secara ekonomi biasanya menunjukkan hubungan spasial yang dekat dengan bijih besi, sepertisfalerit.[6][45]Sumber daya berbasis lahan berjumlah besar tetapi didistribusikan secara tidak teratur. Sekitar 80% dari sumber mangan dunia yang diketahui terdapat di Afrika Selatan; endapan mangan penting lainnya terdapat di Ukraina, Australia, India, Tiongkok,Gabon,dan Brasil.[44]Menurut perkiraan tahun 1978,dasar lautanmemiliki 500 miliar tonnodul mangan.[46]Upaya untuk menemukan metode pemanenan nodul mangan yang layak secara ekonomi ditinggalkan pada tahun 1970-an.[47]
Di Afrika Selatan, endapan yang paling teridentifikasi terletak di dekatHotazeldiProvinsi Northern Cape(ladang mangan Kalahari), dengan perkiraan tahun 2011 sebesar 15 miliar ton. Pada tahun 2011, Afrika Selatan menghasilkan 3,4 juta ton, melampaui semua negara lain.[48]
Mangan ditambang terutama di Afrika Selatan, Australia, Tiongkok, Gabon, Brasil, India, Kazakhstan, Ghana, Ukraina, dan Malaysia.[49]
Produksi[sunting|sunting sumber]
Untuk produksiferomangan,bijih mangan dicampur dengan bijih besi dan karbon, dan kemudian direduksi baik dalam tanur tiup atau tanur busur listrik.[50]Feromangan yang dihasilkan memiliki kandungan mangan 30 hingga 80%.[6]Mangan murni yang digunakan untuk produksi paduan bebas besi diproduksi denganmelindibijih mangan denganasam sulfatdan proseselektrodeposisiberikutnya.[51]

Proses ekstraksi yang lebih progresif melibatkan pereduksian bijih mangan (kadar rendah) secara langsung melaluipelindian timbunan.Ini dilakukan denganmemerkolasigas alam melalui dasar tumpukan; gas alam menyediakan panas (perlu setidaknya 850 °C) dan zat pereduksi (karbon monoksida). Ini akan mereduksi semua bijih mangan menjadi mangan oksida (MnO), yang merupakan bentuk yang dapat dilindi. Bijih kemudian bergerak melalui sebuah sirkuitpenggilinganuntuk mengurangi ukuran partikel bijih menjadi antara 150 dan 250 μm, meningkatkan luas permukaan untuk membantu pelindian. Bijih tersebut kemudian ditambahkan ke dalam tangki pelindian asam sulfat danion fero(Fe2+) dengan perbandingan 1,6:1. Besi kemudian bereaksi denganmangan dioksida(MnO2) untuk membentukbesi hidroksida(FeO(OH)) dan mangan elemental (Mn).[butuh rujukan]
Proses ini menghasilkan sekitar 92% pemulihan mangan. Untuk pemurnian lebih lanjut, mangan kemudian dapat dikirim ke sebuah fasilitas elektrodeposisi.[52]
Pada tahun 1972,Proyek AzorianCIA,melalui miliarderHoward Hughes,menugaskan kapalHughes Glomar Explorerdengan "cerita sampul" memanen nodul mangan dari dasar laut.[53]Hal itu memicu kesibukan untuk mengumpulkan nodul mangan, yang sebenarnya tidak praktis. Misi sebenarnya dariHughes Glomar Exploreradalah mengangkat kapal selamSovietyang tenggelam,K-129,dengan tujuan mengambil buku kode Soviet.[54]
Sumber daya mangan yang melimpah berupa nodul mangan yang ditemukan didasar laut.[55][56]Nodul-nodul ini, yang terdiri dari 29% mangan,[57]terletak di sepanjang dasar laut dan dampak potensial penambangan nodul-nodul ini sedang diteliti. Dampak lingkungan fisik, kimia, dan biologis dapat terjadi karena penambangan nodul ini mengganggu dasar laut dan menyebabkan terbentuknya gumpalan sedimen. Suspensi ini meliputi logam dan nutrisi anorganik, yang dapat menyebabkan kontaminasi perairan dekat dasar dari senyawa beracun terlarut. Nodul mangan juga merupakan tempat merumput, ruang hidup, dan perlindungan untuk sistem endo- dan epifauna. Ketika nodul ini dihilangkan, sistem ini secara langsung akan terpengaruh. Secara keseluruhan, hal ini dapat menyebabkan spesies meninggalkan area tersebut atau mati total.[58]Sebelum dimulainya penambangan itu sendiri, penelitian sedang dilakukan oleh badan-badan afiliasiPerserikatan Bangsa-Bangsadan perusahaan yang disponsori negara dalam upaya untuk memahami sepenuhnyadampak lingkungandengan harapan dapat mengurangi dampak tersebut.[59]
Lingkungan lautan[sunting|sunting sumber]
Banyak unsur renik di lautan berasal dari partikel hidrotermal yang kaya logam dari ventilasi hidrotermal.[60]Mangan terlarut (dMn) ditemukan di seluruh lautan dunia, 90% di antaranya berasal dari lubang hidrotermal.[61]Partikulat Mn berkembang dalam gumpalan apung di atas sumber ventilasi aktif, sedangkan dMn berperilaku secara konservatif.[60]Konsentrasi Mn bervariasi antara kolom air laut. Di permukaan, dMn terangkat karena masukan dari sumber eksternal seperti sungai, debu, dan sedimen landas. Sedimen pesisir biasanya memiliki konsentrasi Mn yang lebih rendah, tetapi dapat meningkat akibat pembuangan antropogenik dari industri seperti pertambangan dan pabrik baja, yang masuk ke laut dari input sungai. Konsentrasi dMn permukaan juga dapat ditingkatkan secara biologis melalui fotosintesis dan secara fisik daripembalikan massa airpantai dan arus permukaan yang digerakkan oleh angin. Siklus internal seperti fotoreduksi dari radiasi UV juga dapat meningkatkan level dengan mempercepat disolusi Mn-oksida dan pemulungan oksidatif, mencegah Mn tenggelam ke perairan yang lebih dalam.[62]Tingkat yang lebih tinggi di pertengahan kedalaman dapat terjadi di dekat pegunungan tengah laut dan ventilasi hidrotermal. Ventilasi hidrotermal melepaskan cairan yang diperkaya dMn ke dalam air. dMn kemudian dapat melakukan perjalanan hingga 4.000 km karena adanya kapsul mikroba, mencegah pertukaran dengan partikel, menurunkan tingkat penenggelaman. Konsentrasi Mn terlarut bahkan lebih tinggi ketika kadar oksigen rendah. Secara keseluruhan, konsentrasi dMn biasanya lebih tinggi di wilayah pesisir dan akan menurun saat bergerak ke lepas pantai.[62]
Tanah[sunting|sunting sumber]
Mangan terjadi di tanah dalam tiga keadaan oksidasi: kation divalen, Mn2+serta sebagai oksida hitam kecokelatan dan hidroksida yang mengandung Mn(III,IV), seperti MnOOH dan MnO2.Kondisi pH tanah dan oksidasi-reduksi akan memengaruhi yang mana dari ketiga bentuk Mn ini yang dominan dalam tanah tertentu. Pada pH kurang dari 6 atau dalam kondisi anaerobik, Mn(II) mendominasi, sedangkan pada kondisi yang lebih basa dan aerobik, Mn(III,IV) oksida dan hidroksida mendominasi. Efek keasaman tanah dan keadaan aerasi pada bentuk Mn ini dapat dimodifikasi atau dikendalikan oleh aktivitas mikroba. Respirasi mikroba dapat menyebabkan oksidasi Mn2+menjadi mangan oksida, dan dapat menyebabkan reduksi oksida tersebut menjadi kation divalen.[63]
Oksida Mn(III,IV) terdapat sebagai noda hitam kecokelatan dan nodul kecil pada partikel pasir, lanau, dan lempung. Lapisan permukaan pada partikel tanah lainnya ini memiliki luas permukaan yang tinggi dan membawa muatan negatif. Sisi bermuatan dapat menyerap dan mempertahankan berbagai kation, terutama logam berat (misalnya Cr3+,Cu2+,Zn2+,dan Pb2+). Selain itu, oksida tersebut dapat menyerap asam organik dan senyawa lainnya. Adsorpsi logam dan senyawa organik kemudian dapat menyebabkannya teroksidasi sedangkan oksida Mn(III,IV) direduksi menjadi Mn2+(misalnya Cr3+menjadi Cr(VI) dan hidrokuinon tidak berwarna menjadi polimer kuinon berwarna teh).[64]
Aplikasi[sunting|sunting sumber]
Mangan tidak memiliki pengganti yang memuaskan dalam aplikasi utamanya dalam metalurgi.[44]Dalam aplikasi kecil (misalnya pemfosfatan mangan),sengdan kadang-kadangvanadiumadalah pengganti yang layak.
Baja[sunting|sunting sumber]

Mangan sangat penting untukproduksi bajadan besi berdasarkan sifat pengikatbelerang,deoksidasi,danpemaduannya,seperti yang pertama kali diakui oleh ahli metalurgi InggrisRobert F. Mushet(1811–1891) yang, pada tahun 1856, memperkenalkan unsur tersebut, dalam bentukspiegeleisen,menjadi baja untuk tujuan khusus untuk menghilangkan kelebihan oksigen, belerang, dan fosforus terlarut untuk meningkatkan kelenturannya.Pembuatan baja,[65]termasuk komponen pembuatan besinya, telah menyumbang sebagian besar permintaan mangan, saat ini berkisar antara 85% sampai 90% dari total permintaan.[51]Mangan adalah komponen utama daribaja nirkaratberbiaya rendah.[66][67]Seringkali feromangan (biasanya sekitar 80% mangan) menjadi zat antara dalam proses modern.
Sejumlah kecil mangan dapat meningkatkan kemampuan kerja baja pada suhu tinggi dengan membentuk sulfida dengan titik lebur tinggi dan mencegah pembentukanbesi sulfidacair pada batas butir. Jika kandungan mangan mencapai 4%, kegetasan baja menjadi ciri yang dominan. Penggetasan akan menurun pada konsentrasi mangan yang lebih tinggi dan mencapai tingkat yang dapat diterima pada 8%. Baja yang mengandung 8 hingga 15% mangan memilikikekuatan tarikyang tinggi hingga 863 MPa.[68][69]Baja dengan mangan 12% ditemukan pada tahun 1882 olehRobert Hadfielddan masih dikenal sebagaibaja Hadfield (mangaloi).Baja ini digunakan untukhelm bajamiliter Britania Raya dan kemudian oleh militer Amerika Serikat.[70]
Paduan aluminium[sunting|sunting sumber]
Mangan digunakan dalam produksi beberapa paduan dengan aluminium. Aluminium dengan sekitar 1,5% mangan dapat meningkatkan ketahanan terhadap korosi melalui butiran yang menyerap kotoran yang akan menyebabkankorosi galvanik.[71]Paduan aluminiumtahan korosi 3004 dan 3104 (0,8 hingga 1,5% mangan) digunakan untuk sebagian besarkaleng minuman.[72]Sebelum tahun 2000, lebih dari 1,6 jutatonpaduan tersebut digunakan; dengan 1% mangan, paduan ini menghabiskan 16.000 ton mangan.[Verifikasi gagal][72]
Baterai[sunting|sunting sumber]
Mangan(IV) oksidadigunakan padabateraisel kering tipe asli sebagai akseptor elektron dari seng, dan merupakan bahan kehitaman pada sel senter tipe karbon–seng. Mangan dioksida akan direduksi menjadi mangan oksida-hidroksida MnO(OH) selama pemakaian, mencegah pembentukan hidrogen pada anoda baterai.[73]
- MnO2+ H2O + e−→ MnO(OH) +OH−
Bahan yang sama juga berfungsi padabaterai alkalin(biasanya sel baterai) yang lebih baru, yang menggunakan reaksi dasar yang sama, tetapi campuran elektrolitnya berbeda. Pada tahun 2002, lebih dari 230.000 ton mangan dioksida digunakan untuk tujuan ini.[42][73]

Resistor[sunting|sunting sumber]
Paduan tembaga mangan, sepertiManganin,umumnya ditemukan dalam resistorshuntunsur logam yang digunakan untuk mengukur jumlah arus yang relatif besar. Paduan ini memilikikoefisien ketahanan suhuyang sangat rendah dan tahan terhadap belerang. Hal ini membuat paduan ini sangat berguna di lingkungan otomotif dan industri yang keras.[74]
Ceruk[sunting|sunting sumber]
Metilsiklopentadienil mangan trikarboniladalah sebuah aditif dalam beberapabensin tanpa timbaluntuk meningkatkannilai oktandan mengurangiketukan mesin.[75]
Mangan(IV) oksida (mangan dioksida, MnO2) digunakan sebagai reagen dalamkimia organikuntukoksidasialkoholbenzilik (di managugus hidroksilberdekatan dengan sebuahcincin aromatik). Mangan dioksida telah digunakan sejak zaman dahulu untuk mengoksidasi dan menetralkan semburat kehijauan pada kaca dari sejumlah kecil besi pengotor.[37]MnO2juga digunakan dalam pembuatan oksigen dan klorin serta dalam pengeringan cat hitam. Dalam beberapa pembuatan, ia adalahpigmencokelat untukcatdan merupakan penyusunserbuk kopialami.[76]
Mangantetravalendigunakan sebagaiaktivatordalamfosforpemancar merah. Walaupun banyak senyawa diketahui dapat menunjukkanluminesensi,[77]mayoritas dari mereka tidak digunakan dalam aplikasi komersial karena efisiensinya rendah atau pancarannya berwarna merah tua.[78][79]Namun, beberapa fluorida teraktivasi Mn4+dilaporkan sebagai fosfor pemancar merah potensial untukLEDputih-hangat.[80][81]Namun hingga hari ini, hanya K2SiF6:Mn4+yang tersedia secara komersial untuk digunakan dalam LED putih-hangat.[82]
Logam ini terkadang digunakan dalam koin; hingga tahun 2000, satu-satunya koin Amerika Serikat yang menggunakan mangan adalahnikel "masa perang"dari tahun 1942 hingga 1945.[83]Sebuah paduan 75% tembaga dan 25% nikel secara tradisional digunakan untuk produksi koin nikel. Namun, karena pasokan logam nikel yang terus berkurang selama perang, ia diganti dengan perak dan mangan yang lebih tersedia, sehingga menghasilkan paduan 56% tembaga, 35% perak, dan 9% mangan. Sejak tahun 2000,koin dolar,misalnyadolar Sacagaweadankoin Presiden $1,dibuat dari kuningan yang mengandung 7% mangan dengan inti tembaga murni.[84]Dalam kedua kasus nikel dan dolar, penggunaan mangan dalam koin ini adalah untuk menduplikasi sifat elektromagnetik dari koin berukuran dan bernilai identik sebelumnya dalam mekanismemesin penjual otomatis.Dalam kasus koin dolar A.S. selanjutnya, paduan mangan dimaksudkan untuk menduplikasi sifat paduan tembaga/nikel yang digunakan dalamdolar Susan B. Anthony.
Senyawa mangan telah digunakan sebagai pigmen dan pewarna keramik dan kaca. Warna cokelat pada keramik terkadang merupakan hasil dari senyawa mangan.[85]Dalam industri kaca, senyawa mangan digunakan untuk dua efek.Mangan(III)akan bereaksi denganbesi(II)untuk mengurangi warna hijau yang kuat pada kaca dengan membentuk besi(III) yang kurang berwarna dan mangan(II) yang berwarna agak merah muda, mengimbangi sisa warna besi(III).[37]Jumlah mangan yang lebih besar digunakan untuk menghasilkan kaca berwarna merah muda. Pada tahun 2009, ProfesorMas Subramaniandan rekannya diUniversitas Negeri Oregonmenemukan bahwa mangan dapat digabungkan denganitriumdanindiumuntuk membentukpigmenyang sangatbiru,tidak beracun, lengai, dan tahan pudar, yaitubiru YInMn,pigmen biru baru pertama yang ditemukan pada tahun 200 terakhir.[butuh rujukan]
Peran biologis[sunting|sunting sumber]

Biokimia[sunting|sunting sumber]
Kelasenzimyang memilikikofaktormangan meliputioksidoreduktase,transferase,hidrolase,liase,isomerase,danligase.Enzim lain yang mengandung mangan adalaharginasedansuperoksida dismutaseyang mengandung Mn (Mn-SOD). Juga, kelas enzimtranskriptase balikdari banyakretrovirus(meskipun bukanlentivirussepertiHIV) mengandung mangan.Polipeptidayang mengandung mangan adalahtoksin difteri,lektin,danintegrin.[86]
Peran biologis pada manusia[sunting|sunting sumber]
Mangan adalah unsur makanan manusia yang penting. Ia hadir sebagai sebuahkoenzimdalam beberapa proses biologis, yang meliputi metabolisme makronutrien, pembentukan tulang, dan sistem pertahananradikal bebas.Ia adalah komponen penting dalam lusinan protein dan enzim.[3]Tubuh manusia mengandung sekitar 12 mg mangan, kebanyakan di tulang. Sisa jaringan lunak terkonsentrasi di hati dan ginjal.[4]Di otak manusia, mangan terikat padametaloproteinmangan, terutamaglutamin sintetasedalamastrosit.[87]
Nutrisi[sunting|sunting sumber]
| Pria | Wanita | ||
|---|---|---|---|
| Usia | AI (mg/hari) | Usia | AI (mg/hari) |
| 1–3 | 1,2 | 1–3 | 1,2 |
| 4–8 | 1,5 | 4–8 | 1,5 |
| 9–13 | 1,9 | 9–13 | 1,6 |
| 14–18 | 2,2 | 14–18 | 1,6 |
| 19+ | 2,3 | 19+ | 1,8 |
| hamil: 2 | |||
| menyusui: 2,6 | |||
Institut KedokteranA.S. (IOM) memperbarui Kebutuhan Perkiraan Rata-rata (EAR) dan Angka Kecukupan Gizi (AKG) untuk mineral pada tahun 2001. Untuk mangan, tidak ada informasi yang cukup untuk menetapkan EAR dan AKG, sehingga kebutuhannya digambarkan sebagai perkiraanAsupan Adekuat(AI). Mengenai keamanan, IOM menetapkanBatas Atas Asupan(UL) yang dapat ditoleransi untuk vitamin dan mineral bila bukti cukup. Dalam kasus mangan, UL dewasa ditetapkan pada 11 mg/hari. Secara kolektif EAR, AKG, AI, dan UL disebut sebagaiAsupan Referensi Diet(DRI).[88]Kekurangan mangan jarang terjadi.[89]
Otoritas Keamanan Makanan Eropa(EFSA) menyebut kumpulan informasi kolektif tersebut sebagai Nilai Referensi Diet, dengan Asupan Referensi Populasi (PRI) alih-alih AKG, dan Kebutuhan Rata-rata alih-alih EAR. AI dan UL didefinisikan sama seperti di Amerika Serikat. Untuk orang berusia 15 tahun ke atas, AI ditetapkan sebesar 3,0 mg/hari. AI untuk ibu hamil dan menyusui adalah 3,0 mg/hari. Untuk anak usia 1–14 tahun, AI meningkat seiring bertambahnya usia dari 0,5 menjadi 2,0 mg/hari. AI dewasa lebih tinggi dari AKG Amerika Serikat.[90]EFSA meninjau pertanyaan keamanan yang sama dan memutuskan bahwa tidak ada cukup informasi untuk menetapkan UL.[91]
Untuk tujuan pelabelan makanan dan suplemen makanan A.S., jumlah dalam satu porsi dinyatakan sebagai persentase dari Nilai Harian (%DV). Untuk tujuan pelabelan mangan, 100% Nilai Harian adalah 2,0 mg, tetapi pada 27 Mei 2016 direvisi menjadi 2,3 mg agar sesuai dengan AKG.[92][93]Tabel nilai harian dewasa lama dan baru disediakan diAsupan Harian Referensi.
Paparan atau asupan yang berlebihan dapat menyebabkan kondisi yang dikenal sebagaimanganisme,sebuah gangguanneurodegeneratifyang dapat menyebabkan kematian neurondopaminergikdan memiliki gejala yang mirip denganpenyakit Parkinson.[4][94]
Kekurangan mangan[sunting|sunting sumber]
Kekurangan mangan pada manusia, yang jarang terjadi, dapat mengakibatkan sejumlah masalah medis. Kekurangan mangan menyebabkan deformasi tulang pada hewan dan menghambat produksi kolagen dalam penyembuhan luka.[butuh rujukan]
Toksisitas dalam kehidupan laut[sunting|sunting sumber]
Banyak sistem enzimatik membutuhkan Mn untuk berfungsi, tetapi dalam kadar tinggi, Mn dapat menjadi racun. Salah satu alasan lingkungan mengapa tingkat Mn dapat meningkat dalam air laut adalah ketika periode hipoksia terjadi.[95]Sejak tahun 1990, telah ada laporan mengenai akumulasi Mn pada organisme laut meliputi ikan,krustasea,moluska,danekinodermata.Jaringan spesifik adalah target pada spesies yang berbeda, meliputi insang, otak, darah, ginjal, dan hati/hepatopankreas. Efek fisiologis telah dilaporkan pada spesies ini. Mn dapat memengaruhi pembaharuan imunosit dan fungsinya, seperti fagositosis dan aktivasi pro-fenoloksidase, menekan sistem kekebalan organisme. Hal ini akan menyebabkan organisme menjadi lebih rentan terhadap infeksi. Saat perubahan iklim terjadi, distribusi patogen akan meningkat, dan agar organisme dapat bertahan hidup dan mempertahankan diri dari patogen ini, mereka memerlukan sistem kekebalan yang sehat dan kuat. Jika sistem mereka dikompromikan dari tingkat Mn yang tinggi, mereka tidak akan mampu melawan patogen ini dan akhirnya mati.[61]
Peran biologis pada bakteri[sunting|sunting sumber]
Mn-SOD adalah jenis SOD yang terdapat padamitokondriaeukariotik,dan juga di sebagian besar bakteri (fakta ini sesuai dengan teori mitokondria berasal dari bakteri). Enzim Mn-SOD mungkin salah satu yang paling kuno, karena hampir semua organisme yang hidup dengan adanya oksigen menggunakannya untuk mengatasi efek racun darisuperoksida(O−2), yang terbentuk dari reduksi 1 elektron dioksigen. Pengecualiannya, yang semuanya adalah bakteri, meliputiLactobacillus plantarumdanlaktobasiliterkait, yang menggunakan sebuah mekanisme nonenzimatik yang berbeda dengan ion mangan (Mn2+) yang dikomplekskan dengan polifosfat, menunjukkan jalur evolusi untuk fungsi ini dalam kehidupan aerobik.[butuh rujukan]
Peran biologis pada tumbuhan[sunting|sunting sumber]
Mangan juga penting dalamevolusi oksigenfotosintesis dalamkloroplaspada tumbuhan.Kompleks evolusi oksigen(OEC) adalah bagian dari fotosistem II yang terkandung dalam membran tilakoid kloroplas; ia bertanggung jawab atasfotooksidasi terminal airselamareaksi cahayafotosintesis,dan memiliki inti metaloenzim yang mengandung empat atom mangan.[96][97]Untuk memenuhi persyaratan ini, sebagian besar pupuk tumbuhan berspektrum-luas mengandung mangan.[butuh rujukan]
Pencegahan[sunting|sunting sumber]
| Bahaya | |
|---|---|
| H401 | |
| P273,P501[98] | |
Senyawa mangan kurang beracun dibandingkan dengan logam lain yang tersebar luas, sepertinikeldantembaga.[99]Namun, paparan debu dan asap mangan tidak boleh melebihi nilai tertinggi sebesar 5 mg/m3bahkan untuk waktu yang singkat karena tingkat toksisitasnya.[100]Keracunan mangan telah dikaitkan dengan gangguan keterampilan motorik dan gangguan kognitif.[101]
Permanganat menunjukkan toksisitas yang lebih tinggi daripada senyawa mangan(II). Dosis fatalnya ialah sekitar 10 g, dan beberapa keracunan fatal telah terjadi. Efek oksidatifnya yang kuat dapat menyebabkannekrosispadaselaput lendir.Misalnya,kerongkonganakan terpengaruh jika permanganat tertelan. Hanya sejumlah kecil yang diserap oleh usus, tetapi jumlah kecil ini menunjukkan efek yang parah pada ginjal dan hati.[102][103]
Paparan mangan diAmerika Serikatdiatur olehAdministrasi Keselamatan dan Kesehatan Kerja(OSHA).[104]Seseorang dapat terpapar mangan di tempat kerja dengan menghirup atau menelannya. OSHA telah menetapkan batas legal (batas paparan yang diizinkan) untuk paparan mangan di tempat kerja sebesar 5 mg/m3selama 8 jam hari kerja.Institut Nasional untuk Keselamatan dan Kesehatan Kerja(NIOSH) telah menetapkanbatas paparan yang direkomendasikan(REL) sebesar 1 mg/m3selama 8 jam hari kerja dan batas jangka pendek sebesar 3 mg/m3.Pada kadar 500 mg/m3,manganlangsung berbahaya bagi kehidupan dan kesehatan.[105]
Secara umum, paparan terhadap konsentrasi udara Mn sekitar yang melebihi 5 μg Mn/m3dapat menyebabkan gejala yang diinduksi oleh Mn. Peningkatan ekspresi proteinferoportindalam sel ginjal embrionik manusia (HEK293) dikaitkan dengan penurunan konsentrasi Mn intraseluler dansitotoksisitasyang dilemahkan, ditandai dengan pembalikan serapanglutamatyang dikurangi Mn dan berkurangnya kebocoranlaktat dehidrogenase.[106]
Masalah kesehatan lingkungan[sunting|sunting sumber]
Dalam air minum[sunting|sunting sumber]
Mangan yang ditularkan melalui air memilikibioavailabilitasyang lebih besar daripada mangan makanan. Menurut hasil dari penelitian tahun 2010,[107]tingkat paparan mangan yang lebih tinggi dalamair minumdikaitkan dengan peningkatangangguan intelektualdan penurunankecerdasan intelektual(IQ) pada anak usia sekolah. Dihipotesiskan bahwa paparan jangka panjang karena menghirup mangan alami dalam air pancuran membuat 8,7 juta orang Amerika berisiko.[108]Namun, data menunjukkan bahwa tubuh manusia dapat pulih dari efek samping tertentu dari paparan berlebih terhadap mangan jika paparan dihentikan dan tubuh dapat membersihkan kelebihannya.[109]
Dalam bensin[sunting|sunting sumber]

Metilsiklopentadienil mangan trikarbonil(MMT) adalah aditifbensinyang digunakan untuk menggantikan senyawa timbal pada bensin tanpa timbal untuk meningkatkannilai oktandistilat minyak beroktan rendah. Ia dapat mengurangi agenketukan mesinmelalui aksigugus karbonil.Bahan bakar yang mengandung mangan cenderung membentuk mangan karbida, yang dapat merusakkatup buang.Dibandingkan dengan tahun 1953, saat ini kadar mangan di udara telah menurun.[110]
Dalam asap tembakau[sunting|sunting sumber]
Tumbuhan tembakaudapat dengan mudah menyerap dan mengakumulasilogam beratseperti mangan dari tanah di sekitarnya ke dalam daunnya. Mereka kemudian dihirup selamapengisapan tembakau.[111]Walaupun mangan adalah salah satu konstituen dariasap tembakau,[112]sebagian besar penelitian menyimpulkan bahwa konsentrasinya tidak berbahaya bagi kesehatan manusia.[113]
Peran dalam gangguan neurologis[sunting|sunting sumber]
Manganisme[sunting|sunting sumber]
Paparan mangan berlebih paling sering dikaitkan denganmanganisme,sebuah kelainan neurologis langka yang terkait dengan konsumsi atau inhalasi mangan yang berlebihan. Secara historis, orang yang bekerja dalam produksi atau pemrosesan paduan mangan[114][115]berisiko mengembangkan manganisme; namun, peraturan kesehatan dan keselamatan saat ini telah melindungi para pekerja di negara maju.[104]Gangguan ini pertama kali dijelaskan pada tahun 1837 oleh akademisi Inggris John Couper, yang mempelajari dua pasien yang merupakan penggiling mangan.[40]
Manganisme adalah sebuah gangguan bifasik. Pada tahap awal, orang yang teler mungkin mengalami depresi, perubahan suasana hati, perilaku kompulsif, dan psikosis. Gejala neurologis awal digantikan oleh manganisme tahap akhir, yang menyerupaipenyakit Parkinson.Gejala-gejalanya meliputi kelemahan, bicara monoton dan lambat, wajah tanpa ekspresi, tremor, gaya berjalan condong ke depan, ketidakmampuan untuk berjalan mundur tanpa jatuh, kekakuan, serta masalah umum dengan ketangkasan, gaya berjalan dan keseimbangan.[40][116]Tidak seperti penyakit Parkinson, manganisme tidak terkait dengan hilangnya indra penciuman dan pasien biasanya tidak responsif terhadap pengobatan denganL-DOPA.[117]Gejala manganisme tahap akhir menjadi lebih parah dari waktu ke waktu bahkan jika sumber paparan dihilangkan dan kadar mangan di otak kembali normal.[116]
Paparan mangan kronis telah terbukti menghasilkan penyakit seperti Parkinsonisme yang ditandai dengan kelainan gerakan.[118]Kondisi ini tidak responsif terhadapterhadap terapi tipikal yang digunakan dalam pengobatan PD,menyarankan jalur alternatif selain kehilangandopaminergiktipikal di dalamsubstantia nigra.[118]Mangan dapat menumpuk dibasal ganglia,menyebabkan gerakan abnormal.[119]Mutasi gen SLC30A10, transporter efluks mangan yang diperlukan untuk menurunkan Mn intraseluler, telah dikaitkan dengan perkembangan penyakit mirip Parkinsonisme ini.[120]Badan Lewykhas untuk PD tidak terlihat pada parkinsonisme yang diinduksi oleh Mn.[119]
Eksperimen pada hewan telah memberikan kesempatan untuk memeriksa konsekuensi dari paparan berlebih mangan dalam kondisi yang terkendali. Pada tikus besar (rat) (yang tidak agresif), mangan akan menginduksi perilaku membunuh-tikus-kecil (mouse-killing).[121]
Gangguan perkembangan anak[sunting|sunting sumber]
Beberapa penelitian baru-baru ini mencoba untuk menguji efek paparan mangan berlebih dosis rendah kronis padaperkembangan anak.Penelitian paling awal dilakukan diprovinsi Shanxi,Tiongkok. Air minum di sana telah terkontaminasi melalui irigasi limbah yang tidak tepat dan mengandung 240–350 μg Mn/L. Meskipun konsentrasi Mn pada atau di bawah 300 μg Mn/L dianggap aman pada saat penelitian oleh EPA A.S. dan 400 μg Mn/L olehOrganisasi Kesehatan Dunia,92 anak yang diambil sampelnya (berusia antara 11 dan 13 tahun) dari provinsi ini menunjukkan kinerja yang lebih rendah pada tes ketangkasan dan kecepatan manual, memori jangka pendek, dan identifikasi visual, dibandingkan dengan anak-anak dari daerah yang tidak terkontaminasi. Baru-baru ini, sebuah penelitian terhadap anak-anak berusia 10 tahun di Bangladesh menunjukkan hubungan antara konsentrasi Mn dalam air sumur dan penurunan skor IQ. Penelitian ketiga yang dilakukan diQuebecmeneliti anak sekolah antara usia 6 dan 15 tahun yang tinggal di rumah yang menerima air dari sumur yang mengandung 610 μg Mn/L; harus terdapat kontrol di rumah yang menerima air dari sumur yang mengandung 160 μg Mn/L. Anak-anak dalam kelompok eksperimen ini menunjukkan peningkatan perilaku hiperaktif dan menentang.[107]
Konsentrasi aman maksimum saat ini berdasarkan peraturan EPA adalah 50 μg Mn/L.[122]
Penyakit neurodegeneratif[sunting|sunting sumber]
Sebuah protein yang disebutDMT1adalah pengangkut utama dalam penyerapan mangan dari usus, dan mungkin merupakan pengangkut utama mangan melintasisawar darah–otak.DMT1 juga mengangkut mangan yang dihirup melintasi epitel hidung. Mekanisme yang diusulkan untuk toksisitas mangan adalah bahwa disregulasi akan menyebabkan stres oksidatif, disfungsi mitokondria,eksitotoksisitasyang dimediasi glutamat, dan agregasi protein.[123]
Lihat pula[sunting|sunting sumber]
- Eksportir mangan,protein transpor membran
- Daftar negara menurut produksi mangan
- Parkerisasi
Referensi[sunting|sunting sumber]
- ^(Indonesia)"Mangan".KBBI Daring.Diakses tanggal17 Juli2022.
- ^Weast, Robert (1984).CRC, Handbook of Chemistry and Physics.Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110.ISBN0-8493-0464-4.
- ^abErikson, Keith M.; Ascher, Michael (2019). "Chapter 10. Manganese: Its Role in Disease and Health". Dalam Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L.Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic.Metal Ions in Life Sciences.19.Berlin: de Gruyter GmbH. hlm. 253–266.doi:10.1515/9783110527872-016.ISBN978-3-11-052691-2.PMID30855111.
- ^abcdefEmsley, John (2001)."Manganese".Nature's Building Blocks: An A-Z Guide to the Elements.Oxford, UK: Oxford University Press. hlm.249–253.ISBN978-0-19-850340-8.
- ^Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). "Chapter 6 Manganese Homeostasis and Transport". Dalam Banci, Lucia.Metallomics and the Cell.Metal Ions in Life Sciences.12.Springer. hlm. 169–201.doi:10.1007/978-94-007-5561-1_6.ISBN978-94-007-5560-4.PMC6542352
 .PMID23595673.Buku elektronikISBN978-94-007-5561-1.
.PMID23595673.Buku elektronikISBN978-94-007-5561-1.
- ^abcdHolleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Mangan".Lehrbuch der Anorganischen Chemie(dalam bahasa Jerman) (edisi ke-91–100). Walter de Gruyter. hlm. 1110–1117.ISBN978-3-11-007511-3.
- ^Lide, David R. (2004).Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics.CRC press.ISBN978-0-8493-0485-9.Diarsipkan dariversi asli
 tanggal 17 Desember 2019.Diakses tanggal27 Juni2023.
tanggal 17 Desember 2019.Diakses tanggal27 Juni2023.
- ^abAudi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017)."The NUBASE2016 evaluation of nuclear properties"(PDF).Chinese Physics C.41(3): 030001.Bibcode:2017ChPhC..41c0001A.doi:10.1088/1674-1137/41/3/030001.
- ^Clery, Daniel (4 Juni 2020)."The galaxy's brightest explosions go nuclear with an unexpected trigger: pairs of dead stars".Science.Diakses tanggal27 Juni2023.
- ^Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregory F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg; Schlüchter, Christian; Serifiddin, Feride; Winckler, Gisela (2006). "Terrestrial manganese-53 – A new monitor of Earth surface processes".Earth and Planetary Science Letters.251(3–4): 334–345.Bibcode:2006E&PSL.251..334S.doi:10.1016/j.epsl.2006.09.016.
- ^Birck, J.; Rotaru, M.; Allègre, C. (1999). "53Mn-53Cr evolution of the early solar system".Geochimica et Cosmochimica Acta.63(23–24): 4111–4117.Bibcode:1999GeCoA..63.4111B.doi:10.1016/S0016-7037(99)00312-9.
- ^Lugmair, G.; Shukolyukov, A. (1998)."Early solar system timescales according to 53Mn-53Cr systematics".Geochimica et Cosmochimica Acta.62(16): 2863–2886.Bibcode:1998GeCoA..62.2863L.doi:10.1016/S0016-7037(98)00189-6.
- ^Shukolyukov, Alexander; Lugmair, Günter W. (2000). "On The 53Mn Heterogeneity In The Early Solar System".Space Science Reviews.92:225–236.Bibcode:2000SSRv...92..225S.doi:10.1023/A:1005243228503.
- ^Trinquier, A.; Birck, J.; Allègre, C.; Göpel, C.; Ulfbeck, D. (2008). "53Mn–53Cr systematics of the early Solar System revisited".Geochimica et Cosmochimica Acta.72(20): 5146–5163.Bibcode:2008GeCoA..72.5146T.doi:10.1016/j.gca.2008.03.023.
- ^abcYoung, D.A. (1975)."Phase diagrams of the elements".International Nuclear Information System.LNL: 15.Diakses tanggal27 Juni2023.
- ^abDhananjayan, N.; Banerjee, T. (1969).Crystallographic modifications of manganese and their transformation characteristics.Chapter 1 of:Structure of Electro-Deposited Manganese.CSIR-NML. hlm. 3–28.
- ^Kemmitt, R. D. W.; Peacock, R. D. (1973).The Chemistry of Manganese, Technetium and Rhenium. Pergamon Texts in Inorganic Chemistry.Saint Louis: Elsevier Science. hlm. 778.ISBN978-1-4831-3806-0.OCLC961064866.
- ^Bradley, A.J.; Thewlis, J. (1927). "The crystal structure of α-manganese".Proceedings of the Royal Society of London, Series A.115(771): 456–471.Bibcode:1927RSPSA.115..456B.doi:10.1098/rspa.1927.0103.ISSN0950-1207.
- ^Lawson, A. C.; Larson, Allen C.; Aronson, M. C.; et al. (1994). "Magnetic and crystallographic order in α‐manganese".J. Appl. Phys.76(10): 7049–7051.Bibcode:1994JAP....76.7049L.doi:10.1063/1.358024.ISSN0021-8979.
- ^abPrior, Timothy J; Nguyen-Manh, Duc; Couper, Victoria J; Battle, Peter D (2004). "Ferromagnetism in the beta-manganese structure: Fe1.5Pd0.5Mo3N ".Journal of Physics: Condensed Matter.16(13): 2273–2281.Bibcode:2004JPCM...16.2273P.doi:10.1088/0953-8984/16/13/008.ISSN0953-8984.
- ^Funahashi, S.; Kohara, T. (1984). "Neutron diffuse scattering in β‐manganese".J. Appl. Phys.55(6): 2048–2050.Bibcode:1984JAP....55.2048F.doi:10.1063/1.333561.ISSN0021-8979.
- ^abcDuschanek, H.; Mohn, P.; Schwarz, K. (1989). "Antiferromagnetic and ferromagnetic gamma-manganese generalisation of the fixed-spin-moment method".Physica B: Condensed Matter.161(1–3): 139–142.doi:10.1016/0921-4526(89)90120-8.ISSN0921-4526.
- ^Bacon, G E; Cowlam, N (1970). "A study of some alloys of gamma -manganese by neutron diffraction".Journal of Physics C: Solid State Physics.3(3): 675–686.Bibcode:1970JPhC....3..675B.doi:10.1088/0022-3719/3/3/023.ISSN0022-3719.
- ^"Ch. 20".Shriver and Atkins' Inorganic Chemistry.Oxford University Press. 2010.ISBN978-0-19-923617-6.
- ^Luft, J. H. (1956)."Permanganate – a new fixative for electron microscopy".Journal of Biophysical and Biochemical Cytology.2(6): 799–802.doi:10.1083/jcb.2.6.799.PMC2224005
 .PMID13398447.
.PMID13398447.
- ^Man, Wai-Lun; Lam, William W. Y.; Lau, Tai-Chu (2014). "Reactivity of Nitrido Complexes of Ruthenium(VI), Osmium(VI), and Manganese(V) Bearing Schiff Base and Simple Anionic Ligands".Accounts of Chemical Research.47(2): 427–439.doi:10.1021/ar400147y.PMID24047467.
- ^Goldberg, David P. (2007). "Corrolazines: New Frontiers in High-Valent Metalloporphyrinoid Stability and Reactivity".Accounts of Chemical Research.40(7): 626–634.doi:10.1021/ar700039y.PMID17580977.
- ^Yano, Junko; Yachandra, Vittal (2014)."Mn4Ca Cluster in Photosynthesis: Where and How Water is Oxidized to Dioxygen".Chemical Reviews.114(8): 4175–4205.doi:10.1021/cr4004874.PMC4002066
 .PMID24684576.
.PMID24684576.
- ^Rayner-Canham, Geoffrey dan Overton, Tina (2003)Descriptive Inorganic Chemistry,Macmillan, hlm. 491,ISBN0-7167-4620-4.
- ^Schmidt, Max (1968). "VII. Nebengruppe".Anorganische Chemie II(dalam bahasa Jerman). Wissenschaftsverlag. hlm. 100–109.
- ^Girolami, Gregory S.; Wilkinson, Geoffrey; Thornton-Pett, Mark; Hursthouse, Michael B. (1983). "Hydrido, alkyl, and ethylene 1,2-bis(dimethylphosphino)ethane complexes of manganese and the crystal structures of MnBr2(dmpe)2, [Mn(AlH4)(dmpe)2]2 and MnMe2(dmpe)2".Journal of the American Chemical Society.105(22): 6752–6753.doi:10.1021/ja00360a054.
- ^languagehat (28 Mei 2005)."MAGNET".languagehat.com(dalam bahasa Inggris).Diakses tanggal27 Juni2023.
- ^Calvert, J. B. (24 Januari 2003)."Chromium and Manganese".Diarsipkan dariversi aslitanggal 31 Desember 2016.Diakses tanggal27 Juni2023.
- ^Chalmin, Emilie; Menu, Michel; Vignaud, Colette (2003). "Analysis of rock art painting and technology of Palaeolithic painters".Measurement Science and Technology.14(9): 1590–1597.doi:10.1088/0957-0233/14/9/310.
- ^Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006)."Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure"(PDF).Applied Physics A.83(12): 213–218.Bibcode:2006ApPhA..83..213C.doi:10.1007/s00339-006-3510-7.hdl:2268/67458.
- ^Sayre, E. V.; Smith, R. W. (1961). "Compositional Categories of Ancient Glass".Science.133(3467): 1824–1826.Bibcode:1961Sci...133.1824S.doi:10.1126/science.133.3467.1824.PMID17818999.
- ^abcMccray, W. Patrick (1998). "Glassmaking in renaissance Italy: The innovation of venetian cristallo".JOM.50(5): 14–19.Bibcode:1998JOM....50e..14M.doi:10.1007/s11837-998-0024-0.
- ^Rancke-Madsen, E. (1975). "The Discovery of an Element".Centaurus.19(4): 299–313.Bibcode:1975Cent...19..299R.doi:10.1111/j.1600-0498.1975.tb00329.x.
- ^Alessio, L.; Campagna, M.; Lucchini, R. (2007). "From lead to manganese through mercury: mythology, science, and lessons for prevention".American Journal of Industrial Medicine.50(11): 779–787.doi:10.1002/ajim.20524.PMID17918211.
- ^abcCouper, John (1837). "On the effects of black oxide of manganese when inhaled into the lungs".Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci.1:41–42.
- ^Olsen, Sverre E.; Tangstad, Merete; Lindstad, Tor (2007). "History of omanganese".Production of Manganese Ferroalloys.Tapir Academic Press. hlm. 11–12.ISBN978-82-519-2191-6.
- ^abPreisler, Eberhard (1980). "Moderne Verfahren der Großchemie: Braunstein".Chemie in unserer Zeit(dalam bahasa Jerman).14(5): 137–148.doi:10.1002/ciuz.19800140502.
- ^Bhattacharyya, P. K.; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984)."Geochemistry of braunite and associated phases in metamorphosed non-calcareous manganese ores of India".Contributions to Mineralogy and Petrology.87(1): 65–71.Bibcode:1984CoMP...87...65B.doi:10.1007/BF00371403.
- ^abcUSGS Mineral Commodity Summaries 2009
- ^Cook, Nigel J.; Ciobanu, Cristiana L.; Pring, Allan; Skinner, William; Shimizu, Masaaki; Danyushevsky, Leonid; Saini-Eidukat, Bernhardt; Melcher, Frank (2009)."Trace and minor elements in sphalerite: A LA-ICPMS study".Geochimica et Cosmochimica Acta(dalam bahasa Inggris).73(16): 4761–4791.Bibcode:2009GeCoA..73.4761C.doi:10.1016/j.gca.2009.05.045.
- ^Wang, X; Schröder, HC; Wiens, M; Schlossmacher, U; Müller, WEG (2009). "Manganese/polymetallic nodules: micro-structural characterization of exolithobiontic- and endolithobiontic microbial biofilms by scanning electron microscopy".Micron.40(3): 350–358.doi:10.1016/j.micron.2008.10.005.PMID19027306.
- ^United Nations (1978).Manganese Nodules: Dimensions and Perspectives.Marine Geology.Natural Resources Forum Library.41.Springer. hlm. 343.Bibcode:1981MGeol..41..343C.doi:10.1016/0025-3227(81)90092-X.ISBN978-90-277-0500-6.OCLC4515098.
- ^"Manganese Mining in South Africa – Overview".MBendi Information Services. Diarsipkan dariversi aslitanggal 5 Februari 2016.Diakses tanggal27 Juni2023.
- ^Elliott, R; Coley, K; Mostaghel, S; Barati, M (2018). "Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals".JOM.70(5): 680–690.Bibcode:2018JOM....70e.680E.doi:10.1007/s11837-018-2769-4.
- ^Corathers, L. A.; Machamer, J. F. (2006)."Manganese".Industrial Minerals & Rocks: Commodities, Markets, and Uses(edisi ke-7). SME. hlm. 631–636.ISBN978-0-87335-233-8.
- ^abZhang, Wensheng; Cheng, Chu Yong (2007). "Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide".Hydrometallurgy.89(3–4): 137–159.doi:10.1016/j.hydromet.2007.08.010.
- ^Chow, Norman; Nacu, Anca; Warkentin, Doug; Aksenov, Igor; Teh, Hoe (2010)."The Recovery of Manganese from low grade resources: bench scale metallurgical test program completed"(PDF).Kemetco Research Inc. Diarsipkan dariversi asli(PDF)tanggal 2 Februari 2012.
- ^"The CIA secret on the ocean floor".BBC News(dalam bahasa Inggris). 19 Februari 2018.Diakses tanggal27 Juni2023.
- ^"Project Azorian: The CIA's Declassified History of the Glomar Explorer".National Security Archive at George Washington University. 12 Februari 2010.Diakses tanggal27 Juni2023.
- ^Hein, James R. (Januari 2016).Encyclopedia of Marine Geosciences - Manganese Nodules.Springer. hlm. 408–412.Diakses tanggal27 Juni2023.
- ^Hoseinpour, Vahid; Ghaemi, Nasser (1 Desember 2018)."Green synthesis of manganese nanoparticles: Applications and future perspective–A review".Journal of Photochemistry and Photobiology B: Biology.189:234–243.doi:10.1016/j.jphotobiol.2018.10.022.PMID30412855.Diakses tanggal27 Juni2023.
- ^International Seabed Authority."Polymetallic Nodules"(PDF).isa.org.International Seabed Authority.Diakses tanggal27 Juni2023.
- ^Oebius, Horst U; Becker, Hermann J; Rolinski, Susanne; Jankowski, Jacek A (Januari 2001)."Parametrization and evaluation of marine environmental impacts produced by deep-sea manganese nodule mining".Deep Sea Research Part II: Topical Studies in Oceanography.48(17–18): 3453–3467.Bibcode:2001DSRII..48.3453O.doi:10.1016/s0967-0645(01)00052-2.ISSN0967-0645.
- ^Thompson, Kirsten F.; Miller, Kathryn A.; Currie, Duncan; Johnston, Paul; Santillo, David (2018). "Seabed Mining and Approaches to Governance of the Deep Seabed".Frontiers in Marine Science.5.doi:10.3389/fmars.2018.00480
 .
.
- ^abRay, Durbar; Babu, E. V. S. S. K.; Surya Prakash, L. (1 Januari 2017). "Nature of Suspended Particles in Hydrothermal Plume at 3°40'N Carlsberg Ridge:A Comparison with Deep Oceanic Suspended Matter".Current Science.112(1): 139.doi:10.18520/cs/v112/i01/139-146
 .ISSN0011-3891.
.ISSN0011-3891.
- ^abHernroth, Bodil; Tassidis, Helena; Baden, Susanne P. (Maret 2020)."Immunosuppression of aquatic organisms exposed to elevated levels of manganese: From global to molecular perspective".Developmental & Comparative Immunology.104:103536.doi:10.1016/j.dci.2019.103536.ISSN0145-305X.PMID31705914.
- ^abSim, Nari; Orians, Kristin J. (Oktober 2019)."Annual variability of dissolved manganese in Northeast Pacific along Line-P: 2010–2013".Marine Chemistry.216:103702.doi:10.1016/j.marchem.2019.103702.ISSN0304-4203.
- ^Bartlett, Richmond; Ross, Donald (2005). "Chemistry of Redox Processes in Soils". Dalam Tabatabai, M.A.; Sparks, D.L.Chemical Processes in Soils.SSSA Book Series, no. 8. Madison, Wisconsin: Soil Science Society of America. hlm. 461–487.LCCN2005924447.
- ^Dixon, Joe B.; White, G. Norman (2002). "Manganese Oxides". Dalam Dixon, J.B.; Schulze, D.G.Soil Mineralogy with Environmental Applications.SSSA Book Series no. 7. Madison, Wisconsin: Soil Science Society of America. hlm. 367–386.LCCN2002100258.
- ^Verhoeven, John D. (2007).Steel metallurgy for the non-metallurgist.Materials Park, Ohio: ASM International. hlm.56–57.ISBN978-0-87170-858-8.
- ^Manganese USGS 2006
- ^Dastur, Y. N.; Leslie, W. C. (1981). "Mechanism of work hardening in Hadfield manganese steel".Metallurgical Transactions A.12(5): 749–759.Bibcode:1981MTA....12..749D.doi:10.1007/BF02648339.
- ^Stansbie, John Henry (2007).Iron and Steel.Read Books. hlm. 351–352.ISBN978-1-4086-2616-0.
- ^Brady, George S.; Clauser, Henry R.; Vaccari. John A. (2002).Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors.New York, NY: McGraw-Hill. hlm. 585–587.ISBN978-0-07-136076-0.
- ^Tweedale, Geoffrey (1985). "Sir Robert Abbott Hadfield F.R.S. (1858–1940), and the Discovery of Manganese Steel Geoffrey Tweedale".Notes and Records of the Royal Society of London.40(1): 63–74.doi:10.1098/rsnr.1985.0004
 .JSTOR531536.
.JSTOR531536.
- ^"Chemical properties of 2024 aluminum allow".Metal Suppliers Online, LLC.Diakses tanggal27 Juni2023.
- ^abKaufman, John Gilbert (2000)."Applications for Aluminium Alloys and Tempers".Introduction to aluminum alloys and tempers.ASM International. hlm. 93–94.ISBN978-0-87170-689-8.
- ^abDell, R. M. (2000). "Batteries fifty years of materials development".Solid State Ionics.134(1–2): 139–158.doi:10.1016/S0167-2738(00)00722-0.
- ^"WSK1216"(PDF).vishay.Vishay Intertechnology.Diakses tanggal27 Juni2023.
- ^"EPA Comments on the Gasoline Additive MMT".epa.gov.EPA.Diakses tanggal27 Juni2023.
- ^Shorter Oxford English Dictionary(edisi ke-5). Oxford University Press. 2002.ISBN978-0-19-860457-0.
Tanah berwarna merah kecokelatan yang mengandung besi dan mangan oksida dan lebih gelap dari oker dan sienna, digunakan untuk membuat berbagai pigmen.
- ^Chen, Daquin; Zhou, Yang; Zhong, Jiasong (2016). "A review on Mn4+activators in solids for warm white light-emitting diodes ".RSC Advances.6(89): 86285–86296.Bibcode:2016RSCAd...686285C.doi:10.1039/C6RA19584A.
- ^Baur, Florian; Jüstel, Thomas (2016). "Dependence of the optical properties of Mn4+activated A2Ge4O9(A=K,Rb) on temperature and chemical environment ".Journal of Luminescence.177:354–360.Bibcode:2016JLum..177..354B.doi:10.1016/j.jlumin.2016.04.046.
- ^Jansen, T.; Gorobez, J.; Kirm, M.; Brik, M. G.; Vielhauer, S.; Oja, M.; Khaidukov, N. M.; Makhov, V. N.; Jüstel, T. (1 Januari 2018). "Narrow Band Deep Red Photoluminescence of Y2Mg3Ge3O12:Mn4+,Li+Inverse Garnet for High Power Phosphor Converted LEDs ".ECS Journal of Solid State Science and Technology.7(1): R3086–R3092.doi:10.1149/2.0121801jss.
- ^Jansen, Thomas; Baur, Florian; Jüstel, Thomas (2017). "Red emitting K2NbF7:Mn4+and K2TaF7:Mn4+for warm-white LED applications ".Journal of Luminescence.192:644–652.Bibcode:2017JLum..192..644J.doi:10.1016/j.jlumin.2017.07.061.
- ^Zhou, Zhi; Zhou, Nan; Xia, Mao; Yokoyama, Meiso; Hintzen, H. T. (Bert) (6 Oktober 2016). "Research progress and application prospects of transition metal Mn4+-activated luminescent materials ".Journal of Materials Chemistry C.4(39): 9143–9161.doi:10.1039/c6tc02496c.
- ^"TriGain LED phosphor system using red Mn4+-doped complex fluorides "(PDF).GE Global Research.Diakses tanggal10 December2022.
- ^Kuwahara, Raymond T.; Skinner III, Robert B.; Skinner Jr., Robert B. (2001)."Nickel coinage in the United States".Western Journal of Medicine.175(2): 112–114.doi:10.1136/ewjm.175.2.112.PMC1071501
 .PMID11483555.
.PMID11483555.
- ^"Design of the Sacagawea dollar".United States Mint.Diakses tanggal27 Juni2023.
- ^Shepard, Anna Osler (1956). "Manganese and Iron–Manganese Paints".Ceramics for the Archaeologist.Carnegie Institution of Washington. hlm. 40–42.ISBN978-0-87279-620-1.
- ^Rice, Derek B.; Massie, Allyssa A.; Jackson, Timothy A. (2017). "Manganese–Oxygen Intermediates in O–O Bond Activation and Hydrogen-Atom Transfer Reactions".Accounts of Chemical Research.50(11): 2706–2717.doi:10.1021/acs.accounts.7b00343.PMID29064667.
- ^Takeda, A. (2003)."Manganese action in brain function".Brain Research Reviews.41(1): 79–87.doi:10.1016/S0165-0173(02)00234-5.PMID12505649.
- ^abInstitute of Medicine (US) Panel on Micronutrients (2001)."Manganese".Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium.National Academy Press. hlm. 394–419.ISBN978-0-309-07279-3.PMID25057538.
- ^Lihat"Manganese".Micronutrient Information Center.Oregon State UniversityLinus Pauling Institute.23 April 2014.
- ^"Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies"(PDF).2017.
- ^Tolerable Upper Intake Levels For Vitamins And Minerals(PDF),European Food Safety Authority, 2006
- ^"Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982"(PDF).
- ^"Daily Value Reference of the Dietary Supplement Label Database (DSLD)".Dietary Supplement Label Database (DSLD).Diarsipkan dariversi aslitanggal 7 April 2020.Diakses tanggal27 Juni2023.
- ^Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). "Chapter 7. Manganese in Health and Disease". Dalam Astrid Sigel; Helmut Sigel; Roland K. O. Sigel.Interrelations between Essential Metal Ions and Human Diseases.Metal Ions in Life Sciences.13.Springer. hlm. 199–227.doi:10.1007/978-94-007-7500-8_7.ISBN978-94-007-7499-5.PMC6589086
 .PMID24470093.
.PMID24470093.
- ^Hernroth, Bodil; Krång, Anna-Sara; Baden, Susanne (February 2015)."Bacteriostatic suppression in Norway lobster (Nephrops norvegicus) exposed to manganese or hypoxia under pressure of ocean acidification".Aquatic Toxicology.159:217–224.doi:10.1016/j.aquatox.2014.11.025.ISSN0166-445X.PMID25553539.
- ^Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (Mei 2011)."Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å"(PDF).Nature.473(7345): 55–60.Bibcode:2011Natur.473...55U.doi:10.1038/nature09913.PMID21499260.
- ^Dismukes, G. Charles; Willigen, Rogier T. van (2006). "Manganese: The Oxygen-Evolving Complex & Models".Manganese: The Oxygen-Evolving Complex & Models Based in part on the article Manganese: Oxygen-Evolving Complex & Models by Lars-Erik Andréasson & Tore Vänngård which appeared in the Encyclopedia of Inorganic Chemistry, First Edition, First Edition.Encyclopedia of Inorganic Chemistry.doi:10.1002/0470862106.ia128.ISBN978-0470860786.
- ^"Safety Data Sheet".Sigma-Aldrich.Diakses tanggal28 Juni2023.
- ^Hasan, Heather (2008).Manganese.The Rosen Publishing Group. hlm. 31.ISBN978-1-4042-1408-8.
- ^"Manganese Chemical Background".Metcalf Institute for Marine and Environmental Reporting University of Rhode Island. April 2006. Diarsipkan dariversi aslitanggal 28 Agustus 2006.Diakses tanggal28 Juni2023.
- ^"Risk Assessment Information System Toxicity Summary for Manganese".Laboratorium Nasional Oak Ridge.Diakses tanggal28 Juni2023.
- ^Ong, K. L.; Tan, T. H.; Cheung, W. L. (1997)."Potassium permanganate poisoning – a rare cause of fatal self poisoning".Emergency Medicine Journal.14(1): 43–45.doi:10.1136/emj.14.1.43.PMC1342846
 .PMID9023625.
.PMID9023625.
- ^Young, R.; Critchley, J. A.; Young, K. K.; Freebairn, R. C.; Reynolds, A. P.; Lolin, Y. I. (1996)."Fatal acute hepatorenal failure following potassium permanganate ingestion".Human & Experimental Toxicology.15(3): 259–61.doi:10.1177/096032719601500313.PMID8839216.
- ^ab"Safety and Health Topics: Manganese Compounds (as Mn)".U.S.Occupational Safety and Health Administration.
- ^"NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)".Centers for Disease Control.Diakses tanggal28 Juni2023.
- ^Yin, Z.; Jiang, H.; Lee, E. S.; Ni, M.; Erikson, K. M.; Milatovic, D.; Bowman, A. B.; Aschner, M. (2010)."Ferroportin is a manganese-responsive protein that decreases manganese cytotoxicity and accumulation"(PDF).Journal of Neurochemistry.112(5): 1190–8.doi:10.1111/j.1471-4159.2009.06534.x.PMC2819584
 .PMID20002294.
.PMID20002294.
- ^abBouchard, M. F; Sauvé, S; Barbeau, B; Legrand, M; Bouffard, T; Limoges, E; Bellinger, D. C; Mergler, D (2011)."Intellectual impairment in school-age children exposed to manganese from drinking water".Environmental Health Perspectives.119(1): 138–143.doi:10.1289/ehp.1002321.PMC3018493
 .PMID20855239.
.PMID20855239.
- ^Barceloux, Donald; Barceloux, Donald (1999). "Manganese".Clinical Toxicology.37(2): 293–307.doi:10.1081/CLT-100102427.PMID10382563.
- ^Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994)."Dystonia, hyperintense basal ganglia, and high whole blood manganese levels in Alagille's syndrome".Gastroenterology.106(4): 1068–71.doi:10.1016/0016-5085(94)90769-2.PMID8143974.
- ^Agency for Toxic Substances and Disease Registry (2012)6. Potential for human exposure,dalamToxicological Profile for Manganese,Atlanta, GA: U.S. Department of Health and Human Services.
- ^Pourkhabbaz, A; Pourkhabbaz, H (2012)."Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues".Iranian Journal of Basic Medical Sciences.15(1): 636–644.PMC3586865
 .PMID23493960.
.PMID23493960.
- ^Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011)."Hazardous Compounds in Tobacco Smoke".International Journal of Environmental Research and Public Health.8(12): 613–628.doi:10.3390/ijerph8020613
 .PMC3084482
.PMC3084482  .PMID21556207.
.PMID21556207.
- ^Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). "Metals in cigarette smoke".IUBMB Life.57(12): 805–9.doi:10.1080/15216540500459667
 .PMID16393783.
.PMID16393783.
- ^Baselt, R. (2008)Disposition of Toxic Drugs and Chemicals in Man,edisi ke-8, Biomedical Publications, Foster City, CA, hlm. 883–886,ISBN0-9626523-7-7.
- ^Normandin, Louise; Hazell, A. S. (2002). "Manganese neurotoxicity: an update of pathophysiologic mechanisms".Metabolic Brain Disease.17(4): 375–87.doi:10.1023/A:1021970120965.PMID12602514.
- ^abCersosimo, M. G.; Koller, W.C. (2007). "The diagnosis of manganese-induced parkinsonism".NeuroToxicology.27(3): 340–346.doi:10.1016/j.neuro.2005.10.006.PMID16325915.
- ^Lu, C. S.; Huang, C.C; Chu, N.S.; Calne, D.B. (1994)."Levodopa failure in chronic manganism".Neurology.44(9): 1600–1602.doi:10.1212/WNL.44.9.1600.PMID7936281.
- ^abGuilarte TR, Gonzales KK (August 2015)."Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson's Disease: Environmental and Genetic Evidence".Toxicological Sciences(Review).146(2): 204–12.doi:10.1093/toxsci/kfv099.PMC4607750
 .PMID26220508.
.PMID26220508.
- ^abKwakye GF, Paoliello MM, Mukhopadhyay S, Bowman AB, Aschner M (Juli 2015)."Manganese-Induced Parkinsonism and Parkinson's Disease: Shared and Distinguishable Features".Int J Environ Res Public Health(Review).12(7): 7519–40.doi:10.3390/ijerph120707519
 .PMC4515672
.PMC4515672  .PMID26154659.
.PMID26154659.
- ^Peres TV, Schettinger MR, Chen P, Carvalho F, Avila DS, Bowman AB, Aschner M (November 2016)."Manganese-induced neurotoxicity: a review of its behavioral consequences and neuroprotective strategies".BMC Pharmacology & Toxicology(Review).17(1): 57.doi:10.1186/s40360-016-0099-0.PMC5097420
 .PMID27814772.
.PMID27814772.
- ^Lazrishvili, I.; et al. (2016). "Manganese loading induces mouse-killing behaviour in nonaggressive rats".Journal of Biological Physics and Chemistry.16(3): 137–141.doi:10.4024/31LA14L.jbpc.16.03.
- ^"Drinking Water Contaminants".US EPA.Diakses tanggal28 Juni2023.
- ^Prabhakaran, K.; Ghosh, D.; Chapman, G.D.; Gunasekar, P.G. (2008). "Molecular mechanism of manganese exposure-induced dopaminergic toxicity".Brain Research Bulletin.76(4): 361–367.doi:10.1016/j.brainresbull.2008.03.004.ISSN0361-9230.PMID18502311.
Pranala luar[sunting|sunting sumber]
- (Inggris)National Pollutant Inventory – Lembar Fakta Mangan dan Senyawanya
- (Inggris)Institut Mangan Internasional
- (Inggris)Halaman Topik Mangan NIOSH
- (Inggris)MangandiThe Periodic Table of Videos(Universitas Nottingham)
- (Inggris)Semua tentang Dendrit Mangan
- (Inggris)Terak Tanur Busur Listrik (EAF)
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


