Mendelevium
101Md Mendelevium | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
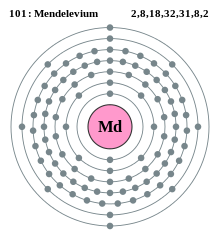 Konfigurasi elektron mendelevium | |||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan |
| ||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | tak diketahui | ||||||||||||||||||||||||||||||||||||||||||||||
| Mendelevium dalamtabel periodik | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom(Z) | 101 | ||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan n/a | ||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 7 | ||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-f | ||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | aktinida | ||||||||||||||||||||||||||||||||||||||||||||||
| Nomor massa | [258] | ||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Rn] 5f137s2 | ||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 31, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||||||||
| FasepadaSTS(0 °C dan 101,325kPa) | padat(diprediksi) | ||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 1100K(827 °C, 1521 °F)(diprediksi) | ||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatanmendekatis.k. | 10,3(7) g/cm3(diprediksi)[2][a] | ||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | +2,+3 | ||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,3 | ||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 636 kJ/mol[3] | ||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | sintetis | ||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka(fcc) (diprediksi)[2] | ||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-11-1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||
| Penamaan | dariD. Mendeleev | ||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Laboratorium Nasional Lawrence Berkeley(1955) | ||||||||||||||||||||||||||||||||||||||||||||||
| Isotop mendeleviumyang utama | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Mendeleviumadalah sebuahunsur kimiasintetisdenganlambangMd(sebelumnya Mv) dannomor atom101. Ia merupakan salah satuunsur transuraniummetalik yangradioaktifdalam deretaktinida.Ia juga merupakan unsur pertama berdasarkan nomor atom yang saat ini tidak dapat diproduksi dalam jumlahmakroskopismelalui pemborbardiranneutronterhadapunsur yang lebih ringan.Ia adalah aktinida ketiga terakhir dan unsur transuranium kesembilan. Ia hanya dapat diproduksi dalamakselerator partikeldengan membombardir unsur yang lebih ringan dengan partikel bermuatan. Tujuh belasisotopnyatelah diketahui; yang paling stabil adalah258Md denganwaktu paruh51 hari; namun,256Md yang berumur lebih pendek (waktu paruh 1,17 jam) adalah yang paling umum digunakan dalam kimia karena dapat diproduksi dalam skala yang lebih besar.
Mendelevium ditemukan melalui pembombardiraneinsteiniumdenganpartikel alfapada tahun 1955, metode yang masih digunakan untuk memproduksinya sampai sekarang. Ia dinamai dariDmitri Mendeleev,bapak daritabel periodikunsur kimia. Dengan menggunakan jumlahmikrogrameinsteinium-253 yang tersedia, lebih dari satu juta atom mendelevium dapat dibuat setiap jam. Sifat kimianya khas untuk aktinida akhir, dengankeadaan oksidasi+3 yang lebih besar tetapi juga keadaan oksidasi +2 yang dapat diakses. Semua isotop mendelevium yang diketahui memiliki waktu paruh yang pendek; saat ini ia tidak memiliki kegunaan di luarpenelitian ilmiahdasar, dan hanya diproduksi dalam jumlah kecil.
Penemuan
[sunting|sunting sumber]
Mendelevium adalahunsur transuraniumkesembilan yang disintesis. Ia pertama kalidisintesisolehAlbert Ghiorso,Glenn T. Seaborg,Gregory R. Choppin,Bernard G. Harvey, dan pemimpin timStanley G. Thompsonpada awal tahun 1955 di Universitas California, Berkeley. Tim tersebut menghasilkan256Md (waktu paruh77 menit[4]) ketika mereka membombardir target253Esyang terdiri dari hanya satumiliar(109) atom einsteinium denganpartikel alfa(intihelium) disiklotron60 inciLaboratorium Radiasi Berkeley,sehingga meningkatkan nomor atom target menjadi dua. Dengan demikian,256Md menjadi isotop pertama dari setiap unsur yang disintesis satu atom pada satu waktu. Secara total, tujuh belas atom mendelevium diproduksi.[5]Penemuan ini adalah bagian dari program yang dimulai pada tahun 1952, yang menyinariplutoniumdengan neutron untuk mentransmutasikannya menjadi aktinida yang lebih berat.[6]Metode ini diperlukan karena metode sebelumnya yang digunakan untuk menyintesis unsur transuranik,penangkapan neutron,tidak dapat bekerja karena kurangnyaisotop fermiumyang meluruh melaluipeluruhan betayang akan menghasilkan isotop unsur berikutnya, mendelevium, dan juga karena waktu paruh yang sangat singkat untukfisi spontan258Fmyang dengan demikian merupakan batas keras untuk keberhasilan proses penangkapan neutron.[4]
Untuk memprediksi kemungkinan produksi mendelevium, tim tersebut menggunakan perhitungan kasar. Jumlah atom yang akan dihasilkan kira-kira sama dengan hasil kali jumlah atom bahan target, penampang lintang target, intensitas berkas ion, dan waktu pengeboman; faktor terakhir ini terkait dengan waktu paruh produk saat membombardir waktu sesuai urutan waktu paruhnya. Ini memberikan satu atom per percobaan. Dengan demikian dalam kondisi optimal, penyusunan hanya satu atom unsur 101 per percobaan dapat diharapkan. Perhitungan ini menunjukkan bahwa percobaan dapat dilanjutkan.[5]Bahan target, einsteinium-253, dapat diproduksi dengan mudah dari penyinaranplutonium:satu tahun penyinaran akan menghasilkan satu miliar atom, danwaktu paruhtiga minggunya berarti bahwa percobaan unsur 101 dapat dilakukan dalam satu minggu setelah einsteinium yang dihasilkan dipisahkan dan dimurnikan untuk membuat target. Namun, siklotron perlu ditingkatkan untuk mendapatkan intensitas yang dibutuhkan sebesar 1014partikel alfa per detik; Seaborg mengajukan dana yang diperlukan.[6]
Saat Seaborg mengajukan pendanaan, Harvey mengerjakan target einsteinium, sementara Thomson dan Choppin berfokus pada metode isolasi kimia. Choppin menyarankan penggunaanasam α-hidroksiisobutiratuntuk memisahkan atom mendelevium dari atom aktinida yang lebih ringan.[6]Sintesis sebenarnya dilakukan dengan teknik putaran, yang diperkenalkan oleh Albert Ghiorso. Dalam teknik ini, einsteinium ditempatkan di sisi target yang berlawanan dari pancaran, sehingga atom mendelevium yang berputar akan mendapatkanmomentumyang cukup untuk meninggalkan target dan ditangkap pada foil penangkap yang terbuat dari emas. Target putaran ini dibuat dengan teknik elektroplating yang dikembangkan oleh Alfred Chetham-Strode. Teknik ini memberikan hasil yang sangat tinggi, yang mutlak diperlukan saat bekerja dengan produk langka dan berharga seperti bahan target einsteinium.[5]Target putaran terdiri dari 109atom253Es yang disimpan secara elektrolitis pada kertas emas tipis. Ia dibombardir olehpartikel alfa41MeVdalamsiklotron Berkeleydengan kerapatan berkas sangat tinggi sebesar 6×1013partikel per detik di area seluas 0,05 cm2.Target didinginkan dengan air atauhelium cair,dan foil dapat diganti.[5][7]
Eksperimen awal dilakukan pada bulan September 1954. Tidak ada peluruhan alfa yang terlihat dari atom mendelevium; dengan demikian, Ghiorso memperkirakan bahwa mendelevium semuanya telah meluruh melaluipenangkapan elektronmenjadifermiumdan percobaan harus diulang untuk mencari peristiwafisi spontan.[6]Pengulangan eksperimen terjadi pada Februari 1955.[6]

Pada hari penemuan, 19 Februari, penyinaran alfa target einsteinium terjadi dalam tiga sesi tiga jam. Siklotron berada di kampusUniversitas California,sedangkan Laboratorium Radiasi berada di bukit berikutnya. Untuk menghadapi situasi ini, prosedur yang rumit digunakan: Ghiorso mengambil foil penangkap (ada tiga target dan tiga foil) dari siklotron ke Harvey, yang akan menggunakanair rajauntuk melarutkannya dan menyebarkannya melalui kolomresinpenukaranionuntuk memisahkanunsur transuraniumdari emas dan produk lainnya.[6][8]Tetesan yang dihasilkan memasukitabung reaksi,yang dibawa Choppin dan Ghiorso dengan mobil untuk sampai ke Laboratorium Radiasi secepat mungkin. Di sana Thompson dan Choppin menggunakan kolom resin penukarkationdan asam α-hidroksiisobutirat. Tetesan larutan dikumpulkan pada piringanplatinadan dikeringkan di bawah lampu panas. Ketiga piringan diperkirakan masing-masing mengandung fermium, tidak ada unsur baru, dan mendelevium. Akhirnya, mereka ditempatkan di lemari mereka sendiri, yang terhubung ke perekam sehingga peristiwa fisi spontan akan dicatat sebagai defleksi besar dalam grafik yang menunjukkan jumlah dan waktu peluruhan. Dengan demikian tidak ada deteksi langsung, tetapi melalui pengamatan peristiwa fisi spontan yang timbul dari produk penangkap elektronnya,256Fm. Yang pertama diidentifikasi dengan "hore" diikuti dengan "hore dobel" dan "hore tripel". Yang keempat akhirnya secara resmi membuktikan identifikasi kimia dari unsur ke-101, mendelevium. Secara total, lima peluruhan dilaporkan hingga pukul 4 pagi. Seaborg diberi tahu dan tim dibiarkan tidur.[6]Analisis tambahan dan percobaan lebih lanjut menunjukkan isotop mendelevium yang dihasilkan memiliki massa 256 dan meluruh melalui penangkapan elektron menjadi fermium-256 dengan waktu paruh 1,5 jam.[4]
Kami pikir cocok bahwa ada unsur yang dinamai dari ahli kimia Rusia Dmitri Mendeleev, yang telah mengembangkan tabel periodik. Di hampir semua eksperimen kami untuk menemukan unsur transuranium, kami bergantung pada metodenya dalam memprediksi sifat kimia berdasarkan posisi unsur dalam tabel. Namun di tengah Perang Dingin, menamai unsur dari orang Rusia adalah sikap yang agak berani yang tidak cocok dengan beberapa kritikus Amerika.[9]
— Glenn T. Seaborg
Menjadi unsur pertama dalam seratus unsur kimia kedua, diputuskan bahwa unsur tersebut akan diberi nama "mendelevium" dari ahli kimia RusiaDmitri Mendeleev,bapaktabel periodik.Karena penemuan ini terjadi selamaPerang Dingin,Seaborg harus meminta izin dari pemerintahAmerika Serikatuntuk mengusulkan agar unsur tersebut diberi nama dari orang Rusia, tetapi dikabulkan.[6]Nama "mendelevium" diterima olehPersatuan Kimia Murni dan Terapan Internasional(IUPAC) pada tahun 1955 dengan lambang "Mv",[10]yang diubah menjadi "Md" pada Sidang Umum IUPAC berikutnya (Paris, 1957).[11]
Karakteristik
[sunting|sunting sumber]Fisik
[sunting|sunting sumber]
Dalam tabel periodik, mendelevium terletak di sebelah kanan aktinidafermium,di sebelah kiri aktinidanobelium,dan di bawah lantanidatulium.Logam mendelevium belum pernah disiapkan dalam jumlah banyak, dan persiapan massal saat ini tidak mungkin dilakukan.[13]Namun demikian, sejumlah prediksi dan beberapa hasil percobaan pendahuluan telah dilakukan mengenai sifat-sifatnya.[13]
Lantanida dan aktinida, dalam keadaan logam, dapat ada sebagai logam divalen (sepertieuropiumdaniterbium) atau trivalen (kebanyakan lantanida lainnya). Yang pertama memiliki konfigurasi fns2,sedangkan yang kedua memiliki konfigurasi fn−1d1s2.Pada tahun 1975, Johansson dan Rosengren meneliti nilaienergi kohesif(entalpikristalisasi)lantanidadanaktinidametalik yang diukur dan diprediksi, baik sebagai logam divalen maupun trivalen.[14][15]Kesimpulannya adalah bahwa peningkatan energi ikatan konfigurasi [Rn]5f126d17s2dibandingkan konfigurasi [Rn]5f137s2untuk mendelevium tidak cukup untuk mengompensasi energi yang dibutuhkan untuk mempromosikan satu elektron 5f ke 6d, sama seperti untuk aktinida akhir: dengan demikianeinsteinium,fermium,mendelevium, dannobeliumdiperkirakan menjadi logam divalen.[14]Meningkatnya dominasi keadaan divalen jauh sebelum deret aktinida berakhir dikaitkan dengan stabilisasirelativistikelektron 5f, yang meningkat dengan meningkatnya nomor atom.[16]Studitermokromatografidengan jumlah renik mendelevium oleh Zvara dan Hübener dari tahun 1976 hingga 1982 mengkonfirmasi prediksi ini.[13]Pada tahun 1990, Haire dan Gibson memperkirakan logam mendelevium memilikientalpi sublimasiantara 134 dan 142 kJ/mol.[13]Logam mendelevium divalen seharusnya memilikijari-jari logamsekitar194±10pm.[13]Seperti aktinida akhir divalen lainnya (sekali lagi kecualilawrensiumtrivalen), logam mendelevium seharusnya memiliki struktur kristalkubus berpusat muka.[2]Titik lebur mendelevium diperkirakan mencapai 827 °C, nilai yang sama seperti yang diprediksikan untuk unsur tetangganya, nobelium.[17]Massa jenisnya diperkirakan sekitar10,3±0,7 g/cm3.[2]
Kimia
[sunting|sunting sumber]Kimia mendelevium sebagian besar hanya diketahui dalam larutan, di mana ia dapat mengambilkeadaan oksidasi+3 atau +2. Keadaan +1 juga telah dilaporkan, tetapi belum dikonfirmasi.[18]
Sebelum penemuan mendelevium,Seaborgdan Katz meramalkan bahwa mendelevium seharusnya trivalen dalam larutan berair dan karenanya harus berperilaku serupa dengan lantanida dan aktinida tripositif lainnya. Setelah sintesis mendelevium pada tahun 1955, prediksi ini dikonfirmasi, pertama dalam pengamatan pada penemuannya bahwa ia terelusitepat setelah fermium dalam urutan elusi aktinida trivalen dari kolom resin penukar kation, dan kemudian pengamatan tahun 1967 bahwa mendelevium dapat membentukhidroksidadanfluoridayang tidak larut yang berkopresipitasi dengan garam lantanida trivalen.[18]Studi pertukaran kation dan ekstraksi pelarut mengarah pada kesimpulan bahwa mendelevium adalah aktinida trivalen dengan jari-jari ionik agak lebih kecil daripada aktinida sebelumnya, fermium.[18]Mendelevium dapat membentukkompleks koordinasidengan asam 1,2-sikloheksanadinitrilotetraasetat (DCTA).[18]
Dalam kondisireduksi,mendelevium(III) dapat dengan mudah direduksi menjadi mendelevium(II), yang stabil dalam larutan berair.[18]Potensial reduksi standardari pasanganE°(Md3+→Md2+) diestimasi secara beragam pada tahun 1967 pada −0,10 V atau −0,20 V:[18]percobaan tahun 2013 kemudian menetapkan nilai pada−0,16±0,05 V.[19]Sebagai perbandingan,E°(Md3+→Md0) seharusnya sekitar −1,74 V, danE°(Md2+→Md0) seharusnya sekitar −2,5 V.[18]Perilaku elusi mendelevium(II) telah dibandingkan dengan perilaku elusistronsium(II) daneuropium(II).[18]
Pada tahun 1973, mendelevium(I) dilaporkan telah diproduksi oleh ilmuwan Rusia, yang memperolehnya dengan mereduksi keadaan oksidasi mendelevium yang lebih tinggi dengansamarium(II). Ia ditemukan stabil dalam larutan air–etanolnetral danhomologdengansesium(I). Namun, percobaan selanjutnya tidak menemukan bukti mendelevium(I) dan menemukan bahwa mendelevium berperilaku seperti unsur divalen ketika direduksi, tidak sepertilogam alkalimonovalen.[18]Namun demikian, tim Rusia melakukan studi lebih lanjut tentangtermodinamikakokristalisasi mendelevium dengan klorida logam alkali, dan menyimpulkan bahwa mendelevium(I) telah terbentuk dan dapat membentuk kristal campuran dengan unsur-unsur divalen, sehingga mengkristal bersama mereka. Status keadaan oksidasi +1 masih tentatif.[18]
Pada tahun 1975, potensial elektrodaE°(Md4+→Md3+) diperkirakan menjadi +5,4 V; eksperimen tahun 1967 dengan oksidator kuatnatrium bismutattidak mampu mengoksidasi mendelevium(III) menjadi mendelevium(IV).[18]
Atom
[sunting|sunting sumber]Sebuah atom mendelevium memiliki 101 elektron. Mereka diperkirakan tersusun dalam konfigurasi [Rn]5f137s2(lambang istilahkeadaan dasar2F7/2), meskipun verifikasi eksperimental konfigurasi elektron ini belum dilakukan hingga tahun 2006. Lima belas elektron dalam subkulit 5f dan 7s adalahelektron valensi.[20]Dalam membentuk senyawa, tiga elektron valensi dapat hilang, meninggalkan inti [Rn]5f12:ini sesuai dengan tren yang ditetapkan oleh aktinida lain dengan konfigurasi elektron [Rn] 5fndalam keadaan tripositif.Potensial ionisasipertama mendelevium diukur paling banyak (6,58 ± 0,07)eVpada tahun 1974, berdasarkan asumsi bahwa elektron 7s akan terionisasi sebelum elektron 5f;[21]nilai ini belum disempurnakan lebih lanjut karena kelangkaan mendelevium dan radioaktivitasnya yang tinggi.[22]Jari-jari ionik Md3+heksakoordinattelah diperkirakan sebelumnya pada tahun 1978 sekitar 91,2 pm;[18]Perhitungan tahun 1988 berdasarkan tren logaritmik antarakoefisien distribusidan jari-jari ionik menghasilkan nilai 89,6 pm, sertaentalpi hidrasi−3654±12 kJ/mol.[18]Md2+seharusnya memiliki jari-jari ionik 115 pm dan entalpi hidrasi −1413 kJ/mol; Md+seharusnya memiliki jari-jari ionik 117 pm.[18]
Isotop
[sunting|sunting sumber]Tujuh belas isotop mendelevium telah diketahui, dengan nomor massa mulai dari 244 hingga 260; semuanya bersifat radioaktif.[23]Selain itu, limaisomer nuklirtelah diketahui:245mMd,247mMd,249mMd,254mMd, dan258mMd.[4][24]Dari jumlah tersebut, isotop dengan umur terpanjang adalah258Md dengan waktu paruh 51,5 hari, dan isomer dengan umur terpanjang adalah258mMd dengan waktu paruh 58,0 menit.[4][24]Namun demikian,256Md yang berumur lebih pendek (waktu paruh 1,17 jam) lebih sering digunakan dalam eksperimen kimia karena dapat diproduksi dalam jumlah yang lebih besar dari penyinaran einsteinium terhadappartikel alfa.[23]Setelah258Md, isotop mendelevium paling stabil berikutnya adalah260Md dengan waktu paruh 31,8 hari,257Md dengan waktu paruh 5,52 jam,259Md dengan waktu paruh 1,60 jam, dan256Md dengan waktu paruh 1,17 jam. Semua isotop mendelevium yang tersisa memiliki waktu paruh kurang dari satu jam, dan sebagian besar memiliki waktu paruh kurang dari 5 menit.[4][23][24]
Waktu paruh isotop mendelevium sebagian besar meningkat dengan lancar dari244Md dan seterusnya, mencapai maksimum pada258Md.[4][23][24]Eksperimen dan prediksi menunjukkan bahwa waktu paruh kemudian akan menurun, selain dari260Md dengan waktu paruh 31,8 hari,[4][23][24]karenafisi spontanmenjadi mode peluruhan yang dominan[4]karena tolakan timbal balik dari proton yang menimbulkan batas pulau stabilitas relatif dari inti berumur panjang dalam deretaktinida.[25]
Mendelevium-256, isotop mendelevium yang paling penting secara kimia, meluruh melaluipenangkapan elektron90% dari waktu danpeluruhan alfa10% dari waktu.[23]Ia paling mudah dideteksi melaluifisi spontanproduk penangkap elektronnyafermium-256,tetapi dengan adanya nuklida lain yang mengalami fisi spontan, peluruhan alfa pada energi karakteristik untuk mendelevium-256 (7,205 dan 7,139MeV) dapat memberikan identifikasi yang lebih berguna.[26]
Produksi dan isolasi
[sunting|sunting sumber]Isotop paling ringan (244Md hingga247Md) sebagian besar dihasilkan melalui pemborbardiran targetbismutdengan ionargon,sedangkan isotop yang sedikit lebih berat (248Md hingga253Md) diproduksi dengan membombardir targetplutoniumdanamerisiumdengan ionkarbondannitrogen.Isotop yang paling penting dan paling stabil berkisar dari254Md hingga258Md dan diproduksi melalui pemborbardiraneinsteiniumdenganpartikel alfa:einsteinium-253, -254, dan -255 semuanya dapat digunakan.259Md diproduksi sebagaiturunandari259No,dan260Md dapat diproduksi dalamreaksi transferantara einsteinium-254 danoksigen-18.[23]Biasanya, isotop256Md yang paling umum digunakan diproduksi dengan membombardir einsteinium-253 atau -254 dengan partikel alfa: einsteinium-254 lebih disukai bila tersedia karena memiliki waktu paruh yang lebih lama dan karena itu dapat digunakan sebagai target lebih lama.[23]Menggunakan jumlah mikrogram einsteinium yang tersedia, jumlahfemtogrammendelevium-256 dapat diproduksi.[23]
Momentumputaran dari atom mendelevium-256 yang dihasilkan digunakan untuk membawa mereka jauh secara fisik dari target einsteinium dari mana mereka diproduksi, membawa mereka ke sebuah foil logam tipis (biasanyaberilium,aluminium,platina,atauemas) tepat di belakang sasaran dalam ruang hampa.[26]Hal ini menghilangkan kebutuhan akan pemisahan bahan kimia segera, yang mahal dan mencegah penggunaan kembali target einsteinium yang mahal.[26]Atom mendelevium kemudian terperangkap dalam atmosfer gas (biasanyahelium), dan semburan gas dari lubang kecil di ruang reaksi membawa mendelevium.[26]Menggunakantabung kapilarpanjang, dan termasuk aerosolkalium kloridadalam gas helium, atom mendelevium dapat diangkut lebih dari puluhan meter untuk dianalisis secara kimia dan ditentukan jumlahnya.[8][26]Mendelevium kemudian dapat dipisahkan dari bahan foil danproduk fisilainnya dengan menerapkan asam ke foil dan kemudianmengopresipitasimendeleviumlantanum fluorida,kemudian menggunakan kolom resinpenukar kationdengan larutanetanol10% yang dijenuhkan denganasam klorida,bertindak sebagaieluen.Namun, jika foil terbuat dari emas dan cukup tipis, cukup dengan melarutkan emas dalamair rajasebelum memisahkan aktinida trivalen dari emas menggunakankromatografipenukar anion,eluennya adalah asam klorida 6 M.[26]
Mendelevium akhirnya dapat dipisahkan dari aktinida trivalen lainnya menggunakan elusi selektif dari kolom resin penukar kation, eluennya adalah amonia α-HIB.[26]Menggunakan metode gas-jet sering membuat dua langkah pertama tidak diperlukan.[26]Prosedur di atas adalah yang paling umum digunakan untuk pemisahan unsur transeinsteinium.[26]
Cara lain yang mungkin untuk memisahkan aktinida trivalen adalah melalui kromatografi ekstraksi pelarut menggunakan asam fosfat bis-(2-etilheksil) (disingkat HDEHP) sebagai fase organik diam danasam nitratsebagai fase berair bergerak. Urutan elusi aktinida dibalik dari kolom resin penukar kation, sehingga aktinida yang lebih berat terelusi kemudian. Mendelevium yang dipisahkan dengan metode ini memiliki keuntungan bebas dari zat pengompleks organik dibandingkan dengan kolom resin; kerugiannya adalah mendelevium kemudian terelusi sangat terlambat dalam urutan elusi, setelah fermium.[8][26]
Metode lain untuk mengisolasi mendelevium mengeksploitasi sifat elusi Md2+yang berbeda dari Es3+dan Fm3+.Langkah awalnya sama seperti di atas, dan menggunakan HDEHP untuk kromatografi ekstraksi, tetapi mempresipitasi mendelevium dengan terbium fluorida, bukan lantanum fluorida. Kemudian, 50 mgkromiumditambahkan pada mendelevium untuk mereduksinya menjadi +2 dalam asam klorida 0,1 M dengansengatauraksa.[26]Ekstraksi pelarut kemudian berlanjut, dan sementara lantanida dan aktinida trivalen dan tetravalen tetap berada di kolom, mendelevium(II) tidak dan tetap di dalam asam klorida. Ia kemudian direoksidasi menjadi +3 menggunakanhidrogen peroksidadan kemudian diisolasi dengan elusi selektif dengan asam klorida 2 M (untuk menghilangkan pengotor, termasuk kromium) dan akhirnya asam klorida 6 M (untuk menghilangkan mendelevium).[26]Dimungkinkan juga untuk menggunakan kolom amalgam kationit dan seng, menggunakan asam klorida 1 M sebagai eluen, mereduksi Md(III) menjadi Md(II) yang berperilaku sepertilogam alkali tanah.[26]Isolasi kimia termokromatografi dapat dicapai dengan menggunakan mendeleviumheksafluoroasetilasetonyang volatil: senyawa analog fermium juga telah dikenal dan juga volatil.[26]
Toksisitas
[sunting|sunting sumber]Meskipun hanya sedikit orang yang bersentuhan dengan mendelevium,Komisi Internasional Perlindungan Radiologistelah menetapkan batas paparan tahunan untuk isotop mendelevium yang paling stabil. Untuk mendelevium-258, batas ingesti ditetapkan pada 9×105becquerel(1 Bq setara dengan satu peluruhan per detik). Mengingat waktu paruh isotop ini, berat batas ini hanya 2,48 ng (nanogram). Batas inhalasi ditetapkan pada 6000 Bq atau 16,5 pg (pikogram).[27]
Catatan dan referensi
[sunting|sunting sumber]Catatan
[sunting|sunting sumber]- ^Kepadatannya dihitung dari jari-jari metalik yang diprediksi (Silva 2006) dan struktur kristal padat yang diprediksi (Fournier 1976).
Referensi
[sunting|sunting sumber]- ^(Indonesia)"Mendelevium".KBBI Daring.Diakses tanggal17 Juli2022.
- ^abcdFournier, Jean-Marc (1976). "Bonding and the electronic structure of the actinide metals".Journal of Physics and Chemistry of Solids.37(2): 235–244.Bibcode:1976JPCS...37..235F.doi:10.1016/0022-3697(76)90167-0.
- ^https://pubs.acs.org/doi/10.1021/jacs.8b09068
- ^abcdefghiAudi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003),"The NUBASEevaluation of nuclear and decay properties ",Nuclear Physics A,729:3–128,Bibcode:2003NuPhA.729....3A,doi:10.1016/j.nuclphysa.2003.11.001
- ^abcdGhiorso, A.; Harvey, B.; Choppin, G.; Thompson, S.; Seaborg, Glenn T. (1955).New Element Mendelevium, Atomic Number 101.Physical Review.98.hlm. 1518–1519.Bibcode:1955PhRv...98.1518G.doi:10.1103/PhysRev.98.1518.ISBN9789810214401.
- ^abcdefghChoppin, Gregory R. (2003)."Mendelevium".Chemical and Engineering News.81(36).
- ^Hofmann, Sigurd (2002).On beyond uranium: journey to the end of the periodic table.CRC Press. hlm. 40–42.ISBN978-0-415-28496-7.
- ^abcHall, Nina (2000).The new chemistry
 .Cambridge University Press. hlm.9–11.ISBN978-0-521-45224-3.
.Cambridge University Press. hlm.9–11.ISBN978-0-521-45224-3.
- ^101. Mendelevium - Elementymology & Elements Multidict.Peter van der Krogt.
- ^Chemistry, International Union of Pure and Applied (1955).Comptes rendus de la confèrence IUPAC.
- ^Chemistry, International Union of Pure and Applied (1957).Comptes rendus de la confèrence IUPAC.
- ^Haire, Richard G. (2006). "Einsteinium". Dalam Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean.The Chemistry of the Actinide and Transactinide Elements(PDF).3(edisi ke-3). Dordrecht, Belanda: Springer. hlm. 1577–1620.doi:10.1007/1-4020-3598-5_12.ISBN978-1-4020-3555-5.Diarsipkan dariversi asli(PDF)tanggal 17 Juli 2010.Diakses tanggal6 Juni2023.
- ^abcdeSilva, hlm. 1634–5
- ^abSilva, hlm. 1626–8
- ^Johansson, Börje; Rosengren, Anders (1975). "Generalized phase diagram for the rare-earth elements: Calculations and correlations of bulk properties".Physical Review B.11(8): 2836–2857.Bibcode:1975PhRvB..11.2836J.doi:10.1103/PhysRevB.11.2836.
- ^Hulet, E. K. (1980)."Chapter 12. Chemistry of the Heaviest Actinides: Fermium, Mendelevium, Nobelium, and Lawrencium".Dalam Edelstein, Norman M.Lanthanide and Actinide Chemistry and Spectroscopy.ACS Symposium Series.131.hlm.239–263.doi:10.1021/bk-1980-0131.ch012.ISBN9780841205680.
- ^Haynes, William M., ed. (2011).CRC Handbook of Chemistry and Physics(edisi ke-92). CRC Press. hlm. 4.121–4.123.ISBN978-1439855119.
- ^abcdefghijklmnSilva, hlm. 1635–6
- ^ Toyoshima, Atsushi; Li, Zijie; Asai, Masato; Sato, Nozomi; Sato, Tetsuya K.; Kikuchi, Takahiro; Kaneya, Yusuke; Kitatsuji, Yoshihiro; Tsukada, Kazuaki; Nagame, Yuichiro; Schädel, Matthias; Ooe, Kazuhiro; Kasamatsu, Yoshitaka; Shinohara, Atsushi; Haba, Hiromitsu; Even, Julia (11 Oktober 2013). "Measurement of the Md3+/Md2+Reduction Potential Studied with Flow Electrolytic Chromatography ".Inorganic Chemistry.52(21): 12311–3.doi:10.1021/ic401571h.PMID24116851.
- ^Silva, hlm. 1633–4
- ^Martin, W. C.; Hagan, Lucy; Reader, Joseph; Sugan, Jack (1974)."Ground Levels and Ionization Potentials for Lanthanide and Actinide Atoms and Ions"(PDF).J. Phys. Chem. Ref. Data.3(3): 771–9.Bibcode:1974JPCRD...3..771M.doi:10.1063/1.3253147.Diarsipkan dariversi asli(PDF)tanggal 11 Februari 2014.Diakses tanggal6 Juni2023.
- ^David R. Lide (ed),CRC Handbook of Chemistry and Physics, Edisi ke-84.CRC Press. Boca Raton, Florida, 2003; Section 10, Atomic, Molecular, and Optical Physics; Ionization Potentials of Atoms and Atomic Ions
- ^abcdefghiSilva, hlm. 1630–1
- ^abcdeNucleonica (2007–2014)."Universal Nuclide Chart".Nucleonica.Diakses tanggal6 Juni2023.
- ^Nurmia, Matti (2003)."Nobelium".Chemical and Engineering News.81(36): 178.doi:10.1021/cen-v081n036.p178.
- ^abcdefghijklmnSilva, hlm. 1631–3
- ^Koch, Lothar (2000). "Transuranium Elements".Transuranium Elements, in Ullmann's Encyclopedia of Industrial Chemistry.Wiley.doi:10.1002/14356007.a27_167.ISBN978-3527306732.
Bibliografi
[sunting|sunting sumber]- Silva, Robert J. (2006)."Fermium, Mendelevium, Nobelium, and Lawrencium"(PDF).Dalam Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean.The Chemistry of the Actinide and Transactinide Elements.3(edisi ke-3). Dordrecht: Springer. hlm. 1621–1651.doi:10.1007/1-4020-3598-5_13.ISBN978-1-4020-3555-5.Diarsipkan dariversi asli(PDF)tanggal 17 Juli 2010.
Bacaan lebih lanjut
[sunting|sunting sumber]- Hoffman, D.C., Ghiorso, A., Seaborg, G. T. The transuranium people: the inside story, (2000), 201–229
- Morss, L. R., Edelstein, N. M., Fuger, J., The chemistry of the actinide and transactinide element, 3, (2006), 1630–1636
- A Guide to the Elements – Revised Edition,Albert Stwertka, (Oxford University Press; 1998)ISBN0-19-508083-1
Pranala luar
[sunting|sunting sumber]- (Inggris)Laboratorium Nasional Los Alamos – Mendelevium
- (Inggris)It's Elemental – Mendelevium
- (Inggris)WebElements.com - Mendelevium
- (Inggris)Environmental Chemistry – Md info
- (Inggris)MendeleviumdiThe Periodic Table of Videos(Universitas Nottingham)
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


