Periode tabel periodik

Periode tabel periodikadalah satu baris horizontal padatabel periodik.Dalamtabel periodik,unsur-unsurdiatur dalam serangkaian baris (atauperiode) sehingga mereka yang memiliki sifat-sifat serupa muncul dalam satu kolom. Unsur-unsur pada periode yang sama memiliki jumlah kulit elektron yang sama; dengan masing-masing perpotongangolongandi sepanjang periode, unsur memiliki satu tambahan proton dan elektron dan berkurang sifatlogamnya.Pengaturan ini mencerminkan keberulangan sifat yang sama secara periodik seiring dengan kenaikannomor atom.Misalnya, logam alkali terletak pada satu golongan (golongan 1) dan berbagi sifat yang mirip, seperti reaktivitas yang tinggi dan kecenderungan untuk kehilangan satu elektron agar sesuai dengan konfigurasi elektron gas mulia. Tabel periodik memiliki total 118 unsur.
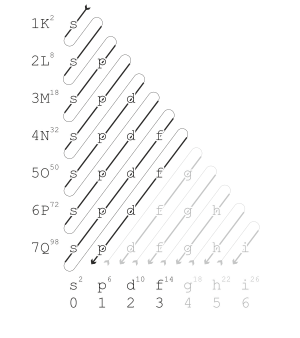
Mekanika kuantummodern menjelaskan tren periodik sifat-sifat dalam halkulit elektron.Seiring dengan kenaikan nomor atom, kulit elektron terisi dengan elektron dengan urutan seperti ditunjukkan di sebelah kanan. Mengisi setiap kulit sesuai dengan baris dalam tabel.
Dalamblok-sdanblok-ptabel periodik, unsur-unsur dalam periode yang sama umumnya tidak menunjukkan tren dan kesamaan sifat (lebih signifikan tren vertikal ke bawah dalam golongan). Namun dalamblok-d,tren sepanjang periode menjadi signifikan, dan dalamblok-f,unsur-unsur menunjukkan tingkat kesamaan yang tinggi di sepanjang periode.
Periode
[sunting|sunting sumber]Tujuh periode unsur terjadi secara alami di Bumi. Untuk periode 8, yang mencakup unsur-unsur yang dapat disintesis setelah 2015, lihattabel periodik perluasan.
Sebuah golongan dalam kimia berarti famili objek dengan kesamaan seperti keluarga yang berbeda. Terdapat 7 periode, yang disusun horizontal di tabel periodik.
Periode 1
[sunting|sunting sumber]| Golongan | 1/17 | 2/18 |
|---|---|---|
| # Nama |
1 H |
2 He |
Periode 1 merupakan periode yang paling sedikit anggotanya, dengan hanya 2 unsur,hidrogendanhelium.Oleh karena itu, mereka tidak mengikutikaidah oktet.Secara kimia, helium berperilaku sebagai gas mulia, dan oleh karenanya dimasukkan sebagai bagian dariunsur golongan 18.Namun, dalam hal struktur intinya, helium masuk ke dalamblok s,dan oleh karena itu kadang-kadang diklasifikasikan ke dalamunsur golongan 2,atau secara simultan masuk ke dua golongan sekaligus golongan 2 dan 18. Hidrogen sangat mudah kehilangan dan menangkap sebuah elektron, dan oleh karena itu secara kimia masuk ke dalam dua golongan sekaligus yaituunsur golongan 1dan17.
- Hidrogen(H) merupakan unsur palingmelimpah,perhitungan kasar sekitar 75% dari massa unsur jagat raya.[1]Ion hidrogen hanyalah sebuahproton.Bintangdalamurutan utamasebagian besar tersusun dari hidrogen pada tingkatplasmanya.Unsur hidrogen relatif jarang diBumi,dan secara industri diproduksi darihidrokarbonsepertimetana.Hidrogen dapat membentuk senyawa-senyawa dengan sebagian besar unsur dan terdapat dalamairserta sebagian besarsenyawa organik.[2]
- Helium(He) hanya hadir dalam kondisigaskecuali dalam kondisi ekstrem.[3]Ia merupakan unsur kedua terringan dan juga peringkat keduakelimpahandi alam semesta.[4]Sebagian besar helium terbentuk selamaLedakan Dahsyat,tetapi helium baru tercipta melaluifusi nuklirhidrogen dalam bintang.[5]DiBumi,helium relatif jarang, hanya muncul sebagai produk sampingpeluruhanalami beberapa unsur radioaktif.[6]Helium 'radiogenik' terperangkan di dalamgas alamdengan konsentrasi sampai dengan tujuh persen dari volume.[7]
Periode 2
[sunting|sunting sumber]| Golongan | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| # Nama |
3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
Periode 2 terdiri dari 8 unsur. Unsur-unsur periode 2 melibatkanorbital2sdan2p.Beberapa unsur dalam periode ini merupakan unsur esensial secara biologi selain hidrogen, yaitu karbon, nitrogen, dan oksigen.
- Litium(Li) adalah logam paling ringan dan unsur padat paling rendah massa jenisnya.[8]Dalam kondisi tak terionisasi, ia merupakan salah satu unsur paling reaktif, sehingga di alam hanya dapat ditemukan sebagaisenyawanya.Litium merupakanunsur primordialpaling berat yang terbentuk dalam jumlah besar selamaLedakan Dahsyat.
- Berilium (Be) adalahlogam ringandengantitik leburtertinggi. Sejumlah kecil berilium terbentuk selama Ledakan Dahsyat, meskipun sebagian besar kemudianmeluruhatau bereaksi lebih lanjut di dalam bintang membentuk inti atom yang lebih besar, seperti karbon, nitrogen, atau oksigen. Berilium diklasifikasikan olehBadan Internasional Penelitian Kanker(International Agency for Research on Cancer, IARC) sebagaikarsinogen golongan 1.[9]Antara 1% dan 15% orang peka terhadap berilium dan dapat menyebabkan reaksi inflamasi padasistem pernapasandankulit,yang disebut penyakit berilium kronis.[10]
- Boron(B) tidak terdapat secara alami sebagai unsur bebas, tetapi dalam senyawa sepertiborat.Ia merupakanzat hara(micronutrient) esensial bagi tumbuhan, yang diperlukan sebagai kekuatan dan pengembangan dinding sel, pembelahan sel, pertumbuhan bibit dan buah, transportasi gula dan pengembangan hormon,[11][12]meskipun bersifat toksik pada dosis tinggi.
- Karbon(C) adalah unsur peringkat keempat paling melimpah di jagat raya berdasarkan massanya, setelahhidrogen,helium,danoksigen.[13]Juga merupakan unsur keduapaling melimpah dalam tubuh manusiasetelahoksigen,[14]peringkat tiga paling melimpah berdasarkan nomor atom.[15]Jumlah senyawa yang mengandung karbon hampir tak terhingga karena kemampuan karbon untuk membentuk rantai panjang yang stabil melalui ikatan C—C.[16][17]Seluruhsenyawa organik,yang esensial bagi kehidupan, mengandung sekurang-kurangnya satu atom karbon;[16][17]yang bersanding denganhidrogen,oksigen,nitrogen,belerang,danfosfor,karbon adalah dasar dari setiap senyawa biologi penting.[17]
- Nitrogen(N) dijumpai sebagian besar sebagai gasinertdiatomik,N2,yang menyusun hingga 78% atmosfer bumi. Ini merupakan komponen esensialprotein,dan oleh karenanya esensial pula bagi kehidupan.[18]
- Oksigen(O) menyusun 21% atmosfer dan diperlukan untukrespirasioleh seluruh (atau hampir seluruh) hewan, dan merupakan komponen pembentukair.Oksigen adalah unsur paling melimpah ketiga di alam semesta, dan senyawa oksigen mendominasi susunan kerak bumi.[19]
- Fluor(F) adalah unsur paling reaktif dalam kondisi tak-terionisasi, sehingga tidak pernah ditemukan sebagai unsur di alam.[20]
- Neon(Ne) adalahgas muliayang digunakan dalamlampu neon.[21]
Periode 3
[sunting|sunting sumber]| Golongan | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| # Nama |
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
Periode 3 terdiri dari 8 unsur. Seluruh unsur periode tiga terdapat di alam dan sekurang-kurangnya memiliki satuisotop stabil.Selain gas muliaargon,semuanya merupakan unsur esensial untuk biologi dan geologi.
- Natrium(Na) adalah sebuahlogam alkali.Ia terdapat dalam samudera di Bumi dalam jumlah besar dan hadir sebagainatrium klorida(garam meja).[22]
- Magnesium(Mg) adalahlogam alkali tanah.Ion magnesiumionditemukan dalamklorofil.
- Aluminium(Al) adalahlogam pasca transisi.Ia merupakan logam paling melimpah dalamkerakbumi.
- Silikon(Si) adalahmetaloid.Ia bersifatsemikonduktor,menjadikannya komponen utama dalam banyaksirkuit terpadu(IC).Silikon dioksidaadalah konstituen utamapasir.Seperti pentingnya karbon untukBiologi,Silicon penting untukGeologi.
- Fosforus(P) adalahnonlogamesensial untukDNA.Ia sangatreaktif,dan oleh karenanya tidak pernah dijumpai di alam sebagai unsur bebas.
- Belerang(S) adalahnonlogam.Ia dijumpai dalam duaasam amino:sisteindanmetionin.
- Klorin(Cl) adalahhalogen.Ia digunakan sebagai desinfektan, terutama dalamkolam renang.
- Argon(Ar) adalah suatugas mulia,menjadikannya hampir sepenuhnya tidak reaktif.Lampu pendarsering diisi dengan gas mulia seperti argon untuk menjaga filamen pada temperatur tinggi.
Periode 4
[sunting|sunting sumber]
| Golongan | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| # Nama |
19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
Periode 4 terdiri dari 18 unsur, dimulai darikalium(K) dan diakhiri olehkripton(Kr). Periode 4 meliputi unsur esensial untuk biologi yaitu kalium dankalsium,juga merupakan periode pertama dalamblok-ddenganlogam transisiyang ringan. Masuk di dalamnya adalahbesi,unsur terberat yang terbentuk dalambintang deret utamadan merupakan komponen utama bumi sama halnya logam penting lainnya sepertikobalt,nikel,tembaga,danseng.Hampir semuanya memiliki peran biologis.
Periode 5
[sunting|sunting sumber]| Golongan | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| # Nama |
37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
Periode 5 terdiri dari 18 unsur, dimulai darirubidium(Rb) dan diakhiri olehxenon(Xe). Unsur yang memiliki peran biologis bagi manusia paling berat hanyalahmolibdenumdaniodin.Periode ini juga meliputiteknesium,unsurradioaktifpaling ringan.
Periode 6
[sunting|sunting sumber]| Golongan | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| # Nama |
55 Cs |
56 Ba |
57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
Periode 6 terdiri dari 32 unsur, dimulai darisesium(Cs) dan diakhiri olehradon(Rn). Periode 6 adalah periode pertama yang memilikiblok-f,melalui golonganlantanida(yang dikenal juga sebagaiunsur tanah jarang), dan terdapat pula pada periode ini unsur stabil paling berat (timbal). Kebanyakan dari periode ini adalahlogam beratyang beracun dan 5 di antaranya bersifat radioaktif (prometium,bismut,polonium,astatin,danradon), tetapiplatinadanemashampir sepenuhnya inert.Wolframmerupakan unsur yang memiliki peran biologis paling berat.
Periode 7
[sunting|sunting sumber]| Golongan | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| # Nama |
87 Fr |
88 Ra |
89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
Periode 7 terdiri dari 32 unsur, dimulai darifransium(Fr) dan diakhiri olehoganeson(Og). Seluruh unsur periode 7 bersifatradioaktif.Periode ini mengandung unsur terberat yang secara alami ada di bumi,plutonium.Semua unsur setelahnya dalam periode ini telah disintesis secara artifisial. Sementara salah satu dari ini (einsteinium) saat ini tersedia dalam jumlah makroskopis, sebagian besar sangat jarang, dan hanya disintesis dalam jumlah mikrogram atau kurang. Beberapa unsur terakhir belum diidentifikasi di laboratorium dalam jumlah beberapa atom dalam waktu yang bersamaan.
Meskipun jarangnya unsur-unsur ini menandakan hasil percobaan tidak ekstensif, tren perilaku periodik dan golongan tampaknya kurang terdefinisi dengan baik untuk periode 7 dibandingkan periode lainnya. Sementarafransiumdanradiummenunjukkan sifat-sifat sepertigolongan 1dan2,aktinidamenunjukkan variasi perilaku dan tingkat oksidasi yang amat besar dibandingkanlantanida.Anomali periode 7 ini mungkin diakibatkan oleh beragam faktor, termasuk di antaranya besarnya tingkatpasangan spin-orbitdan efek relativistik. Dugaan terakhir, ini akibat dari tingginya muatan positif dariinti atommereka yang masif.
Periode 8
[sunting|sunting sumber]| Golongan | 1 | 2 |
|---|---|---|
| # Nama |
119 Uue |
120 Ubn |
Periode 8 kemungkinan terdiri dari 50 atau 54 unsur, dimulai dariununennium(Uue) dan diakhiri olehunheksoktium(Uho) (Z= 168) atauunseptbium(Usb) (Z= 172). Belum ada unsur dalam periode 8 yang berhasil disintesis.Blok-gadalah sebuah prediksi. Belum jelas apakah semua unsur yang diprediksi berada pada periode 8 secara fakta memungkinkan ada secara fisik.
Periode 9
[sunting|sunting sumber]Saat ini, periode 9 masih berupahipotesis.Ada kemungkinan bahwa tidak akan ada periode 9.
Lihat pula
[sunting|sunting sumber]Referensi
[sunting|sunting sumber]- ^Palmer, David (13 November 1997),Hydrogen in the Universe,NASA,diakses tanggal5 Februari2008
- ^"IARC Monograph, Volume 58".International Agency for Research on Cancer. 1993.Diakses tanggal18 September2008.
- ^"Helium",WebElements
- ^"Functions of Boron in Plant Nutrition"(PDF).U.S. Borax Inc.
- ^Blevins, Dale G.; Lukaszewski, Krystyna M. (1998). "Functions of Boron in Plant Nutrition".Annual Review of Plant Physiology and Plant Molecular Biology.49:481–500.doi:10.1146/annurev.arplant.49.1.481.PMID15012243.
- ^BABINECK, M (5 November 2006)."Helium shortage leaves partygoers deflated: Helium supply deflated, Production shortages mean some industries and partygoers must squeak by".Houston Chronicle.
- ^Chang, Raymond (2007).Chemistry(edisi ke-9th). McGraw-Hill Higher Education. hlm. 52.ISBN0-07-110595-6.
- ^"Lithium".WebElements.
- ^"IARC Monograph".International Agency for Research on Cancer. 1993.Diakses tanggal18 September2008.
- ^Rossman, M.D. (1996),"Chronic Beryllium Disease: Diagnosis and Management"(PDF),Environmental Health Perspectives,104(5): 945–947,PMC1469698

- ^"Functions of Boron in Plant Nutrition"(PDF).U.S. Borax Inc. Diarsipkan dariversi asli(PDF)tanggal 24 April 2015.Diakses tanggal4 Februari2016.
- ^Blevins, D.G.; Lukaszewski, K.M. (1998)."BORON IN PLANT STRUCTURE AND FUNCTION".Annual Review of Plant Physiology and Plant Molecular Biology.49:481–500.doi:10.1146/annurev.arplant.49.1.481.PMID15012243.
- ^"Ten most abundant elements in the universe, taken fromThe Top 10 of Everything,2006, Russell Ash, page 10 ".Diarsipkan dariversi aslitanggal 10 Februari 2010.Diakses tanggal4 Februari2016.
- ^Chang, Raymond (2007).Chemistry, Ninth Edition.McGraw-Hill. hlm. 52.ISBN0-07-110595-6.
- ^Freitas Jr., Robert A. (1999).Nanomedicine.Landes Bioscience. Tables 3-1 & 3-2.ISBN1-57059-680-8.Diarsipkan dariversi aslitanggal 2018-04-16.Diakses tanggal2016-02-04.
- ^ab"Structure and Nomenclature of Hydrocarbons".Purdue University.Diakses tanggal23 Maret2008.
- ^abcAlberts, B.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K. (2002).Molecular Biology of the Cell(edisi ke-4). New York: Garland Science.
- ^"Nitrogen".WebElements.
- ^"Oxygen",WebElements
- ^"Fluorine".WebElements.
- ^"Neon".WebElements.
- ^"Natrium",WebElements
Keterangan warna latar belakang
|
