Timbal

82Pb Timbal | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Nodul timbal murni dan kubus timbal 1 cm3 | ||||||||||||||||||||||||||
Garis spektrum timbal | ||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||
| Pengucapan | /timbal/[1] | |||||||||||||||||||||||||
| Penampilan | abu-abu metalik | |||||||||||||||||||||||||
| Timbal dalamtabel periodik | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Nomor atom(Z) | 82 | |||||||||||||||||||||||||
| Golongan | golongan 14 (golongan karbon) | |||||||||||||||||||||||||
| Periode | periode 6 | |||||||||||||||||||||||||
| Blok | blok-p | |||||||||||||||||||||||||
| Kategori unsur | logam miskin | |||||||||||||||||||||||||
| Berat atom standar(Ar) |
| |||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f145d106s26p2 | |||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 18, 4 | |||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||
| FasepadaSTS(0 °C dan 101,325kPa) | padat | |||||||||||||||||||||||||
| Titik lebur | 600,61K(327,46 °C, 621,43 °F) | |||||||||||||||||||||||||
| Titik didih | 2022 K (1749 °C, 3180 °F) | |||||||||||||||||||||||||
| Kepadatanmendekatis.k. | 11,34 g/cm3 | |||||||||||||||||||||||||
| saat cair, padat.l. | 10,66 g/cm3 | |||||||||||||||||||||||||
| Kalor peleburan | 4,77kJ/mol | |||||||||||||||||||||||||
| Kalor penguapan | 179,5 kJ/mol | |||||||||||||||||||||||||
| Kapasitas kalor molar | 26,650 J/(mol·K) | |||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||
| Bilangan oksidasi | −4, −2, −1, +1,+2,+3,+4(oksidaamfoter) | |||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,87 (+2) 2,33 (+4) | |||||||||||||||||||||||||
| Energi ionisasi | ke-1: 715,6 kJ/mol ke-2: 1450,5 kJ/mol ke-3: 3081,5 kJ/mol | |||||||||||||||||||||||||
| Jari-jari atom | empiris: 175pm | |||||||||||||||||||||||||
| Jari-jari kovalen | 146±5 pm | |||||||||||||||||||||||||
| Jari-jari van der Waals | 202 pm | |||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka(fcc) a=495,08 pm | |||||||||||||||||||||||||
| Kecepatan suarabatang ringan | 1190 m/s (padas.k.) (teranil) | |||||||||||||||||||||||||
| Ekspansi kalor | 28,9 µm/(m·K) (suhu 25 °C) | |||||||||||||||||||||||||
| Konduktivitas termal | 35,3 W/(m·K) | |||||||||||||||||||||||||
| Resistivitas listrik | 208 nΩ·m (suhu 20 °C) | |||||||||||||||||||||||||
| Arah magnet | diamagnetik | |||||||||||||||||||||||||
| Suseptibilitas magnetik molar | −23,0×10−6cm3/mol (suhu 298 K)[3] | |||||||||||||||||||||||||
| Modulus Young | 16 GPa | |||||||||||||||||||||||||
| Modulus Shear | 5,6 GPa | |||||||||||||||||||||||||
| Modulus curah | 46 GPa | |||||||||||||||||||||||||
| Rasio Poisson | 0,44 | |||||||||||||||||||||||||
| Skala Mohs | 1,5 | |||||||||||||||||||||||||
| Skala Brinell | 38–50 MPa | |||||||||||||||||||||||||
| Nomor CAS | 7439-92-1 | |||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||
| Penemuan | Timur Tengah(7000 SM) | |||||||||||||||||||||||||
| Simbol | "Pb": dariLatinplumbum | |||||||||||||||||||||||||
| Isotop timbalyang utama | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Kelimpahan isotop sangat bervariasi menurut sampel | ||||||||||||||||||||||||||
Timbalatautimbel(disebut jugaplumbumatautimah hitam)[a]adalahunsur kimiadengan lambangPbdannomor atom82. Unsur ini merupakanlogam beratdenganmassa jenisyang lebih tinggi daripada banyak bahan yang ditemui sehari-hari. Timbal memiliki sifatlunak,mudah ditempa,danbertitik lelehrendah. Saat baru dipotong, timbal berwarna perak mengilat kebiruan, tetapi jika terpapar udara permukaannya akan berubah menjadi warna abu-abu buram. Timbal adalahunsur stabilbernomor atom tertinggi dan tiga di antara isotopnya adalah hasil akhir peluruhan berantai unsur-unsur yang lebih berat.
Timbal adalah logamgolongan IVA(14) yang relatiflengaiatau tidak mudah bereaksi. Logam ini bersifatamfoter;unsur timbal maupunsenyawaoksidanyamudah bereaksi denganasammaupunbasa.Dalam senyawa, timbal biasanya memilikibilangan oksidasi+2, dan jarang teroksidasi hingga +4 yang umum pada unsur golongan IVA di atasnya. Namun, bilangan oksidasi +4 sering terjadi dalamsenyawa-senyawa organotimbal.
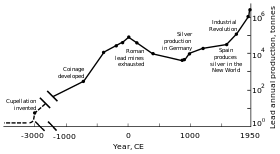
Timbal dapat ditambang daribijihmineral tertentu; hal ini dilakukan sejak zaman prasejarah diAsia Kecil.Galena,bijih timbal yang paling utama, sering mengandung perak, sehingga banyak ditambang dan digunakan diRomawi Kuno.Namun, produksinya menurun sejakkeruntuhan Romawi,dan baru padaRevolusi Industriproduksi timbal kembali mencapai tingkat seperti zaman Romawi. Pada 2014, produksi timbal dunia melebihi 10 juta ton per tahun, dan lebih dari setengahnya dihasilkan melalui daur ulang.
Sifat-sifat timbal yang berguna di antaranya adalah kepadatan tinggi, titik leleh rendah, kemudahan ditempa, dan tahankorosi.Selain itu, logam ini relatif murah dan banyak ditemukan sumbernya, sehingga sering digunakan manusia, termasuk untuk bangunan,pipa air,baterai,peluru,pemberat,solder,cat,zat aditif bahan bakar,dantameng radiasi.Namun, sejak abad ke-19, sifat racun timbal mulai ditemukan dan penggunaannya mulai dikurangi. Timbal dapat masuk tubuh manusia melalui makanan, minuman, serta udara atau debu yang tercemar. Unsur ini merusaksistem sarafdan mengganggu fungsienzimdalam tubuh. Timbal sangat berbahaya terutama untuk anak-anak karena dapat mengganggu pertumbuhanotak.
Sifat fisik
Sifat atom
Atom timbal memiliki 82elektron,dengankonfigurasi[Xe]4f145d106s26p2.Jumlahenergi ionisasipertama dan kedua timbal (energi untuk mengeluarkan dua elektron terluarnya) mirip dengantimah(Sn), tetangga atas timbal dalam golongan IVA. Hal ini tidak wajar karena energi ionisasi suatu unsur biasanya lebih rendah daripada tetangga atasnya di golongan yang sama, karena elektron terluarnya lebih jauh dariinti atomdan dipisahkan oleh lebih banyak orbital tingkat rendah. Ketidakwajaran ini disebabkan oleh fenomena yang disebutkontraksi lantanida,yaitu berkurangnyajari-jari atomdari lantanum (nomor atom 57) kelutesium(71), dan relatif kecilnya jari-jari atom unsur-unsur berikutnya. Ini adalah akibat dari kurang efektifnya elektron-elektron 4f dalam melindungi elektron luar dari tarikan inti atom. Bahkan jika energi ionisasi pertama sampai keempat dijumlahkan, total energi ionisasi timbal melebihi timah,[8]kebalikan dari pola yang umum untuk tetangga atas-bawah di tabel periodik. Di antara penyebab anomali ini adalah efek-efekkimia kuantum relativistik.Salah satunya adalahefek pasangan lengai,yang menyebabkan kedua elektron 6s timbal cenderung tidak terlibat dalam ikatan, sehingga jarak antara atom-atom pada kristal timbal menjadi sangat jauh.[9]
Unsur-unsur di atas timbal pada golongan IVA (karbon,silikon,germanium,dan timah) memilikialotropdengan struktur kubik seperti intan, yaitu denganikatan kovalenbersusunantetrahedral.Pada unsur-unsur tersebut, tingkat energi orbital s dan p terluar sangat mirip sehingga dapat melakukanhibridisasi orbitalmenjadi orbital sp3.Namun, hal serupa tidak terjadi pada timbal, karena efek pasangan lengai meningkatkan jarak energi orbital s dan p sehingga tidak dapat ditutupi oleh energi yang dibebaskan melalui ikatan yang melibatkan orbital sp3.[10]Karena itu, timbal tidak memiliki struktur kristal kubik seperti intan, tetapi terikat melaluiikatan logamyang melibatkan ion-ion Pb2+yang dikelilingi "lautan elektron" yang berasal dari orbital 6p. Timbal mengkristal dengan strukturkubik pusat muka(kpm, atauface-centred cubic,fcc)[11]seperti halnya logamgolongan IIAkalsiumdanstronsium.[12]
Sifat benda

Timbal murni memiliki warna perak terang dengan sedikit kebiru-biruan.[13]Zat ini memudar saat terkena udara lembap dan warnanya pun akan berubah tergantung kondisi. Ciri utama timbal di antaranya adalahmassa jenistinggi, lunak, dan mudah ditempa, serta tahan korosi karena adanya gejalapasivasi.[14]
Massa jenis timbal yang tinggi (11,34 g/cm3) disebabkan oleh susunan atomnya yang berupa kubik pusat muka dengan kepadatan tinggi dan berat atom tinggi. Massa jenis ini lebih berat dari banyak logam lainnya, sepertibesi(7,87 g/cm3),tembaga(8,93 g/cm3) danseng(7,14 g/cm3).[15]Ada beberapa logam yang lebih berat daripada timbal, tetapi lebih langka, yaitutungstendanemas(keduanya 19,3 g/cm3) danosmium(22,59 g/cm3dan logam terberat yang diketahui saat ini).[16]
Timbal memiliki sifat lunak (hanya 1,5skala Mohs) dan dapat digores dengan kuku.[17]Logam ini cukup mudah ditempa (malleable) dan ditarik (ductile).[18]Timbal memilikimodulus curah(bilangan yang menunjukkantekananyang dibutuhkan untuk mengurangi volume) sebesar 45,8GPa.Sebagai perbandingan, logam aluminium memiliki modulus curah 75,2 GPa, tembaga 137,8 GPa, danbaja karbon sedang160–169 GPa.[19]Selain itu, timbal memilikikekuatan tarikyang relatif rendah, yaitu 12–17 MPa (hanya sekitar 1/6 dari kekuatan tarik aluminium, 1/10 dari tembaga, dan 1/15 dari baja karbon sedang). Namun, timbal dapat diperkuat jikadipadukandengan sedikit tembaga atauantimon.[20]
Timbal memilikititik leleh327,5 °C,[21]sangat rendah dibandingkan dengan kebanyakan logam.[22][b]Titik didihnyaadalah 1749 °C, terendah di golongan IVA.[21]Timbal memilikiresistansi jenis(ρ) 192nanoohm-meterpada suhu 20 °C, hampir 10 kali lebih besar dibanding logam-logam yang banyak digunakan industri, seperti tembaga (15,43 nΩ·m), emas (20,51 nΩ·m); dan aluminium (24,15 nΩ·m).[24]Angka-angka ini menunjukkan bahwa timbal adalah penghantararus listrikyang lebih buruk dibandingkan logam-logam tersebut. Timbal menjadisuperkonduktorpada suhu di bawah 7,19K,[25]ini adalah suhu kritis superkonduktor tertinggi dari seluruhsuperkonduktor tipe I,dan tertinggi ketiga dari seluruh superkonduktor yang berupa unsur.[26]
Isotop
Kelimpahan isotop sangat bervariasi menurut sampel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standarAr°(Pb) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Di alam, timbal memiliki 4 isotop stabil (dengannomor massa205, 206, 207, dan 208) dan 5radioisotop renikyang cepat meluruh dan kelimpahannya sangat rendah. Banyaknya jumlah isotop ini adalah hal yang umum untuk unsur dengan nomor atom yang genap.[c]Timbal memiliki 82 proton, yang merupakan salah satu "bilangan ajaib"dalam fisika inti; sesuai denganmodel kulit nuklir,hal ini berarti timbal memiliki inti atom yang sangat stabil.[28]Isotop timbal-208 bahkan memiliki 126 neutron (126 juga termasuk bilangan ajaib); alhasil isotop 208 ini (82 proton + 126 neutron) adalah isotop yang luar biasa stabil.[28]
Timbal adalah unsur dengan nomor atom terbesar yang diketahui memiliki isotop stabil, dan isotop timbal-208 adalah isotop terberat yang diketahui stabil.[29]Di atas kertas, keempat isotop stabil timbal dapat mengalamipeluruhan alfadengan melepaskan energi menjadi isotop-isotopraksa(nomor atom 80), tetapi peluruhan seperti itu belum pernah ditemukan. Justru keempat isotop ini sangat stabil dan waktu paruhnya diprediksi di antara 1035–10189tahun, jauh lebih panjang dibandingkan denganumur alam semestasaat ini.[30]
Sebagian dari isotop stabil timbal, yaitu timbal-206, timbal-207 dan timbal-208 adalah produk akhir dari tigaderet radioaktifyang umum ditemui di alam. Ketiga deret ini berturut-turut adalah rantai yang berawal dari uranium-238 ( "deret uranium" ), dari uranium-235 ( "deret aktinium" ), dan dari torium-232 ( "deret torium" ). Ketiga deret ini merupakan tiga dari empat deret radioaktif utama yang ditemukan di alam.[31][32]Distribusi isotop timbal di alam memiliki variasi yang tinggi tergantung keberadaan tiga isotop induk tersebut (uranium maupun torium). Misalnya, timbal yang diperoleh daribijihtorium dapat memiliki kelimpahan timbal-208 sebesar 90%, tetapi pada sampel biasa hanya memiliki kelimpahan 52%.[33]Seiring perjalanan waktu, perbandingan timbal-206 dan timbal-207 terhadap timbal-204 akan meningkat karena timbal-206 dan timbal-207 akan bertambah diakibatkan peluruhan unsur lain, sedangkan timbal-204 bukanlah produk akhir peluruhan. Fenomena ini dimanfaatkan sebagai basis metodepenanggalanyang disebutpenanggalan timbal–timbaluntuk memperkirakan umur batuan. Selain itu, karena uranium meluruh menjadi timbal, perubahan konsentrasi uranium dan timbal dimanfaatkan sebagai basis metode lain yang disebut metodepenanggalan uranium–timbal.[34]Isotop timbal-207 mengalami fenomenaresonansi magnet inti(RMI, atau NMR,nuclear magnetic resonance), sehingga senyawa-senyawanya dapat diteliti melalui RMI baik dalam larutan, padatan, maupun dalam tubuh manusia.[35][36][37]

Hampir seluruh timbal yang terdapat di alam terdiri dari isotop-isotop stabil yang disebut di atas. Selain itu, terdapat juga beberapa isotop radioaktif yang jumlahnyarenikatau sangat kecil dan berumur sangat pendek. Salah satunya adalah timbal-210 yang waktu paruhnya hanya 22,3 tahun[27]tetapi masih ditemukan di alam karena terus terbentuk sebagai produk perantara dalam deret peluruhan uranium-238. Isotop timbal-211, timbal-212, dan timbal-214 berturut-turut adalah produk perantara deret peluruhan uranium-235, deret torium, dan deret uranium-238, sehingga juga ditemukan di alam dengan jumlah renik. Timbal-209 juga terbentuk pada peluruhan radium-223. Radium-223 adalah isotop langka yang terbentuk sebagai produk sementara deret radioaktif uranium-235 dan deret neptunium-237, sehingga isotop timbal-209 dapat ditemukan dalam jumlah kecil pada bijih uranium. Timbal-210 dapat digunakan untuk memperkirakan umur sampel dengan menghitung nisbahnya terhadap timbal-206, karena keduanya terlibat dalam deret uranium-238.[38]
Secara keseluruhan, terdapat 43 isotop timbal yang dapat disintesis, dengan nomor massa antara 178–220.[27]Di antara isotop-isotop sintetis ini, timbal-205 adalah isotop yang paling stabil, dengan waktu paruh 1,5×107tahun.[d]Isotop sintetis terstabil berikutnya adalah timbal-202, dengan waktu paruh 53.000 tahun, lebih tinggi dibanding isotop-isotop renik timbal yang alami.[27]
Sifat kimia
Reaksi dasar

Saat bersentuhan dengan udara lembap, padatan timbal bereaksi membentuk lapisan tipis di permukaan yang melindungi timbal tersebut dari korosi; fenomena ini disebutpasivasi.[40]Lapisan yang terbentuk terdiri dari berbagai senyawa yang berbeda-beda tergantung keadaan.Timbal(II) karbonatadalah senyawa yang paling umum;[41]selain itutimbal(II) sulfatmaupuntimbal(II) kloridadapat terbentuk dalam kondisi perkotaan atau di laut. Namun, dalam bentuk bubuk yang sangat halus, timbal dapat terbakar spontan di udara menghasilkan api berwarna putih kebiruan.[42][43]
Timbal bereaksi denganfluorinpada suhu ruangan membentuktimbal(II) fluorida.Reaksi serupa denganklorinhanya terjadi pada suhu tinggi, karena reaksi ini menghasilkan lapisan timbal(II) klorida yang mengurangi reaktivitas.[40]Timbal juga bereaksi dengan unsurgolongan VIA,misalnya dengan oksigen membentuktimbal(II) oksida.[44]
Logam timbal tidak bereaksi denganasam sulfatdanasam fosfat,tetapi bereaksi denganasam kloridadanasam nitrat;hasilnya tergantung apakah garam-garam yang dihasilkan dapat larut atau dapat membentuk lapisan pasivasi.[45]Timbal larut dalam asam organik sepertiasam asetatjika ada oksigen.[40]Timbal juga bereaksi dengan basa pekat membentuk senyawa plumbit (PbO2−2).[46]
Senyawa anorganik
Dalam senyawa, timbal memiliki dua bilangan oksidasi utama, +2 (sebagai timbal(II)) dan +4 (timbal(IV)). Bilangan oksidasi +4 sangat umum pada unsur golongan IVA. Kelaziman bilangan oksidasi +2 berbeda-beda untuk unsur-unsur golongan IVA: sangat langka padakarbondansilikon,kadang terjadi padagermanium,dan lazim (tetapi bukan yang paling lazim) pada timah. Namun, pada timbal, bilangan oksidasi +2 lebih sering terjadi dibandingkan +4.[40]Perbedaan ini diakibatkan efek-efekkimia kuantum relativistik,terutama efek pasangan lengai yang terjadi ketika ada perbedaanelektronegativitasyang besar antara timbal dan anion yang diikatnya (sepertioksida,halidaataunitrida), menyebabkan adanya muatan positif besar pada ion timbal. Hal ini lalu menyebabkan kontraksi pada orbital 6s timbal (lebih kuat dibandingkan kontraksi pada orbital 6p-nya), sehingga elektron-elektron 6s menjadi lebih lengai dan tidak mudah terionisasi. Namun,efek pasangan lengai ini kurang efektif pada senyawa yang melibatkan timbal dalam ikatan kovalen, misalnya padasenyawa organotimbal(senyawa dengan ikatan kovalen antara timbal dan karbon). Pada senyawa-senyawa ini, orbital 6s dan 6p berukuran sama dan cenderung berhibridisasi menjadi orbital sp3.Karena itu, timbal (seperti halnya karbon) umumnya memiliki bilangan oksidasi +4 pada senyawa organotimbal.[47]
Elektronegativitas timbal(II) adalah 1,87 dan berselisih relatif jauh dengan elektronegativitas timbal(IV) yaitu 2,33. Selisih besar ini merupakan anomali dibanding unsur golongan IVA yang berada di atasnya. Sebagai contoh, timah(II) memiliki elektronegativitas 1,80 dan timah(IV) hanya terpaut sedikit di 1,96.[48]
Timbal(II)

Terbentuknya senyawa-senyawa timbal(II) atau Pb2+merupakan ciri khas timbal dalam reaksi anorganik. Bahkanpengoksidasikuat seperti fluorin dan klorin hanya bisa mengoksidasi timbal menjadi timbal(II), membentuk senyawa PbF2and PbCl2.[40]Ion timbal(II) atau Pb2+biasanya tidak berwarna dalam larutan,[49]danterhidrolisissebagian untuk menghasilkan Pb(OH)+dan kemudian [Pb4(OH)4]4+(ionhidroksidaberfungsi sebagaijembatan ligan),[50][51]tetapi ion-ion ini tidak bersifatpereduksiseperti halnya ion timah(II).Analisis kualitatifuntuk mendeteksi ion Pb2+biasanya dilakukan dengan larutan asam klorida encer yang akan menghasilkanendapantimbal(II) klorida (PbCl2). Namun, analisis ini tidak dapat mendeteksi ion Pb2+yang sangat encer, karena PbCl2tidak mengendap jika konsentrasinya sangat kecil. Untuk mendeteksi larutan Pb2+sangat encer, ditiupkan gashidrogen sulfida,yang menghasilkan endapan timbal(II) sulfida (PbS).[52]
Senyawa PbO atautimbal(II) oksidaterdapat dalam dua bentuk kristal (polimorf), yang pertama disebutlitharge(α-PbO, berwarna merah) dan yang kedua disebutmassicot(β-PbO, berwarna kuning).Lithargeadalah senyawa anorganik timbal yang paling banyak digunakan, sedangkan massicot hanya stabil pada suhu di atas 488 °C.[53]Tidak ada senyawa timbal(II) hidroksida, jika larutan garam timbal(II) direaksikan dengan basa, maka Pb2+akan terhidrolisis.[54]Selain oksigen, timbal dapat bersenyawa dengan unsur golongan VIA (kalkogen) lainnya, membentuk keluarga senyawa timbal kalkogenida. Timbal sulfida bersifatsemikonduktor,fotokonduktor,dan merupakandetektor radiasi inframerahyang sangat sensitif. Senyawa timbal kalkogenida lainnya, yaitutimbal selenida(PbSe) dantimbal telurida(PbTe), juga bersifat fotokonduktor. Salah satu keunikan senyawa-senyawa ini adalah warnanya semakin terang dari atas ke bawah tabel periodik.[55]
Dengan unsur halogen, timbal(II) membentuk keluarga senyawa timbal(II) halida atau timbal dihalida, contohnya timbal(II) astatida (PbAt2)[56]dan halida campuran seperti PbFCl. Senyawa-senyawa halida campuran memiliki kelarutan yang relatif rendah sehingga dapat dimanfaatkan untukanalisis gravimetriterhadap fluorin. Timbal(II) fluorida, PbF2ditemukan pada 1834 olehMichael Faradaydan merupakan padatan pertama yang ditemukan bersifatkonduktor ion.[57]Dihalida-dihalida lainnya mudah terurai jika terkena sinar tampak atauultraviolet,terutama timbal(II) iodida, PbI2.[58]Senyawa timbal(II)pseudohalidajuga telah ditemukan, seperti timbal(II) sianida (Pb(CN)2), sianat (Pb(OCN)2), dan tiosianat (Pb(SCN)2). Timbal(II) dan halogen juga membentuk banyaksenyawa kompleks,seperti [PbCl4]2−,[PbCl6]4−,dan keluargaanion[Pb2Cl9]n5n−.[58]
Selain itu, terdapat jugatimbal(II) sulfatyang tidak larut dalam air, seperti banyak garam sulfat dengan kation logam berat berbilangan oksidasi +2 lainnya. Senyawa timbal(II) nitrat dantimbal(II) asetatlarut dengan baik dalam air, sehingga sering dipakai untuk sintesis senyawa-senyawa timbal lainnya.[59]
Timbal(IV)

Hanya sedikit senyawa anorganik yang mengandung timbal(IV). Senyawa-senyawa ini biasanya hanya terbentuk dalam larutan oksidator kuat dan tidak terbentuk dalam kondisi standar.[60]Contohnya adalah Pb3O4,yang memiliki campuran timbal(II) dan timbal(IV) dengan struktur 2PbO·PbO2,dan merupakan contoh utama senyawa timbal dengan bilangan oksidasi campuran. Senyawa timbal(IV) lainnya adalahtimbal(IV) oksida(PbO2), yang merupakan zat oksidator yang kuat dan dapat mengoksidasi asam klorida menjadi gas klorin.[61]Ini disebabkan senyawa PbCl4tidak stabil dan terurai secara spontan menjadi PbCl2and Cl2.[62]Timbal(IV) oksida juga dapat membentuk berbagai bentuk anion plumbat(IV). Terdapat juga timbal(IV) fluorida (PbF4), yang berwujud serbuk kristal kuning dan bersifat stabil tetapi tidak sestabil timbal(II) fluorida. Senyawa halida lainnya adalah timbal(IV) klorida (PbCl4) yang berwujud minyak kuning yang terurai pada suhu kamar, dan timbal(IV) bromida yang bahkan lebih tak stabil lagi. Keberadaan timbal(IV) iodida masih diragukan.[63]
Dengan bilangan oksidasi lain
Sedikit sekali senyawa yang memiliki timbal dengan bilangan oksidasi selain +2 atau +4. Timbal(III) dan Timbal(I) bersifat tak stabil baik dalam bentuk ion maupun senyawa kompleks karena adanyaradikal bebas.Sekalipun demikian, timbal(III) kadang ditemukan pada senyawa kompleks organotimbal besar sebagai zat perantara antara timbal(II) dan timbal(IV).[64][65][66]
Timbal dengan bilangan oksidasi negatif dapat ditemukan dalam zatfase Zintl,baik sebagai ion Pb4-bebas, seperti pada Ba2Pb,[67]maupun sebagai gugus ion berbentuk cincin atau polihedral.[68]Contoh gugus ion polihedral adalah Pb52−,yang strukturnya adalahbipiramida segitiga.Ion ini memiliki dua atom timbal dengan bilangan oksidasi -1 dan tiga dengan bilangan oksidasi 0.[68]Dalam ion ini, setiap atom berada pada tiap sudut bipiramida dan masing-masing menyumbangkan 2 elektron dari orbital sp3nya kepada rusuk-rusuk bipiramida. Dua elektron sp3yang tersisa menjadipasangan sunyi.[50]Ion ini dapat terbentuk dalamamonia cairmelalui reaksi reduksi timbal olehnatrium.[69]
Senyawa-senyawa organotimbal

Karbon(C)
Hidrogen(H)
Timbal (Pb)
Timbal dapat membentukrantai molekul panjang,seperti karbon dan unsur-unsur di golongan IVA pada umumnya. Namun,energi ikatanPb–Pb relatif lemah, sekitar 3,5 kali lebih lemah dibanding ikatan karbon–karbon.[44]Jika rantai molekul hanya terdiri dari timbal, panjang maksimal yang mungkin tercapai hanyalah 3.[70]Jika rantai ini juga memiliki karbon, maka terbentuk senyawa-senyawa yang disebut senyawaorganotimbal,yang mirip dengan senyawa-senyawa organik biasa tetapi lebih tak stabil karena ikatan Pb–C relatif lebih lemah.[71][50]Hal ini menyebabkan senyawaorganologamini lebih langka dibandingkan saudara dekatnya di tabel periodik yaituorganotimah.Timbal pada sebagian besar senyawa organotimbal memiliki bilangan oksidasi +4, bahkan ketika diproduksi dari senyawa anorganik timbal(II). Contoh langka senyawa organotimbal(II) adalah Pb[CH(SiMe3)2]2dan Pb(η5-C5H5)2.[72]
Plumbana(PbH4) adalah analog timbal untuk metana (CH4), senyawa organik paling sederhana. Plumbana dapat dihasilkan melalui reaksi antara logam timbal danatom hidrogen.[73]Dua senyawa turunan plumbana, yaitutetra metil timbaldantetra etil timbal(TET atau TEL,tetraethyllead), adalah senyawa organotimbal yang paling terkenal. Keduanya relatif stabil, dan TET hanya terurai jika dipanaskan atau terpapar sinar matahari maupun ultraviolet.[74][75]Terdapat juga tetrafenil timbal yang lebih stabil dan baru terurai pada suhu 270 °C.[72]Banyak senyawa organotimbal bersifat oksidator, misalnya timbal tetraasetat yang digunakan sebagai oksidator untuk reaksi organik di laboratorium.[76]Senyawa-senyawa organotimbal lainnya bersifat kurang stabil,[71]dan banyak senyawa organik yang analog timbalnya tidak ditemukan.[73]
Keberadaan
Di luar angkasa
| Nomor atom |
Unsur | Kelimpahan relatif (timbal=1) |
|---|---|---|
| 42 | Molibdenum | 0,798 |
| 46 | Paladium | 0,440 |
| 50 | Timah | 1,146 |
| 78 | Platinum | 0,417 |
| 80 | Raksa | 0,127 |
| 82 | Timbal | 1 |
| 90 | Torium | 0,011 |
| 92 | Uranium | 0,003 |
DiTata Surya,timbal memiliki kelimpahan 0,112ppb(bagian per semiliar).[77]Kelimpahan ini 2,5 kali lipat kelimpahan unsur platinum, 8 kali raksa, dan 17 kali emas.[77]Jumlah timbal di alam semesta saat ini meningkat perlahan karena banyak atom-atom berat yang meluruh perlahan menjadi timbal.[78][79]Sejak terbentuknya Tata Surya 4,5 miliar tahun lalu, kelimpahan timbal telah meningkat sekitar 0,75%.[80]Walaupun timbal memiliki nomor atom relatif tinggi, timbal memiliki kelimpahan yang lebih tinggi dibanding kebanyakan unsur bernomor di atas 40 (lihat tabel).[77]
Isotop primordial(isotop yang terbentuk sejak sebelum terbentuknya bumi) timbal terdiri dari isotop 204, 206, 207, dan 208. Semuanya terbentuk karena prosespenangkapan neutronyang berulang-ulang terjadi di dalam bintang. Proses ini dibedakan menjadi dua mode:proses sdanproses r.[81]

Dalam proses s (dari kataslow,"lambat" ), penangkapan neutron terjadi setiap beberapa tahun atau puluhan tahun, sehingga inti-inti atom yang kurang stabil dapat mengalamipeluruhan beta.[82]Misalnya, inti203
81Tldapat menangkap neutron menjadi204
81Tl,yang lalu mengalami peluruhan beta menjadi204
82Pbyang bersifat stabil. Jika204
82Pbmenangkap neutron lagi, ia akan menjadiPb,yang memiliki paruh waktu 15 juta tahun. Jika terus terjadi penangkapan neutron, inti ini akan menjadi206
82Pb,lalu207
82Pb,lalu208
82Pb.Tambahan satu neutron lagi akan mengubahnya menjadi209
82Pb,yang bersifat tidak stabil dan meluruh menjadi209
83Bidan melepaskan partikel beta. Inti ini lalu menangkap neutron menjadi210
83Bi,yang meluruh (beta) menjadi210
84Po,yang lalu mengalami peluruhan alfa menjadi206
82Pb.Hasil siklus ini adalah Pb-206, Pb-207, Pb-208, dan Bi-209 (lihat gambar).[83]
Dalam proses r (dari katarapid,"cepat" ), penangkapan neutron terjadi dengan sangat cepat, sehingga inti-inti atom yang terlibat tidak sempat mengalami peluruhan beta.[84]Biasanya proses ini terjadi dalam kondisi kaya neutron, misalnya dalam sebuahsupernovaatau bergabungnya duabintang neutron.Aliran neutron pada kondisi ini dapat mencapai 1022neutron per cm2per detik.[85]Proses r tidak menghasilkan timbal sebanyak proses s.[86]Proses ini cenderung berhenti ketika inti atom mencapai 126 neutron.[87]Pada posisi ini, konfigurasi neutron telah memenuhikulit nuklirnyasehingga sangat sulit untuk menerima neutron tambahan.[88]Saat aliran elektron berkurang, inti-inti kaya neutron yang terbentuk akan mengalami peluruhan beta menjadi osmium, iridium, dan plantinum.[89]
Di bumi

Dalamklasifikasi Goldschmidt,timbal digolongkan sebagai unsur kalkofil, yang berarti unsur ini sering ditemukan bersama-sama dengan belerang.[90]Timbal jarang ditemukan dalam bentuklogam asli.[91]Timbal ditemukan dalam mineral-mineral yang relatif ringan, dan sepanjangsejarah bumitetap bertahan dikerak bumialih-alih tenggelam ke inti bumi. Hal ini menyebabkan timbal memilikikelimpahan di kerak bumiyang relatif tinggi, yaitu 14 ppm (bagian per sejuta) atau peringkat ke-38 dari seluruh unsur.[92][e]
| Negara | Cadangan (juta ton) |
|---|---|
| 35 | |
| 17 | |
| 6,4 | |
| 6,3 | |
| 5,6 | |
| 5,0 | |
| Lainnya | 12,9 |
Mineral utama yang mengandung timbal adalahgalena(PbS), yang sering ditemukan bersama-sama dengan bijih seng.[95]Kebanyakan mineral timbal lain masih terkait dengan galena:boulangerite,Pb5Sb4S11,adalah sulfida campuran yang diturunkan dari galena,anglesite,PbSO4adalah hasil oksidasi galena, dancerussite,PbCO3,adalah hasil penguraian galena. Mineral-mineral ini sering tercampur unsur-unsur lain, sepertiarsenik,timah, antimon, perak, emas, tembaga, dan bismut.[95]
Dunia memiliki sumber timbal dengan total melebihi 2 miliar ton. Sumber timbal yang besar terdapat di Amerika Serikat, Australia, Irlandia, Meksiko, Peru, Portugal, Rusia, dan Tiongkok. Jika hanya menghitung sumber yang layak diekstraksi secara ekonomi, cadangan timbal dunia mencapai 88 juta ton pada tahun 2016. Dari total ini, jumlah terbesar adalah 35 juta yang berada di Australia, 17 juta di Tiongkok, dan 6,4 juta di Rusia.[94]
Pada umumnya konsentrasi latar timbal di atmosfer berada di bawah 0,1 μg/m3,<100 mg/kg di tanah, dan <5 μg/L di air laut maupun tawar.[96]
Sejarah
Prasejarah dan zaman kuno
Manik-manikdari logam timbal yang diperkirakan berasal dari 7000–6500 SM telah ditemukan diAsia Kecil(sekarang daerah Turki); bisa jadi ini adalah kali pertama manusia mengekstraksi logam dari bijihnya melalui teknikpeleburan.[98]Pada masa itu, timbal agaknya memiliki sedikit kegunaan karena bersifat lunak dan tampak buram.[98]Penyebab meningkatnya produksi timbal adalah karena bijih timbal yang disebutgalenajuga merupakan sumber perak.[99]BangsaMesir Kunoadalah bangsa pertama yang menggunakan mineral timbal sebagaikosmetika,dan praktik inipun menyebar keYunani Kunodan daerah-daerah lain.[100]Bangsa Mesir Kuno bisa jadi juga menggunakan timbal untuk pemberat jaring penangkap ikan,kaca,email porselen,dan sebagai hiasan.[99]Berbagai kebudayaan di daerahBulan Sabit Suburmenggunakan timbal untuk alat tulis, sebagai mata uang, dan sebagai bahan bangunan.[99]DiTiongkok Kuno,timbal digunakanpsikostimulandi kalangan istana,[99]sebagai mata uang[101]dan sebagaialat kontrasepsi.[102]Peradaban Lembah IndusdanMesoamerikamenggunakannya untuk membuat berbagai jimat;[99]bangsa-bangsa Afrika daerah selatan dan timur menggunakannya untuk mengerjakanpenarikan kawat.[103]
Zaman klasik

Karena perak (yang sering tercampur dalam mineral timbal) banyak digunakan sebagai alat tukar dan perhiasan, sumber-sumber timbal mulai diolah di Asia Kecil sejak 3000 SM, lalu diikuti pengolahan diKepulauan AegeadanLavrio(sekarang di Yunani). Tiga kawasan ini mendominasi pertambangan timbal hingga sekitar 1200 SM.[105]Selain itu, sejak 2000 SM bangsaBangsa Fenisiamengolah sumber timbal diSemenanjung Iberia;pada 1600 SM pulau Siprus danSardiniapun juga memiliki pertambangan timbal.[106]DaerahNusantaratelah mengenal pertambangan timbal dan penggunaannya dalam paduanperunggusetidaknya sudah ada sejak zamankebudayaan bercorak Hindu-Buddha.Sebagianartefakperunggu yang ditemukan dari zaman ini diSumatradanJawamengandung kadar timbal yang berkisar antara 1,22% sampai 17,43%.[107]Daerah pertambangan yang menggunakan teknik peleburan ditemukan di berbagai tempat di Sumatra, termasukMuara Sipongi,Sumatera Utara.[108]
Republik Romawimenjadi produser terbesar timbal pada zaman klasik akibat perluasan wilayahnya di Eropa dan Laut Mediterania serta pengembangan pertambangan yang mereka lakukan. Puncak produksi timbal Romawi pada masa ini diperkirakan mencapai 80.000 ton. Seperti sebelumnya, sebagian besar timbal diperoleh sebagai hasil sampingan pertambangan perak.[97][109]Pertambangan timbal dibuka di Eropa Tengah,Britania,Semenanjung Balkan,Yunani, Asia Kecil, dan Semenanjung Iberia. Semenanjung Iberia (atauHispania) menghasilkan 40% timbal dunia.[97]
Papan timbal banyak digunakan sebagai bahan menulis surat.[110]DiProvinsi Yudea,timbal digunakan sebagai peti mati yang dicetak dengan motif-motif sesuai kepercayaan penghuninya.[111]Timbal digunakan untuk bahanpipa airdiKekaisaran Romawi.[112]Karena mudah diolah dan tahan korosi,[112]timbal pun banyak digunakan sebagai bahan obat-obatan, atap, mata uang, maupun persenjataan.[113][114][115]Penulis sepertiMarcus Porcius Cato,Columella,danPlinius yang Tuamenyarankan penggunaan wadah berbahan atau berlapis timbal untuk membuatdefrutum,pemanis dan pengawet yang digunakan untukminuman anggurdan makanan. Saat ini diketahui bahwa wadah timbal memberikan rasa manis karena dapat bereaksi membentuk timbal(II) asetat ( "gula timbal" ), sedangkan wadah tembaga atau perunggu dapat menberikan rasa pahit akibat terbentuknyatembaga(II) asetat( "verdigris" ).[116]

Penulis RomawiVitruviusmenulis bahwa timbal berbahaya untuk kesehatan,[117]dan beberapa penulis modern berpendapat bahwakeracunan timbaladalah salah satu penyebab melemahnya bangsa Romawi.[118][119][f]Namun, peneliti lain mengkritik pendapat tersebut, salah satunya dengan menunjukkan bahwa tidak semua gejala sakit perut diakibatkan keracunan timbal.[121]Menurut penelitian arkeologi, pipa timbal yang digunakan bangsa Romawi meningkatkan kadar timbal dalam air leding, tetapi efeknya kemungkinan besar tidak terlalu berbahaya.[122][123]
Abad Pertengahan dan Renaisans
Penambangan timbal di Eropa barat menurun setelahruntuhnya Kekaisaran Romawi Barat,dan hanyaAl-Andalus(Hispania) yang masih memproduksi timbal dengan jumlah besar.[124][125]Pada saat bersamaan, pertambangan timbal tumbuh dengan cepat di luar Eropa. Produksi terbesar terjadi di Asia Timur (terutama Tiongkok) dan Asia Selatan (terutama India).[125]
Pertambangan timbal mulai meningkat lagi di Eropa pada abad ke-11 dan ke-12, dan logam tersebut digunakan kembali untuk bahan atap dan pipa.[126]Sejak abad ke-13, timbal digunakan untuk membuatkaca berwarna.[126]Menurut ilmualkimiadalamtradisi dunia Islamdan Eropa pada abad pertengahan, timbal merupakanlogam dasartak murni yang konon dapat diubah menjadi emas melalui proses pemisahan dan pemurnian.[127]

Pada masa ini, timbal juga digunakan sebagai bahan campuran pada minuman anggur.Paus Aleksander VImelarang penggunaan anggur yang tercampur timbal dalammisadan ritus-ritus lainnya pada 1498, tetapi praktik ini terus berlangsung, mengakibatkan terjadinya banyak keracunan hingga abad ke-18.[124][129]Timbal juga merupakan bahan penting untukmesin cetakyang ditemukan sekitar 1440; pekerja mesin cetak sering terpapar racun karena menghirup debu timbal.[130]Timbal menjadi bahan utama peluru untuk senjata api pada masa ini. Walaupun lebih mahal dibanding besi, timbal dipilih karena besi membuat laras senapan tidak awet, sedangkan timbal lebih padat dan mudah diproduksi karena titik lelehnya lebih rendah.[131]Kosmetik berbahan timbal digunakan oleh kalangan bangsawan Eropa Barat sebagai pemutih wajah, dan kelak juga untukrambut palsudancelak.Tren ini baru surut pada masaRevolusi Prancispada akhir abad ke-18.[132][133]
Tren serupa juga muncul di Jepang abad ke-18, sejak munculnya profesigeishaatau wanita penghibur. Timbal sangat umum dipakai sebagai pemutih wajah.[134]Wajah putih dianggap melambangkan sifat baik wanita Jepang.[135]Di Afrika, pertambangan dan pengolahan timbal berlangsung diPalung Benue[136]dan daerah hilirCekungan Kongo,serta penggunaan logam ini sebagai mata uang dan alat tukar dengan bangsa Eropa telah terjadi pada abad ke-17, sebelumpenjajahan besar-besaranoleh bangsa Eropa.[137]
Zaman penjelajahan Bangsa Eropa
Di benua Amerika, kedatangan bangsa Eropa diikuti juga dengan pertambangan timbal. Pertambangan mulai didirikan diKoloni Virginiapada 1621, 14 tahun setelah pendirian koloni tersebut.[138]Di Australia, pertambangan timbal adalah pertambangan pertama yang didirikan oleh pemukim Eropa, yaitu pada tahun 1841.[139]
Revolusi Industri

Revolusi Industriterjadi pada paruh kedua abad ke-18, dimulai diBritania Rayadan menyebar ke benua Eropa dan Amerika Serikat. Saat ini produksi timbal meningkat kembali, dan melebihi produksi zaman Romawi untuk pertama kalinya.[97]Awalnya, Britania Raya adalah penghasil timbal terbesar hingga pertengahan abad ke-19, saat persediaan timbalnya mulai habis dan pertambangan di Jerman, Spanyol, dan Amerika Serikat semakin berkembang.[140]Pada 1900, Amerika Serikat adalah penghasil timbal terbesar, dan negara non-Eropa lainnya (terutama Kanada, Meksiko, dan Australia) mulai menambang timbal dalam jumlah besar.[141]Alhasil, produksi timbal di luar Eropa melebihi produksi Eropa.[141]Timbal paling banyak digunakan untuk membuat pipa dancat.[142]Semakin banyak orang (terutama golongan pekerja) terpapar timbal dan kasus-kasus keracunan pun meningkat. Hal ini memicu penelitian mengenai efek timbal bagi tubuh manusia. Penelitian selanjutnya menyimpulkan bahwa asap timbal lebih berbahaya daripada timbal berbentuk padatan. Timbal dikaitkan dengan penyakitpirai—dokter InggrisAlfred Baring Garrodmenemukan bahwa sepertiga dari pasien pirainya adalah tukang leding atau tukang cat. Pada abad ke-19, diteliti juga efek menghirup timbal (terutama jika terus menerus) terhadap kelainan-kelainan mental. Pada dekade 1870-an dan 1880-an, Britania Raya mengeluarkan undang-undang untuk mengurangi keracunan timbal di pabrik-pabrik.[142]
Zaman modern

Bukti-bukti bahaya yang ditimbulkan timbal terus ditemukan pada abad ke-19 dan 20. Pengetahuan akan mekanisme unsur ini dalam tubuh manusia semakin jelas, dan ditemukan juga fenomena kebutaan yang diakibatkan oleh timbal. Akibatnya, unsur ini mulai dihindari di Amerika Serikat dan Eropa. Britania Raya mewajibkan inspeksi pabrik pada 1878 dan menunjuk pejabat khusus untuk mengepalai inspeksi pabrik pada 1898; setelah itu, kasus keracunan timbal berkurang 25 kali lipat dalam rentang 1900–1944.[143]Pada 1930, sebagian besar negara Eropa telah melarang cat timbal (yang populer karena warnanya pekat dan tahan air)[144]untuk interior bangunan.[145]
Timbal (dalam bentuk tetra etil timbal) mulai digunakan sebagaizat antiketukuntuk bensin di Amerika Serikat pada 1921. Praktik ini menyebar dan menjadi sumber terakhir yang memaparkan timbal pada khalayak umum. Pada 2000, praktik ini telah dilarang di Amerika Serikat dan Uni Eropa.[146][142]
Pada dasawarsa 1970-an, Amerika Serikat dan negara-negara Eropa Barat mulai mengeluarkan undang-undang untuk membatasi pencemaran timbal di udara.[147][148]Hal ini terbukti efektif: penelitianPusat Pengendalian dan Pencegahan PenyakitAmerika Serikat menunjukkan bahwa populasi yang menderita tingginyakadar timbal darahmenurun dari 77,8% (1976–1980) menjadi 2,2% (1991–1994).[149]Pada akhir abad ke-20, produk mengandung timbal yang paling umum adalahbaterai asam timbalyang dianggap tidak berbahaya bagi manusia.[150]
Selama rentang 1960–1990, produksi timbal di negara-negaraBlok Barattumbuh sekitar 31%.[151]Produksi di negara-negaraBlok Timurjuga meningkat, dan persentase timbal dunia yang dihasilkan di negara-negara ini meningkat dari sekitar 10% (1950) menjadi 30% (1990).Uni Sovietmenjadi penghasil timbal terbesar dunia dari pertengahan 1970-an hingga 1980-an, dan Tiongkok mulai melakukan penambangan timbal besar-besaran pada akhir abad ke-20.[152]Berbeda dengan negara-negara Blok Timur di Eropa, pada pertengahan abad ke-20 sebagian besar Tiongkok masih belum terindustrikan. Penggunaan timbal terkait pengindustrian yang selanjutnya terjadi di negara tersebut menjadi ancaman kesehatan (seperti halnya di Eropa pada masa Revolusi Industri).[153]Pada tahun 2004, Tiongkok menjadi produsen timbal terbesar dunia.[154]
Produksi

Menurut data tahun 2014, produksi timbal dunia saat ini sedang meningkat karena diperlukan untuk baterai asam timbal.[155]Ada dua mode produksi: yaitu produksi primer dengan mengolah bijih mineral, dan produksi sekunder dengan mendaur ulang barang bekas. Pada 2014, 4,58 juta ton timbal dihasilkan melalui produksi primer dan 5,64 juta ton melalui produksi sekunder. Negara penghasil timbal terbesar melalui pertambangan adalah Tiongkok, Australia, dan Amerika Serikat,[94]sedangkan penghasil terbesar melalui daur ulang adalah Tiongkok, Amerika Serikat, dan India.[156]Menurut laporanInternational Resource Panelpada 2010, jumlah total timbal yang digunakan, disimpan, dibuang, atau tersebar ke lingkungan mencapai 8 kgper kapita.Di negara maju, angka ini mencapai 20–150 kg per kapita sedangkan di negara berkembang hanya 1–4 kg per kapita.[157]
Proses produksi timbal secara primer dan sekunder cukup mirip. Beberapa pabrik produksi primer juga melengkapi operasinya dengan produksi sekunder, praktik yang diprediksi akan terus meningkat. Dengan teknik yang tepat, timbal yang diproduksi secara sekunder dapat menjadi serupa timbal yang dihasilkan secara primer dan tidak dapat dibedakan. Proses produksi timbal melalui daur ulang biasanya lebih hemat energi dibanding produksi primer, dengan penghematan sering mencapai 50% atau lebih.[158]
Primer
Kebanyakan bijih timbal memiliki kadar timbal yang kecil (bijih yang dianggap "kaya" biasanya hanya memiliki kadar 3–8%), dan harus dipekatkan sebelum diekstraksi.[159]Awalnya bijih tersebut diproses dengan penggilingan, pemisahan berdasarkan berat,pengapungan buih,dan pengeringan. Konsentrat yang dihasilkan memiliki kadar massa 30%–80% (umumnya 50–60%).[159]
Konsentrat ini selanjutnya diubah menjadi logam timbal (yang belum murni). Ada dua cara melakukan hal ini, yang disebut "proses dua tahap" dan "proses langsung". Belakangan ini, proses langsung lebih sering dilakukan, tetapi masih banyak juga yang melakukan proses dua tahap.[160]
Proses dua tahap
| Negara | Produksi (ribu ton) |
|---|---|
| 2.400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Lainnya | 170 |
Awalnya, timbal yang masih dalam bentuk sulfida (PbS)dipanggangdi udara agar teroksidasi:[161]
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
Karena timbal sulfida yang diolah masih belum murni, pemanggangan ini menghasilkan tidak hanya timbal(II) oksida (PbO) seperti reaksi di atas, tetapi juga campuran oksida, sulfat, dan silikat dari timbal maupun logam-logam lain yang terdapat dalam bijih. PbO tak murni ini lalu direduksi olehkokas(karbon daribatu bara) dalam sebuahtanur tiup:[162]
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
Karena pereaksinya tidak murni, hasil reaksi ini pun tidak murni dan mengandung logam pengotor seperti arsenik, antimon, bismut, seng, tembaga, perak, dan emas. Selanjutnya pengotor-pengotor ini dimurnikan, umumnya melalui sebuah prosespirometalurgi.Hasil dari proses sebelumnya (yang masih berupa lelehan panas) diolah melaluitanur pantul.Ke dalam tanur pantul dicampurkan udara, uap air, dan sulfur, yang dapat mengoksidasi pengotor-pengotor yang ada, kecuali perak, emas, dan bismut. Pengotor yang telah teroksidasi akanmemadatdan mengapung sehingga dapat dipisahkan.[163][164]Emas dan perak lalu dipisahkan melaluiproses Parkesdengan cara mencampurkan cairan seng. Seng melarutkan emas dan perak tetapi tidakbercampurdengan timbal. Seng ini dapat dipisahkan, lalu emas dan perak yang terlarut didalamnya diambil sebagai hasil samping.[165][164]Bismut dipisahkan denganproses Betterton–Kroll,yaitu mencampurkan kalsium dan magnesium yang menghasilkan senyawa bismut yang mengapung.[164]
Selain proses pirometalurgi, pemurnian timbal juga dapat dilakukan melalui proseselektrolisisyang disebutproses Bettsyang menghasilkan kemurnian lebih tinggi. Namun, proses ini sangat mahal sehingga hanya dilakukan jika benar-benar dibutuhkan.[166][164]
Proses langsung
Pada proses langsung, logam timbal dihasilkan langsung dari konsentrat. Konsentrat yang—seperti proses primer—mengandung timbal sulfida (PbS) dilelehkan dalam sebuah tanur dan dioksidasi menghasilkan timbal(II) oksida atau PbO. Karbon (dari kokas maupungas batubara) ditambahkan ke dalam lelehan ini bersama denganfluks(bahan yang dapat bereaksi terus menerus). Karbon ini mereduksi PbO menjadi logam Pb, yang tercampur denganterak(ampas) PbO dan pengotor lain.[160]
Jika konsentrat masukan proses ini memiliki kadar timbal tinggi, 80% dari timbal yang ada dapat menjadi logam Pb, sedangkan sisanya akan menjadi PbO yang tercampur di dalam terak. Jika konsentrat hanya memiliki kadar timbal rendah, semua timbal yang ada akan teroksidasi dan hanya menjadi terak. Terak ini kaya akan timbal (25–40%), dan logamnya dapat diperoleh dengan prosespembakaran tenggelam,reduksi dalamtanur busur listrik,atau kombinasi keduanya.[160]
Proses lain
Para peneliti juga mencari proses penambangan timbal yang lebih bersih dan hemat energi. Namun, sejauh ini metode-metode alternatif memiliki kelemahan, di antaranya adalah banyaknya timbal yang terbuang dalam terak, serta tingginya kadar belerang pada logam timbal yang dihasilkan. Salah satu teknik yang mendapat perhatian peneliti adalah ekstraksihidrometalurgimelaluielektrolisis.Dalam proses ini, timbal kotor digunakan sebagai anode, dan listrik dialirkan sehingga timbal kotor larut dan akan mengendap di katode sebagai timbal murni. Namun, saat ini proses ini masih belum ekonomis kecuali di lokasi dengan sumber listrik amat murah.[167]
Sekunder
| Negara | Produksi (ribu ton) |
|---|---|
| 1.480 | |
| 1.020 | |
| 357 | |
| 340 | |
| 248 | |
| 195 | |
| 190 | |
| 166 | |
| 160 | |
| 157 | |
| 153 | |
| 151 |
Proses sekunder dilakukan dengan daur ulang barang bekas yang mengandung timbal. Barang bekas yang paling umum adalah baterai asam timbal; selain itu, pipa timbal,lembaran timbal,maupun pelapis kabel juga banyak digunakan.[158]Dalam proses sekunder, sering kali tidak perlu dilakukan reduksi seperti halnya pada proses primer, karena timbal pada barang bekas sudah berupa unsur (bukan senyawa). Hanya kasus-kasus tertentu (misalnya timbal yang telah teroksidasi, atau bahan yang berupa senyawa seperti sisa baterai) perlu diproses dengan reduksi.[158]Jika reduksi dibutuhkan, prosesnya mirip dengan pada proses primer, dan biasanya dilakukan pada tanur tiup atau tanur putar. Perbedaan utama kedua tanur ini adalah kadar pengotornya: tanur tiup biasanya menghasilkan timbal keras dengan 10% antimon, sedangkan tanur putar biasanya menghasilkan timbal semilunak (3–4% antimon).[168]Selain itu juga adaproses Isasmelt,yang di atas kertas juga dapat dilakukan untuk proses primer. Pada proses ini, sampah baterai asam timbal (yang terdiri dari timbal oksida dan timbal sulfat) direaksikan dengan basa untuk memisahkan sulfatnya, lalu direaksikan dengan karbon pada sebuah tanur beroksigen. Proses ini menghasilkan timbal tak murni, pengotor utamanya biasanya adalah antimon.[169]Pemurnian hasil ini mirip dengan pemurnian pada proses primer, tetapi kadang sebagian tahap pemurnian dapat ditiadakan tergantung pengotor yang terdapat dalam bahan yang didaur ulang.[169]
Kegunaan
Timbal sebagai unsur
Logam timbal memiliki banyak sifat fisik yang berguna, di antaranya massa jenis tinggi, titik leleh rendah, mudah ditarik, dan relatif lengai. Banyak unsur logam lain yang memiliki sebagian sifat ini, bahkan lebih baik daripada timbal, tetapi umumnya logam-logam tersebut lebih langka atau sulit ditambang. Namun, timbal mulai ditinggalkan karena sifat racunnya.[170]
Timbal digunakan sebagaipelurusejak abad pertengahan. Timbal cocok untuk kegunaan ini karena murah, bertitik leleh rendah sehingga dapat dicetak dengan peralatan sederhana, dan bermassa jenis tinggi sehingga lebih mampu mempertahankan kecepatannya setelah ditembakkan. Saat ini, timbal masih menjadi bahan utama peluru, dan biasanya dipadukan dengan logam lain sebagai pengeras.[131]Namun, ada kekhawatiran bahwa penggunaan peluru timbal untuk berburu dapat merusak lingkungan.[g][171]
Sifat timbal yang padat dan tahan korosi dimanfaatkan untuk banyak hal. Logam ini digunakan sebagai pemberat padalunas kapalkarena massa besar dan volume kecilnya mengurangi gesekan air maupun goyangan kapal akibat angin.[172]Timbal juga digunakan pada tali pengikatselam skubakarena beratnya memudahkan penyelam turun di air.[173]Pada tahun 1993, dasarMenara Pisadiperkuat menggunakan 600 ton timbal.[174]Logam ini juga digunakan untuk melapisi kabel bawah laut karena bersifat tahan korosi.[175]

Timbal banyak digunakan dalam arsitektur dan konstruksi bangunan. Lembaran timbal digunakan sebagai bahan atap,kelongsong,talang,dan tembok atap.[176][177]Timbal juga masih digunakan sebagai bahanpatung,termasuk padaangkurnya.[178][179]Dulunya timbal juga digunakan untuk menjaga keseimbangan roda mobil, tetapi diganti bahan lain karena alasan kesehatan dan lingkungan.[94]
Timbal digunakan dalam paduan tembaga, termasukkuningandan perunggu, agar bahan tersebut menjadi mudah dipotong dan lebihlumas.[180]Karena tidak larut dalam tembaga, timbal membentuk globul (globule,tetesan kecil) yang padat pada celah-celah dalam paduan timbal-tembaga tersebut. Pada konsentrasi rendah, globul-globul ini berfungsi sebagai pelumas dan mencegak robeknya paduan tersebut saat dipotong atau diolah. Paduan dengan konsentrasi timbal tinggi digunakan untuk membuatbantalanpada mesin. Pada paduan timbal seperti ini, timbal berfungsi sebagai pelumas sedangkan tembaga berfungsi untuk menahan beban.[180]
Timbal juga digunakan sebagai peredam suara, getaran, atau radiasi. Hal ini disebabkan kepadatan dan nomor atom timbal yang tinggi, serta sifatnya yang mudah dibentuk.[181]Timbal tidak memilikifrekuensi resonansi alami,[181]alhasil lembaran timbal digunakan sebagai insulasi pada tembok, lantai, dan langit-langit studio suara.[182]Pipa organsering dibuat dari timbal yang dipadukan dengan timah untuk mengendalikan nada tiap pipa.[183][184]Timbal merupakan bahan utama untukpenangkal radiasidalam ruangan sinar X maupun penelitian nuklir, karena kepadatannya yang tinggi dan sifatnya yang sulit ditembus radiasi.[185][186]Timbal cair digunakan sebagai pendingin pada jenis reaktor nuklir yang disebutreaktor cepat berpendingin timbal.[187]

Pada abad ke-21, penggunaan timbal yang terbesar adalah dalambaterai asam timbal.Dalam baterai ini, tegangan listrik dihasilkan oleh reaksi antara timbal, timbal(IV) oksida, dan asam sulfat.[h][188]Superkapasitoryang menggunakan baterai asam timbal telah digunakan di Amerika Serikat, Australia, dan Jepang.[189]Baterai asam timbal jauh lebih murah dibanding alternatifnya yaitubaterai ion litium,tetapi memiliki kepadatan energi yang lebih rendah dan efisiensi siklus pengisian (charge-discharge efficiency) yang lebih buruk.[190]
Timbal digunakan sebagai insulasi pada kabel tegangan tinggi untuk mencegah meresapnya air, tetapi mulai ditinggalkan dan diganti bahan lain.[191]Penggunaan timbal dalamsolderjuga mulai ditinggalkan untuk mengurangi limbah yang mencemari lingkungan.[192]Timbal digunakan dalamTes Oddy(bersama perak dan tembaga) untuk mendeteksi zat-zat yang dapat merusak karya seni rupa di museum.[193][194]
Sebagai senyawa

Senyawa-senyawa timbal digunakan dalam baterai asam timbal (bersama-sama dengan logam timbal).[188]Selain itu, senyawa timbal saat ini hanya digunakan untuk kegunaan yang sangat khusus dan banyak ditinggalkan.[195]Senyawa timbal digunakan untuk pigmen merah dan kuning untuk mewarnai keramik dan gelas. Penggunaan cat timbal telah ditinggalkan di Amerika Serikat dan Eropa, tetapi masih umum di negara berkembang seperti Indonesia,[196]Tiongkok,[197]dan India.[198]Timbal(IV) asetat dan timbal(IV) oksida banyak digunakan sebagai oksidator dalam reaksi kimia organik. Senyawa timbal juga ditambahkan padaplastik PVCuntuk insulasi alat-alat listrik.[199][200]Senyawa timbal juga bisa ditambahkan pada lilin agar lebih awet saat dibakar; tetapi karena sifat racunnya, negara-negara Eropa dan Amerika Utara menggantinya dengan seng.[201][202]Kaca timbaldibuat dari 12–28%timbal(II) oksida,yang memengaruhi sifat optiknya dan dapat melemahkan radiasi pengion.[203]Senyawa-senyawa timbal juga digunakan sebagaisemikonduktor,misalnya timbal telurida dan timbal selenida yang digunakan untuk selfotovoltaikdan detektorinframerah.[204]
Dampak terhadap tubuh manusia
Walaupun timbal tidak diketahui memiliki fungsi khusus secara biologi,[205]unsur ini sangat banyak ditemui dalam tubuh manusia. Kadar rata-rata timbal dalam tubuh manusia dewasa mencapai 120 mg,[i]logam berat tertinggi ketiga setelah zat besi (4000 mg) dan seng (2500 mg).[209]Garam-garamtimbal diserap tubuh dengan mudah.[210]Pada orang dewasa, 1% timbal disimpan dalam tulang dan sisanya dibuang melalui urin dan feses setelah beberapa minggu. Namun, pada anak-anak, hanya sepertiga timbal yang dibuang oleh tubuh, dan pemaparan secara terus-menerus dapat menyebabkanbioakumulasi.[211]
Toksisitas
Timbal merupakan racun yang kuat (baik jika dihirup atau ditelan), dapat memengaruhi hampir semuaorgandansistemdalam tubuh manusia.[212]MenurutNational Institute for Occupational Safety and Healthdi Amerika Serikat, timbal dengan konsentrasi 100 mg/m3di udara memiliki status "berbahaya langsung" (kode bahasa Inggris "IDLH",immediately dangerous to life and health).[213]Jika timbal terhirup, hampir semuanya akan diserap masuk ke peredaran darah.[214]Faktor utama dalam sifat racun timbal adalah kecenderungannya mengganggu fungsi-fungsienzimdengan cara mengikatgugus tioldalam banyak enzim,[215]maupun berkompetisi dengan unsur logam penting yang menjadikofaktordalam banyakreaksi enzimatik.[216]Logam-logam yang sering disaingi oleh timbal adalah zat besi, seng, dan kalsium.[217]Tubuh yang kekurangan zat besi dan kalsium cenderung lebih rentan keracunan timbal.[210]
Gejala
Timbal menyebabkan kerusakanotakdanginjalyang dapat berakhir dengan kematian. Dengan meniru (menggantikan posisi) kalsium, timbal dapat menembussawar darah otak,lalu mengurangi dan merusakselubung mielinyang membungkus neuron, menggangu jalurpengiriman sinyalpada saraf, dan mengurangi pertumbuhan neuron.[215]Dalam tubuh, timbalmenghambatenzimporfobilinogen sintasedanferokelatase,sehingga mencegah terbentuknyaporfobilinogendan mengikatnya besi keprotoporfirin IX,yang merupakan tahap terakhir pembentukan molekulheme.Akibatnya, pembentukan heme dalam tubuh menjadi tidak efektif dan menyebabkananemia mikrositik.[218]

Gejala keracunan timbal di nataranyanefropati(kerusakan ginjal),mulas,dan kadang disertai lemahnya jari, pergelangan tangan, dan kaki. Keracunan ini juga dapat menyebabkan sedikit kenaikan tekanan darah, yang dapat menyebabkan anemia terutama pada penderita berumur menengah atau tua. Beberapa penelitian (kebanyakan bermetodepotong lintang) menemukan keterkaitan antara kontak dengan timbal dengan berkurangnyavariabilitas denyut jantung.[219]Pada wanita hamil, pemaparan timbal yang tinggi dapat menyababkankeguguran.Pemaparan yang tinggi dan terus-menerus juga dapat mengurangi kesuburan pria.[220]
Timbal juga dapat mengganggu proses pembentukansinapsisdikorteks otak besarmaupun pembentukan senyawaneurokimiasertasaluran iondalam otak anak yang sedang tumbuh.[221]Pemaparan timbal pada anak kecil telah dikaitkan dengan meningkatnya risiko gangguan tidur maupun kantuk di siang hari pada masa anak akhir.[222]Kadar timbal tinggi dalam darah pada anak perempuan dikaitkan dengan terlambatnyapubertas.[223]Selain itu, ada hipotesis bahwa naik dan turunnya kadar timbal di udara akibat penggunaan tetra etil timbal pada abad ke-20 berkorelasi dengan naik turunnya tingkat kriminalitas, tetapi hipotesis ini masih belum diterima kebanyakan ilmuwan.[224]
Sumber paparan
Paparan timbal adalah masalah global karena penambangan, pengolahan, dan penggunaan barang-barang berbahan timbal banyak terjadi di berbagai negara. Timbal dapat masuk tubuh manusia dengan dihirup, ditelan, atau diserap kulit. Hampir semua timbal yang dihirup akan diserap tubuh, sedangkan timbal yang ditelan biasanya diserap sebesar 20–70%, dan anak-anak menyerap lebih banyak dibanding dewasa.[225]
Keracunan biasanya terjadi akibat makanan atau minuman yang terkontaminasi timbal. Selain itu, kadang timbal masuk karena tidak sengaja menelan tanah, debu, atau cat yang terkontaminasi.[226]Air laut dapat mengandung timbal jika dicemari limbah industri.[227]Tanah dapat terkontaminasi melalui akumulasi partikel limbah dari pipa, cat, maupun emisi bahan bakar yang ditambahi aditif timbal. Buah dan sayuran juga dapat terkontaminasi jika tumbuh di tanah berkadar timbal tinggi.[228]
Penggunaan pipa timbal dapat berbahaya di daerah dengan air asam atau air lunak.[229]Air sadahmembentuk lapisan pelindung pada permukaan pipa, sedangkan air asam atau lunak dapat melarutkan dan menyerap timbal.[230]Air yang berkarbondioksida dapat menyerap timbal menjadi timbalbikarbonat(Pb(HCO3)2,air yang beroksigen juga dapat menyerap timbal menjaditimbal(II) hidroksida.Meminum air yang terkontaminasi seperti ini dapat menyebabkan masalah kesehatan. Ini dapat dicegah jika air memiliki kesadahan tinggi, karena kalsium karbonat dan kalsium sulfat pada air sadah akan bereaksi dengan timbal membentuk timbal karbonat atau timbal sulfat yang melapisi permukaan pipa.[231]
Cat timbal sering tertelan oleh anak-anak, misalnya ketika anak itu menjilat kusen atau bagian bangunan lain. Selain itu, ketika cat tersebut mulai terkelupas, partikelnya menjadi debu dan dapat menempel di mulut, makanan, atau minuman.[232]
Timbal juga dapat masuk melalui hirupan, terutama pada perokok dan pekerja di sektor yang melibatkan timbal.[214]Isotop radioaktif timbal-210 (bersama racun-racun lain) sering ada dalam rokok, yang berasal dari jenik pupuk fosfat yang digunakan untuk tembakau.[233]Penyerapan melalui kulit biasanya terjadi pada pekerjaan yang melibatkan senyawa timbal organik. Senyawa timbal anorganik biasanya lebih sulit diserap melalui kulit.[234]
Pengobatan
Keracunan timbal biasanya ditangani dengandimerkaproldanasam dimerkaptosuksinat(DMSA).[235]Pada kasus yang lebih parah, kadang diperlukannatrium kalsium edetat(natrium kalsium EDTA). EDTA lebih terikat pada timbal dibanding kalsium, sehingga dalam tubuh obat ini akan melepaskan kalsiumnya untuk diganti dengan timbal, membentuk senyawakelatdengan timbal yang akan keluar melalui urin.[236]
Dampak lingkungan

Penambangan, pengolahan, dan pembuangan timbal menyebabkan kontaminasi dalam tanah dan air. Emisi timbal ke atmosfer mencapai puncaknya selama Revolusi Industri dan selama penggunaan aditif timbal di bahan bakar. Timbal dilepaskan dari sumber alam (misal akibat aktvitas vulkanik), maupun dari kegiatan manusia, misalnya industri, pembakaran, daur ulang, dan kegiatan manusia yang mengganggu timbal yang sebelumnya tertimbun.[237]Tanah dan endapan di daerah industri dan perkotaan banyak mengandung kadar timbal tinggi.[238]Emisi akibat pembakaran batubara sering terjadi.[239]Masalah-masalah ini sering lebih parah di negara berkembang akibat kurangnya peraturan, infrastruktur pengolahan sampah, dan banyaknya praktik penggunaan timbal yang telah ditinggalkan di negara maju.[240]
Timbal dapat terakumulasi di tanah, terutama tanah dengan kadar organik tinggi, dan bertahan hingga ratusan atau ribuan tahun. Timbal dapat bersaing dengan logam-logam lain dalam tubuh dan permukaan tanaman sehingga mengganggu proses fotosintesis, bahkan pada konsentrasi tinggi dapat membahayakan pertumbuhan dan hidup tumbuhan itu. Kontaminasi timbal dapat mengikuti rantai makanan, sehingga kontaminasi pada tanah dan tumbuhan akan menyebabkan juga kontaminasi pada hewan atau mikroorganisme yang memakannya. Pada hewan, timbal meracuni banyak organ, merusaksistem saraf,ginjal,reproduksi,pembuatan sel darah,danperedaran darah.[241]Ikan dapat menyerap timbal melalui air dan endapan yang terdapat di habitatnya,[242]sehingga unsur ini dapatterakumulasimelalui rantai makanan dan membahayakan hewan-hewan laut lainnya.[243]

Penggunaan timbal dalam peluru dan peralatan memancing juga memperparah kontaminasi unsur ini di lingkungan. Selain industri, dua hal ini adalah penyebab utama kontaminasi timbal.[244]Pada 2017, Amerika Serikat sempat melarang penggunaan timbal pada peluru dan peralatan memancing (tetapi dibatalkan dalam 1 bulan setelahpergantian pemerintahan);[245][246]Uni Eropa mempertimbangkan memberlakukan larangan serupa.[247]
Metode analisisuntuk menentukan keberadaan timbal di lingkungan di antaranya metodespektrofotometri,fluoresensi sinar-X,spektroskopi atomik,danelektrokimia.Metode elektrokimia dapat dilakukan denganelektrode selektif ionmenggunakanionoforS,S'-Metilenebis(N,N-diisobutilditiokarbamat).[248]
Pembatasan dan pembersihan
Sejak 1980, negara-negara maju mulai mengurangi penggunaan timbal untuk industri. Amerika Serikat mengeluarkan peraturan-peraturan untuk mengurangi atau menghilangkan penggunaan timbal pada produk selain baterai, termasuk bensin, cat, solder, dan sistem pipa air. Alat penangkap partikel dipasang padapembangkit listrik tenaga batubarauntuk mencegah emisi timbal.[239]Pada 1992,Kongres Amerika SerikatmemerintahkanEnvironmental Protection Agencymengurangi kadar timbal darah pada anak-anak Amerika Serikat.[249]Uni Eropa mengeluarkanDirektifRoHSyang membatasi penggunaan timbal.[250]
DiAmerika Serikat,peraturan yang berlaku pada 2012 membatasi konsentasi timbal di tempat kerja menjadi maksimal 50 μg/m3selama 8 jam kerja, dan kadar timbal darah dibatasi maksimal 5 μg per 100 g.[251]Timbal dalam kadar berbahaya masih ditemukan padatembikar,[252]vinil,[253]dan kuningan tertentu.[j][254]Banyak negara maju telah melarang penjualan cat timbal putih (lihatKonvensi Cat Timbal Putih 1921), tetapi masih dipakai untuk pigmen kuning yang berbahantimbal kromat.[144]Membersihkan cat timbal pada bangunan lama dapat melepaskan debu timbal yang mudah terhirup.[255]Beberapa negara mewajibkan penghilangan timbal di bangunan-bangunan yang ditinggali anak-anak.[256]
Tiongkok, salah satu produsen cat terbesar dunia,[257]membatasi kadar timbal pada cat interior bangunan, cat dekoratif, maupun catmainananak-anak.[258]Batas maksimalnya adalah 90 ppm (bagian per sejuta) jika diekstraksi dengan reaksi asam standar, sebanding dengan kira-kira 600 ppm kadar timbal total.[259]Namun, penelitian yang dilakukan lembaga antipencemaran IPEN serta Insight Explorer di akhir 2014 menunjukkan bahwa sekitar setengah dari sampel yang diteliti melebihi batas ini.[257]Bahkan, 34% dari sampel memiliki kadar timbal total yang dianggap "sangat berbahaya", yaitu di atas 10.000 ppm.[257]
Ilmuwan juga meneliti cara menghilangkan timbal secara biologi. JamurAspergillus versicolormampu menyerap ion timbal yang terlarut dalam air limbah industri.[260][261]Penelitian dilakukan terhadap berbagaibakteriyang diduga dapat membersihkan timbal dari lingkungan, di antaranyaDesulfovibriodanDesulfotomaculum;keduanya bersifatreduktor sulfatdan efektif dalam air.[262]Tulang ikan juga saat ini diteliti sifatbioremediasinyapada timbal yang terkandung di tanah.[260][263]
Keterangan
- ^Kamus Besar Bahasa Indonesiamemuat lematimbal,[4]timbel,[5]danplumbum[6]untuk unsur ini. Selain itu kadang istilahtimah hitamdigunakan, tetapi timbal adalah unsur yang berbeda dengantimah(Sn, nomor atom 50) yang kadang disebut jugatimah putih.[7]
- ^Bandingkan dengan titik leleh besi yaitu 1536 °C, tembaga yaitu 1084 °C, dan aluminum yaitu 660 °C. Ada juga yang lebih rendah dibanding timbal, misalnya timah (231,9 °C).[23]
- ^Hal ini disebabkan jumlah proton atau neutron yang genap biasanya meningkatkan kestabilan inti sebuah atom, relatif dibandingkan inti atom dengan jumlah ganjil. Tidak ada unsur bernomor atom ganjil yang memiliki lebih dari dua isotop stabil, sedangkan semua unsur bernomor genap memiliki lebih dari satu isotop stabil, termasuk timah (nomor atom 50) yang memiliki jumlah isotop stabil tertinggi yaitu 10.[27]
- ^Timbal-205 hanya dapat meluruh melaluipenangkapan elektron.Oleh karena itu, jika tidak ada elektron dan atom timbal telah terionisasi penuh, atom isotop ini tidak dapat meluruh.[39]
- ^Perlu diketahui bahwa angka-angka kelimpahan ini adalah perkiraan dan dapat berubah-ubah tergantung sumber yang digunakan.[93]Lihat pulaKelimpahan unsur di kerak bumiuntuk perbandingan angka kelimpahan beberapa sumber.
- ^Bahkan,Frankenburg 2014,hlm. 16 menganggap timbal sebagai penyebabJulius Caesarhanya memiliki satu anak dan penerusnyaAugustustidak memiliki anak.[120]
- ^Negara bagianCaliforniadi Amerika Serikat melarang peluru timbal pada Juli 2015 karena alasan ini.[171]
- ^LihatProgressive Dynamics, Inc.untuk rincian cara kerja baterai asam timbal.
- ^Kadar ini berbeda-beda tergantung negara.[206]Kadar timbal darah juga berbeda-beda, misalnya di Amerika Serikat rata-rata ukur timbal darah adalah 1,3 µg/dl (mikrogram per dekaliter), sedangkan di India rata-rata adalah 5,3 µg/dl, di Tiongkok 4,3–8,3 µg/dl, dan Thailand 9,8 µg/dl.[207]Negara berkembang cenderung memiliki kadar lebih tinggi karena lebih banyaknya sumber pemaparan, kurangnya gizi, banyaknya anak, kurangnya infrastruktur daur ulang, kurangnya regulasi serta kurangnya pengawasan kesehatan.[208]
- ^Kuningan ini disebutChinese brass( "Kuningan Cina" ) yang dasarnya adalah tembaga dan seng yang dipadukan dengan timbal, besi, timah, dan kadang antimon.[254]
Referensi
Versi bahasa Inggris bertanggal 2018 dari artikel ini telah melewati prosesulasan sejawat(di sini), telah dimuat dalam jurnalWikiJournal of Sciencedan dapat dirujuk sebagai: Boldyrev M, et al. (2018)."Lead: properties, history, and applications".WikiJournal of Science.1(1): 7.doi:10.15347/wjs/2018.007. |
- ^(Indonesia)"Timbal".KBBI Daring.Diakses tanggal17 Juli2022.
- ^abMeijaet al.2016.
- ^Weast, Astle & Beyer 1983,hlm. E110.
- ^KBBI,timbal
- ^KBBI,timbel
- ^KBBI,plumbum
- ^Soedowo 2012,hlm. 152.
- ^Lide 2005,hlm. 10-179.
- ^Norman 1996,hlm. 36.
- ^Greenwood & Earnshaw 1998,hlm. 226–27, 374.
- ^Christensen 2002,hlm. 867.
- ^Considine & Considine 2013,hlm. 501, 2970.
- ^Greenwood & Earnshaw 1998,hlm. 372.
- ^Greenwood & Earnshaw 1998,hlm. 372–73.
- ^Lide 2005,hlm. 12-35, 12-40.
- ^Lide 2005,hlm. 4-13, 4-21, 4-33.
- ^Vogel & Achilles 2013,hlm. 8.
- ^Anderson 1869,hlm. 341–43.
- ^Gale & Totemeier 2003,hlm. 15–2–15–3.
- ^Thornton, Rautiu & Brush 2001,hlm. 8.
- ^abLide 2005,hlm. 12-219.
- ^Thornton, Rautiu & Brush 2001,hlm. 6.
- ^Thornton, Rautiu & Brush 2001,hlm. 13.
- ^Lide 2005,hlm. 12-45.
- ^Blakemore 1985,hlm. 272.
- ^Webb, Marsiglio & Hirsch 2015.
- ^abcdIAEA - Nuclear Data Section 2017.
- ^abStone 1997.
- ^Marcillacet al.2003,hlm. 876–78.
- ^Beemanet al.2013.
- ^Radioactive Decay Series 2012.
- ^Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materialset al.1999.
- ^Smirnov, Borisevich & Sulaberidze 2012.
- ^Levin 2009,hlm. 40–41.
- ^Webb 2000,hlm. 115.
- ^Wrackmeyer & Horchler 1990.
- ^Cangelosi & Pecoraro 2015.
- ^Fiorini 2010,hlm. 7–8.
- ^Takahashiet al.1987.
- ^abcdeGreenwood & Earnshaw 1998,hlm. 373.
- ^Thürmer, Williams & Reutt-Robey 2002,hlm. 2033–35.
- ^Bretherick 2016,hlm. 1442.
- ^Harbison, Bourgeois & Johnson 2015,hlm. 132.
- ^abGreenwood & Earnshaw 1998,hlm. 374.
- ^Thornton, Rautiu & Brush 2001,hlm. 11–12.
- ^Polyanskiy 1986,hlm. 20.
- ^Kaupp 2014,hlm. 9–10.
- ^Dieter & Watson 2009,hlm. 509.
- ^Hunt 2014,hlm. 215.
- ^abcKing 1995,hlm. 43–63.
- ^Bunker & Casey 2016,hlm. 89.
- ^Whitten, Gailey & David 1996,hlm. 904–5.
- ^Greenwood & Earnshaw 1998,hlm. 384.
- ^Greenwood & Earnshaw 1998,hlm. 387.
- ^Greenwood & Earnshaw 1998,hlm. 389.
- ^Zuckerman & Hagen 1989,hlm. 426.
- ^Funke 2013.
- ^abGreenwood & Earnshaw 1998,hlm. 382.
- ^Greenwood & Earnshaw 1998,hlm. 388.
- ^Toxicological Profile for Lead 2007,hlm. 277.
- ^Downs & Adams 2017,hlm. 1128.
- ^Brescia 2012,hlm. 234.
- ^Greenwood & Earnshaw 1998,hlm. 381.
- ^Mosseri, Henglein & Janata 1990,hlm. 2722–26.
- ^Konu & Chivers 2011,hlm. 391–92.
- ^Hadlington 2017,hlm. 59.
- ^Röhr 2017.
- ^abAlsfasser 2007,hlm. 261–63.
- ^Greenwood & Earnshaw 1998,hlm. 393.
- ^Stabenow, Saak & Weidenbruch 2003.
- ^abPolyanskiy 1986,hlm. 43.
- ^abGreenwood & Earnshaw 1998,hlm. 404.
- ^abWiberg, Wiberg & Holleman 2001,hlm. 918.
- ^Toxicological Profile for Lead 2007,hlm. 287.
- ^Polyanskiy 1986,hlm. 44.
- ^Zýka 1966,hlm. 569.
- ^abcdLodders 2003,hlm. 1222–23.
- ^Roedereret al.2009,hlm. 1963–80.
- ^Lochner, Rohrbach & Cochrane 2005,hlm. 12.
- ^Lodders 2003,hlm. 1224.
- ^Burbidgeet al.1957,hlm. 608–615.
- ^Burbidgeet al.1957,hlm. 551.
- ^Burbidgeet al.1957,hlm. 608–609.
- ^Burbidgeet al.1957,hlm. 553.
- ^Frebel 2015,hlm. 114–15.
- ^Burbidgeet al.1957,hlm. 608–610.
- ^Burbidgeet al.1957,hlm. 595.
- ^Burbidgeet al.1957,hlm. 596.
- ^Burbidgeet al.1957,hlm. 582, 609–615.
- ^Langmuir & Broecker 2012,hlm. 183–184.
- ^Davidsonet al.2014,hlm. 4–5.
- ^Emsley 2011,hlm. 286, passim.
- ^Cox 1997,hlm. 182.
- ^abcdeUnited States Geological Survey 2017,hlm. 97.
- ^abDavidsonet al.2014,hlm. 4.
- ^Rieuwerts 2015,hlm. 225.
- ^abcdHonget al.1994,hlm. 1841–43.
- ^abRich 1994,hlm. 4.
- ^abcdeWinder 1993b.
- ^History of Cosmetics.
- ^Yu & Yu 2004,hlm. 26.
- ^Toronto museum explores 2003.
- ^Bisson & Vogel 2000,hlm. 105.
- ^Lead sling bullet.
- ^Rich 1994,hlm. 5.
- ^United States Geological Survey 1973.
- ^Soedowo 2012,hlm. 159.
- ^Soedowo 2012,hlm. 162.
- ^de Callataÿ 2005,hlm. 361–72.
- ^Ceccarelli 2013,hlm. 35.
- ^Ossuaries and Sarcophagi.
- ^abRich 1994,hlm. 6.
- ^Thornton, Rautiu & Brush 2001,hlm. 179–84.
- ^Bisel & Bisel 2002,hlm. 459–60.
- ^Retief & Cilliers 2006,hlm. 149–51.
- ^Grout 2017.
- ^Hodge 1981,hlm. 486–91.
- ^Gilfillan 1965,hlm. 53–60.
- ^Nriagu 1983,hlm. 660–63.
- ^Frankenburg 2014,hlm. 16.
- ^Scarborough 1984.
- ^Reddy & Braun 2010,hlm. 1052.
- ^Delileet al.2014,hlm. 6594–99.
- ^abWinder 1993a.
- ^abRich 1994,hlm. 7.
- ^abRich 1994,hlm. 8.
- ^Cotnoir 2006,hlm. 35.
- ^Kellett 2012,hlm. 106–07.
- ^Samson 1885,hlm. 388.
- ^Sinhaet al.1993.
- ^abRamage 1980,hlm. 8.
- ^Tungate 2011,hlm. 14.
- ^Donnelly 2014,hlm. 171–172.
- ^Nakashimaet al.1998,hlm. 59.
- ^Ashikari 2003,hlm. 65.
- ^Bisson & Vogel 2000,hlm. 85.
- ^Bisson & Vogel 2000,hlm. 131–32.
- ^Rabinowitz 1995,hlm. 66.
- ^Gill & Libraries Board of South Australia 1974,hlm. 69.
- ^Lead mining.
- ^abRich 1994,hlm. 11.
- ^abcRivaet al.2012,hlm. 11–16.
- ^Hernberg 2000,hlm. 246.
- ^abCrow 2007.
- ^Markowitz & Rosner 2000,hlm. 37.
- ^Uekoetter 2004,hlm. 132.
- ^Moreet al.2017.
- ^American Geophysical Union 2017.
- ^Centers for Disease Control and Prevention 1997.
- ^Rich 1994,hlm. 117.
- ^Rich 1994,hlm. 17.
- ^Rich 1994,hlm. 91–92.
- ^Zhanget al.2012,hlm. 2261–73.
- ^United States Geological Survey 2005.
- ^Tolliday 2014.
- ^abGuberman 2016,hlm. 42.14–15.
- ^Graedel 2010.
- ^abcThornton, Rautiu & Brush 2001,hlm. 56.
- ^abDavidsonet al.2014,hlm. 6.
- ^abcDavidsonet al.2014,hlm. 17.
- ^Thornton, Rautiu & Brush 2001,hlm. 51.
- ^Thornton, Rautiu & Brush 2001,hlm. 51–52.
- ^Davidsonet al.2014,hlm. 25.
- ^abcdPrimary Lead Refining.
- ^Pauling 1947.
- ^Davidsonet al.2014,hlm. 23.
- ^Thornton, Rautiu & Brush 2001,hlm. 52–53.
- ^United States Environmental Protection Agency 2010,hlm. 1.
- ^abThornton, Rautiu & Brush 2001,hlm. 57.
- ^Baird & Cann 2012,hlm. 537–38, 543–47.
- ^abCalifornia Department of Fish and Wildlife.
- ^Parker 2005,hlm. 194–95.
- ^Krestovnikoff & Halls 2006,hlm. 70.
- ^Street & Alexander 1998,hlm. 182.
- ^Jensen 2013,hlm. 136.
- ^Think Lead research.
- ^Weatherings to Parapets.
- ^Lead garden ornaments 2016.
- ^Putnam 2003,hlm. 216.
- ^abCopper Development Association.
- ^abRich 1994,hlm. 101.
- ^Guruswamy 2000,hlm. 31.
- ^Audsley 1965,hlm. 250–51.
- ^Palmieri 2006,hlm. 412–13.
- ^National Council on Radiation Protection and Measurements 2004,hlm. 16.
- ^Thornton, Rautiu & Brush 2001,hlm. 7.
- ^Tuček, Carlsson & Wider 2006,hlm. 1590.
- ^abProgressive Dynamics, Inc.
- ^Olinsky-Paul 2013.
- ^Gulbinska 2014.
- ^Rich 1994,hlm. 133–34.
- ^Zhao 2008,hlm. 440.
- ^Beineret al.2015.
- ^Szczepanowska 2013,hlm. 84–85.
- ^Burleson 2001,hlm. 23.
- ^Ismawatiet al.2013,hlm. 2.
- ^Insight Explorer & IPEN 2016.
- ^Singh 2017.
- ^Zweifel 2009,hlm. 438.
- ^Wilkeset al.2005,hlm. 106.
- ^Randerson 2002.
- ^Nriagu & Kim 2000,hlm. 37–41.
- ^Amstock 1997,hlm. 116–19.
- ^Rogalski 2010,hlm. 485–541.
- ^Emsley 2011,hlm. 280.
- ^World Health Organization 2000,hlm. 149–53.
- ^Gottessfeld 2016,hlm. 3.
- ^Gottessfeld 2016,hlm. 4.
- ^Emsley 2011,hlm. 280, 621, 255.
- ^abLuckey & Venugopal 1979,hlm. 177–78.
- ^Toxic Substances Portal.
- ^United States Food and Drug Administration 2015,hlm. 42.
- ^National Institute for Occupational Safety and Health.
- ^abOccupational Safety and Health Administration.
- ^abRudolphet al.2003,hlm. 369.
- ^Dart, Hurlbut & Boyer-Hassen 2004,hlm. 1426.
- ^Kosnett 2006,hlm. 238.
- ^Cohen, Trotzky & Pincus 1981,hlm. 904–06.
- ^Sokol 2005,hlm. 133, passim.
- ^Mycyk, Hryhorczuk & Amitai 2005,hlm. 462.
- ^Liuet al.2015,hlm. 1869–74.
- ^Schoeterset al.2008,hlm. 168–75.
- ^Casciani 2014.
- ^Tarragó 2012,hlm. 16.
- ^Toxicological Profile for Lead 2007,hlm. 4.
- ^Bremner 2002,hlm. 101.
- ^Agency for Toxic Substances and Disease Registry.
- ^Thornton, Rautiu & Brush 2001,hlm. 17.
- ^Moore 1977,hlm. 109–15.
- ^Wiberg, Wiberg & Holleman 2001,hlm. 914.
- ^Tarragó 2012,hlm. 11.
- ^Centers for Disease Control and Prevention 2015.
- ^Wani, Ara & Usman 2015,hlm. 57, 58.
- ^Prasad 2010,hlm. 651–52.
- ^Masters, Trevor & Katzung 2008,hlm. 481–83.
- ^United Nations Environment Programme 2010,hlm. 4.
- ^United Nations Environment Programme 2010,hlm. 61.
- ^abTrace element emission 2012.
- ^United Nations Environment Programme 2010,hlm. 6.
- ^Assiet al.2016.
- ^World Health Organization 1995.
- ^UK Marine SACs Project 1999.
- ^United Nations Environment Programme 2010,hlm. 9.
- ^McCoy 2017.
- ^Cama 2017.
- ^Layton 2017.
- ^Hauser 2017,hlm. 49–60.
- ^Aueret al.2016,hlm. 4.
- ^Petzel, Juuti & Sugimoto 2004,hlm. 122–124.
- ^Agency for Toxic Substances and Disease Registry 2017.
- ^Grandjean 1978,hlm. 303–21.
- ^Levinet al.2008,hlm. 1288.
- ^abDuda 1996,hlm. 242.
- ^Marinoet al.1990,hlm. 1183–85.
- ^Schoch 1996,hlm. 111.
- ^abcInsight Explorer & IPEN 2016,hlm. 2.
- ^Insight Explorer & IPEN 2016,hlm. 1.
- ^Insight Explorer & IPEN 2016,hlm. 1–2.
- ^abFreeman 2012,hlm. a20–a21.
- ^Acton 2013,hlm. 94–95.
- ^Parket al.2011,hlm. 162–74.
- ^Young 2012.
Daftar pustaka
- Acton, Q. A., ed. (2013).Issues in Global Environment—Pollution and Waste Management: 2012 Edition.ScholarlyEditions.ISBN978-1-4816-4665-9.
- Agency for Toxic Substances and Disease Registry."Information for the Community: Lead Toxicity"(MP4 webcast, 82 MB).Diakses tanggal11 Februari2017.
- Agency for Toxic Substances and Disease Registry(2017)."Lead Toxicity. What Are U.S. Standards for Lead Levels?".Diakses tanggal12 Juni2018.
- Alsfasser, R. (2007).Moderne anorganische Chemie[Kimia anorganik modern] (dalam bahasa Jerman). Walter de Gruyter.ISBN978-3-11-019060-1.
- American Geophysical Union(2017)."Human Activity Has Polluted European Air for 2000 Years".Eos Science News. Diarsipkan dariversi aslitanggal 2017-06-27.Diakses tanggal2018-12-23.
- Amstock, J. S. (1997).Handbook of Glass in Construction.McGraw-Hill Professional.ISBN978-0-07-001619-4.
- Anderson, J. (1869)."Malleability and ductility of metals".Scientific American.21(22): 341–43.doi:10.1038/scientificamerican11271869-341.
- Ashikari, M. (2003)."The memory of the women's white faces: Japaneseness and the ideal image of women".Japan Forum.15(1): 55–79.doi:10.1080/0955580032000077739.
- Assi, M. A.; Hezmee, M. N. M.; Haron, A. W.; et al. (2016)."The detrimental effects of lead on human and animal health".Veterinary World.9(6): 660–671.doi:10.14202/vetworld.2016.660-671.ISSN0972-8988.PMC4937060
 .PMID27397992.
.PMID27397992. - Audsley, G. A.(1965).The Art of Organ Building.2.Courier.ISBN978-0-486-21315-6.
- Auer, Charles M.; Kover, Frank D.; Aidala, James V.; Greenwood, Mark (1 Maret 2016).Toxic Substances: A Half Century of Progress(PDF)(Laporan). EPA Alumni Association.Diakses tanggal1 Januari2019.
- Baird, C.; Cann, N. (2012).Environmental Chemistry(edisi ke-5). W. H. Freeman and Company.ISBN978-1-4292-7704-4.
- Becker, M.; Förster, C.; Franzen, C.; et al. (2008). "Persistent radicals of trivalent tin and lead".Inorganic Chemistry.47(21): 9965–78.doi:10.1021/ic801198p.PMID18823115.
- Beeman, J. W.; Bellini, F.; Cardani, L.; et al. (2013). "New experimental limits on theadecays of lead isotopes ".European Physical Journal A.49(50): 50.arXiv:1212.2422
 .Bibcode:2013EPJA...49...50B.doi:10.1140/epja/i2013-13050-7.
.Bibcode:2013EPJA...49...50B.doi:10.1140/epja/i2013-13050-7. - Beiner, G. G.; Lavi, M.; Seri, H.; et al. (2015). "Oddy Tests: Adding the Analytical Dimension".Collection Forum.29(1–2): 22–36.doi:10.14351/0831-4985-29.1.22.ISSN0831-4985.
- Bharara, M. S.; Atwood, D. A. (2006). "Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in theEncyclopedia of Inorganic Chemistry, First Edition".Lead: Inorganic Chemistry.doi:10.1002/0470862106.ia118.ISBN978-0470860786.
- Bisel, S. C.;Bisel, J. F. (2002)."Health and nutrition at Herculaneum".Dalam Jashemski, W. F.; Meyer, F. G.The Natural History of Pompeii.Cambridge University Press.hlm. 451–75.ISBN978-0-521-80054-9.
- Bisson, M. S.; Vogel, J. O. (2000).Ancient African Metallurgy: The Sociocultural Context.Rowman & Littlefield.ISBN978-0-7425-0261-1.
- Blakemore, J. S. (1985).Solid State Physics.Cambridge University Press.ISBN978-0-521-31391-9.
- Burleson, M. (2001).The Ceramic Glaze Handbook: Materials, Techniques, Formulas.New York, NY:Sterling.ISBN9781579904395.
- Bremner, H. A. (2002).Safety and Quality Issues in Fish Processing.Elsevier.ISBN978-1-85573-678-8.
- Brenner, G. A. (2003).Webster's New World American Idioms Handbook.John Wiley & Sons.ISBN978-0-7645-2477-6.
- Brescia, F. (2012).Fundamentals of Chemistry: A Modern Introduction.Elsevier.ISBN978-0-323-14231-1.
- Bretherick, L. (2016).Bretherick's Handbook of Reactive Chemical Hazards.Elsevier.ISBN978-1-4831-6250-8.
- Bunker, B. C.; Casey, W. H. (2016).The Aqueous Chemistry of Oxides.Oxford University Press.ISBN978-0-19-938425-9.
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. (1957)."Synthesis of the Elements in Stars"(PDF).Reviews of Modern Physics.29(4): 547–654.Bibcode:1957RvMP...29..547B.doi:10.1103/RevModPhys.29.547.Diarsipkan dariversi asli(PDF)tanggal 2016-06-24.Diakses tanggal2018-12-23.
- California Department of Fish and Wildlife."Nonlead Ammunition in California".www.wildlife.ca.gov.Diakses tanggal17 Mei2017.
- de Callataÿ, F. (2005). "The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks".Journal of Roman Archaeology.18:361–72.doi:10.1017/S104775940000742X.
- Cama, T. (2017)."Interior secretary repeals ban on lead bullets".The Hill.Diakses tanggal30 Mei2018.
- Cangelosi, V. M.; Pecoraro, V. L. (2015)."Lead".Dalam Roduner, E.Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles.Royal Society of Chemistry. hlm. 843–875.ISBN978-1-78262-494-3.
- Casciani, D. (2014)."Did removing lead from petrol spark a decline in crime?".BBC News.Diakses tanggal30 January2017.
- Ceccarelli, P. (2013).Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC).OUP Oxford.ISBN978-0-19-967559-3.
- Centers for Disease Control and Prevention(1997). "Update: blood lead levels--United States, 1991-1994".Morbidity and Mortality Weekly Report.46(7): 141–146.ISSN0149-2195.PMID9072671.
- Centers for Disease Control and Prevention (2015)."Radiation and Your Health".Diakses tanggal28 Februari2017.
- Christensen, N. E. (2002)."Relativistic Solid State Theory".Dalam Schwerdtfeger, P.Relativistic Electronic Structure Theory — Fundamentals.Theoretical and Computational Chemistry.11.Elsevier. hlm. 867–68.doi:10.1016/s1380-7323(02)80041-3.ISBN978-0-08-054046-7.
- Cohen, A. R.; Trotzky, M. S.; Pincus, D. (1981)."Reassessment of the Microcytic Anemia of Lead Poisoning".Pediatrics.67(6): 904–906.PMID7232054.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials; Commission on Life Sciences; Division on Earth and Life Studies; National Research Council (1999).Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials.National Academies Press. hlm. 26, 30–32.ISBN978-0-309-58070-0.
- Considine, D. M.; Considine, G. D. (2013).Van Nostrand's Scientific Encyclopedia.Springer Science & Business Media.ISBN978-1-4757-6918-0.
- Copper Development Association."Leaded Coppers".copper.org.Diakses tanggal10 Juli2016.
- Cotnoir, B. (2006).The Weiser Concise Guide to Alchemy.Weiser Books.ISBN978-1-57863-379-1.
- Cox, P. A. (1997).The Elements: Their Origin, Abundance and Distribution.Oxford University Press.ISBN978-0-19-855298-7.
- Crow, J. M. (2007)."Why use lead in paint?".Chemistry World.Royal Society of Chemistry.Diakses tanggal22 Februari2017.
- Dart, R. C.; Hurlbut, K. M.; Boyer-Hassen, L. V. (2004). "Lead". Dalam Dart, R. C.Medical Toxicology(edisi ke-3).Lippincott Williams & Wilkins.hlm.1426.ISBN978-0-7817-2845-4.
- Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). "Lead".Ullmann's Encyclopedia of Industrial Chemistry.doi:10.1002/14356007.a15_193.pub3.ISBN978-3-527-30673-2.
- Delile, H.; Blichert-Toft, J.; Goiran, J.-P.; et al. (2014)."Lead in ancient Rome's city waters".Proceedings of the National Academy of Sciences.111(18): 6594–99.Bibcode:2014PNAS..111.6594D.doi:10.1073/pnas.1400097111.ISSN0027-8424.PMC4020092
 .PMID24753588.
.PMID24753588. - Deltares;Netherlands Organisation for Applied Scientific Research(2016).Lood en zinkemissies door jacht[Emisi timbal dan seng dari berburu](PDF)(Laporan) (dalam bahasa Belanda). Diarsipkan dariversi asli(PDF)tanggal 2019-04-12.Diakses tanggal18 Februari2017.
- Dieter, R. K.; Watson, R. T. (2009)."Transmetalation reactions producing organocopper compounds".Dalam Rappoport, Z.; Marek, I.The Chemistry of Organocopper Compounds.1.John Wiley & Sons. hlm. 443–526.ISBN978-0-470-77296-6.
- Donnelly, J. (2014).Deep Blue.Hachette Children's Group.ISBN978-1-4449-2119-9.
- Downs, A. J.; Adams, C. J. (2017).The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry.Elsevier.ISBN978-1-4831-5832-7.
- Duda, M. B. (1996).Traditional Chinese Toggles: Counterweights and Charms.Editions Didier Millet.ISBN978-981-4260-61-9.
- Ede, A.; Cormack, L. B. (2016).A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition.University of Toronto Press.ISBN978-1-4426-3503-6.
- Emsley, J.(2011).Nature's Building Blocks: An A-Z Guide to the Elements.Oxford University Press.ISBN978-0-19-960563-7.
- "Encyclopedia Judaica: Ossuaries and Sarcophagi".www.jewishvirtuallibrary.org.Diakses tanggal14 Juli2018.
- Eschnauer, H. R.; Stoeppler, M. (1992). "Wine—An enological specimen bank". Dalam Stoeppler, M.Hazardous Materials in the Environment.Elsevier Science. hlm.49–72 (58).doi:10.1016/s0167-9244(08)70103-3.ISBN978-0-444-89078-8.
- Evans, J. W.(1908). "V.— The meanings and synonyms of plumbago".Transactions of the Philological Society.26(2): 133–79.doi:10.1111/j.1467-968X.1908.tb00513.x.
- Finger, S. (2006).Doctor Franklin's Medicine.University of Pennsylvania Press.ISBN978-0-8122-3913-3.
- Fiorini, E. (2010)."2.000 years-old Roman Lead for physics"(PDF).ASPERA:7–8. Diarsipkan dariversi asli(PDF)tanggal 2018-04-26.Diakses tanggal29 Oktober2016.
- Frankenburg, F. R. (2014).Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History.ABC-CLIO.ISBN978-1-4408-2932-1.
- Frebel, A.(2015).Searching for the Oldest Stars: Ancient Relics from the Early Universe.Princeton University.ISBN978-0-691-16506-6.
- Freeman, K. S. (2012)."Remediating soil lead with fishbones".Environmental Health Perspectives.120(1): a20–a21.doi:10.1289/ehp.120-a20a.PMC3261960
 .PMID22214821.
.PMID22214821. - Funke, K. (2013)."Solid State Ionics: from Michael Faraday to green energy—the European dimension".Science and Technology of Advanced Materials.14(4): 1–50.Bibcode:2013STAdM..14d3502F.doi:10.1088/1468-6996/14/4/043502.PMC5090311
 .PMID27877585.
.PMID27877585. - Gale, W. F.; Totemeier, T. C. (2003).Smithells Metals Reference Book.Butterworth-Heinemann.ISBN978-0-08-048096-1.
- Gilfillan, S. C. (1965). "Lead poisoning and the fall of Rome".Journal of Occupational Medicine.7(2): 53–60.ISSN0096-1736.PMID14261844.
- Gill, T.; Libraries Board of South Australia (1974).The history and topography of Glen Osmond, with map and illustrations.Libraries Board of South Australia.
- Gottessfeld, Perry (2016).The Environmental And Health Impacts Of Lead Battery Recycling(PDF)(Laporan). Occupational Knowledge International.
- Graedel, T. E.; et al. (2010).Metal stocks in Society – Scientific Synthesis(PDF)(Laporan). International Resource Panel. hlm. 17.ISBN978-92-807-3082-1.Diarsipkan dariversi asli(PDF)tanggal 2021-02-24.Diakses tanggal18 April2017.
- Grandjean, P.(1978). "Widening perspectives of lead toxicity".Environmental Research.17(2): 303–21.Bibcode:1978ER.....17..303G.doi:10.1016/0013-9351(78)90033-6.PMID400972.
- Greenwood, N. N.;Earnshaw, A. (1998).Chemistry of the Elements(edisi ke-2). Butterworth-Heinemann.ISBN978-0-7506-3365-9.
- Grout, J. (2017)."Lead poisoning and Rome".Encyclopaedia Romana.Diakses tanggal15 Februari2017.
- Guberman, D. E. (2016). "Lead".2014 Minerals Yearbook(PDF)(Laporan).United States Geological Survey.Diakses tanggal8 Mei2017.
- Gulbinska, M. K. (2014).Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective.Springer.hlm. 96.ISBN978-1-4471-6548-4.
- Guruswamy, S. (2000).Engineering properties and applications of lead alloys.Marcel Dekker.ISBN978-0-8247-8247-4.
- Hadlington, T. J. (2017).On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes.Springer.ISBN978-3-319-51807-7.
- Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. (2015).Hamilton and Hardy's Industrial Toxicology.John Wiley & Sons.ISBN978-0-470-92973-5.
- Hauser, P. C. (2017). "Analytical Methods for the Determination of Lead in the Environment". Dalam Astrid, S.; Helmut, S.; Sigel, R. K. O.Lead: Its Effects on Environment and Health.Metal Ions in Life Sciences.17.de Gruyter.doi:10.1515/9783110434330-003.ISBN9783110434330.PMID28731296.
- Hernberg, S. (2000)."Lead Poisoning in a Historical Perspective"(PDF).American Journal of Industrial Medicine.38(3): 244–54.doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F.PMID10940962.Diarsipkan dariversi asli(PDF)tanggal 2013-04-13.Diakses tanggal1 Maret2017.
- "A History of Cosmetics from Ancient Times".Cosmetics Info.Diarsipkan dariversi aslitanggal 2018-12-29.Diakses tanggal18 Juli2016.
- Hodge, T. A. (1981)."Vitruvius, lead pipes and lead poisoning".American Journal of Archaeology.85(4): 486–91.doi:10.2307/504874.JSTOR504874.
- Hong, S.; Candelone, J.-P.; Patterson, C. C.; et al. (1994)."Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations"(PDF).Science.265(5180): 1841–43.Bibcode:1994Sci...265.1841H.doi:10.1126/science.265.5180.1841.PMID17797222.
- Hunt, A. (2014).Dictionary of Chemistry.Routledge.ISBN978-1-135-94178-9.
- IAEA - Nuclear Data Section (2017)."Livechart - Table of Nuclides - Nuclear structure and decay data".www-nds.iaea.org.International Atomic Energy Agency.Diakses tanggal31 Maret2017.
- Insight Explorer; IPEN (2016).New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves(PDF)(Laporan).Diakses tanggal3 Mei2018.
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Clark; Weinberg, Jack; Denney, Valerie (2013).Timbal dalam Cat Enamel Rumah Tangga di Indonesia(PDF)(Laporan). BaliFokus & IPEN.Diakses tanggal26 Desember2018.
- Jensen, C. F. (2013).Online Location of Faults on AC Cables in Underground Transmission.Springer.ISBN978-3-319-05397-4.
- Jones, P. A. (2014).Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions.Constable.ISBN978-1-47211-389-4.
- Kamus Besar Bahasa Indonesia Daring.Jakarta:Badan Pengembangan dan Pembinaan Bahasa.2016.
- Kaupp, M. (2014)."Chemical bonding of main-group elements"(PDF).Dalam Frenking, G.; Shaik, S.The Chemical Bond: Chemical Bonding Across the Periodic Table.John Wiley & Sons. hlm. 1–24.doi:10.1002/9783527664658.ch1.ISBN9783527664658.
- Kellett, C. (2012).Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes.Accent Press.ISBN978-1-909335-05-9.[pranala nonaktif permanen]
- King, R. B. (1995).Inorganic Chemistry of Main Group Elements.VCH Publishers.ISBN978-1-56081-679-9.
- Konu, J.; Chivers, T. (2011)."Stable Radicals of the Heavy p-Block Elements".Dalam Hicks, R. G.Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds.John Wiley & Sons.doi:10.1002/9780470666975.ch10.ISBN978-0-470-77083-2.
- Kosnett, M. J. (2006). "Lead". Dalam Olson, K. R.Poisoning and Drug Overdose(edisi ke-5).McGraw-Hill Professional.hlm. 238.ISBN978-0-07-144333-3.
- Krestovnikoff, M.; Halls, M. (2006).Scuba Diving.Dorling Kindersley.ISBN978-0-7566-4063-7.
- Kroonen, G. (2013).Etymological Dictionary of Proto-Germanic.Leiden Indo-European Etymological Dictionary Series.11.Brill.ISBN978-90-04-18340-7.
- Langmuir, C. H.; Broecker, W. S. (2012).How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind.Princeton University Press.ISBN978-0-691-14006-3.
- Lauwerys, R. R.; Hoet, P. (2001).Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition.CRC Press.ISBN978-1-4822-9383-8.
- Layton, M. (2017)."Lead faces threat of new Euro ban".shootinguk.co.uk.Diakses tanggal30 Mei2018.
- "Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI" Catch!"".The British Museum.Diarsipkan dariversi aslitanggal 2012-02-14.Diakses tanggal30 April2012.
- "Lead garden ornaments".H. Crowther Ltd.2016.Diakses tanggal20 Februari2017.
- "Lead in Waste Disposal".United States Environmental Protection Agency.2016.Diakses tanggal28 Februari2017.
- "Lead mining".The Northern Echo.Diakses tanggal16 Februari2016.
- Levin, H. L. (2009).The Earth Through Time.John Wiley & Sons.ISBN978-0-470-38774-0.
- Levin, R.; Brown, M. J.; Kashtock, M. E.; et al. (2008)."Lead exposures in U.S. children, 2008: Implications for prevention".Environmental Health Perspectives.116(10): 1285–93.doi:10.1289/ehp.11241.PMC2569084
 .PMID18941567.
.PMID18941567. - Lewis, J. (1985)."Lead Poisoning: A Historical Perspective".EPA Journal.11(4): 15–18.Diakses tanggal31 January2017.
- Lide, D. R., ed. (2005).CRC Handbook of Chemistry and Physics(edisi ke-85).CRC Press.ISBN978-0-8493-0484-2.
- Liu, J.; Liu, X.; Pak, V.; et al. (2015)."Early blood lead levels and sleep disturbance in preadolescence".Sleep.38(12): 1869–74.doi:10.5665/sleep.5230.PMC4667382
 .PMID26194570.
.PMID26194570. - Lochner, J. C.; Rohrbach, G.; Cochrane, K. (2005)."What is Your Cosmic Connection to the Elements?"(PDF).Goddard Space Flight Center.Diarsipkan dariversi asli(PDF)tanggal 29 Desember 2016.Diakses tanggal2 Juli2017.
- Lodders, K. (2003)."Solar System abundances and condensation temperatures of the elements"(PDF).The Astrophysical Journal.591(2): 1220–47.Bibcode:2003ApJ...591.1220L.doi:10.1086/375492.ISSN0004-637X.
- Luckey, T. D.; Venugopal, B. (1979).Physiologic and Chemical Basis for Metal Toxicity.Plenum Press.ISBN978-1-4684-2952-7.
- Macintyre, J. E. (1992).Dictionary of Inorganic Compounds.CRC Press.ISBN978-0-412-30120-9.
- Marcillac, P. de; Coron, N.; Dambier, G.; et al. (2003). "Experimental detection of?-particles from the radioactive decay of natural bismuth".Nature.422(6934): 876–78.Bibcode:2003Natur.422..876D.doi:10.1038/nature01541.PMID12712201.
- Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. (1990)."A case report of lead paint poisoning during renovation of a Victorian farmhouse".American Journal of Public Health.80(10): 1183–85.doi:10.2105/AJPH.80.10.1183.PMC1404824
 .PMID2119148.
.PMID2119148. - Markowitz, G.;Rosner, D. (2000).""Cater to the children ": the role of the lead industry in a public health tragedy, 1900–55".American Journal of Public Health.90(1): 36–46.doi:10.2105/ajph.90.1.36.PMC1446124
 .PMID10630135.
.PMID10630135. - Masters, S. B.; Trevor, A. J.; Katzung, B. G. (2008).Katzung & Trevor's Pharmacology: Examination & Board Review(edisi ke-8).McGraw-Hill Medical.ISBN978-0-07-148869-3.
- McCoy, S. (2017)."The End of Lead? Federal Gov't Order Bans Sinkers, Ammo".GearJunkie.Diarsipkan dariversi aslitanggal 2020-03-08.Diakses tanggal30 Mei2018.
- Meija, J.; Coplen, T. B.; Berglund, M.; et al. (2016)."Atomic weights of the elements 2013 (IUPAC Technical Report)".Pure and Applied Chemistry.88(3): 265–291.doi:10.1515/pac-2015-0305.
- Merriam-Webster."Definition of LEAD".www.merriam-webster.com.Diakses tanggal12 Agustus2016.
- Moore, M. R. (1977). "Lead in drinking water in soft water areas—health hazards".Science of the Total Environment.7(2): 109–15.Bibcode:1977ScTEn...7..109M.doi:10.1016/0048-9697(77)90002-X.PMID841299.
- More, A. F.; Spaulding, N. E.; Bohleber, P.; et al. (2017). "Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death".GeoHealth.1(4): 211–219.doi:10.1002/2017GH000064.ISSN2471-1403.
- Mosseri, S.; Henglein, A.; Janata, E. (1990). "Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species".Journal of Physical Chemistry.94(6): 2722–26.doi:10.1021/j100369a089.
- Mycyk, M.; Hryhorczuk, D.; Amitai, Y.; et al. (2005). "Lead". Dalam Erickson, T. B.; Ahrens, W. R.; Aks, S.Pediatric Toxicology: Diagnosis and Management of the Poisoned Child.McGraw-Hill Professional.ISBN978-0-07-141736-5.
- Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. (1998). "Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period".Journal of Occupational Health.40(1): 55–60.doi:10.1539/joh.40.55.
- National Council on Radiation Protection and Measurements(2004).Structural Shielding Design for Medical X-ray Imaging Facilities.ISBN978-0-929600-83-3.
- National Institute for Occupational Safety and Health."NIOSH Pocket Guide to Chemical Hazards — Lead".www.cdc.gov.Diakses tanggal18 November2016.
- Navas-Acien, A. (2007)."Lead Exposure and Cardiovascular Disease—A Systematic Review".Environmental Health Perspectives.115(3): 472–482.doi:10.1289/ehp.9785.PMC1849948
 .PMID17431501.
.PMID17431501. - Nikolayev, S., ed. (2012). "*lAudh-".Indo-European Etymology.starling.rinet.ru.Diakses tanggal21 Agustus2016.
- Norman, N. C. (1996).Periodicity and the s- and p-Block Elements.Oxford University Press.ISBN978-0-19-855961-0.
- Nriagu, J. O. (1983). "Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?".The New England Journal of Medicine.308(11): 660–63.doi:10.1056/NEJM198303173081123.PMID6338384.
- Nriagu, J. O.; Kim, M-J. (2000). "Emissions of lead and zinc from candles with metal-core wicks".Science of the Total Environment.250(1–3): 37–41.Bibcode:2000ScTEn.250...37N.doi:10.1016/S0048-9697(00)00359-4.PMID10811249.
- Occupational Safety and Health Administration."Substance data sheet for occupational exposure to lead".www.osha.gov.Diarsipkan dariversi aslitanggal 16 Maret 2018.Diakses tanggal1 Juli2017.
- Olinsky-Paul, T. (2013)."East Penn and Ecoult battery installation case study webinar"(PDF).Clean Energy States Alliance.Diakses tanggal28 Februari2017.
- Palmieri, R., ed. (2006).The Organ.Psychology Press.ISBN978-0-415-94174-7.
- "surma".Oxford English Dictionary(edisi ke-2). Oxford University Press. 2009.
- Park, J. H.; Bolan, N.; Meghara, M.; et al. (2011)."Bacterial-assisted immobilization of lead in soils: Implications for remediation"(PDF).Pedologist:162–74. Diarsipkan dariversi asli(PDF)tanggal 26 November 2015.
- Parker, R. B. (2005).The New Cold-Molded Boatbuilding: From Lofting to Launching.WoodenBoat Books.ISBN978-0-937822-89-0.
- Parthé, E. (1964).Crystal Chemistry of Tetrahedral Structures.CRC Press.ISBN978-0-677-00700-7.
- Pauling, L.(1947).General Chemistry.W. H. Freeman and Company.ISBN978-0-486-65622-9.
- Peneva, S. K.; Jjuieva, K. D.; Tsukeva, E. A. (1981). "RHEED study of the initial stages of crystallization and oxidation of lead and tin".Journal of Crystal Growth.53(2): 382–396.Bibcode:1981JCrGr..53..382P.doi:10.1016/0022-0248(81)90088-9.ISSN0022-0248.
- Petzel, S.; Juuti, M.; Sugimoto, Yu. (2004)."Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue".Dalam Puttlitz, K. J.; Stalter, K. A.Handbook of Lead-Free Solder Technology for Microelectronic Assemblies.CRC Press.ISBN978-0-8247-5249-1.
- Polyanskiy, N. G. (1986). Fillipova, N. A, ed.Аналитическая химия элементов: Свинец[Kimia Analisis Unsur-Unsur: Timbal] (dalam bahasa Rusia).Nauka.
- Prasad, P. J. (2010).Conceptual Pharmacology.Universities Press.ISBN978-81-7371-679-9.Diakses tanggal21 Juni2012.
- "Primary Lead Refining Technical Notes".LDA International. Diarsipkan dariversi aslitanggal 22 Maret 2007.Diakses tanggal7 April2007.
- Progressive Dynamics, Inc."How Lead Acid Batteries Work: Battery Basics".progressivedyn.com.Diakses tanggal3 Juli2016.
- Putnam, B. (2003).The Sculptor's Way: A Guide to Modelling and Sculpture.Dover Publications.ISBN978-0-486-42313-5.
- Pyykkö, P.(1988). "Relativistic effects in structural chemistry".Chemical Reviews.88(3): 563–94.doi:10.1021/cr00085a006.
- Rabinowitz, M. B. (1995)."Imputing lead sources from blood lead isotope ratios".Dalam Beard, M. E.; Allen Iske, S. D.Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance.ASTM. hlm. 63–75.doi:10.1520/stp12967s.ISBN978-0-8031-1884-3.
- "Radioactive Decay Series"(PDF).Nuclear Systematics.MIT OpenCourseWare.2012.Diakses tanggal28 April2018.
- Ramage, C. K., ed. (1980).Lyman Cast Bullet Handbook(edisi ke-3). Lyman Products Corporation.
- Randerson, J. (2002)."Candle pollution".New Scientist(2348).Diakses tanggal7 April2007.
- Reddy, A.; Braun, C. L. (2010)."Lead and the Romans".Journal of Chemical Education.87(10): 1052–55.Bibcode:2010JChEd..87.1052R.doi:10.1021/ed100631y.
- Retief, F.; Cilliers, L. P. (2006). "Lead poisoning in ancient Rome".Acta Theologica.26(2): 147–64 (149–51).doi:10.4314/actat.v26i2.52570.
- Rich, V. (1994).The International Lead Trade.Woodhead Publishing.ISBN978-0-85709-994-5.
- Rieuwerts, J. (2015).The Elements of Environmental Pollution.Routledge.ISBN978-0-415-85919-6.
- Riva, M. A.; Lafranconi, A.; d'Orso, M. I.; et al. (2012)."Lead poisoning: Historical aspects of a paradigmatic" occupational and environmental disease"".Safety and Health at Work.3(1): 11–16.doi:10.5491/SHAW.2012.3.1.11.PMC3430923
 .PMID22953225.
.PMID22953225. - Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. (2009). "The end of nucleosynthesis: Production of lead and thorium in the early galaxy".The Astrophysical Journal.698(2): 1963–80.arXiv:0904.3105
 .Bibcode:2009ApJ...698.1963R.doi:10.1088/0004-637X/698/2/1963.
.Bibcode:2009ApJ...698.1963R.doi:10.1088/0004-637X/698/2/1963. - Rogalski, A. (2010).Infrared Detectors(edisi ke-2). CRC Press.ISBN978-1-4200-7671-4.Diakses tanggal19 November2016.
- Röhr, C. (2017)."Binare Zintl-Phasen"[Binary Zintl Phases].Intermetallische Phasen[Fase intermetalik] (dalam bahasa Jerman).Universitat Freiburg.Diakses tanggal18 Februari2017.
- Rudolph, A. M.; Rudolph, C. D.; Hostetter, M. K.; et al. (2003). "Lead".Rudolph's Pediatrics(edisi ke-21). McGraw-Hill Professional. hlm.369.ISBN978-0-8385-8285-5.
- Samson, G. W. (1885).The divine law as to wines.J. B. Lippincott & Co.
- Scarborough, J. (1984)."The myth of lead poisoning among the Romans: An essay review".Journal of the History of Medicine and Allied Sciences.39(4): 469–475.doi:10.1093/jhmas/39.4.469.PMID6389691.
- Schoch, R. M.(1996).Case Studies in Environmental Science.West Publishing.ISBN978-0-314-20397-7.
- Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. (2008). "Endocrine disruptors and abnormalities of pubertal development".Basic & Clinical Pharmacology & Toxicology.102(2): 168–175.doi:10.1111/j.1742-7843.2007.00180.x.hdl:1854/LU-391408.PMID18226071.
- Sharma, H. R.; Nozawa, K.; Smerdon, J. A.; et al. (2013). "Templated three-dimensional growth of quasicrystalline lead".Nature Communications.4:2715.Bibcode:2013NatCo...4E2715S.doi:10.1038/ncomms3715.PMID24185350.
- Sharma, H. R.; Smerdon, J. A.; Nugent, P. J.; et al. (2014). "Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb".The Journal of Chemical Physics.140(17): 174710.Bibcode:2014JChPh.140q4710S.doi:10.1063/1.4873596.PMID24811658.
- Silverman, M. S. (1966). "High-pressure (70-k) synthesis of new crystalline lead dichalcogenides".Inorganic Chemistry.5(11): 2067–69.doi:10.1021/ic50045a056.
- Singh, P. (2017)."Over 73% of paints found to have excessive lead: Study".Times of India.Diakses tanggal3 Mei2018.
- Sinha, S. P.; Shelly; Sharma, V.; et al. (1993)."Neurotoxic effects of lead exposure among printing press workers".Bulletin of Environmental Contamination and Toxicology.51(4): 490–93.doi:10.1007/BF00192162.
- Slater, J. C. (1964). "Atomic Radii in Crystals".The Journal of Chemical Physics.41(10): 3199–3204.Bibcode:1964JChPh..41.3199S.doi:10.1063/1.1725697.ISSN0021-9606.
- Smirnov, A. Yu.; Borisevich, V. D.; Sulaberidze, A. (2012)."Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials".Theoretical Foundations of Chemical Engineering.46(4): 373–78.doi:10.1134/s0040579512040161.
- Soedowo, Ery (2012). "Persamaan dan perbedaan unsur logam benda-benda perunggu Sumatra bagian Utara dengan benda-benda perunggu Jawa Tengah".Berkala Arkeologi.Yogyakarta: Balai Arkeologi Daerah Istimewa Yogyakarta.32(1).doi:10.30883/jba.v32i2.54.ISSN2548-7132.
- Sokol, R. C. (2005)."Lead exposure and its effects on the reproductive system".Dalam Golub, M. S.Metals, Fertility, and Reproductive Toxicity.CRC Press. hlm. 117–53.doi:10.1201/9781420023282.ch6.ISBN978-0-415-70040-5.
- Stabenow, F.; Saak, W.; Weidenbruch, M. (2003). "Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds".Chemical Communications(18): 2342–2343.doi:10.1039/B305217F.
- Stone, R. (1997). "An Element of Stability".Science.278(5338): 571–572.Bibcode:1997Sci...278..571S.doi:10.1126/science.278.5338.571.
- Street, A.; Alexander, W. (1998).Metals in the Service of Man(edisi ke-11).Penguin Books.ISBN978-0-14-025776-2.
- Szczepanowska, H. M. (2013).Conservation of Cultural Heritage: Key Principles and Approaches.Routledge.ISBN978-0-415-67474-4.
- Takahashi, K.; Boyd, R. N.; Mathews, G. J.; et al. (1987)."Bound-state beta decay of highly ionized atoms"(PDF).Physical Review C.36(4): 1522.Bibcode:1987PhRvC..36.1522T.doi:10.1103/physrevc.36.1522.OCLC1639677.Diarsipkan dariversi asli(PDF)tanggal 21 Oktober 2014.Diakses tanggal27 Agustus2013.
- Tarragó, A. (2012)."Case Studies in Environmental Medicine (CSEM) Lead Toxicity"(PDF).Agency for Toxic Substances and Disease Registry.
- Tétreault, J.; Sirois, J.; Stamatopoulou, E. (1998). "Studies of lead corrosion in acetic acid environments".Studies in Conservation.43(1): 17–32.doi:10.2307/1506633.JSTOR1506633.
- "Think Lead research summary"(PDF).The Lead Sheet Association. Diarsipkan dariversi asli(PDF)tanggal 2017-02-20.Diakses tanggal20 Februari2017.
- Thomson, T.(1830).The History of Chemistry.Henry Colburn and Richard Bentley (publishers).
- Thornton, I.; Rautiu, R.; Brush, S. M. (2001).Lead: The Facts(PDF).International Lead Association.ISBN978-0-9542496-0-1.Diarsipkan dariversi asli(PDF)tanggal 2020-07-26.Diakses tanggal5 Februari2017.
- Thürmer, K.; Williams, E.; Reutt-Robey, J. (2002). "Autocatalytic oxidation of lead crystallite surfaces".Science.297(5589): 2033–35.Bibcode:2002Sci...297.2033T.doi:10.1126/science.297.5589.2033.PMID12242437.
- Tolliday, B. (2014)."Significant growth in lead usage underlines its importance to the global economy".International Lead Association.Diarsipkan dariversi aslitanggal 2018-09-28.Diakses tanggal28 Februari2017.
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead-acid batteries
- "Toronto museum explores history of contraceptives".ABC News.2003.Diakses tanggal13 Februari2016.
- "Toxic Substances Portal – Lead".Agency for Toxic Substances and Disease Registry. Diarsipkan dariversi aslitanggal 6 Juni 2011.
- "Toxicological Profile for Lead"(PDF).Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine.2007. Diarsipkan dariversi asli(PDF)tanggal 2 Juli 2017.
- "Trace element emission from coal".IEA Clean Coal Centre. 2012. Diarsipkan dariversi aslitanggal 2020-03-11.Diakses tanggal1 Maret2017.
- Tucek, K.; Carlsson, J.; Wider, H. (2006)."Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues"(PDF).Nuclear Engineering and Design.236(14–16): 1589–98.doi:10.1016/j.nucengdes.2006.04.019.
- Tungate, M. (2011).Branded Beauty: How Marketing Changed the Way We Look.Kogan Page Publishers.ISBN978-0-7494-6182-9.
- UK Marine SACs Project (1999). "Lead".Water Quality(Laporan).Diakses tanggal10 Juni2018.
- United Nations Environment Programme(2010).Final review of scientific information on lead(PDF).Chemicals Branch, Division of Technology, Industry and Economics.Diakses tanggal31 January2017.
- United States Environmental Protection Agency (2010)."Metallurgical Industry:Secondary Lead Processing".AP 42 Compilation of Air Pollutant Emission Factors(edisi ke-5).Diakses tanggal20 Mei2018.
- United States Environmental Protection Agency (2000)."Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (Agustus 2000)".Diakses tanggal28 Februari2017.
- United States Environmental Protection Agency (2005)."Best Management Practices for Lead at Outdoor Shooting Ranges"(PDF).Diakses tanggal12 Juni2018.
- United States Food and Drug Administration(2015).Q3D Elemental Impurities Guidance for Industry(PDF)(Laporan).United States Department of Health and Human Services.hlm. 41.Diakses tanggal15 Februari2017.
- United States Geological Survey(1973).Geological Survey Professional Paper.United States Government Publishing Office.hlm. 314.
- United States Geological Survey (2005).Lead(PDF)(Laporan).Diakses tanggal20 Februari2016.
- United States Geological Survey (2017)."Lead"(PDF).Mineral Commodities Summaries.Diakses tanggal8 Mei2017.
- University of CaliforniaNuclear Forensic Search Project."Decay Chains".Nuclear Forensics: A Scientific Search Problem.Diakses tanggal23 November2015.
- Vasmer, M.(1986–1987) [1950–1958].Trubachyov, O. N.;Larin, B. O., ed.Этимологический словарь русского языка[Kamus etimologi bahasa Rusia] (dalam bahasa Rusia) (edisi ke-2). Progress.Diakses tanggal4 Maret2017.
- Vogel, N. A.; Achilles, R. (2013).The Preservation and Repair of Historic Stained and Leaded Glass(PDF)(Laporan).United States Department of the Interior.Diakses tanggal30 Oktober2016.
- Waldron, H. A. (1985)."Lead and lead poisoning in antiquity".Medical History.29(1): 107–08.doi:10.1017/S0025727300043878.PMC1139494
 .
. - Wani, A. L.; Ara, A.; Usman, J. A. (2015)."Lead toxicity: A review"(PDF).Interdisciplinary Toxicology.8(2): 55–64.doi:10.1515/intox-2015-0009.PMC4961898
 .PMID27486361.
.PMID27486361. - Weast, R. C.; Astle, M. J.; Beyer, W. H. (1983).CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data.CRC Press.ISBN978-0-8493-0464-4.
- "Weatherings to Parapets and Cornices".The Lead Sheet Association. Diarsipkan dariversi aslitanggal 2018-03-31.Diakses tanggal20 Februari2017.
- Webb, G. A. (2000).Nuclear Magnetic Resonance.Royal Society of Chemistry.ISBN978-0-85404-327-9.
- Webb, G. W.; Marsiglio, F.; Hirsch, J. E. (2015). "Superconductivity in the elements, alloys and simple compounds".Physica C: Superconductivity and its Applications.514:17–27.arXiv:1502.04724
 .Bibcode:2015PhyC..514...17W.doi:10.1016/j.physc.2015.02.037.
.Bibcode:2015PhyC..514...17W.doi:10.1016/j.physc.2015.02.037. - Whitten, K. W.; Gailey, K. D.; David, R. E. (1996).General chemistry with qualitative analysis(edisi ke-3). Saunders College.ISBN978-0-03-012864-6.
- Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001).Inorganic Chemistry.Academic Press.ISBN978-0-12-352651-9.
- Wilkes, C. E.; Summers, J. W.; Daniels, C. A.; et al. (2005).PVC Handbook.Hanser.ISBN978-1-56990-379-7.
- Willey, D. G.(1999)."The physics behind four amazing demonstrations — CSI".Skeptical Inquirer.23(6).Diakses tanggal6 September2016.
- Winder, C. (1993a)."The history of lead — Part 1".LEAD Action News.2(1).ISSN1324-6011.Diarsipkan dariversi aslitanggal 31 Agustus 2007.Diakses tanggal5 Februari2016.
- Winder, C. (1993b)."The history of lead — Part 3".LEAD Action News.2(3).ISSN1324-6011.Diarsipkan dariversi aslitanggal 31 Agustus 2007.Diakses tanggal12 Februari2016.
- Windholz, M. (1976).Merck Index of Chemicals and Drugs(edisi ke-9).Merck & Co.ISBN978-0-911910-26-1.Monograph 8393.
- World Health Organization(1995).Environmental Health Criteria 165: Inorganic Lead(Laporan).Diakses tanggal10 Juni2018.
- World Health Organization (2000)."Lead"(PDF).Air quality guidelines for Europe.Regional Office for Europe. hlm. 149–53.ISBN978-92-890-1358-1.OCLC475274390.
- World Nuclear Association(2015)."Nuclear Radiation and Health Effects".Diarsipkan dariversi aslitanggal 2015-12-24.Diakses tanggal12 November2015.
- Wrackmeyer, B.; Horchler, K. (1990).207Pb-NMR Parameters.Annual Reports on NMR Spectroscopy.22.Academic Press. hlm. 249–303.ISBN978-0-08-058405-8.
- Yong, L.; Hoffmann, S. D.; Fässler, T. F. (2006). "A low-dimensional arrangement of [Pb9]4?clusters in [K(18-crown-6)]2K2Pb9·(en)1.5".Inorganica Chimica Acta.359(15): 4774–78.doi:10.1016/j.ica.2006.04.017.
- Young, S. (2012)."Battling lead contamination, one fish bone at a time".Compass.United States Coast Guard.Diarsipkan dariversi aslitanggal 2013-06-14.Diakses tanggal11 Februari2017.
- Yu, L.; Yu, H. (2004).Chinese Coins: Money in History and Society.Long River Press.ISBN978-1-59265-017-0.
- Zhang, X.; Yang, L.; Li, Y.; et al. (2012). "Impacts of lead/zinc mining and smelting on the environment and human health in China".Environmental Monitoring and Assessment.184(4): 2261–73.doi:10.1007/s10661-011-2115-6.PMID21573711.
- Zhao, F. (2008).Information Technology Entrepreneurship and Innovation.IGI Global. hlm. 440.ISBN978-1-59904-902-1.
- Zuckerman, J. J.; Hagen, A. P. (1989).Inorganic Reactions and Methods, the Formation of Bonds to Halogens.John Wiley & Sons.ISBN978-0-471-18656-4.
- Zweifel, H. (2009).Plastics Additives Handbook.Hanser.ISBN978-3-446-40801-2.
- Zýka, J. (1966)."Analytical study of the basic properties of lead tetraacetate as oxidizing agent".Pure and Applied Chemistry.13(4): 569–81.doi:10.1351/pac196613040569.Diakses tanggal2 Maret2017.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


