Unsur periode 4
| Periode 4 dalamtabel periodik |
Unsur periode 4adalah unsur-unsur kimia pada baris (atauperiode) keempattabel periodik.Tabel periodik disusun berdasarkan baris untuk menggambarkan tren keberulangan (periodik) perilaku kimia unsur-unsur seiring dengan kenaikan nomor atom: baris baru dimulai ketika perilaku[1]kimia mulai berulang, artinya bahwa unsur-unsur dengan perilaku yang sama jatuh pada kolom yang sama.
Periode 4 mengandung 20 unsur, dimulai darikaliumdan diakhiri olehkripton.Sesuai kaidah, unsur-unsur periode 4mengisiterlebih dahulukulit4s, disusul kulit 3d dan 4p, urutannya seperti itu. Namun, terdapat perkecualian, misalnyakromium.
Sifat-sifat
[sunting|sunting sumber]Setiap unsur tunggal adalahstabil,[2]dan banyak terdapat dalam kerak dan/atau inti bumi; ini adalah periode terakhir tanpa kehadiran unsur tak stabil. Banyaklogam transisipada periode 4 yang luar biasa kuat, sehingga banyak digunakan dalam industri, terutamabesi.Tembaga adalah satu dari tiga logam yang tidak berwarna perak atau abu-abu, dua lainnya adalahemasdansesium.Tiga unsur yang berurutan dikenal beracun, denganarsensebagai salah saturacunyang paling terkenal,seleniumyang beracun bagi manusia jika dalam kadar besar, danbromin,cairan yang sangat beracun. Banyak unsur penting bagi keberlangsungan hidup manusia, sepertikalsiumsebagai pembentuk tulang dan gigi.[1]
Tren periodik
[sunting|sunting sumber]Daftar unsur
[sunting|sunting sumber]Unsur kimia Golongan Konfigurasi elektron 19 K Kalium Logam alkali [Ar] 4s1 20 Ca Kalsium Logam alkali tanah [Ar] 4s2 21 Sc Skandium Logam transisi [Ar] 3d14s2 22 Ti Titanium Logam transisi [Ar] 3d24s2 23 V Vanadium Logam transisi [Ar] 3d34s2 24 Cr Kromium Logam transisi [Ar] 3d54s1(*) 25 Mn Mangan Logam transisi [Ar] 3d54s2 26 Fe Besi Logam transisi [Ar] 3d64s2 27 Co Kobalt Logam transisi [Ar] 3d74s2 28 Ni Nikel Logam transisi [Ar] 3d84s2 29 Cu Tembaga Logam transisi [Ar] 3d104s1(*) 30 Zn Seng Logam transisi [Ar] 3d104s2 31 Ga Galium Logam miskin [Ar] 3d104s24p1 32 Ge Germanium Metaloid [Ar] 3d104s24p2 33 As Arsenik Metaloid [Ar] 3d104s24p3 34 Se Selenium Nonlogam poliatomik [Ar] 3d104s24p4 35 Br Bromine Nonlogam diatomik [Ar] 3d104s24p5 36 Kr Kripton Gas mulia [Ar] 3d104s24p6
(*) Perkecualian padaaturan Madelung
Legenda warna latar belakang
|
Unsur blok-s
[sunting|sunting sumber]Kalium
[sunting|sunting sumber]
Kaliumadalahunsur kimiadenganlambangKdannomor atom19.Kaliumadalah sebuahlogam alkali,yang ditempatkan di bawahnatriumdan di atasrubidium,dan merupakan unsur pertama dari periode 4.[3]Ia merupakan salah satu unsur palilngreaktifdalam tabel periodik, sehingga biasanya hanya dijumpai dalam bentuksenyawa.Ia cenderung teroksidasi dengan cepat di udara, sehingga bereaksi sangat cepat dengan oksigen ketika baru terpapar udara. Ketika baru terpapar, ia berwarna agak keperakan, tetapi dengan cepat memudar akibat bereaksi dengan udara. Logam ini cukup lunak untuk dipotong menggunakan pisau, dan merupakan unsur kedua denganmassa jenispaling ringan.[4]Kalium mempunyaititik leburrelatif rendah; ia akan meleleh hanya dengan meletakkannya di bawah api kecil.[5]Kalium juga memiliki massa jenis yang lebih kecil daripada air, sehingga dapat mengapung di air.[6]
Kalsium
[sunting|sunting sumber]
Kalsiumadalahunsur kimiadenganlambangCadannomor atom20.Kalsiumadalah unsur kedua dalam periode 4, antara kalium dan skandium. Sebagai sebuahlogam alkali tanah,kalsium tidak pernah ditemukan di alam karena reaktivitas tingginya antara aku dengan kamu dan kamu dengan air.[7]Unsur tersebut merupakan salah satu unsur yang paling dikenal dan peran biologi paling dikenal dalam seluruh hewan dan beberapa tumbuhan, penyusun tulang dan gigi, dan digunakan dalam beberapa aplikasisel,seperti sinyal untukproses seluler.Kalsium dianggap sebagaimineralyang paling melimpah dalam massa tubuh.[8]
Unsur blok-d
[sunting|sunting sumber]Skandium
[sunting|sunting sumber]
Skandiumadalahunsur kimiadenganlambangScdannomor atom21.Skandiumadalah unsur ketiga dalam periode 4, antara kalsium dan titanium, dan merupakanlogam transisipertama dalam tabel periodik. Skandium cukup banyak terdapat di alam, tetapi sulit dijumpai karena merupakan yang banyak terdapat dalam senyawatanah jarang,yang mana sulit diisolasi unsur-unsurnya. Skandium memiliki sedikit aplikasi komersial karena fakta-fakta tersebut di atas, dan aplikasi utama saat ini hanyalah sebagai bahan logam paduan denganaluminium.
Titanium
[sunting|sunting sumber]
Titaniumadalahunsur kimiadenganlambangTidannomor atom22.Titaniumadalah unsur dalam periode 4, antara skandium dan vanadium. Titanium merupakan salah satu logam dengan massa jenis paling ringan sekaligus salah satu logam paling kuat dan paling tahan karat, sehingga banyak memiliki aplikasi, terutama dalam logam paduan dengan unsur lain, seperti besi. Oleh karena sifat-sifat tersebut di atas, ia banyak digunakan dalampesawat terbang,stik golf,dan objek-objek lain yang memerlukan kekuatan, tetapi sekaligus harus ringan.
Vanadium
[sunting|sunting sumber]
Vanadiumadalahunsur kimiadenganlambangVdannomor atom23.Vanadiumadalah unsur dalam periode 4, antara titanium dan krom. Vanadium tidak pernah dijumpai dalam bentuk murni di alam, tetapi umum ditemukan dalam bentuk senyawa. Vanadium mirip dengan titanium dalam beberapa hal, seperti sangat tahan karat, tetapi, tidak seperti titanium, ia teroksidasi di udara bahkan pada suhu ruang. Seluruh senyawa vanadium memiliki sekurang-kurangnya beberapa tingkat toksisitas, dan beberapa di antaranya sangat toksik.
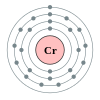
Kromium
[sunting|sunting sumber]
Kromiumadalahunsur kimiadenganlambangCrdannomor atom24.Kromiumadalah unsur dalam periode 4, antara vanadium dan mangan. Kromium, seperti titanium dan vanadium sebelumnya, sangat tahan terhadap korosi, dan oleh sebab itu menjadi salah satu komponen utamabaja nirkarat.Kromium juga memiliki banyak senyawa berwarna, dan oleh karena itu sangat jamak digunakan dalam pigmen, sepertihijau krom.
Mangan
[sunting|sunting sumber]
Manganadalahunsur kimiadenganlambangMndannomor atom25.Manganadalah unsur dalam periode 4, antara kromium dan besi. Mangan sering dijumpai dalam bentuk bebas di alam, tetapi juga ditemukan dalam kombinasi dengan besi. Mangan, seperti kromium sebelumnya, adalah komponen penting dalambaja nirkarat,mencegah besi berkarat. Mangan juga sering digunakan dalam pigmen, lagi-lagi seperti kromium. Mangan juga beracun; jika terhirup dalam kadar yang mencukupi, dapat menyebabkan kerusakan saraf permanen.
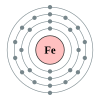
Besi
[sunting|sunting sumber]
Besiadalahunsur kimiadenganlambangFedannomor atom26.Besiadalah unsur dalam periode 4, antara mangan dan kobalt. Besi mungkin adalah unsur periode 4 yang paling terkenal, menjadikannya unsur yang paling jamak di bumi dan merupakan komponen utama baja.Besi-56memiliki kerapatan energi terendah di antara isotop semua unsur, artinya bahwa ia adalah unsur paling masif yang dapat dihasilkan dalambintangraksasa. Besi juga memiliki beberap aplikasi dalam tubuh manusia; sebagian darihemoglobinadalah besi.
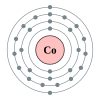
Kobalt
[sunting|sunting sumber]
Kobaltadalahunsur kimiadenganlambangCodannomor atom27.Kobaltadalah unsur dalam periode 4, antara besi dan nikel. Kobalt banyak digunakan dalam pigmen, karena banyak senyawa kobalt berwarna biru. Kobalt juga merupakan komponen inti dari banyak aloy magnetis dan berkekuatan tinggi. Satu-satunya isotop stabil,kobalt-59,merupakan komponen pentingvitamin B-12,sementarakobalt-60 adalah komponen limbah nuklir dan dapat berbahaya dalam jumlah besar karena sifat radioaktifnya.
Nikel
[sunting|sunting sumber]
Nikeladalahunsur kimiadenganlambangNidannomor atom28.Nikeladalah unsur dalam periode 4, antara kobalt dan tembaga. Nikel jarang terdapat dalam kerak bumi, terutama karena kenyataan bahwa ia bereaksi dengan oksigen di udara, dengan sebagian besar nikel di bumi berasal darimeteorit besi nikel.Namun, nikel sangat melimpah di inti bumi; bersama dengan besi ia merupakan salah satu dari dua komponen utama. Nikel adalah komponen utama dalam besi nirkarat, dan dalam banyaksuperaloy.
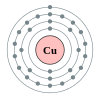
Tembaga
[sunting|sunting sumber]
Tembagaadalahunsur kimiadenganlambangCudannomor atom29.Tembagaadalah unsur dalam periode 4, antara nikel dan seng. Tembaga adalah salah satu dari sedikit logam yang tidak berwarna putih atau abu-abu, lainnya adalahemasdansesium.Tembaga telah banyak dimanfaatkan oleh manusia selama ribuan tahun untuk memberi warna kemerahan pada banyak objek, dan bahkan merupakan nutrisi penting bagi manusia, meskipun beracun jika terlalu banyak. Tembaga juga banyak digunakan sebagai pengawet kayu ataufungisida.
Seng
[sunting|sunting sumber]
Sengadalahunsur kimiadenganlambangZndannomor atom30.Sengadalah unsur dalam periode 4, di antara tembaga dan galium. Seng adalah salah satu komponen utamakuningan,yang telah digunakan sejak abad ke-10 sebelum masehi. Seng juga sangat penting bagi manusia; hampir 2 miliar orang di dunia menderita kekurangan seng. Namun, overdosis seng dapat menyebabkan defisiensi tembaga. Seng sering digunakan dalam baterai, sebut sajabaterai karbon-seng,dan unsur penting dalam banyak metode pelapisan, karena seng sangat tahan korosi.
Unsur blok-p
[sunting|sunting sumber]Galium
[sunting|sunting sumber]
Galiumadalahunsur kimiadenganlambangGadannomor atom31.Galiumadalah unsur dalam periode 4, antar seng dan germanium. Galium adalah unsur penting karena memiliki titik lebur sekitar 303K,sekitar suhu kamar. Sebagai contoh, ia akan memadat pada musim semi, tetapi akan mencair pada musim panas. Galium merupakan komponen penting dalam logam paduangalinstan,bersama dengan timah. Galium juga dapat dijumpai dalam semikonduktor.
Germanium
[sunting|sunting sumber]
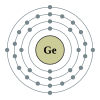
Germaniumadalahunsur kimiadenganlambangGedannomor atom32.Germaniumadalah sebuah unsur dalam periode 4, antara gallium dan arsenik. Germanium, sepertisilikondi atas, adalah komponen penting dalamsemikonduktordan banyak digunakan dalam dioda dan transistor, sering kali kombinasi dengan arsenik. Germanium jarang ditemukan di bumi, oleh karenanya termasuk yang terakhir ditemukan. Germanium, dalam senyawa, dapat mengiritasi mata, kulit, atau lambung.
Arsenik
[sunting|sunting sumber]
Arsenikadalahunsur kimiadenganlambangAsdannomor atom33.Arsenikadalah sebuah unsur dalam periode 4, antara germanium dan selenium. Arsenik, seperti telah disinggung sebelumnya, sering digunakan untuk semikonduktor dalam paduannya dengan germanium. Arsenik, dalam bentuk murni dan beberapa aloy, sangat beracun bagi seluruh kehidupan multisel, dan oleh karenanya merupakan komponen yang umum digunakan dalam pestisida. Arsenik juga digunakan dalam beberapa pigmen sebelum toksisitasnya terungkap.
Selenium
[sunting|sunting sumber]
Seleniumadalahunsur kimiadenganlambangSedannomor atom34.Seleniumadalah sebuah unsur dalam periode 4, antara arsenik dan bromin. Selenium adalah nonlogam pertama dalam periode 4, dengan sifat yang mirip denganbelerang.Selenium cukup jarang dijumpai di alam dalam bentuk murni, kebanyakan ditemukan dalam mineral sepertipirit,dan bahkan inipun cukup jarang. Selenium diperlukan oleh manusia dalam kadar renik, tetapi unsur ini toksik dalam kadar besar.
Bromin
[sunting|sunting sumber]
Brominadalahunsur kimiadenganlambangBrdannomor atom35.Brominadalah sebuah unsur dalam periode 4, antara selenium dan kripton. Bromin adalah sebuahhalogen,tidak pernah ada dalam bentuk murni di alam. Bromin berbentuk cair dalam temperatur kamar, mendidih pada temperatur sekitar 330K.Bromin juga cukup toksik dan korosif, tetapi ion bromida, yang relatif inert, dapat dijumpai dalamhalit,atau garam meja. Bromin sering digunakan sebagaipenahan apikarena banyak senyawa dapat dibuat untuk membebaskan atom bromin bebas.
Kripton
[sunting|sunting sumber]
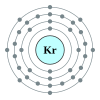
Kriptonadalahunsur kimiadenganlambangKrdannomor atom36.Kriptonadalah sebuahgas muliayang ditempatkan di bawahargondan di atasxenon.Sebagai gas mulia, kripton jarang berinteraksi dengan dirinya sendiri maupun dengan unsur lain; meskipun beberapa senyawa kripton telah terdeteksi, seluruhnya tidak stabil dan meluruh dengan cepat. Oleh karenanya, kripton sering digunakan dalam lampu pendar. Kripton, seperti gas mulia lainnya, juga digunakan dalam penerangan karena ia memiliki banyak garis spektrum dan alasan-alasan di atas.
Peran biologis
[sunting|sunting sumber]Kaliumpenting bagi kehidupan. Ion kalium dijumpai dalam seluruh sel. Ia diperlukan untuk mempertahankan keseimbangan cairan danelektrolit.Sel tanaman sangat kaya kalium, yang mereka dapat dari tanah. Lahan pertanian, yang dipanen setiap tahun, perlu dikembalikan kandungan kaliumnya dengan penambahanpupukberbasis kalium. Rata-rata manusia mengkonsumsi sampai dengan 7 gram kalium per hari, dan menyimpan sekitar 140 gram dalam sel tubuh. Diet sehat normal mengandung kalium, tetapi beberapa makanan sepertikopi instan,sarden,kacang,kismis,kentang,cokelatmemiliki kandungan kalium di atas rata-rata. Isotop alamikalium-40bersifat radioaktif dan, meskipun tingkat radiasinya rendah, merupakan salah satu penyebab alamimutasi genetikpada manusia.[9]
Kalsiumpenting bagi seluruh bentuk kehidupan, terutama untuk pertumbuhan dan kesehatantulangdangigi.Kalsium fosfatadalah komponen utama tulang. Rata-rata manusia mengandung sekitar 1 kilogram kalsium. Anak-anak dan wanita hamil dianjurkan mengonsumsi makanan yang kaya kalsium, seperti susu dan produk susu, sayuran berdaun hijau, ikan dan kacang serta biji-bijian.[10]
Peran biologisskandiumtidak diketahui. Unsur ini didugakarsinogen.[11]
Peran biologistitaniumtidak diketahui. Unsur ini tak beracun. Debu halustitanium dioksidadiduga karsinogen.[12]
Vanadiumpenting bagi beberapa spesies, termasuk manusia, meskipun kebutuhannya sangat kecil. Manusia hanya mengasup sekitar 0,01 miligram per hari, dan ini sudah melebihi kebutuhan harian tubuh manusia. Dalam beberapa senyawa vanadium dapat bersifat racun.[13]
Kromatau kromium merupakan unsur renik yang penting bagi manusia karena membantu pemanfaatanglukosatubuh. Namun, unsur ini beracun jika berlebih. Asupan harian sekitar 1 miligram per hari. Makanan sepertiragibir,wheat germdanginjalkaya akan kromium.[14]
Manganadalah unsur esensial dalam organisme hidup. Banyak jenisenzimmengandung mangan. Sebagai contoh, enzim yang bertindak mengubah molekulairmenjadioksigenselamafotosintesismengandung empat atom mangan. Beberapa lahan berkadar mangan rendah, sehingga perlu ditambahkanpupukdan diberikan sebagai suplemen pakan bagi hewan pemakan rumput. Rata-rata tubuh manusia mengandung 12 miligram mangan. Asupan mangan per hari sekitar 4 miligram dari makanan sepertikacang,dedak,sereal utuh (wholegrain cereals),tehdanpeterseli.Tanpa mangan,tulangmenjadikeroposdan mudah retak. Mangan juga esensial dalam utilisasivitamin B1.[15]
Besiadalah unsur esensial bagi segala bentuk kehidupan dan tak beracun. Rata-rata manusia mengandung sekitar 4 gram besi. Sebagian besar berada dalamhemoglobin,dalamdarah.Hemoglobin mengangkutoksigendariparu-parumenujusel,tempat oksigen digunakan untuk respirasi jaringan. Manusia membutuhkan 10–18 miligram besi setiap harinya. Kekurangan besi akan menyebabkananemia.Makanan seperti hati, ginjal,molases,ragi bir,kokoadanliquoricemengandung banyak besi.[16]
Kobaltadalah unsur renik esensial, dan pembentuk bagian aktifvitamin B12.Jumlah yang dibutuhkan manusia sangat kecil, dan tubuh hanya mengandung sekitar 1 miligram. Garam kobalt dapat diberikan kepada hewan tertentu dalam dosis kecil untuk mengobati defisiensi mineral. Dalam dosis besar, kobalt bersifatkarsinogenik.
Kobalt-60adalahisotopradioaktif. Ini merupakan sumber sinar-gama yang penting. Ia banyak digunakan dalam pengobatankanker,sebagai penjejak dan untukradioterapi.[17]
Peran biologinikeltidak menentu. Ia dapat mempengaruhi pertumbuhan tanaman tetapi telah menunjukkan bahwa ia penting bagi beberapa spesies. Beberapa senyawa nikel dapat menyebabkan kanker jika debunya terhirup, dan beberapa orang alergi jika kontak dengan logam ini. Nikel tidak dapat sepenuhnya dihindari. Manusia mengkonsumsi senyawa nikel bersamaan dengan makanan. Ini adalah unsur esensial bagi beberapa kacang-kacangan, sepertinavy beanyang digunakan untuk kacang panggang.[18]
Tembagaadalah unsur esensial. Manusia dewasa memerlukan sekitar 1,2 miligram tembaga per hari, untuk membantu enzim memindahkan energi dalam sel. Overdosis tembaga bersifat racun. Kelainan genetika, sepertipenyakit Wilsondanpenyakit Menkes,dapat mempengaruhi kemampuan tubuh untuk menggunakan tembaga secara benar. Tidak seperti mamalia, yang menggunakanbesi(dalam hemoglobin) untuk transportasi oksigen ke seluruh tubuh, beberapakrustaseamenggunakan kompleks tembaga.[19]
Sengpenting untuk seluruh makhluk hidup, membentuk titik-titik aktif dalam lebih dari 20 metalo-enzim. Rata-rata tubuh manusia mengandung sekitar 2,5 gram dan mengasup sekitar 15 miligram per hari. Beberapa makanan memiliki kadar seng di atas rata-rata, di antaranyaikan hering,daging sapi, daging domba, bijibunga mataharidankeju.Seng dapat menjadi karsinogenik jika berlebih. Menghirup seng(II) oksida yang baru terbentuk, dapat mengakibatkan suatu gejala yang disebut ‘gemetar oksida’ (oxide shakes) atau 'menggigil seng' (zinc chills).[20]
Galiumtidak diketahui mempunyai peran biologis apapun. Unsur ini tak beracun.[21]
Germaniumtidak diketahui mempunyai peran biologis apapun. Unsur ini tak beracun. Senyawa germanium tertentu memiliki efek racun rendah pada mamalia, sementara daya racunnya efektif melawan beberapa bakteri. Ini memicu beberapa ilmuwan meneliti potensi manfaat unsur ini untuk obat-obatan.[22]
Beberapa ilmuwan berpikir bahwaarsenmerupakan unsur esensial dalam makanan dalam dosis yang amat sangat kecil. Dalam dosis kecil, arsen bersifat toksik dan didugakarsinogen.Sekali masuk kedalam tubuh, arsen terikat dengan atom-atom dalam rambut, sehingga analisis sampel rambut dapat menunjukkan paparan arsenik pada seseorang. Beberapa makanan, seperti udang, mengandung kadar arsenik yang mengejutkan, tetapi dalam bentuk yang kurang berbahaya yaitu arsen organik.[23]
Seleniumadalah unsur renik esensial untuk beberapa spesies, termsuk manusia. Tubuh manusia mengandung sekitar 14 miligram, dan setiap sel dalam tubuh manusia mengandung lebih dari satu juta atom selenium. Kekurangan selenium dapat menyebabkan masalah kesehatan, tetapi terlalu banyak juga berbahaya. Dalam dosis berlebih, selenium bersifat karsinogenik danteratogenik(mengganggu perkembangan embrio atau janin).[24]
Brominhadir dalam jumlah kecil, sebagai bromida, dalam semua makhluk hidup. Namun, belum diketahui peran biologisnya bagi manusia. Bromin memiliki efek iritasi pada mata dan tenggorokan, dan menghasilkan rasa nyeri jika terkena kulit.[25]
Kriptontidak diketahui memiliki peran biologis.[26]
Tabel unsur
[sunting|sunting sumber]| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Golongan→ | ||||||||||||||||||||||||||||||
| ↓Periode | ||||||||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
Lihat juga
[sunting|sunting sumber]Referensi
[sunting|sunting sumber]- ^abGray, Theodore (2009).The Elements: A Visual Exploration of Every Known Atom in the Universe.New York: Black Dog & Leventhal Publishers.ISBN978-1-57912-814-2.
- ^"List of Elements of the Periodic Table – Sorted by Abundance in Earth's crust".Science.co.il.Diakses tanggal2012-08-14.
- ^"Elements in the Modern Periodic Table, Periodic Classification of Elements".Tutorvista.com.Diarsipkan dariversi aslitanggal 2017-12-22.Diakses tanggal2012-08-14.
- ^"It's Elemental – The Element Potassium".Education.jlab.org.Diakses tanggal2012-08-14.
- ^"Potassium, Chemical Element – Overview, Discovery and naming, Physical properties, Chemical properties, Occurrence in nature, Isotopes".Chemistryexplained.com.Diakses tanggal2012-08-14.
- ^"Potassium (K) – Chemical properties, Health and Environmental effects".Lenntech.com.Diakses tanggal2012-08-14.
- ^"Reactions of the Group 2 elements with water".Chemguide.co.uk.Diakses tanggal2012-08-14.
- ^"Chapter 11. Calcium",Human Vitamin and Mineral Requirements,Rome, Italy: Report of a joint FAO/WHO expert consultation, 2002,diakses tanggal2012-08-14
- ^"Potassium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Calcium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Scandium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Titanium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Vanadium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Chromium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Manganese".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Iron".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Cobalt".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Nickel".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Copper".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Zinc".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Gallium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Germanium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Arsenic".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Selenium".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Bromine".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.
- ^"Krypton".Periodic Table.Royal Society of Chemistry.Diakses tanggal2016-02-10.