Xenon
54Xe Xenon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Gas xenon dalamtabung lucutan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum xenon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | gas tak berwarna, akan menjadi biru bila diletakkan pada medan listrik bertegangan tinggi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xenon dalamtabel periodik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom(Z) | 54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 18 (gas mulia) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | gas mulia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar(Ar) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Kr] 5s24d105p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FasepadaSTS(0 °C dan 101,325kPa) | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 161,40K(−111,75 °C, −169,15 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 165,051 K (−108,099 °C, −162,578 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kerapatan(pada STS) | 5,894 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, padat.d. | 2,942 g/cm3[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik tripel | 161,405 K, 81,77 kPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik kritis | 289,733 K, 5,842 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 2,27kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 12,64 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 21,01[4]J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | 0,+2, +4, +6, +8 (jarang lebih dari 0;oksidaasamlemah) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1170,4 kJ/mol ke-2: 2046,4 kJ/mol ke-3: 3099,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 140±9pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 216 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka(fcc) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara | gas: 178 m·s−1 cair: 1090m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 5,65×10−3W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | diamagnetik[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | −43,9×10−6cm3/mol (298 K)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-63-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuandan isolasi pertama | W. RamsaydanM. Travers(1898) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop xenonyang utama | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Xenonadalah sebuahunsur kimiadenganlambangXedannomor atom54. Ia adalah sebuahgas muliayang padat, tidak berwarna, dan tidak berbau yang ditemukan diatmosfer Bumidalam jumlah kecil.[9]Meskipun umumnya tidak reaktif, ia dapat mengalami beberapareaksi kimiaseperti pembentukanxenon heksafluoroplatinat,senyawa gas muliapertama yang berhasil disintesis.[10][11][12]
Xenon digunakan dalamlampu blitz[13]danlampu busur,[14]serta sebagaianestesi umum.[15]Desainlaser eksimerpertama menggunakan molekuldimerxenon (Xe2) sebagaimedia pelaseran,[16]dan desainlaserpaling awal menggunakan lampu blitz xenon sebagaipompa.[17]Xenon juga digunakan untuk mencaripartikel masif berinteraksi lemahyang hipotetis[18] dan sebagaipropelanuntukpendorong ionpada wahana antariksa.[19]
Xenon alami terdiri daritujuh isotop stabildan dua isotop radioaktif berumur panjang. Lebih dari 40 isotop xenon yang tidak stabil mengalamipeluruhan radioaktif,dan rasio isotop xenon merupakan alat penting untuk mempelajari sejarah awalTata Surya.[20]Xenon-135yang radioaktif diproduksi melaluipeluruhan betadariiodin-135(sebuah produkfisi nuklir), dan merupakan sebuahpengabsorpsi neutronpaling signifikan (dan tidak diinginkan) dalamreaktor nuklir.[21]
Sejarah
[sunting|sunting sumber]Xenon ditemukan di Inggris oleh kimiawan SkotlandiaWilliam Ramsaydan kimiawan InggrisMorris Traverspada September 1898,[22]tak lama setelah penemuan unsurkriptondanneonmereka. Mereka menemukan xenon dalam residu yang tersisa dari komponenudara cairyang menguap.[23][24]Ramsay mengusulkan namaxenonuntuk gas ini dari kataYunaniξένονxénon,bentuk tunggal netral dari ξένοςxénos,yang berarti 'asing', 'aneh', atau 'tamu'.[25][26]Pada tahun 1902, Ramsay memperkirakan proporsi xenon di atmosfer Bumi menjadi satu bagian dari 20 juta.[27]
Selama tahun 1930-an, insinyur AmerikaHarold Edgertonmulai mengeksplorasi teknologilampu strobountukfotografi kecepatan tinggi.Ini membawanya pada penemuanlampu blitzdi mana cahaya akan dihasilkan dengan mengalirkan arus listrik singkat melalui tabung yang diisi dengan gas xenon. Pada tahun 1934, Edgerton mampu menghasilkan kilatan sesingkat satumikrodetikdengan metode ini.[13][28][29]
Pada tahun 1939, dokter AmerikaAlbert R. BehnkeJr. mulai menyelidiki penyebab "mabuk" pada penyelam laut dalam. Dia menguji efek dari memvariasikan campuran pernapasan pada subjeknya, dan menemukan bahwa hal ini menyebabkan para penyelam merasakan perubahan kedalaman. Dari hasil penelitiannya, dia menyimpulkan bahwa gas xenon dapat berfungsi sebagaianestesi.Meskipun ahli toksikologi RusiaNikolay V. Lazarevtampaknya mempelajari anestesi xenon pada tahun 1941, laporan terbitan pertama yang mengonfirmasi anestesi xenon adalah pada tahun 1946 oleh peneliti medis Amerika John H. Lawrence, yang bereksperimen pada beberapa tikus. Xenon pertama kali digunakan sebagai anestesi bedah pada tahun 1951 oleh ahli anestesi Amerika Stuart C. Cullen, yang berhasil menggunakannya pada dua pasien.[30]

Untuk waktu yang lama, xenon dan gas mulia lainnya dianggap sepenuhnya lengai secara kimiawi dan tidak dapat membentuksenyawa.Namun, saat mengajar diUniversitas British Columbia,Neil Bartlettmenemukan bahwa gasplatina heksafluorida(PtF6) adalah zatpengoksidasikuat yang dapat mengoksidasi gas oksigen (O2) untuk membentukdioksigenil heksafluoroplatinat(O+2[PtF6]−).[31]Karena O2(1165 kJ/mol) dan xenon (1170 kJ/mol) memilihpotensial ionisasipertama yang hampir sama, Bartlett menyadari bahwa platina heksafluorida mungkin juga dapat mengoksidasi xenon. Pada tanggal 23 Maret 1962, dia mencampurkan kedua gas tersebut dan menghasilkan senyawa gas mulia pertama yang diketahui,xenon heksafluoroplatinat.[32][12]
Bartlett mengira komposisi senyawa tersebut adalah Xe+[PtF6]−,tetapi penelitian selanjutnya mengungkapkan bahwa ia mungkin merupakan campuran berbagai garam yang mengandung xenon.[33][34][35]Sejak saat itu, banyak senyawa xenon lainnya telah ditemukan,[36]termasuk beberapa senyawa gas muliaargon,kripton,danradon,sepertiargon fluorohidrida(HArF),[37]kripton difluorida(KrF2),[38][39]danradon fluorida.[40]Pada tahun 1971, lebih dari 80 senyawa xenon telah diketahui.[41][42]
Pada November 1989,IBMmendemonstrasikan teknologi yang mampu memanipulasiatomindividual. Program tersebut, yang disebutIBM dalam atom,menggunakan sebuahmikroskop penerowongan payaranuntuk mengatur 35 atom xenon individual pada substrat kristalnikeldingin untuk menguraikan tiga huruf inisial perusahaan itu. Ini adalah pertama kalinya atom ditempatkan dengan tepat pada permukaan yang datar.[43]
Karakteristik
[sunting|sunting sumber]
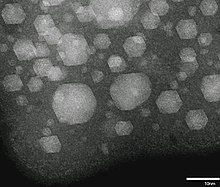
Xenon memilikinomor atom54; yaitu, intinya mengandung 54proton.Padasuhu dan tekanan standar,gas xenon murni memilikikepadatan5,894 kg/m3,sekitar 4,5 kali kepadatan atmosfer Bumi di permukaan laut, 1,217 kg/m3.[44]Sebagai cairan, xenon memiliki kepadatan hingga 3,100 g/mL, dengan kepadatan maksimum terjadi padatitik tripel.[45]Xenon cair memiliki polarisasi yang tinggi karena volume atomnya yang besar, sehingga ia merupakan pelarut yang sangat baik. Ia dapat melarutkan hidrokarbon, molekul biologis, dan bahkan air.[46]Pada kondisi yang sama, kepadatan xenon padat, 3,640 g/cm3,lebih besar dari kepadatan rata-ratagranit,2,75 g/cm3.[45]Di bawahtekananbeberapagigapascal,xenon akan membentuk fase metalik.[47]
Xenon padat berubah dari fase kristalkubus berpusat-muka(fcc) menjadiheksagon tetal-rapat(hcp) di bawah tekanan dan mulai berubah menjadi metalik pada tekanan sekitar 140 GPa, tanpa perubahan volume yang nyata pada fase hcp. Ia akan benar-benar metalik pada tekanan 155 GPa. Saat termetalisasi, xenon akan tampak berwarna biru langit karena ia menyerap cahaya merah dan mentransmisikan frekuensi lain yang terlihat. Perilaku seperti itu tidak biasa untuk logam dan dijelaskan oleh lebar pita elektron yang relatif kecil dalam keadaan itu.[48][49]

(versi animasi)
Nanopartikel xenon cair atau padat dapat dibentuk pada suhu kamar dengan menanamkan ion Xe+ke dalam matriks padat. Banyak padatan memiliki konstanta kisi lebih kecil dari padatan Xe. Ini akan menghasilkan kompresi Xe yang ditanamkan ke tekanan yang mungkin cukup untuk pencairan atau pemadatannya.[50]
Xenon adalah anggota dari unsur-unsurvalensinol yang disebutgas muliaataulengai.Ia bersifat lengai terhadap reaksi kimia yang paling umum (misalnya seperti pembakaran) karenakulit valensiterluarnya mengandung delapan elektron. Ini menghasilkan konfigurasi energi minimum yang stabil di mana elektron terluar terikat erat.[51]
Dalamtabung lucutan,xenon akan memancarkan cahaya berwarnabiruataulavendersaat dieksitasi olehlucutan listrik.Xenon memancarkan pitagaris emisiyang menjangkau spektrum visual,[52]tetapi garis yang paling intens terjadi di wilayah cahaya biru, yang merupakan asal warnanya.[53]
Keterjadian dan produksi
[sunting|sunting sumber]Xenon adalah sebuahgas renikdiatmosfer Bumi,terjadi pada fraksi volume sebesar87±1 nL/L(bagian per miliar), atau sekitar 1 bagian per 11,5 juta.[54]Ia juga ditemukan sebagai komponen gas yang dipancarkan dari beberapamata air mineral.Mengingat massa total atmosfer adalah sebesar 5,15×1018kilogram (1,135×1019pon), atmosfer mengandung sekitar 2,03 gigaton (2,00×109ton panjang; 2,24×109ton pendek) xenon secara total ketika mengambil massa molar rata-rata atmosfer sebesar 28,96 g/mol yang setara dengan 394 massa ppb.
Komersial
[sunting|sunting sumber]Xenon diperoleh secara komersial sebagai produk sampingan daripemisahan udaramenjadioksigendannitrogen.[55]Setelah pemisahan ini, umumnya dilakukan dengandistilasi fraksionaldalam instalasi kolom ganda,oksigen cairyang dihasilkan akan mengandungkriptondan xenon dalam jumlah kecil. Dengan distilasi fraksional tambahan, oksigen cair dapat diperkaya untuk mengandung 0,1–0,2% campuran kripton/xenon, yang diekstraksi baik melaluiadsorpsimenjadigel silikaatau melalui distilasi. Terakhir, campuran kripton/xenon dapat dipisahkan menjadi kripton dan xenon melalui distilasi lebih lanjut.[56][57]
Produksi xenon di seluruh dunia pada tahun 1998 diperkirakan mencapai 5.000–7.000 meter kubik (180.000–250.000 cu ft).[58]Pada kepadatan sebesar 5,894 gram per liter (0,0002129 lb/cu in), ini setara dengan kira-kira 30 hingga 40 ton (30 hingga 39 ton panjang; 33 hingga 44 ton pendek). Karena kelangkaannya, xenon jauh lebih mahal daripada gas mulia yang lebih ringan—harga perkiraan untuk pembelian dalam jumlah kecil di Eropa pada tahun 1999 adalah 10€/L (=~€1,7/g) untuk xenon, 1 €/L (=~€0,27/g) untuk kripton, dan 0,20 €/L (=~€0,22/g) untuk neon,[58]sedangkan argon yang jauh lebih banyak, yang membentuk lebih dari 1% volume atmosfer bumi, harganya kurang dari satu sen per liter.
Tata Surya
[sunting|sunting sumber]Di dalam Tata Surya, fraksinukleonxenon adalah1,56 × 10−8,dengankelimpahankira-kira satu bagian dalam 630 ribu massa total.[59]Xenon relatif jarang di atmosferMatahari,diBumi,serta diasteroiddankomet.Kelimpahan xenon di atmosfer planetJupiterluar biasa tinggi, sekitar 2,6 kali Matahari.[60][61]Kelimpahan ini tetap tidak dapat dijelaskan, tetapi mungkin disebabkan oleh penumpukan awal dan cepat dariplanetisimal—benda luar angkasa kecil, subplanet—sebelum pemanasancakram prasurya.[62](Jika tidak, xenon tidak akan terperangkap dalam es planetisimal.) Masalah rendahnya xenon terestrial dapat dijelaskan melaluiikatan kovalenxenon dengan oksigen di dalamkuarsa,mengurangipelepasan gasxenon ke atmosfer.[63]
Bintang
[sunting|sunting sumber]Berbeda dengan gas mulia bermassa lebih rendah, prosesnukleosintesis bintangnormal di dalam bintang tidak membentuk xenon. Unsur-unsur yang lebih masif daribesi-56akan mengonsumsi energi melalui fusi, dan sintesis xenon menunjukkan tidak adanya perolehan energi untuk sebuah bintang.[64]Sebaliknya, xenon terbentuk selama ledakansupernova,[65]dalam ledakannovaklasik,[66]melalui proses penangkapan neutron lambat (proses-s) di dalam bintangraksasa merahyang telah kehabisan inti hidrogennya dan memasukicabang raksasa asimtotik,[67]serta dari peluruhan radioaktif, misalnyapeluruhan betadariiodin-129yang telahpunahdanfisi spontantorium,uranium,danplutonium.[68]
Fisi nuklir
[sunting|sunting sumber]Xenon-135adalah sebuahracun neutronterkenal denganhasil produk fisiyang tinggi. Karena umurnya yang relatif pendek, ia meluruh pada tingkat yang sama seperti yang dihasilkan selama pengoperasian reaktor nuklir yangstabil.Namun, jika dayanya berkurang atau reaktornya dimatikan secara darurat (di-scram), lebih sedikit xenon yang dihancurkan daripada yang dihasilkan dari peluruhan betanuklida induknya.Fenomena yang disebutkeracunan xenonini dapat menyebabkan masalah signifikan dalam menghidupkan kembali reaktor setelahscramatau meningkatkan daya setelah dikurangi dan merupakan salah satu dari beberapa faktor penyebabkecelakaan nuklir Chernobyl.[69][70]
Isotop xenon yang stabil atau berumur sangat panjang juga diproduksi dalam jumlah yang cukup besar dalam fisi nuklir. Xenon-136 diproduksi ketika xenon-135 mengalamipenangkapan neutronsebelum dapat meluruh. Rasio xenon-136 terhadap xenon-135 (atau produk peluruhannya) dapat memberikan petunjuk mengenai sejarah daya reaktor tertentu, dan tidak adanya xenon-136 dapat menjadi "sidik jari" untuk ledakan nuklir, karena xenon-135 tidak diproduksi secara langsung tetapi sebagai produk peluruhan beta berturut-turut sehingga ia tidak dapat menyerap neutron dalam ledakan nuklir yang terjadi dalam sepersekian detik.[71]
Isotop xenon-132 yang stabil memiliki hasil produk fisi lebih dari 4% dalam fisineutron termal235U,mengartikan bahwa isotop xenon yang stabil atau hampir stabil memiliki fraksi massa yang lebih tinggi dalambahan bakar nuklir bekas(yaitu sekitar 3% produk fisi) daripada di udara. Namun, hingga tahun 2022, tidak ada upaya komersial untuk mengekstraksi xenon dari bahan bakar bekas selamapemrosesan ulang nuklir.[72][73]
Isotop
[sunting|sunting sumber]Xenon alami terdiri dari tujuhisotopstabil:126Xe,128–132Xe, dan134Xe. Secara teoretis, isotop126Xe dan134Xe diperkirakan akan mengalamipeluruhan beta ganda,tetapi hal ini belum pernah teramati sehingga mereka dianggap stabil.[74]Selain itu, lebih dari 40 isotop tidak stabil telah dipelajari. Isotop yang berumur paling panjang adalah124Xe yangprimordial,mengalamipenangkapan elektron gandadenganwaktu paruh1,8 × 1022tahun,[7]dan136Xe, mengalami peluruhan beta ganda dengan waktu paruh2,11 × 1021tahun.[75]129Xe diproduksi melaluipeluruhan beta129I,yang memiliki waktu paruh 16 juta tahun.131mXe,133Xe,133mXe, dan135Xe adalah beberapaprodukfisi dari235Udan239Pu,[68]dan digunakan untuk mendeteksi dan memantau ledakan nuklir.
Spin inti
[sunting|sunting sumber]Inti dari dua isotop stabil xenon,129Xe dan131Xe, memilikimomentum sudut(spin inti) intrinsik bukan nol, cocok untukresonansi magnet inti.Spin nuklir mereka dapat disejajarkan di luar tingkat polarisasi biasa melalui cahaya terpolarisasi sirkular dan uaprubidium.[76]Polarisasi spinintixenon yang dihasilkan dapat melampaui 50% dari nilai maksimum yang mungkin, sangat melebihi nilai kesetimbangan termal yang ditentukan oleh statistikparamagnetik(biasanya 0,001% dari nilai maksimum padasuhu kamar,bahkan padamagnetterkuat). Penjajaran spin nonekuilibrium semacam itu adalah kondisi sementara, dan disebuthiperpolarisasi.Proses hiperpolarisasi xenon disebutpemompaan optik(walaupun prosesnya berbeda denganpemompaan laser).[77]
Karena inti129Xe memiliki spin 1/2, sehingga memilikimomen kuadrupollistriknol, inti129Xe tidak akan mengalami interaksi kuadrupolar selama tumbukan dengan atom lain, dan hiperpolarisasi akan bertahan untuk waktu yang lama bahkan setelah cahaya dan uap yang dihasilkan telah dihilangkan. Polarisasi spin129Xe dapat bertahan dari beberapadetikuntuk atom xenon yang dilarutkan dalamdarah[78]hingga beberapa jam dalamfase gas[79]dan beberapa hari dalam xenon padat yang sangat beku.[80]Sebaliknya,131Xememiliki nilai spin inti3⁄2dan momen kuadrupol bukan nol, serta memiliki waktu relaksasi t1dalam rentangmilidetikdan detik.[81]
Dari fisi
[sunting|sunting sumber]Beberapa isotop radioaktif xenon (misalnya133Xe dan135Xe) dihasilkan olehiradiasineutrondari bahan fisi di dalamreaktor nuklir.[10]135Xesangat penting dalam pengoperasianreaktor fisi nuklir.135Xe memilikipenampang lintangyang besar untukneutron termal,yaitu sebesar 2,6×106barn,[21]dan beroperasi sebagai "racun"ataupengabsorb neutronyang dapat memperlambat atau menghentikan reaksi rantai setelah periode operasi. Ini ditemukan di reaktor nuklir paling awal yang dibangun olehProyek ManhattanAmerika untuk produksiplutonium.Namun, para perancang telah membuat ketentuan dalam desain untuk meningkatkan reaktivitas reaktor (jumlah neutron per fisi yang terjadi pada fisi atombahan bakar nuklirlainnya).[82]Keracunan reaktor135Xe merupakan faktor utama dalambencana Chernobyl.[83]Pemadaman atau penurunan daya reaktor dapat mengakibatkan penumpukan135Xe, dengan operasi reaktor masuk ke kondisi yang dikenal sebagailubang iodin.Dalam kondisi buruk, konsentrasi isotop radioaktif xenon yang relatif tinggi dapat berasal dari retakanbatang bahan bakar,[84]atau fisi uranium dalamair pendingin.[85]
Rasio isotop xenon yang dihasilkan dalamreaktor fisi nuklir alamidiOklo,Gabon mengungkapkan sifat reaktor tersebut selama reaksi rantai yang telah terjadi sekitar 2 miliar tahun yang lalu.[86]
Proses kosmik
[sunting|sunting sumber]Karena xenon adalah pelacak dua isotop induk, rasio isotop xenon dalammeteoritadalah alat yang ampuh untuk mempelajaripembentukan Tata Surya.Metodepenanggalaniodin–xenonmemberikan waktu yang berlalu antaranukleosintesisdan kondensasi benda padat darinebula matahari.Pada tahun 1960, fisikawanJohn H. Reynoldsmenemukan bahwa meteorit tertentu mengandung anomali isotop berupa kelebihan xenon-129. Dia menyimpulkan bahwa ini adalahproduk peluruhandariiodin-129yang radioaktif. Isotop ini diproduksi secara perlahan melaluispalasi sinar kosmikdanfisi nuklir,tetapi diproduksi secara besar hanya dalam ledakan supernova.[87][88]
Karena waktu paruh129I relatif singkat pada skala waktu kosmologis (16 juta tahun), ini menunjukkan bahwa hanya ada waktu singkat antara supernova dan waktu meteorit memadat dan menjebak129I. Kedua peristiwa ini (supernova dan pemadatan awan gas) disimpulkan telah terjadi selama sejarah awalTata Surya,karena isotop129I kemungkinan dihasilkan sesaat sebelum Tata Surya terbentuk, menaburkan awan gas matahari dengan isotop dari sumber kedua. Sumber supernova ini mungkin juga telah menyebabkan keruntuhan awan gas matahari.[87][88]
Dengan cara yang sama, rasio isotop xenon seperti129Xe/130Xe dan136Xe/130Xe dapat menjadi alat yang ampuh untuk memahami diferensiasi planet dan pelepasan gas awal.[20]Misalnya,atmosfer Marsmenunjukkan kelimpahan xenon yang mirip dengan Bumi (0,08 bagian per juta[89]) tetapi Mars menunjukkan kelimpahan129Xe yang lebih besar daripada Bumi atau Matahari. Karena isotop ini dihasilkan melalui peluruhan radioaktif, hasil ini mungkin mengindikasikan bahwa Mars kehilangan sebagian besar atmosfer purbanya, mungkin dalam 100 juta tahun pertama setelah planet itu terbentuk.[90][91]Dalam contoh lain, kelebihan129Xe yang ditemukan dalam gas sumurkarbon dioksidadariNew Mexicodiyakini berasal dari peluruhan gas yang berasal darimantelsegera setelah pembentukan Bumi.[68][92]
Senyawa
[sunting|sunting sumber]Setelah penemuan Neil Bartlett pada tahun 1962 bahwa xenon dapat membentuk senyawa kimia, sejumlah besar senyawa xenon lainnya telah ditemukan dan dideskripsikan. Hampir semua senyawa xenon yang diketahui mengandung atom fluorin atau oksigen yangelektronegatif.Sifat kimia xenon di setiap keadaan oksidasi ialah analog dengan unsur tetangganyaiodindi keadaan oksidasi yang lebih rendah.[93]
Halida
[sunting|sunting sumber]

Tiga xenonfluoridatelah dikenal:XeF2,XeF4,danXeF6.XeF diteorikan bersifat tidak stabil.[94]Ini adalah titik awal untuk sintesis hampir semua senyawa xenon.
Xenon difluoridaXeF2kristalin padat terbentuk ketika campuran gasfluorindan xenon terkena sinar ultraungu.[95]Komponen ultraungu dari cahaya matahari pada siang hari biasa sudah cukup.[96]PemanasanXeF2jangka panjang pada suhu tinggi di bawah katalisNiF2akan menghasilkanXeF6.[97]PirolisisXeF6in dengan adanyaNaFakan menghasilkanXeF4dengan kemurnian tinggi.[98]
Xenon fluorida berperilaku baik sebagai akseptor fluorida maupun dan donor fluorida, membentuk garam yang mengandung kation sepertiXeF+danXe2F+3,serta anion sepertiXeF−5,XeF−7,danXeF2−8.Xe+2berwarna hijau yang bersifat paramagnetik terbentuk dari reduksiXeF2oleh gas xenon.[93]
XeF2juga dapat membentukkompleks koordinasidengan ionlogam transisi.Lebih dari 30 kompleks semacam itu telah disintesis dan dikarakterisasi.[97]
Meskipun xenon fluorida telah dicirikan dengan baik, xenon halida lainnya tidak.Xenon diklorida,dibentuk melalui iradiasi frekuensi tinggi dari campuran xenon, fluorin, dansilikonataukarbon tetraklorida,[99]dilaporkan sebagai senyawa kristal bersifat endotermik dan nirwarna yang akan terurai menjadi unsur-unsur tersebut pada suhu 80 °C. Namun,XeCl2mungkin hanya merupakanmolekul van der Waalsdari atom Xe dan molekulCl2yang terikat lemah dan bukan senyawa nyata.[100]Perhitungan teoretis menunjukkan bahwa molekul linearXeCl2kurang stabil dibandingkan kompleks van der Waals.[101]Xenon tetrakloridadanxenon dibromidalebih tidak stabil sehingga tidak dapat disintesis melalui reaksi kimia. Mereka diciptakan melaluipeluruhan radioaktifdari masing-masing129ICl−4dan129IBr−2.[102][103]
Oksida dan oksihalida
[sunting|sunting sumber]Tiga oksida xenon telah dikenal:xenon trioksida(XeO3) danxenon tetroksida(XeO4), keduanya merupakan zat pengoksidasi yang kuat dan sangat mudah meledak, sertaxenon dioksida(XeO2), yang dilaporkan pada tahun 2011 denganbilangan koordinasiempat.[104]XeO2terbentuk ketika xenon tetrafluorida dituangkan di atas es. Struktur kristalnya memungkinkannya untuk menggantikan silikon dalam mineral silikat.[105]Kation XeOO+telah diidentifikasi melaluispektroskopi inframerahdalamargonpadat.[106]
Xenon tidak bereaksi dengan oksigen secara langsung; xenon trioksida dibentuk melalui hidrolisisXeF6:[107]
- XeF6+ 3H2O→XeO3+ 6 HF
XeO3bersifat asam lemah, larut dalam alkali untuk membentuk garamxenatyang tidak stabil yang mengandung anionHXeO−4.Garam-garam yang tidak stabil ini mudahterdisproporsionasimenjadi gas xenon dan garamperxenat,yang mengandung anionXeO4−6.[108]
Barium perxenat, ketika direaksikan denganasam sulfatpekat, akan menghasilkan gas xenon tetroksida:[99]
- Ba2XeO6+ 2H2SO4→ 2BaSO4+ 2H2O+XeO4
Untuk mencegah dekomposisi, xenon tetroksida yang terbentuk dengan cepat didinginkan menjadi padatan kuning pucat. Ia akan meledak di atas suhu −35,9 °C menjadi gas xenon dan oksigen, tetapi bersifat stabil.
Sejumlah xenon oksifluorida telah diketahui, meliputiXeOF2,XeOF4,XeO2F2,danXeO3F2.XeOF2dapat dibentuk melalui pereaksianOF2dengan gas xenon pada suhu rendah. Ia juga dapat diperoleh melalui hidrolisisXeF4parsial. Ia akan terdisproporsionasi pada suhu −20 °C menjadiXeF2danXeO2F2.[109]XeOF4dapat dibentuk melalui hidrolisisXeF6parsial,[110]atau reaksiXeF6dengan natrium perxenat,Na4XeO6.Reaksi terakhir juga menghasilkan sejumlah kecilXeO3F2.XeOF4akan bereaksi denganCsFmembentuk anionXeOF−5,[109][111]sedangkan XeOF3akan bereaksi dengan fluorida logam alkaliKF,RbF,dan CsF membentuk anionXeOF−4anion.[112]
Senyawa lainnya
[sunting|sunting sumber]Xenon dapat langsung berikatan dengan unsur-unsur yang kurang elektronegatif daripada fluorin atau oksigen, khususnyakarbon.[113]Gugus penarik elektron, seperti gugus dengan substitusi fluorin, diperlukan untuk menstabilkan senyawa ini.[108]Banyak senyawa seperti itu telah dikarakterisasi, meliputi:[109][114]
- C6F5–Xe+–N≡C–CH3,di mana C6F5adalah gugus pentafluorofenil.
- [C6F5]2Xe
- C6F5–Xe–C≡N
- C6F5–Xe–F
- C6F5–Xe–Cl
- C2F5–C≡C–Xe+
- [CH3]3C–C≡C–Xe+
- C6F5–XeF+2
- (C6F5Xe)2Cl+
Senyawa lain yang mengandung xenon yang berikatan dengan unsur yang kurang elektronegatif meliputiF–Xe–N(SO2F)2danF–Xe–BF2.F–Xe–BF2disintesis daridioksigeniltetrafluoroborat,O2BF4,pada suhu −100 °C.[109][115]
Ion yang tidak biasa yang mengandung xenon adalah kationtetraxenonoemas(II),AuXe2+4,yang mengandung ikatan Xe–Au.[116]Ion ini terdapat dalam senyawaAuXe4(Sb2F11)2,dan sangat tidak biasa karena memiliki ikatan kimia langsung antara dua atom yang terkenal tidak reaktif, xenon danemas,dengan xenon bertindak sebagai ligan logam transisi.
SenyawaXe2Sb2F11mengandung ikatan Xe–Xe, ikatan unsur–unsur terpanjang yang diketahui (308,71pm= 3,0871Å).[117]
Pada tahun 1995, M. Räsänen dan rekan kerjanya, beberapa ilmuwan diUniversitas HelsinkidiFinlandia,mengumumkan pembuatan xenon dihidrida (HXeH), dan kemudian xenon hidrida-hidroksida (HXeOH), hidroksenoasetilena (HXeCCH), dan molekul yang mengandung Xe lainnya.[118]Pada tahun 2008, Khriachtchev dkk. melaporkan pembuatan HXeOXeH melaluifotolisisair dalam matriks xenonkriogenik.[119]Molekulterdeuterasi,HXeOD dan DXeOH, juga telah diproduksi.[120]
Klatrat dan eksimer
[sunting|sunting sumber]Selain senyawa di mana xenon dapat membentukikatan kimia,xenon juga dapat membentukklatrat—zat di mana atom atau pasangan xenon terperangkap olehkisi kristalsenyawa lain. Salah satu contohnya adalahxenon hidrat(Xe·5 ¾H2O), di mana atom xenon menempati kekosongan dalam kisi molekul air.[121]Klatrat ini memiliki titik lebur sebesar 24 °C.[122]Versiterdeuterasidari hidrat ini juga telah diproduksi.[123]Contoh lainnya adalah xenonhidrida(Xe(H2)8), di mana pasangan (dimer) xenon terperangkap di dalamhidrogen padat.[124]Hidrat klatratsemacam itu dapat terjadi secara alami dalam kondisi tekanan tinggi, seperti diDanau Vostokdi bawah lapisan esAntarktika.[125]Formasi klatrat dapat digunakan untuk menyaring xenon, argon, dan kripton secara fraksional.[126]
Xenon juga dapat membentuk senyawafulerena endohedral,di mana atom xenon terperangkap di dalam molekulfulerena.Atom xenon yang terperangkap dalam fulerena dapat diamati dengan spektroskopiresonansi magnet inti(NMR)129Xe. Melaluipergeseran kimiayang sensitif dari atom xenon ke lingkungannya, reaksi kimia pada molekul fulerena dapat dianalisis. Pengamatan ini bukan tanpa peringatan, karena atom xenon memiliki pengaruh elektronik pada reaktivitas fulerena.[127]
Ketika atom xenon berada dalamkeadaan energi dasar,mereka akan saling tolak menolak dan tidak akan membentuk sebuah ikatan. Namun, ketika atom xenon menjadi terenergi, mereka dapat membentuk sebuaheksimer(dimer tereksitasi) hingga elektronnya kembali kekeadaan dasar.Entitas ini terbentuk karena atom xenon cenderung melengkapikulit elektronikterluar dengan menambahkan elektron dari atom xenon tetangganya. Umur tipikal dari eksimer xenon adalah 1–5 nanodetik, dan peluruhannya akan melepaskanfotondenganpanjang gelombangsekitar 150 dan 173nm.[128][129]Xenon juga dapat membentuk eksimer dengan unsur lain, sepertihalogenbromin,klorin,danfluorin.[130]
Aplikasi
[sunting|sunting sumber]Meskipun xenon dapat terbilang langka dan relatif mahal untuk diekstraksi dariatmosfer Bumi,xenon memiliki sejumlah aplikasi.
Penerangan dan optik
[sunting|sunting sumber]Lampu lucutan
[sunting|sunting sumber]Xenon digunakan dalam perangkat pemancar cahaya yang disebut lampu blitz xenon, digunakan dalamblitz fotografisdan lampu stroboskopis;[13]untuk mengeksitasimedia aktifdalamlaseryang kemudian menghasilkancahaya koheren;[131]dan, kadang-kadang, dalam lampubakterisidal.[132]Laser benda padat pertama, ditemukan pada tahun 1960, dipompa menggunakan lampu blitz xenon,[17]dan laser yang digunakan untuk menyalakanfusi kurungan inersiajuga dipompa menggunakan lampu blitz xenon.[133]



Lampu busur xenonbertekanan tinggi, dengan busur pendek, dan kontinu memilikisuhu warnayang mendekati sinar matahari tengah hari dan digunakan dalamsimulator surya.Artinya,kromatisitaslampu ini mendekati radiatorbenda hitamyang dipanaskan pada suhu Matahari. Pertama kali diperkenalkan pada tahun 1940-an, lampu ini menggantikanlampu busur karbonberumur pendek pada proyektor film.[14]Mereka juga digunakan dalam sistemproyeksi film35mm,IMAX,dandigital.Mereka adalah sumber radiasiultraungupanjang gelombang pendek yang sangat baik dan memiliki emisi intens dalaminframerahdekat yang digunakan dalam beberapa sistempenglihatan malam.Xenon digunakan sebagai gas starter padalampu halida logamuntuklampu depan HID otomotif,dansenter "taktis"kelas atas.
Sel individual dalamtampilan plasmamengandung campuran xenon dan neon terionisasi denganelektroda.Interaksi plasma ini dengan elektroda akan menghasilkanfotonultraungu, yang kemudian mengeksitasi lapisanfosfordi bagian depan layar.[134][135]
Xenon digunakan sebagai "gas starter" padalampu natrium bertekanan tinggi.Ia memilikikonduktivitas termalterendah danpotensial ionisasiterendah dari semua gas mulia nonradioaktif. Sebagai gas mulia, ia tidak akan mengganggu reaksi kimia yang terjadi pada lampu tersebut saat beroperasi. Konduktivitas termal yang rendah akan meminimalkan kerugian termal pada lampu tersebut saat dalam keadaan beroperasi, dan potensial ionisasi yang rendah akan menyebabkantegangan rusakgas menjadi relatif rendah dalam keadaan dingin, yang memungkinkan lampu tersebut lebih mudah dinyalakan.[136]
Laser
[sunting|sunting sumber]Pada tahun 1962, sekelompok peneliti diLaboratorium Bellmenemukan aksi laser pada xenon,[137]dan kemudian menemukan bahwa penguatan laser dapat ditingkatkan dengan menambahkanheliumke media pelaseran.[138][139]Laser eksimerpertama menggunakandimerxenon (Xe2) yang diberi energi oleh seberkas elektron untuk menghasilkanemisi terstimulasipada panjang gelombangultraungu176nm.[16] Xenon klorida dan xenon fluorida juga telah digunakan dalam laser eksimer (atau, lebih tepatnya, eksipleks).[140]
Medis
[sunting|sunting sumber]Anestesi
[sunting|sunting sumber]Xenon telah digunakan sebagaianestesi umum,tetapi harganya lebih mahal daripada anestesi konvensional.[141]
Xenon berinteraksi dengan banyak reseptor dan saluran ion yang berbeda, dan seperti banyak anestesi inhalasi multimodal secara teoretis lainnya, interaksi ini kemungkinan saling melengkapi. Xenon adalahantagonis reseptor NMDAsitus glisin berafinitas tinggi.[142]Namun, xenon berbeda dari antagonis reseptor NMDA tertentu lainnya karena ia tidak bersifatneurotoksikserta akan menghambat neurotoksisitasketaminadandinitrogen monoksida(N2O), dan justru menghasilkanefek neuroprotektif.[143][144]Tidak seperti ketamina dan dinitrogen monoksida, xenon tidak akan merangsang penghabisan dopamin dinucleus accumbens.[145]
Seperti dinitrogen monoksida dansiklopropana,xenon dapat mengaktifkan saluran kalium domain berpori duaTREK-1.Saluran terkaitTASK-3juga terlibat dalam tindakan anestesi inhalasi tidak sensitif terhadap xenon.[146]Xenon akan menghambat reseptor asetilkolina nikotinikα4β2yang berkontribusi pada analgesia yang dimediasi secara spinal.[147][148]Xenon adalah sebuah penghambatmembran plasma ATPase Ca2+yang efektif. Xenon akan menghambat ATPase Ca2+dengan mengikat pori hidrofobik di dalam enzim tersebut dan mencegah enzim itu mengambil konformasi aktif.[149]
Xenon adalah penghambat kompetitif dari reseptorserotonin5-HT3.Meskipun bukan merupakan anestesi ataupun antinosiseptif, ini dapat mengurangi mual dan muntah yang muncul akibat anestesi.[150]
Xenon memilikikonsentrasi alveolar minimum(MAC) sebesar 72% pada usia 40 tahun, menjadikannya 44% lebih kuat daripada N2O sebagai anestesi.[151]Dengan demikian, ia dapat digunakan dengan oksigen dalam konsentrasi yang memiliki risikohipoksialebih rendah. Tidak seperti dinitrogen monoksida, xenon bukanlah sebuahgas rumah kacadan dianggapramah lingkungan.[152]Meskipun didaur ulang dalam sistem modern, xenon yang dibuang ke atmosfer hanya kembali ke sumber aslinya, tanpa menghasilkan dampak lingkungan.
Neuroprotektan
[sunting|sunting sumber]Xenon dapat menginduksiperlindungan jantungdansarafyang kuat melalui berbagai mekanisme. Melalui pengaruhnya terhadap antagonisme Ca2+,K+,KATP\HIF, dan NMDA, xenon bersifat neuroprotektif bila diberikan sebelum, selama, dan setelah seranganiskemis.[153][154]Xenon adalah antagonis afinitas tinggi pada situs glisin reseptor NMDA.[142]Xenon bersifat kardioprotektif dalam kondisi iskemia-reperfusi dengan menginduksi prakondisifarmakologisnoniskemik. Xenon bersifat kardioprotektif dengan mengaktifkan PKC-epsilon dan p38-MAPK hilir.[155]Xenon akan meniru prakondisi iskemis saraf dengan mengaktifkan saluran kalium sensitif ATP.[156]Xenon secara alosterik mengurangi penghambatan aktivasi saluran yang dimediasi ATP secara independen dari subunit reseptor1 sulfonilurea, meningkatkan waktu dan frekuensi saluran terbuka KATP.[157]
Doping olahraga
[sunting|sunting sumber]Menghirup campuran xenon/oksigen dapat mengaktifkan produksifaktor transkripsiHIF-1-alfa,yang dapat menyebabkan peningkatan produksieritropoietin.Hormon terakhir diketahui dapat meningkatkan produksisel darah merahdan kinerja atletik. Kabarnya, doping dengan inhalasi xenon telah digunakan di Rusia sejak 2004 dan mungkin sebelumnya.[158]Pada 31 Agustus 2014,Badan Anti Doping Dunia(WADA) menambahkan xenon (danargon) ke dalam daftar zat dan metode terlarang, meskipun belum ada uji doping yang andal untuk gas ini yang telah dikembangkan.[159]Selain itu, efek xenon pada produksi eritropoietin pada manusia sejauh ini belum terbukti.[160]
Pencitraan
[sunting|sunting sumber]Emisigamadariradioisotop133Xe dapat digunakan untuk mencitrakan jantung, paru-paru, dan otak, misalnya, dengan menggunakantomografi terkomputasi emisi foton tunggal.133Xe juga telah digunakan untuk mengukuraliran darah.[161][162][163]
Xenon, khususnya129Xe yang terhiperpolarisasi, adalah agen kontras yang berguna untukpencitraan resonansi magnetik(MRI). Pada fase gas, ia dapat mencitrakan rongga dalam sampel berpori, alveoli di paru-paru, atau aliran gas di dalam paru-paru.[164][165]Karena xenondapat larutbaik dalam air maupun dalam pelarut hidrofobik, xenon dapat mencitrakan berbagai jaringan lunak yang hidup.[166][167][168]
Xenon-129 saat ini digunakan sebagai agen visualisasi dalam pemindaian MRI. Ketika seorang pasien menghirup xenon-129 yang terhiperpolarisasi, ventilasi dan pertukaran gas di paru-paru dapat dicitrakan dan diukur. Tidak seperti xenon-133, xenon-129 tidak mengion dan aman untuk dihirup tanpa adanya efek samping.[169]
Pembedahan
[sunting|sunting sumber]Laser eksimerxenon klorida memiliki kegunaan dermatologis tertentu.[170]
Spektroskopi NMR
[sunting|sunting sumber]Karena kulit elektron terluar atom xenon yang besar dan fleksibel, spektrumNMRberubah sebagai respons terhadap kondisi sekitar dan dapat digunakan untuk memantau keadaan kimiawi di sekitarnya. Misalnya, xenon yang larut dalam air, xenon yang larut dalam pelarut hidrofobik, dan xenon yang berasosiasi dengan protein tertentu dapat dibedakan melalui NMR.[171][172]
Xenon terhiperpolarisasi dapat digunakan olehkimiawan permukaan.Biasanya, sulit untuk mengarakterisasi permukaan dengan NMR karena sinyal dari permukaan diliputi oleh sinyal dari inti atom dalam sebagian besar sampel, yang jumlahnya jauh lebih banyak daripada inti permukaan. Namun, spin inti pada permukaan padat dapat dipolarisasikan secara selektif denganmentransfer polarisasi spin ke merekadari gas xenon yang terhiperpolarisasi. Ini akan membuat sinyal permukaan cukup kuat untuk diukur dan dibedakan dari sinyal massal.[173][174]
Lainnya
[sunting|sunting sumber]Dalam studienergi nuklir,xenon digunakan dalambilik gelembung,[175]prob, dan di area lain di manaberat molekultinggi dan sifat lengai diinginkan. Produk sampingan dari pengujiansenjata nukliradalah pelepasanxenon-133 dan xenon-135yang radioaktif. Kedua isotop ini dipantau untuk memastikan kepatuhan terhadaptraktat pelarangan uji cobanuklir,[176]dan untuk mengonfirmasi uji coba nuklir oleh negara-negara sepertiKorea Utara.[177]

Xenon cair digunakan dalamkalorimeter[178]untuk mengukursinar gama,dan sebagai pendeteksipartikel masif berinteraksi lemah(WIMP) yang hipotetis. Ketika WIMP bertabrakan dengan nukleus xenon, teori memperkirakan bahwa ia akan memberikan energi yang cukup untuk menyebabkan ionisasi danskintilasi.Xenon cair berguna untuk eksperimen ini karena kepadatannya membuat interaksi materi gelap lebih mungkin terjadi dan memungkinkan pendeteksi senyap melalui pelindung diri.
Xenon adalahpropelanpilihan untukpropulsi ionwahana antariksakarena ia memilikipotensial ionisasiperberat atomyang rendah dan dapat disimpan sebagai cairan di dekatsuhu kamar(di bawah tekanan tinggi), namun mudah diuapkan untuk memberi makan mesin. Xenon bersifat lengai, ramah lingkungan, dan kurang korosif terhadapmesin iondibandingkan bahan bakar lain sepertiraksaatausesium.Xenon pertama kali digunakan untuk mesin ion satelit pada tahun 1970-an.[179]Ia kemudian digunakan sebagai propelan untuk probDeep Space 1JPL, wahana antariksaSMART-1Eropa,[19]dan untuk tiga mesin propulsi ion padaWahana AntariksaDawnNASA.[180]
Secara kimia, senyawaperxenatdigunakan sebagaizat pengoksidasidalamkimia analitik.Xenon difluoridadigunakan sebagai etsa untuksilikon,khususnya dalam produksisistem mikroelektromekanis(MEMS).[181]Obat antikanker5-fluorourasildapat diproduksi dengan mereaksikan xenon difluorida denganurasil.[182]Xenon juga digunakan dalamkristalografi protein.Diterapkan pada tekanan mulai dari 0,5 hingga 5 MPa(5 hingga 50atm) pada kristal protein, atom xenon akan mengikat dalam rongga yang didominasihidrofobik,seringkali menciptakan turunan atom berat berkualitas tinggi dan isomorf yang dapat digunakan untuk memecahkanmasalah fase.[183][184]
Pencegahan
[sunting|sunting sumber]| Bahaya |
|---|
Gas xenon dapat disimpan dengan aman dalam wadah kaca atau logam tertutup normal padasuhu dan tekanan standar.Namun, ia mudah larut di sebagian besar plastik dan karet, dan secara bertahap akan keluar dari wadah yang disegel dengan bahan tersebut.[186]Xenon tidakberacun,meskipun ia dapat larut dalam darah dan termasuk dalam kelompok zat tertentu yang menembussawar darah–otak,menyebabkananestesibedah ringan hingga penuh saat dihirup dalam konsentrasi tinggi dengan oksigen.[187]
Kecepatan suaradalam gas xenon (169 m/s) lebih rendah daripada di udara[188]karena kecepatan rata-rata atom xenon berat lebih rendah daripada molekul nitrogen dan oksigen di udara. Oleh karena itu, xenon bergetar lebih lambat padapita suarasaat dihembuskan dan menghasilkan nada suara yang lebih rendah (suara dengan frekuensi rendah yang ditingkatkan, tetapifrekuensi dasarataunadatidak berubah), efek yang berlawanan dengan suara nada tinggi yang dihasilkan dalamhelium.Khususnya, saatsaluran vokaldiisi dengan gas xenon, frekuensi resonansi alaminya menjadi lebih rendah daripada saat diisi udara. Dengan demikian, frekuensi rendah dari gelombang suara yang dihasilkan oleh getaran langsung yang sama dari pita suara akan ditingkatkan, menghasilkan perubahantimbresuara yang diperkuat oleh saluran vokal. Sama seperti helium, xenon tidak memenuhi kebutuhan tubuh akan oksigen, dan ia merupakanasfiksiasederhana dan anestesi yang lebih kuat daripada dinitrogen monoksida; akibatnya, dan karena xenon berharga mahal, banyak universitas melarang aksi perubahan suara sebagai demonstrasi kimia umum. Gasbelerang heksafluoridamirip dengan xenon dalam berat molekul (146 versus 131), lebih murah, dan meskipun merupakan asfiksia, ia tidak beracun atau bersifat anestesi; ia sering diganti dalam demonstrasi ini.[189]
Gas padat seperti xenon dan belerang heksafluorida dapat dihirup dengan aman bila dicampur dengan setidaknya 20% oksigen. Xenon pada konsentrasi 80% bersama dengan oksigen 20% akan dengan cepat menghasilkan ketidaksadaran anestesi umum (dan telah digunakan untuk ini, seperti yang dibahas di atas). Pernapasan dapat mencampur gas dengan kepadatan berbeda dengan sangat efektif dan cepat sehingga gas yang lebih berat akan dibersihkan bersama dengan oksigen, dan tidak menumpuk di dasar paru-paru.[190]Namun, ada bahaya yang terkait dengan gas berat apa pun dalam jumlah besar: gas tersebut mungkin tidak terlihat di dalam wadah, dan seseorang yang memasuki area yang berisi gas tidak berbau dan tidak berwarna dapat mengalami sesak napas tanpa peringatan. Xenon jarang digunakan dalam jumlah yang cukup besar untuk dapat menjadi perhatian, meskipun potensi bahaya selalu ada setiap kali tangki atau wadah xenon disimpan di ruangan yang tidak berventilasi.[191]
Senyawa xenon yang larut dalam air sepertimononatrium xenatcukup beracun, tetapi memiliki waktu paruh tubuh yang sangat singkat — xenat yang disuntikkansecara intravenaakan direduksi menjadi xenon elemental dalam waktu sekitar satu menit.[187]
Lihat pula
[sunting|sunting sumber]Referensi
[sunting|sunting sumber]- ^(Indonesia)"Xenon".KBBI Daring.Diakses tanggal17 Juli2022.
- ^"Xenon".Gas Encyclopedia.Air Liquide. 2009.
- ^abHaynes, William M., ed. (2011).CRC Handbook of Chemistry and Physics(edisi ke-92). Boca Raton, FL:CRC Press.hlm. 4.123.ISBN1439855110.
- ^Hwang, Shuen-Cheng; Weltmer, William R. (2000). "Helium Group Gases".Kirk-Othmer Encyclopedia of Chemical Technology.Wiley. hlm. 343–383.doi:10.1002/0471238961.0701190508230114.a01.ISBN0-471-23896-1.
- ^Magnetic susceptibility of the elements and inorganic compounds,inLide, D. R., ed. (2005).CRC Handbook of Chemistry and Physics(edisi ke-86). Boca Raton (FL): CRC Press.ISBN0-8493-0486-5.
- ^Weast, Robert (1984).CRC, Handbook of Chemistry and Physics.Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110.ISBN0-8493-0464-4.
- ^ab"Observation of two-neutrino double electron capture in124Xe with XENON1T ".Nature.568(7753): 532–535. 2019.doi:10.1038/s41586-019-1124-4.Kesalahan pengutipan: Tanda
<ref>tidak sah; nama "xenon1T" didefinisikan berulang dengan isi berbeda - ^Albert, J. B.; Auger, M.; Auty, D. J.; Barbeau, P. S.; Beauchamp, E.; Beck, D.; Belov, V.; Benitez-Medina, C.; Bonatt, J.; Breidenbach, M.; Brunner, T.; Burenkov, A.; Cao, G. F.; Chambers, C.; Chaves, J.; Cleveland, B.; Cook, S.; Craycraft, A.; Daniels, T.; Danilov, M.; Daugherty, S. J.; Davis, C. G.; Davis, J.; Devoe, R.; Delaquis, S.; Dobi, A.; Dolgolenko, A.; Dolinski, M. J.; Dunford, M.; et al. (2014). "Improved measurement of the 2νββ half-life of136Xe with the EXO-200 detector ".Physical Review C.89.arXiv:1306.6106
 .Bibcode:2014PhRvC..89a5502A.doi:10.1103/PhysRevC.89.015502.
.Bibcode:2014PhRvC..89a5502A.doi:10.1103/PhysRevC.89.015502.
- ^Staff (2007)."Xenon".Columbia Electronic Encyclopedia(edisi ke-6). Columbia University Press.Diakses tanggal20 Juni2023.
- ^abHusted, Robert; Boorman, Mollie (15 Desember 2003)."Xenon".Laboratorium Nasional Los Alamos,Chemical Division.Diakses tanggal20 Juni2023.
- ^Rabinovich, Viktor Abramovich; Vasserman, A. A.; Nedostup, V. I.; Veksler, L. S. (1988).Thermophysical properties of neon, argon, krypton, and xenon.Washington.10.Washington, DC: Hemisphere Publishing Corp.Bibcode:1988wdch...10.....R.ISBN0-89116-675-0.—National Standard Reference Data Service of the USSR. Volume 10.
- ^abFreemantle, Michael (25 Agustus 2003). "Chemistry at its Most Beautiful".Chemical & Engineering News.Vol. 81 no. 34. hlm. 27–30.doi:10.1021/cen-v081n034.p027.
- ^abcBurke, James (2003).Twin Tracks: The Unexpected Origins of the Modern World.Oxford University Press. hlm.33.ISBN0-7432-2619-4.
- ^abMellor, David (2000).Sound Person's Guide to Video
 .Focal Press.hlm.186.ISBN0-240-51595-1.
.Focal Press.hlm.186.ISBN0-240-51595-1.
- ^Sanders, Robert D.; Ma, Daqing; Maze, Mervyn (2005). "Xenon: elemental anaesthesia in clinical practice".British Medical Bulletin.71(1): 115–35.doi:10.1093/bmb/ldh034
 .PMID15728132.
.PMID15728132.
- ^abBasov, N. G.; Danilychev, V. A.; Popov, Yu. M. (1971). "Stimulated Emission in the Vacuum Ultraviolet Region".Soviet Journal of Quantum Electronics.1(1): 18–22.Bibcode:1971QuEle...1...18B.doi:10.1070/QE1971v001n01ABEH003011.
- ^abToyserkani, E.; Khajepour, A.; Corbin, S. (2004).Laser Cladding.CRC Press. hlm. 48.ISBN0-8493-2172-7.
- ^Ball, Philip (1 Mei 2002)."Xenon outs WIMPs".Nature.doi:10.1038/news020429-6.Diakses tanggal20 Juni2023.
- ^abSaccoccia, G.; del Amo, J. G.; Estublier, D. (31 Agustus 2006)."Ion engine gets SMART-1 to the Moon".ESA.Diakses tanggal21 Juni2023.
- ^abKaneoka, Ichiro (1998). "Xenon's Inside Story".Science.280(5365): 851–852.doi:10.1126/science.280.5365.851b.
- ^abStacey, Weston M. (2007).Nuclear Reactor Physics.Wiley-VCH. hlm. 213.ISBN978-3-527-40679-1.
- ^ Ramsay, Sir William (12 Juli 1898)."Nobel Lecture – The Rare Gases of the Atmosphere".nobelprize.org.Nobel Media AB.Diakses tanggal20 Juni2023.
- ^Ramsay, W.; Travers, M. W. (1898)."On the extraction from air of the companions of argon, and neon".Report of the Meeting of the British Association for the Advancement of Science:828.
- ^Gagnon, Steve."It's Elemental – Xenon".Thomas Jefferson National Accelerator Facility.Diakses tanggal20 Juni2023.
- ^Anonymous (1904). Daniel Coit Gilman; Harry Thurston Peck; Frank Moore Colby, ed.The New International Encyclopædia.Dodd, Mead and Company.hlm. 906.
- ^Staff (1991).The Merriam-Webster New Book of Word Histories.Merriam-Webster, Inc. hlm. 513.ISBN0-87779-603-3.
- ^Ramsay, William (1902). "An Attempt to Estimate the Relative Amounts of Krypton and of Xenon in Atmospheric Air".Proceedings of the Royal Society of London.71(467–476): 421–426.Bibcode:1902RSPS...71..421R.doi:10.1098/rspl.1902.0121.
- ^Anonymous."History".Millisecond Cinematography. Diarsipkan dariversi aslitanggal 22 Agustus 2006.Diakses tanggal20 Juni2023.
- ^Paschotta, Rüdiger (1 November 2007)."Lamp-pumped lasers".Encyclopedia of Laser Physics and Technology.RP Photonics.Diakses tanggal20 Juni2023.
- ^Marx, Thomas; Schmidt, Michael; Schirmer, Uwe; Reinelt, Helmut (2000)."Xenon anesthesia"(PDF).Journal of the Royal Society of Medicine.93(10): 513–7.doi:10.1177/014107680009301005.PMC1298124
 .PMID11064688.Diakses tanggal20 Juni2023.
.PMID11064688.Diakses tanggal20 Juni2023.
- ^Bartlett, Neil; Lohmann, D. H. (1962). "Dioxygenyl hexafluoroplatinate (V),O+2[PtF6]−".Proceedings of the Chemical Society.London: Chemical Society (3): 115.doi:10.1039/PS9620000097.
- ^Bartlett, N. (1962). "Xenon hexafluoroplatinate (V) Xe+[PtF6]−".Proceedings of the Chemical Society.London:Chemical Society(6): 218.doi:10.1039/PS9620000197.
- ^Graham, L.; Graudejus, O.; Jha N.K.; Bartlett, N. (2000). "Concerning the nature of XePtF6".Coordination Chemistry Reviews.197(1): 321–334.doi:10.1016/S0010-8545(99)00190-3.
- ^Holleman, A. F.; Wiberg, Egon (2001). Bernhard J. Aylett, ed.Inorganic Chemistry.translated by Mary Eagleson and William Brewer. San Diego:Academic Press.ISBN0-12-352651-5.;terjemahan dariLehrbuch der Anorganischen Chemie,ditemukan oleh A. F. Holleman,dilanjutkan oleh Egon Wiberg,disunting oleh Nils Wiberg, Berlin: de Gruyter, 1995, edisi ke-34,ISBN3-11-012641-9.
- ^Steel, Joanna (2007)."Biography of Neil Bartlett".College of Chemistry, University of California, Berkeley. Diarsipkan dariversi aslitanggal 23 September 2009.Diakses tanggal20 Juni2023.
- ^Bartlett, Neil (9 September 2000)."The Noble Gases".Chemical & Engineering News.American Chemical Society.81(36): 32–34.doi:10.1021/cen-v081n036.p032.Diakses tanggal20 Juni2023.
- ^Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (24 Agustus 2000)."A stable argon compound".Nature.406(6798): 874–6.Bibcode:2000Natur.406..874K.doi:10.1038/35022551.PMID10972285.
- ^Lynch, C. T.; Summitt, R.; Sliker, A. (1980).CRC Handbook of Materials Science
 .CRC Press.ISBN0-87819-231-X.
.CRC Press.ISBN0-87819-231-X.
- ^MacKenzie, D. R. (1963). "Krypton Difluoride: Preparation and Handling".Science.141(3586): 1171.Bibcode:1963Sci...141.1171M.doi:10.1126/science.141.3586.1171.PMID17751791.
- ^Paul R. Fields; Lawrence Stein; Moshe H. Zirin (1962). "Radon Fluoride".Journal of the American Chemical Society.84(21): 4164–4165.doi:10.1021/ja00880a048.
- ^"Xenon".Periodic Table Online.CRC Press. Diarsipkan dariversi aslitanggal 10 April 2007.Diakses tanggal20 Juni2023.
- ^Moody, G. J. (1974)."A Decade of Xenon Chemistry".Journal of Chemical Education.51(10): 628–630.Bibcode:1974JChEd..51..628M.doi:10.1021/ed051p628.Diakses tanggal20 Juni2023.
- ^Browne, Malcolm W. (5 April 1990)"2 Researchers Spell 'I.B.M.,' Atom by Atom".New York Times
- ^Williams, David R. (19 April 2007)."Earth Fact Sheet".NASA.Diakses tanggal20 Juni2023.
- ^abAprile, Elena; Bolotnikov, Aleksey E.; Doke, Tadayoshi (2006).Noble Gas Detectors.Wiley-VCH.hlm. 8–9.ISBN3-527-60963-6.
- ^Rentzepis, P. M.;Douglass, D. C. (1981-09-10). "Xenon as a solvent".Nature.293(5828): 165–166.Bibcode:1981Natur.293..165R.doi:10.1038/293165a0.
- ^Caldwell, W. A.; Nguyen, J.; Pfrommer, B.; Louie, S.;Jeanloz, R.(1997). "Structure, bonding and geochemistry of xenon at high pressures".Science.277(5328): 930–933.doi:10.1126/science.277.5328.930.
- ^Fontes, E."Golden Anniversary for Founder of High-pressure Program at CHESS".Cornell University.Diakses tanggal20 Juni2023.
- ^Eremets, Mikhail I.;Gregoryanz, Eugene A.; Struzhkin, Victor V.; Mao, Ho-Kwang; Hemley, Russell J.; Mulders, Norbert; Zimmerman, Neil M. (2000). "Electrical Conductivity of Xenon at Megabar Pressures".Physical Review Letters.85(13): 2797–800.Bibcode:2000PhRvL..85.2797E.doi:10.1103/PhysRevLett.85.2797.PMID10991236.
- ^Iakoubovskii, Konstantin; Mitsuishi, Kazutaka; Furuya, Kazuo (2008). "Structure and pressure inside Xe nanoparticles embedded in Al".Physical Review B.78(6): 064105.Bibcode:2008PhRvB..78f4105I.doi:10.1103/PhysRevB.78.064105.
- ^Bader, Richard F. W."An Introduction to the Electronic Structure of Atoms and Molecules".McMaster University.Diakses tanggal20 Juni2023.
- ^Talbot, John."Spectra of Gas Discharges".Rheinisch-Westfälische Technische Hochschule Aachen. Diarsipkan dariversi aslitanggal 18 Juli 2007.Diakses tanggal20 Juni2023.
- ^Watts, William Marshall (1904).An Introduction to the Study of Spectrum Analysis.London:Longmans, Green, and Co.
- ^Hwang, Shuen-Cheng; Robert D. Lein; Daniel A. Morgan (2005). "Noble Gases".Kirk-Othmer Encyclopedia of Chemical Technology(edisi ke-5).Wiley.doi:10.1002/0471238961.0701190508230114.a01.ISBN0-471-48511-X.
- ^Lebedev, P. K.; Pryanichnikov, V. I. (1993)."Present and future production of xenon and krypton in the former USSR region and some physical properties of these gases"(PDF).Nuclear Instruments and Methods in Physics Research A.327(1): 222–226.Bibcode:1993NIMPA.327..222L.doi:10.1016/0168-9002(93)91447-U.
- ^Kerry, Frank G. (2007).Industrial Gas Handbook: Gas Separation and Purification.CRC Press. hlm. 101–103.ISBN978-0-8493-9005-0.
- ^"Xenon – Xe".CFC StarTec LLC. 10 Agustus 1998. Diarsipkan dariversi aslitanggal 12 Juni 2020.Diakses tanggal21 Juni2023.
- ^abHäussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann (2001). "Noble Gases".Ullmann's Encyclopedia of Industrial Chemistry(edisi ke-6). Wiley.doi:10.1002/14356007.a17_485.ISBN3-527-20165-3.
- ^Arnett, David (1996).Supernovae and Nucleosynthesis.Princeton, New Jersey:Princeton University Press.ISBN0-691-01147-8.
- ^Mahaffy, P. R.; Niemann, H. B.; Alpert, A.; Atreya, S. K.; Demick, J.; Donahue, T. M.; Harpold, D. N.; Owen, T. C. (2000). "Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer".Journal of Geophysical Research.105(E6): 15061–15072.Bibcode:2000JGR...10515061M.doi:10.1029/1999JE001224
 .
.
- ^Fraksi massa dihitung dari massa rata-rata atom di Tata Surya, sekitar 1,29 satuan massa atom
- ^Owen, Tobias; Mahaffy, Paul; Niemann, H. B.; Atreya, Sushil; Donahue, Thomas; Bar-Nun, Akiva; de Pater, Imke (1999)."A low-temperature origin for the planetesimals that formed Jupiter"(PDF).Nature.402(6759): 269–70.Bibcode:1999Natur.402..269O.doi:10.1038/46232.hdl:2027.42/62913
 .PMID10580497.
.PMID10580497.
- ^Sanloup, Chrystèle; et al. (2005). "Retention of Xenon in Quartz and Earth's Missing Xenon".Science.310(5751): 1174–7.Bibcode:2005Sci...310.1174S.doi:10.1126/science.1119070.PMID16293758.
- ^Clayton, Donald D. (1983).Principles of Stellar Evolution and Nucleosynthesis
 .University of Chicago Press.hlm.604.ISBN0-226-10953-4.
.University of Chicago Press.hlm.604.ISBN0-226-10953-4.
- ^Heymann, D.; Dziczkaniec, M. (19–23 Maret 1979).Xenon from intermediate zones of supernovae.Proceedings 10th Lunar and Planetary Science Conference.Houston, Texas: Pergamon Press, Inc. hlm. 1943–1959.Bibcode:1979LPSC...10.1943H.
- ^Pignatari, M.; Gallino, R.; Straniero, O.; Davis, A. (2004). "The origin of xenon trapped in presolar mainstream SiC grains".Memorie della Societa Astronomica Italiana.75:729–734.Bibcode:2004MmSAI..75..729P.
- ^Beer, H.; Kaeppeler, F.; Reffo, G.; Venturini, G. (November 1983). "Neutron capture cross-sections of stable xenon isotopes and their application in stellar nucleosynthesis".Astrophysics and Space Science.97(1): 95–119.Bibcode:1983Ap&SS..97...95B.doi:10.1007/BF00684613.
- ^abcCaldwell, Eric (January 2004)."Periodic Table – Xenon".Resources on Isotopes.USGS.Diakses tanggal21 Juni2023.
- ^""Xenon Poisoning "or Neutron Absorption in Reactors".
- ^"Chernobyl Appendix 1: Sequence of Events - World Nuclear Association".
- ^Lee, Seung-Kon; Beyer, Gerd J.; Lee, Jun Sig (2016)."Development of Industrial-Scale Fission 99Mo Production Process Using Low Enriched Uranium Target".Nuclear Engineering and Technology.48(3): 613–623.doi:10.1016/j.net.2016.04.006.
- ^"Novel gas-capture approach advances nuclear fuel management".
- ^"What's in Spent Nuclear Fuel? (After 20 yrs) – Energy from Thorium".
- ^Barabash, A. S. (2002). "Average (Recommended) Half-Life Values for Two-Neutrino Double-Beta Decay".Czechoslovak Journal of Physics.52(4): 567–573.arXiv:nucl-ex/0203001
 .Bibcode:2002CzJPh..52..567B.doi:10.1023/A:1015369612904.
.Bibcode:2002CzJPh..52..567B.doi:10.1023/A:1015369612904.
- ^Ackerman, N. (2011). "Observation of Two-Neutrino Double-Beta Decay in136Xe with the EXO-200 Detector ".Physical Review Letters.107(21): 212501.arXiv:1108.4193
 .Bibcode:2011PhRvL.107u2501A.doi:10.1103/PhysRevLett.107.212501.PMID22181874.
.Bibcode:2011PhRvL.107u2501A.doi:10.1103/PhysRevLett.107.212501.PMID22181874.
- ^Otten, Ernst W. (2004). "Take a breath of polarized noble gas".Europhysics News.35(1): 16–20.Bibcode:2004ENews..35...16O.doi:10.1051/epn:2004109
 .
.
- ^Ruset, I. C.; Ketel, S.; Hersman, F. W. (2006). "Optical Pumping System Design for Large Production of Hyperpolarized129Xe ".Physical Review Letters.96(5): 053002.Bibcode:2006PhRvL..96e3002R.doi:10.1103/PhysRevLett.96.053002.PMID16486926.
- ^Wolber, J.; Cherubini, A.; Leach, M. O.; Bifone, A. (2000). "On the oxygenation-dependent129Xe t1in blood ".NMR in Biomedicine.13(4): 234–7.doi:10.1002/1099-1492(200006)13:4<234::AID-NBM632>3.0.CO;2-K.PMID10867702.
- ^Chann, B.; Nelson, I. A.; Anderson, L. W.; Driehuys, B.; Walker, T. G. (2002). "129Xe-Xe molecular spin relaxation ".Physical Review Letters.88(11): 113–201.Bibcode:2002PhRvL..88k3201C.doi:10.1103/PhysRevLett.88.113201.PMID11909399.
- ^von Schulthess, Gustav Konrad; Smith, Hans-Jørgen; Pettersson, Holger; Allison, David John (1998).The Encyclopaedia of Medical Imaging.Taylor & Francis. hlm. 194.ISBN1-901865-13-4.
- ^Warren, W. W.; Norberg, R. E. (1966). "Nuclear Quadrupole Relaxation and Chemical Shift of Xe131in Liquid and Solid Xenon ".Physical Review.148(1): 402–412.Bibcode:1966PhRv..148..402W.doi:10.1103/PhysRev.148.402.
- ^Staff."Hanford Becomes Operational".The Manhattan Project: An Interactive History.U.S. Department of Energy.Diarsipkan dariversi aslitanggal 10 Desember 2009.Diakses tanggal21 Juni2023.
- ^Pfeffer, Jeremy I.; Nir, Shlomo (2000).Modern Physics: An Introductory Text.Imperial College Press.hlm. 421 ff.ISBN1-86094-250-4.
- ^Laws, Edwards A. (2000).Aquatic Pollution: An Introductory Text.John Wiley and Sons. hlm. 505.ISBN0-471-34875-9.
- ^Staff (9 April 1979)."A Nuclear Nightmare".Time.Diarsipkan dariversi aslitanggal 12 Oktober 2007.Diakses tanggal21 Juni2023.
- ^Meshik, A. P.; Hohenberg, C. M.; Pravdivtseva, O. V. (2004). "Record of Cycling Operation of the Natural Nuclear Reactor in the Oklo/Okelobondo Area in Gabon".Phys. Rev. Lett.93(18): 182302.Bibcode:2004PhRvL..93r2302M.doi:10.1103/physrevlett.93.182302.ISSN0031-9007.PMID15525157.
- ^abClayton, Donald D. (1983).Principles of Stellar Evolution and Nucleosynthesis
 (edisi ke-2). University of Chicago Press. hlm.75.ISBN0-226-10953-4.
(edisi ke-2). University of Chicago Press. hlm.75.ISBN0-226-10953-4.
- ^abBolt, B. A.; Packard, R. E.; Price, P. B. (2007)."John H. Reynolds, Physics: Berkeley".The University of California, Berkeley.Diakses tanggal21 Juni2023.
- ^Williams, David R. (September 1, 2004)."Mars Fact Sheet".NASA. Diarsipkan dariversi aslitanggal 12 Juni 2010.Diakses tanggal21 Juni2023.
- ^Schilling, James."Why is the Martian atmosphere so thin and mainly carbon dioxide?".Mars Global Circulation Model Group. Diarsipkan dariversi aslitanggal 28 Mei 2010.Diakses tanggal21 Juni2023.
- ^Zahnle, Kevin J. (1993)."Xenological constraints on the impact erosion of the early Martian atmosphere".Journal of Geophysical Research.98(E6): 10,899–10,913.Bibcode:1993JGR....9810899Z.doi:10.1029/92JE02941.
- ^Boulos, M. S.; Manuel, O.K. (1971). "The xenon record of extinct radioactivities in the Earth".Science.174(4016): 1334–6.Bibcode:1971Sci...174.1334B.doi:10.1126/science.174.4016.1334.PMID17801897.
- ^abHarding, Charlie; Johnson, David Arthur; Janes, Rob (2002).Elements of thepblock.Great Britain: Royal Society of Chemistry. hlm. 93–94.ISBN0-85404-690-9.
- ^Dean H Liskow; Henry F Schaefer III; Paul S Bagus; Bowen Liu (1973). "Probable nonexistence of xenon monofluoride as a chemically bound species in the gas phase".J Am Chem Soc.95(12): 4056–4057.doi:10.1021/ja00793a042.
- ^Weeks, James L.; Chernick, Cedric; Matheson, Max S. (1962). "Photochemical Preparation of Xenon Difluoride".Journal of the American Chemical Society.84(23): 4612–4613.doi:10.1021/ja00882a063.
- ^Streng, L. V.; Streng, A. G. (1965). "Formation of Xenon Difluoride from Xenon and Oxygen Difluoride or Fluorine in Pyrex Glass at Room Temperature".Inorganic Chemistry.4(9): 1370–1371.doi:10.1021/ic50031a035.
- ^abTramšek, Melita; Žemva, Boris (December 5, 2006). "Synthesis, Properties and Chemistry of Xenon(II) Fluoride".Acta Chimica Slovenica.53(2): 105–116.doi:10.1002/chin.200721209.
- ^Ogrin, Tomaz; Bohinc, Matej; Silvnik, Joze (1973). "Melting-point determinations of xenon difluoride-xenon tetrafluoride mixtures".Journal of Chemical and Engineering Data.18(4): 402.doi:10.1021/je60059a014.
- ^abScott, Thomas; Eagleson, Mary (1994)."Xenon Compounds".Concise encyclopedia chemistry.Walter de Gruyter.hlm. 1183.ISBN3-11-011451-8.
- ^Proserpio, Davide M.; Hoffmann, Roald; Janda, Kenneth C. (1991). "The xenon-chlorine conundrum: van der Waals complex or linear molecule?".Journal of the American Chemical Society.113(19): 7184–7189.doi:10.1021/ja00019a014.
- ^Richardson, Nancy A.; Hall, Michael B. (1993). "The potential energy surface of xenon dichloride".The Journal of Physical Chemistry.97(42): 10952–10954.doi:10.1021/j100144a009.
- ^Bell, C.F. (2013).Syntheses and Physical Studies of Inorganic Compounds.Elsevier Science. hlm. 143.ISBN9781483280608.
- ^Cockett, A.H.; Smith, K.C.; Bartlett, N. (2013).The Chemistry of the Monatomic Gases: Pergamon Texts in Inorganic Chemistry.Elsevier Science. hlm. 292.ISBN9781483157368.
- ^Brock, D.S.; Schrobilgen, G.J. (2011). "Synthesis of the missing oxide of xenon, XeO2,and its implications for earth's missing xenon ".Journal of the American Chemical Society.133(16): 6265–9.doi:10.1021/ja110618g.PMID21341650.
- ^"Chemistry: Where did the xenon go?".Nature.471(7337): 138. 2011.Bibcode:2011Natur.471T.138..doi:10.1038/471138d
 .
.
- ^Zhou, M.; Zhao, Y.; Gong, Y.; Li, J. (2006). "Formation and Characterization of the XeOO+Cation in Solid Argon ".Journal of the American Chemical Society.128(8): 2504–5.doi:10.1021/ja055650n.PMID16492012.
- ^Holloway, John H.; Hope, Eric G. (1998). A. G. Sykes, ed.Advances in Inorganic Chemistry Press.Academic. hlm. 65.ISBN0-12-023646-X.
- ^abHenderson, W. (2000).Main group chemistry.Britania Raya:Royal Society of Chemistry.hlm. 152–153.ISBN0-85404-617-8.
- ^abcdMackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002).Introduction to modern inorganic chemistry(edisi ke-6). CRC Press. hlm. 497–501.ISBN0-7487-6420-8.
- ^Smith, D. F. (1963). "Xenon Oxyfluoride".Science.140(3569): 899–900.Bibcode:1963Sci...140..899S.doi:10.1126/science.140.3569.899.PMID17810680.
- ^Christe, K. O.; Dixon, D. A.; Sanders, J. C. P.; Schrobilgen, G. J.; Tsai, S. S.; Wilson, W. W. (1995). "On the Structure of the [XeOF5]−Anion and of Heptacoordinated Complex Fluorides Containing One or Two Highly Repulsive Ligands or Sterically Active Free Valence Electron Pairs ".Inorg. Chem.34(7): 1868–1874.doi:10.1021/ic00111a039.
- ^Christe, K. O.; Schack, C. J.; Pilipovich, D. (1972). "Chlorine trifluoride oxide. V. Complex formation with Lewis acids and bases".Inorg. Chem.11(9): 2205–2208.doi:10.1021/ic50115a044.
- ^Holloway, John H.; Hope, Eric G. (1998).Advances in Inorganic Chemistry.Contributor A. G. Sykes. Academic Press. hlm. 61–90.ISBN0-12-023646-X.
- ^Frohn, H.; Theißen, Michael (2004). "C6F5XeF, a versatile starting material in xenon–carbon chemistry ".Journal of Fluorine Chemistry.125(6): 981–988.doi:10.1016/j.jfluchem.2004.01.019.
- ^Goetschel, Charles T.; Loos, Karl R. (1972). "Reaction of xenon with dioxygenyl tetrafluoroborate. Preparation of FXe-BF2".Journal of the American Chemical Society.94(9): 3018–3021.doi:10.1021/ja00764a022.
- ^Li, Wai-Kee; Zhou, Gong-Du; Mak, Thomas C. W. (2008). Gong-Du Zhou; Thomas C. W. Mak, ed.Advanced Structural Inorganic Chemistry.Oxford University Press.hlm. 678.ISBN978-0-19-921694-9.
- ^Li, Wai-Kee; Zhou, Gong-Du; Mak, Thomas C. W. (2008).Advanced Structural Inorganic Chemistry
 .Oxford University Press. hlm.674.ISBN978-0-19-921694-9.
.Oxford University Press. hlm.674.ISBN978-0-19-921694-9.
- ^Gerber, R. B. (2004). "Formation of novel rare-gas molecules in low-temperature matrices".Annual Review of Physical Chemistry.55(1): 55–78.Bibcode:2004ARPC...55...55G.doi:10.1146/annurev.physchem.55.091602.094420.PMID15117247.
- ^Khriachtchev, Leonid; Isokoski, Karoliina; Cohen, Arik; Räsänen, Markku; Gerber, R. Benny (2008). "A Small Neutral Molecule with Two Noble-Gas Atoms: HXeOXeH".Journal of the American Chemical Society.130(19): 6114–8.doi:10.1021/ja077835v.PMID18407641.
- ^Pettersson, Mika; Khriachtchev, Leonid; Lundell, Jan; Räsänen, Markku (1999). "A Chemical Compound Formed from Water and Xenon: HXeOH".Journal of the American Chemical Society.121(50): 11904–11905.doi:10.1021/ja9932784.
- ^Pauling, L.(1961). "A molecular theory of general anesthesia".Science.134(3471): 15–21.Bibcode:1961Sci...134...15P.doi:10.1126/science.134.3471.15.PMID13733483.Dicetak ulang sebagaiPauling, Linus; Kamb, Barclay, ed. (2001).Linus Pauling: Selected Scientific Papers.2.River Edge, New Jersey: World Scientific. hlm. 1328–1334.ISBN981-02-2940-2.
- ^Henderson, W. (2000).Main group chemistry.Great Britain: Royal Society of Chemistry. hlm. 148.ISBN0-85404-617-8.
- ^Ikeda, Tomoko; Mae, Shinji; Yamamuro, Osamu; Matsuo, Takasuke; Ikeda, Susumu; Ibberson, Richard M. (23 November 2000). "Distortion of Host Lattice in Clathrate Hydrate as a Function of Guest Molecule and Temperature".Journal of Physical Chemistry A.104(46): 10623–10630.Bibcode:2000JPCA..10410623I.doi:10.1021/jp001313j.
- ^Kleppe, Annette K.; Amboage, Mónica; Jephcoat, Andrew P. (2014). "New high-pressure van der Waals compound Kr(H2)4discovered in the krypton-hydrogen binary system ".Scientific Reports.4:4989.Bibcode:2014NatSR...4E4989K.doi:10.1038/srep04989
 .
.
- ^McKay, C. P.; Hand, K. P.; Doran, P. T.; Andersen, D. T.; Priscu, J. C. (2003). "Clathrate formation and the fate of noble and biologically useful gases in Lake Vostok, Antarctica".Geophysical Research Letters.30(13): 35.Bibcode:2003GeoRL..30.1702M.doi:10.1029/2003GL017490.
- ^Barrer, R. M.; Stuart, W. I. (1957). "Non-Stoichiometric Clathrate of Water".Proceedings of the Royal Society of London.243(1233): 172–189.Bibcode:1957RSPSA.243..172B.doi:10.1098/rspa.1957.0213.
- ^Frunzi, Michael; Cross, R. James; Saunders, Martin (2007)."Effect of Xenon on Fullerene Reactions".Journal of the American Chemical Society.129(43): 13343–6.doi:10.1021/ja075568n.PMID17924634.
- ^Silfvast, William Thomas (2004).Laser Fundamentals.Cambridge University Press.ISBN0-521-83345-0.
- ^Webster, John G. (1998).The Measurement, Instrumentation, and Sensors Handbook.Springer.ISBN3-540-64830-5.
- ^McGhee, Charles; Taylor, Hugh R.; Gartry, David S.; Trokel, Stephen L. (1997).Excimer Lasers in Ophthalmology.Informa Health Care.ISBN1-85317-253-7.
- ^Staff (2007)."Xenon Applications".Praxair Technology. Diarsipkan dariversi aslitanggal 22 Maret 2013.Diakses tanggal21 Juni2023.
- ^Baltás, E.; Csoma, Z.; Bodai, L.; Ignácz, F.; Dobozy, A.; Kemény, L. (2003). "A xenon-iodine electric discharge bactericidal lamp".Technical Physics Letters.29(10): 871–872.Bibcode:2003TePhL..29..871S.doi:10.1134/1.1623874.
- ^Skeldon, M. D.; Saager, R.; Okishev, A.; Seka, W. (1997)."Thermal distortions in laser-diode- and flash-lamp-pumped Nd:YLF laser rods"(PDF).LLE Review.71:137–144. Diarsipkan dariversi asli(PDF)tanggal 16 Oktober 2003.Diakses tanggal21 Juni2023.
- ^Anonymous."The plasma behind the plasma TV screen".Plasma TV Science. Diarsipkan dariversi aslitanggal 15 Oktober 2007.Diakses tanggal21 Juni2023.
- ^Marin, Rick (21 Maret 2001)."Plasma TV: That New Object Of Desire".The New York Times.Diakses tanggal21 Juni2023.
- ^Waymouth, John (1971).Electric Discharge Lamps.Cambridge, MA:MIT Press.ISBN0-262-23048-8.
- ^Patel, C. K. N.; Bennett Jr., W. R.; Faust, W. L.; McFarlane, R. A. (1 Agustus 1962)."Infrared spectroscopy using stimulated emission techniques".Physical Review Letters.9(3): 102–104.Bibcode:1962PhRvL...9..102P.doi:10.1103/PhysRevLett.9.102.
- ^Patel, C. K. N.; Faust, W. L.; McFarlane, R. A. (1 Desember 1962). "High gain gaseous (Xe-He) optical masers".Applied Physics Letters.1(4): 84–85.Bibcode:1962ApPhL...1...84P.doi:10.1063/1.1753707.
- ^Bennett, Jr., W. R. (1962). "Gaseous optical masers".Applied Optics.1(S1): 24–61.Bibcode:1962ApOpt...1S..24B.doi:10.1364/AO.1.000024.
- ^"Laser Output".University of Waterloo. Diarsipkan dariversi aslitanggal 6 Juli 2011.Diakses tanggal21 Juni2023.
- ^Neice, A. E.; Zornow, M. H. (2016). "Xenon anaesthesia for all, or only a select few?".Anaesthesia.71(11): 1259–1272.doi:10.1111/anae.13569
 .PMID27530275.
.PMID27530275.
- ^abBanks, P.; Franks, N. P.; Dickinson, R. (2010)."Competitive inhibition at the glycine site of the N-methyl-D-aspartate receptor mediates xenon neuroprotection against hypoxia-ischemia".Anesthesiology.112(3): 614–22.doi:10.1097/ALN.0b013e3181cea398
 .PMID20124979.
.PMID20124979.
- ^Ma, D.; Wilhelm, S.; Maze, M.; Franks, N. P. (2002)."Neuroprotective and neurotoxic properties of the 'inert' gas, xenon".British Journal of Anaesthesia.89(5): 739–46.doi:10.1093/bja/89.5.739
 .PMID12393773.
.PMID12393773.
- ^Nagata, A.; Nakao Si, S.; Nishizawa, N.; Masuzawa, M.; Inada, T.; Murao, K.; Miyamoto, E.; Shingu, K. (2001)."Xenon inhibits but N2O enhances ketamine-induced c-Fos expression in the rat posterior cingulate and retrosplenial cortices ".Anesthesia & Analgesia.92(2): 362–8.doi:10.1213/00000539-200102000-00016.PMID11159233.
- ^Sakamoto, S.; Nakao, S.; Masuzawa, M.; Inada, T.; Maze, M.; Franks, N. P.; Shingu, K. (2006)."The differential effects of nitrous oxide and xenon on extracellular dopamine levels in the rat nucleus accumbens: a microdialysis study".Anesthesia & Analgesia.103(6): 1459–63.doi:10.1213/01.ane.0000247792.03959.f1.PMID17122223.
- ^Gruss, M.; Bushell, T. J.; Bright, D. P.; Lieb, W. R.; Mathie, A.; Franks, N. P. (2004). "Two-pore-domain K+channels are a novel target for the anesthetic gases xenon, nitrous oxide, and cyclopropane ".Molecular Pharmacology.65(2): 443–52.doi:10.1124/mol.65.2.443.PMID14742687.
- ^Yamakura, T.; Harris, R. A. (2000)."Effects of gaseous anesthetics nitrous oxide and xenon on ligand-gated ion channels. Comparison with isoflurane and ethanol".Anesthesiology.93(4): 1095–101.doi:10.1097/00000542-200010000-00034.PMID11020766.
- ^Rashid, M. H.; Furue, H.; Yoshimura, M.; Ueda, H. (2006). "Tonic inhibitory role of α4β2 subtype of nicotinic acetylcholine receptors on nociceptive transmission in the spinal cord in mice".Pain.125(1–2): 125–35.doi:10.1016/j.pain.2006.05.011.PMID16781069.
- ^Lopez, Maria M.; Kosk-Kosicka, Danuta (1995). "How Do Volatile Anesthetics Inhibit Ca2+-ATPases? ".The Journal of Biological Chemistry.270(47): 28239–28245.doi:10.1074/jbc.270.47.28239
 .PMID7499320.
.PMID7499320.
- ^Suzuki, T.; Koyama, H.; Sugimoto, M.; Uchida, I.; Mashimo, T. (2002)."The diverse actions of volatile and gaseous anesthetics on human-cloned 5-hydroxytryptamine3receptors expressed inXenopusoocytes ".Anesthesiology.96(3): 699–704.doi:10.1097/00000542-200203000-00028.PMID11873047.
- ^Nickalls, R.W.D.; Mapleson, W.W. (August 2003)."Age-related iso-MAC charts for isoflurane, sevoflurane and desflurane in man".British Journal of Anaesthesia.91(2): 170–174.doi:10.1093/bja/aeg132
 .PMID12878613.
.PMID12878613.
- ^Goto, T.; Nakata Y; Morita S (2003)."Will xenon be a stranger or a friend?: the cost, benefit, and future of xenon anesthesia".Anesthesiology.98(1): 1–2.doi:10.1097/00000542-200301000-00002.PMID12502969.
- ^Schmidt, Michael; Marx, Thomas; Glöggl, Egon; Reinelt, Helmut; Schirmer, Uwe (May 2005)."Xenon Attenuates Cerebral Damage after Ischemia in Pigs".Anesthesiology.102(5): 929–936.doi:10.1097/00000542-200505000-00011.PMID15851879.
- ^Dingley, J.; Tooley, J.; Porter, H.; Thoresen, M. (2006)."Xenon Provides Short-Term Neuroprotection in Neonatal Rats When Administered After Hypoxia-Ischemia".Stroke.37(2): 501–6.doi:10.1161/01.STR.0000198867.31134.ac
 .PMID16373643.
.PMID16373643.
- ^Weber, N. C.; Toma, O.; Wolter, J. I.; Obal, D.; Müllenheim, J.; Preckel, B.; Schlack, W. (2005)."The noble gas xenon induces pharmacological preconditioning in the rat heart in vivo via induction of PKC-epsilon and p38 MAPK".Br J Pharmacol.144(1): 123–32.doi:10.1038/sj.bjp.0706063.PMC1575984
 .PMID15644876.
.PMID15644876.
- ^Bantel, C.; Maze, M.; Trapp, S. (2009)."Neuronal preconditioning by inhalational anesthetics: evidence for the role of plasmalemmal adenosine triphosphate-sensitive potassium channels".Anesthesiology.110(5): 986–95.doi:10.1097/ALN.0b013e31819dadc7.PMC2930813
 .PMID19352153.
.PMID19352153.
- ^Bantel, C.; Maze, M.; Trapp, S. (2010)."Noble gas xenon is a novel adenosine triphosphate-sensitive potassium channel opener".Anesthesiology.112(3): 623–30.doi:10.1097/ALN.0b013e3181cf894a.PMC2935677
 .PMID20179498.
.PMID20179498.
- ^"Breathe it in".The Economist.8 Februari 2014.
- ^"WADA amends Section S.2.1 of 2014 Prohibited List".31 Agustus 2014. Diarsipkan dariversi aslitanggal 27 April 2021.Diakses tanggal21 Juni2023.
- ^Jelkmann, W. (2014). "Xenon Misuse in Sports".Deutsche Zeitschrift für Sportmedizin.Deutsche Zeitschrift für Sportmedizin/German Journal of Sports Medicine.2014(10): 267–271.doi:10.5960/dzsm.2014.143
 .
.
- ^Van Der Wall, Ernst (1992).What's New in Cardiac Imaging?: SPECT, PET, and MRI.Springer.ISBN0-7923-1615-0.
- ^Frank, John (1999)."Introduction to imaging: The chest".Student BMJ.12:1–44.Diakses tanggal21 Juni2023.
- ^Chandak, Puneet K. (20 Juli 1995)."Brain SPECT: Xenon-133".Brigham RAD. Diarsipkan dariversi aslitanggal 4 Januari 2012.Diakses tanggal21 Juni2023.
- ^Albert, M. S.; Balamore, D. (1998). "Development of hyperpolarized noble gas MRI".Nuclear Instruments and Methods in Physics Research A.402(2–3): 441–53.Bibcode:1998NIMPA.402..441A.doi:10.1016/S0168-9002(97)00888-7.PMID11543065.
- ^Irion, Robert (March 23, 1999)."Head Full of Xenon?".Science News.Diarsipkan dariversi aslitanggal 17 Januari 2004.Diakses tanggal21 Juni2023.
- ^Wolber, J.; Rowland, I. J.; Leach, M. O.; Bifone, A. (1998). "Intravascular delivery of hyperpolarized 129Xenon for in vivo MRI".Applied Magnetic Resonance.15(3–4): 343–352.doi:10.1007/BF03162020.
- ^Driehuys, B.; Möller, H.E.; Cleveland, Z.I.; Pollaro, J.; Hedlund, L.W. (2009)."Pulmonary perfusion and xenon gas exchange in rats: MR imaging with intravenous injection of hyperpolarized 129Xe".Radiology.252(2): 386–93.doi:10.1148/radiol.2522081550.PMC2753782
 .PMID19703880.
.PMID19703880.
- ^Cleveland, Z.I.; Möller, H.E.; Hedlund, L.W.; Driehuys, B. (2009)."Continuously infusing hyperpolarized 129Xe into flowing aqueous solutions using hydrophobic gas exchange membranes".The Journal of Physical Chemistry.113(37): 12489–99.doi:10.1021/jp9049582.PMC2747043
 .PMID19702286.
.PMID19702286.
- ^Marshall, Helen; Stewart, Neil J.; Chan, Ho-Fung; Rao, Madhwesha; Norquay, Graham; Wild, Jim M. (1 Februari 2021)."In vivo methods and applications of xenon-129 magnetic resonance".Progress in Nuclear Magnetic Resonance Spectroscopy(dalam bahasa Inggris).122:42–62.doi:10.1016/j.pnmrs.2020.11.002.ISSN0079-6565.PMC7933823
 .PMID33632417Periksa nilai
.PMID33632417Periksa nilai|pmid=(bantuan). - ^Baltás, E.; Csoma, Z.; Bodai, L.; Ignácz, F.; Dobozy, A.; Kemény, L. (2006). "Treatment of atopic dermatitis with the xenon chloride excimer laser".Journal of the European Academy of Dermatology and Venereology.20(6): 657–60.doi:10.1111/j.1468-3083.2006.01495.x.PMID16836491.
- ^Luhmer, M.; Dejaegere, A.; Reisse, J. (1989)."Interpretation of the solvent effect on the screening constant of Xe-129".Magnetic Resonance in Chemistry.27(10): 950–952.doi:10.1002/mrc.1260271009.
- ^Rubin, Seth M.; Spence, Megan M.; Goodson, Boyd M.; Wemmer, David E.; Pines, Alexander (August 15, 2000)."Evidence of nonspecific surface interactions between laser-polarized xenon and myoglobin in solution".Proceedings of the National Academy of Sciences USA.97(17): 9472–5.Bibcode:2000PNAS...97.9472R.doi:10.1073/pnas.170278897
 .PMC16888
.PMC16888  .PMID10931956.
.PMID10931956.
- ^Raftery, Daniel; MacNamara, Ernesto; Fisher, Gregory; Rice, Charles V.; Smith, Jay (1997). "Optical Pumping and Magic Angle Spinning: Sensitivity and Resolution Enhancement for Surface NMR Obtained with Laser-Polarized Xenon".Journal of the American Chemical Society.119(37): 8746–8747.doi:10.1021/ja972035d.
- ^Gaede, H. C.; Song, Y. -Q.; Taylor, R. E.; Munson, E. J.; Reimer, J. A.; Pines, A. (1995). "High-field cross polarization NMR from laser-polarized xenon to surface nuclei".Applied Magnetic Resonance.8(3–4): 373–384.doi:10.1007/BF03162652.
- ^Galison, Peter Louis (1997).Image and Logic: A Material Culture of Microphysics.University of Chicago Press. hlm. 339.ISBN0-226-27917-0.
- ^Fontaine, J.-P.; Pointurier, F.; Blanchard, X.; Taffary, T. (2004). "Atmospheric xenon radioactive isotope monitoring".Journal of Environmental Radioactivity.72(1–2): 129–35.doi:10.1016/S0265-931X(03)00194-2.PMID15162864.
- ^Garwin, Richard L.; von Hippel Frank N. (November 2006)."A Technical Analysis: Deconstructing North Korea's October 9 Nuclear Test".Arms Control Today.Arms Control Association.38(9).Diakses tanggal21 Juni2023.
- ^Gallucci, G. (2009). "The MEG liquid xenon calorimeter".Journal of Physics: Conference Series.160(1): 012011.Bibcode:2009JPhCS.160a2011G.doi:10.1088/1742-6596/160/1/012011
 .
.
- ^Zona, Kathleen (17 Maret 2006)."Innovative Engines: Glenn Ion Propulsion Research Tames the Challenges of 21st century Space Travel".NASA. Diarsipkan dariversi aslitanggal 15 September 2007.Diakses tanggal21 Juni2023.
- ^"Dawn Launch: Mission to Vesta and Ceres"(PDF).NASA.Diakses tanggal21 Juni2023.
- ^Brazzle, J. D.; Dokmeci, M. R.; Mastrangelo, C. H. (28 Juli – 1 Agustus 1975).Modeling and Characterization of Sacrificial Polysilicon Etching Using Vapor-Phase Xenon Difluoride.Proceedings 17th IEEE International Conference on Micro Electro Mechanical Systems (MEMS).Maastricht, Belanda: IEEE. hlm. 737–740.ISBN978-0-7803-8265-7.
- ^Staff (2007)."Neil Bartlett and the Reactive Noble Gases".American Chemical Society.Diakses tanggal21 Juni2023.
- ^Staff (21 Desember 2004)."Protein Crystallography: Xenon and Krypton Derivatives for Phasing".Daresbury Laboratory, PX. Diarsipkan dariversi aslitanggal 16 Maret 2005.Diakses tanggal21 Juni2023.
- ^Drenth, Jan;Mesters, Jeroen (2007). "The Solution of the Phase Problem by the Isomorphous Replacement Method".Principles of Protein X-Ray Crystallography
 (edisi ke-3). New York:Springer.hlm.123–171.doi:10.1007/0-387-33746-6_7.ISBN978-0-387-33334-2.
(edisi ke-3). New York:Springer.hlm.123–171.doi:10.1007/0-387-33746-6_7.ISBN978-0-387-33334-2.
- ^Safety Data Sheet: Xenon(PDF)(Laporan).Airgas.15 Februari 2018.
- ^LeBlanc, Adrian D.; Johnson, Philip C. (1971). "The handling of xenon-133 in clinical studies".Physics in Medicine and Biology.16(1): 105–9.Bibcode:1971PMB....16..105L.doi:10.1088/0031-9155/16/1/310.PMID5579743.
- ^abFinkel, A. J.; Katz, J. J.; Miller, C. E. (1 April 1968)."Metabolic and toxicological effects of water-soluble xenon compounds are studied".NASA.Diakses tanggal21 Juni2023.
- ^169,44 m/s dalam xenon (pada suhu 0 °C dan tekanan 107 kPa), dibandingkan dengan 344 m/s di udara. Lihat:Vacek, V.; Hallewell, G.; Lindsay, S. (2001). "Velocity of sound measurements in gaseous per-fluorocarbons and their mixtures".Fluid Phase Equilibria.185(1–2): 305–314.doi:10.1016/S0378-3812(01)00479-4.
- ^Spangler, Steve (2007)."Anti-Helium – Sulfur Hexafluoride".Steve Spangler Science. Diarsipkan dariversi aslitanggal 29 September 2007.Diakses tanggal21 Juni2023.
- ^Yamaguchi, K.; Soejima, K.; Koda, E.; Sugiyama, N (2001)."Inhaling Gas With Different CT Densities Allows Detection of Abnormalities in the Lung Periphery of Patients With Smoking-Induced COPD".Chest.120(6): 1907–16.doi:10.1378/chest.120.6.1907.PMID11742921.
- ^Staff (1 Agustus 2007)."Cryogenic and Oxygen Deficiency Hazard Safety".Stanford Linear Accelerator Center. Diarsipkan dariversi aslitanggal 9 Juni 2007.Diakses tanggal21 Juni2023.
Pranala luar
[sunting|sunting sumber]| Cari tahu mengenai Xenon pada proyek-proyek Wikimedia lainnya: | |
| Definisi dan terjemahandari Wiktionary | |
| Gambar dan mediadari Commons | |
- (Inggris)XenondiThe Periodic Table of Videos(Universitas Nottingham)
- (Inggris)USGS Periodic Table – Xenon
- (Inggris)EnvironmentalChemistry.com – Xenon
- (Inggris)Sir William Ramsay's Nobel-Prize lecture (1904)
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


