Iridium
77Ir Iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Beberapa potongan iridium murni, masing-masing berukuran 1−3 mm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /iridium/[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | putih keperakan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iridium dalamtabel periodik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom(Z) | 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar(Ar) |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f145d76s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 15, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FasepadaSTS(0 °C dan 101,325kPa) | padat | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 2719K(2446 °C, 4435 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 4403 K (4130 °C, 7466 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatanmendekatis.k. | 22,56 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, padat.l. | 19 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 41,12kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 563 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 25,10 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −3, −1, 0, +1, +2,+3,+4,+5, +6, +7, +8, +9[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 880 kJ/mol ke-2: 1600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 136pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 141±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka(fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kecepatan suarabatang ringan | 4825 m/s (suhu 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 6,4 µm/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 147 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 47,1 nΩ·m (suhu 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | 25,6×10−6cm3/mol (298 K)[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 210 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 320 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Vickers | 1760–2200 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skala Brinell | 1670 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuandan isolasi pertama | S. Tennant(1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop iridiumyang utama | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Iridiumadalah sebuahunsur kimiadenganlambangIrdannomor atom77. Sebuahlogam transisiyang sangat keras, rapuh, dan berwarna putih keperakan darigolongan platina,ia dianggap sebagai logam alami terpadat kedua (setelahosmium) dengan kepadatan 22,56 g/cm3(0,815 lb/cu in) seperti yang didefinisikan melaluikristalografi sinar-Xeksperimental.[a]Ia adalah salah satu logam yang paling tahankorosi,bahkan pada suhu setinggi 2.000 °C (3.630 °F). Namun, ketahanan korosi tidak dapat diukur secara mutlak; meskipun hanya beberapa garam cair danhalogentertentu yang bersifat korosif terhadap iridium padat, debu iridium yang terbelah halus jauh lebih reaktif dan mudah terbakar, sedangkan debu emas tidak mudah terbakar tetapi dapat diserang oleh zat yang dapat ditahan oleh iridium, sepertiair raja.
Iridium ditemukan pada tahun 1803 di antara pengotor yang tidak larut dalamplatinaalami.Smithson Tennant,penemunya yang utama, menamainya dari nama dewi YunaniIris,personifikasi pelangi, karena warna garamnya yang mencolok dan beragam. Iridium adalahsalah satu unsur paling langkadikerak Bumi,dengan produksi dan konsumsi tahunan hanya 3 ton (6,6 ribu pon). Iridium hanya memiliki duaisotopalami danstabil,191Ir dan193Ir; yang terakhir lebih melimpah.
Penggunaan iridium yang dominan adalah logam itu sendiri dan paduannya, seperti padabusiberperforma tinggi,krusuntuk rekristalisasi semikonduktor pada suhu tinggi, dan elektroda untuk produksi klorin dalamproses kloralkali.Senyawa iridium yang penting adalah klorida dan iodida dalamkatalisisindustri. Iridium adalah salah satu komponen dari beberapaOLED.
Iridium ditemukan dimeteoritdalam kelimpahan yang jauh lebih tinggi daripada di kerak Bumi.[7]Karena alasan ini, kelimpahan iridium yang luar biasa tinggi di lapisan tanah liat dibatas Kapur–Paleogenmemunculkanhipotesis Alvarezbahwa dampak dari sebuah benda luar angkasa besar telah menyebabkankepunahan dinosaurus dan banyak spesies lainnya 66 juta tahun yang lalu,sekarang diketahui dihasilkan oleh tumbukan yang membentukkawah Chicxulub.Demikian pula, anomali iridium dalam sampel inti dariSamudra Pasifikmemperkirakan adanyatumbukan Eltaninsekitar 2,5 juta tahun yang lalu.[8]
Diperkirakan bahwa jumlah total iridium di tanah jauh lebih tinggi daripada yang diamati pada batuan kerak Bumi, tetapi seperti logam golongan platina lainnya, kepadatan tinggi dankecenderunganiridium untuk berikatan dengan besi menyebabkan sebagian besar iridium turun di bawah kerak saat planet ini masih muda dan masih cair.
Karakteristik
[sunting|sunting sumber]Sifat fisik
[sunting|sunting sumber]
Merupakan salah satu anggotalogamgolongan platina,iridium memiliki warna putih, menyerupaiplatina,tetapi dengan semburat agak kekuningan. Karenakekerasannya,kerapuhannya,dantitik leburnyayang sangat tinggi, iridium padat sulit dibentuk, dikerjakan, atau dikerjakan dengan mesin; dengan demikianmetalurgi bubukumumnya digunakan sebagai gantinya.[9]Ia adalah satu-satunya logam yang dapat mempertahankan sifat mekanik yang baik di udara pada suhu di atas 1.600 °C (2.910 °F).[10]Ia memilikititik didih tertinggi ke-10di antara semua unsur dan menjadisuperkonduktorpada suhu di bawah 0,14K(−273,010 °C; −459,418 °F).[11]
Modulus elastisitasiridium adalah yang tertinggi kedua di antara semua logam, hanya dilampaui olehosmium.[10]Hal ini, bersama denganmodulus geseryang tinggi dan angka yang sangat rendah untukrasio Poisson(hubunganterikanlongitudinal dengan terikan lateral), menunjukkan tingkatkekakuandan ketahanan yang tinggi terhadap deformasi yang membuat fabrikasinya menjadi komponen yang berguna menjadi masalah yang sangat sulit. Terlepas dari keterbatasan ini dan biaya iridium yang tinggi, sejumlah aplikasi telah dikembangkan di mana kekuatan mekanik merupakan faktor penting dalam beberapa kondisi yang sangat parah yang dihadapi dalam teknologi modern.[10]
Kepadataniridium terukur hanya sedikit lebih rendah (sekitar 0,12%) daripada osmium,logam terpadatyang diketahui.[12][13]Beberapa ketidakjelasan terjadi mengenai unsur mana yang lebih padat, karena kecilnya perbedaan kepadatan dan kesulitan dalam mengukurnya secara akurat,[14]tetapi, dengan peningkatan akurasi pada faktor yang digunakan untuk menghitung kepadatan, datakristalografi sinar-Xmenghasilkan kepadatan sebesar 22,56 g/cm3(0,815 lb/cu in) untuk iridium dan 22,59 g/cm3(0,816 lb/cu in) untuk osmium.[15]
Iridium sangatlah rapuh, hingga pada titik di mana ia sulit untuk dilas karena zona yang terkena panas akan retak, tetapi dapat dibuat lebih ulet dengan menambahkan sejumlah keciltitaniumdanzirkonium(0,2% dari masing-masing tampaknya bekerja dengan baik).[16]
Kekerasan Vickersplatina murni adalah 56 HV, sedangkan platina dengan 50% iridium dapat mencapai lebih dari 500 HV.[17][18]
Sifat kimia
[sunting|sunting sumber]Iridium adalah logam palingtahan korosiyang diketahui:[19]ia tidak dapat diserang oleh berbagaiasam,termasukair raja.Dengan adanya oksigen, ia bereaksi dengan garamsianida.[20]Oksidan tradisional juga bereaksi, termasukhalogendan oksigen[21]pada suhu yang lebih tinggi.[22]Iridium juga bereaksi langsung denganbelerangpada tekanan atmosfer untuk menghasilkaniridium disulfida.[23]
Isotop
[sunting|sunting sumber]Iridium memiliki duaisotopstabil alami,191Ir dan193Ir, dengankelimpahan alamimasing-masing 37,3% dan 62,7%.[24]Setidaknya 37radioisotopjuga telah disintesis, dengannomor massamulai dari 164 hingga 202.192Ir,yang berada di antara dua isotop stabil, adalah radioisotop yang paling stabil, denganwaktu paruh73,827 hari, dan memiliki aplikasi dalambrakiterapi[25]dan dalamradiografiindustri, khususnya untuk pengujian nondestruktif las baja dalam industri minyak dan gas; sumber iridium-192 telah terlibat dalam sejumlah kecelakaan radiologis. Tiga isotop lainnya memiliki waktu paruh setidaknya satu hari—188Ir,189Ir, dan190Ir.[24]Isotop dengan massa di bawah 191 meluruh melalui beberapa kombinasipeluruhan β+,peluruhan α,danemisi proton(langka), dengan pengecualian189Ir, yang meluruh melaluipenangkapan elektron.Isotop sintetis yang lebih berat dari 191 meluruh melaluipeluruhan β−,meskipun192Ir juga memiliki jalur peluruhan penangkapan elektron minor.[24]Semua isotop iridium yang telah diketahui ditemukan antara tahun 1934 dan 2008, dengan penemuan terbaru adalah200–202Ir.[26]
Setidaknya 32isomer metastabiltelah dikarakterisasi, mulai dari nomor massa 164 hingga 197. Yang paling stabil di antaranya adalah192m2Ir, yang meluruh melaluitransisi isomerisdengan waktu paruh 241 tahun,[24]membuatnya lebih stabil daripada isotop sintetis iridium mana pun dalamkeadaan dasarnya.Isomer yang paling tidak stabil adalah190m3Ir dengan waktu paruh hanya 2 μs.[24]Isotop191Ir adalah yang pertama dari unsur apa pun yang diketahui memilikiefek Mössbauer.Ini membuatnya berguna untukspektroskopi Mössbaueruntuk penelitian di bidang fisika, kimia, biokimia, metalurgi, dan mineralogi.[27]
Kimia
[sunting|sunting sumber]| Keadaan oksidasi[b] | |
|---|---|
| −3 | [Ir(CO)3]3− |
| −1 | [Ir(CO) 3(PPh 3)]1− |
| 0 | Ir 4(CO) 12 |
| +1 | [IrCl(CO)(PPh 3) 2] |
| +2 | Ir(C 5H 5) 2 |
| +3 | IrCl 3 |
| +4 | IrO 2 |
| +5 | Ir 4F 20 |
| +6 | IrF6 |
| +7 | [Ir(O 2)O 2]+ |
| +8 | IrO 4 |
| +9 | [IrO 4]+ [2] |
Keadaan oksidasi
[sunting|sunting sumber]Iridium membentuk berbagai senyawa dalamkeadaan oksidasiantara −3 dan +9, tetapi keadaan oksidasi yang paling umum adalah +1, +3, dan +4.[9]Senyawa yang telah dikarakterisasi dengan baik yang mengandung iridium dalam keadaan oksidasi +6 meliputiIrF
6serta oksida Sr
2MgIrO
6dan Sr
2CaIrO
6.[9][28]Iridium(VIII) oksida(IrO
4) dihasilkan dalam kondisi isolasi matriks pada suhu 6 K dalamargon.[29]Keadaan oksidasi tertinggi (+9), yang juga merupakan keadaan oksidasi tercatat tertinggi untuksetiapunsur, ditemukan dalam kation [IrO
4]+
yang berwujud gas.[2]
Senyawa biner
[sunting|sunting sumber]Iridium tidak membentukhidridabiner.Hanya satuoksida bineryang terkarakterisasi dengan baik:iridium dioksida,IrO2.Ia adalah padatan hitam biru yang mengadopsistruktur fluorit.[9]Sebuahsesquioksida,Ir2O3,digambarkan sebagai bubuk biru kehitaman, yang dioksidasi menjadiIrO2olehHNO3.[21]Disulfida, diselenida, sesquisulfida, dan sesquiselenida yang sesuai juga diketahui, sertaIrS3.[9]
Trihalida biner,IrX3,dikenal untuk semua halogen.[9]Untuk keadaan oksidasi +4 ke atas, hanyatetrafluorida,pentafluorida,danheksafluoridayang diketahui.[9]Iridium heksafluorida,IrF6,adalah padatan kuning yang volatil, terdiri dari molekul oktahedron. Ia akan terurai dalam air dan tereduksi menjadiIrF4.[9]Iridium pentafluorida juga merupakan oksidan yang kuat, tetapi ia merupakan sebuahtetramer,Ir4F20,yang dibentuk oleh empat oktahedra yang berbagi sudut.[9]
Kompleks
[sunting|sunting sumber]
Iridium memilikikimia koordinasiyang luas.
Iridium dalam kompleksnya selalu memilikispin rendah.Ir(III) dan Ir(IV) umumnya membentukkompleks oktahedron.[9]Kompleks polihidrida dikenal dengan keadaan oksidasi +5 dan +3.[30]Salah satu contohnya adalah IrH
5(PiPr
3)
2.[31]Hidrida ternerMg6Ir2H11diyakini mengandung anionIrH4−5dan 18-elektronIrH5−4.[32]
Iridium juga membentuk berbagaioksianiondengan keadaan oksidasi +4 dan +5.K2IrO3danKIrO3dapat dibuat dari reaksikalium oksidaataukalium superoksidadengan iridium pada suhu tinggi. Padatan tersebut tidak larut dalam pelarut konvensional.[33]
Sama seperti banyak unsur, iridium membentuk berbagai kompleks klorida yang penting. Asam heksakloroiridat(IV),H2IrCl6,dan garam amoniumnya adalah senyawa iridium yang paling umum dari perspektif industri dan preparatif.[34]Mereka adalah zat antara dalam pemurnian iridium dan digunakan sebagai prekursor untuk sebagian besar senyawa iridium lainnya, serta dalam pembuatan pelapisanoda.IonIrCl2−6memiliki warna cokelat gelap pekat, dan dapat dengan mudah direduksi menjadiIrCl3−6yang berwarna lebih terang, dan sebaliknya.[34]Iridium triklorida,IrCl3,yang dapat diperoleh dalam bentuk anhidrat dari oksidasi langsung bubuk iridium olehklorinpada suhu 650 °C,[34]atau dalam bentuk terhidrasi dengan melarutkanIr2O3dalamasam klorida,sering digunakan sebagai bahan awal untuk sintesis senyawa Ir(III) lainnya.[9]Senyawa lain yang digunakan sebagai bahan awal adalah amonium heksakloroiridat(III),(NH4)3IrCl6.
Di hadapan udara, logam iridium akan larut dalam sianida logam alkali cair untuk menghasilkan ionIr(CN)3−6(heksasianoiridat).
Kimia organoiridium
[sunting|sunting sumber]
Senyawa organoiridiummengandung ikatan iridium–karbon.Beberapa penelitian awal telah mengidentifikasitetrairidium dodekakarbonil(Ir4(CO)12) yang sangat stabil.[9]Dalam senyawa ini, masing-masing atom iridium terikat pada tiga lainnya, membentuk sebuah gugus tetrahedron. Penemuankompleks Vaska(IrCl(CO)[P(C6H5)3]2) membuka pintu untuk reaksiadisi oksidatif,sebuah proses fundamental untuk berbagai reaksi yang berguna. Misalnya,katalis Crabtree,sebuahkatalis homogenuntuk reaksihidrogenasi.[35][36]

Kompleks Iridium memainkan peran penting dalam pengembanganpengaktifan ikatan karbon–hidrogen(pengaktifan C–H), yang memungkinkan fungsionalisasi hidrokarbon, yang secara tradisional dianggap tidak reaktif.[39]
Sejarah
[sunting|sunting sumber]Golongan platina
[sunting|sunting sumber]
Penemuan iridium memiliki kaitan dengan penemuan platina dan logam lain dari golongan platina. Referensi Eropa pertama untuk platina muncul pada tahun 1557 dalam tulisan-tulisan karya humanisItaliaJulius C. Scaligersebagai deskripsi dari sebuah logam mulia yang tidak diketahui yang ditemukan antaraDariéndan Meksiko, "yang belum dapat dicairkan oleh api atau kecerdasan Spanyol mana pun".[40]Dari pertemuan pertama mereka dengan platina, orang Spanyol umumnya melihat logam itu sebagai semacam pengotor emas, dan diperlakukan seperti itu. Ia sering dibuang begitu saja, dan ada keputusan resmi yang melarangadulterasiemas dengan platina.[41]


Pada tahun 1735,Antonio de UlloadanJorge Juan y Santaciliamelihat penduduk asli Amerika menambang platina saat orang Spanyol melakukan perjalanan melalui Kolombia dan Peru selama delapan tahun. Ulloa dan Juan menemukan beberapa tambang dengan bongkahan logam keputihan dan membawanya pulang ke Spanyol. Antonio de Ulloa kembali ke Spanyol dan mendirikan laboratorium mineralogi pertama di Spanyol dan merupakan orang pertama yang mempelajari platina secara sistematis, yaitu pada tahun 1748. Catatan sejarahnya mengenai ekspedisi tersebut mencakup deskripsi mengenai platina yang tidak dapat dipisahkan atau dikalsinasi.Ulloa juga mengantisipasi penemuan tambang platina. Setelah menerbitkan laporan tersebut pada tahun 1748, Ulloa tidak melanjutkan penyelidikan logam baru tersebut. Pada 1758, dia dikirim untuk mengawasi operasi penambangan raksa diHuancavelica.[40]
Pada tahun 1741, Charles Wood,[42]seorangahli metalurgiBritania Raya, menemukan berbagai sampel platina Kolombia di Jamaika, yang dikirimnya keWilliam Brownrigguntuk penyelidikan lebih lanjut.
Pada tahun 1750, setelah mempelajari platina yang dikirim kepadanya oleh Wood, Brownrigg memberikan penjelasan rinci mengenai logam tersebut kepadaRoyal Society,menyatakan bahwa dia tidak pernah melihat penyebutannya dalam catatan sebelumnya mengenai berbagai mineral yang diketahui.[43]Brownrigg juga mencatat titik lebur platina yang sangat tinggi dan perilakunya seperti logam tahan api terhadapboraks.Kimiawan lain di seluruh Eropa segera mulai mempelajari platina, termasukAndreas S. Marggraf,[44]Torbern O. Bergman,Jöns J. Berzelius,William Lewis,danPierre Macquer.Pada tahun 1752,Henrik T. Scheffermenerbitkan sebuah deskripsi ilmiah mendetail mengenai logam tersebut, yang dia sebut sebagai "emas putih", termasuk penjelasan tentang bagaimana dia berhasil menggabungkan bijih platina dengan bantuanarsen.Scheffer menggambarkan platina sebagai kurang lentur dibandingkan emas, tetapi memiliki ketahanan yang sama terhadap korosi.[40]
Penemuan
[sunting|sunting sumber]Para kimiawan yang mempelajari platina melarutkannya dalamair raja(sebuah campuranasam kloridadannitrat) untuk membuat garam yang larut. Mereka selalu mengamati sejumlah kecil residu yang gelap dan tidak larut.[10]Joseph L. Proustberpikir bahwa residu tersebut adalahgrafit.[10]Kimiawan PrancisVictor Collet-Descotils,Antoine François, comte de Fourcroy,danLouis N. Vauquelinjuga mengamati residu hitam tersebut pada tahun 1803, tetapi tidak memperoleh cukup untuk melakukan eksperimen lebih lanjut.[10]
Pada tahun 1803, ilmuwan Britania RayaSmithson Tennant(1761–1815) menganalisis residu yang tidak larut tersebut dan menyimpulkan bahwa itu pasti mengandung sebuah logam baru. Vauquelin mengolah bubuk tersebut secara bergantian dengan alkali dan asam[19]dan memperoleh sebuah oksida baru yang volatil, yang dia yakini berasal dari logam baru ini—yang dia beri namaptene,dari kata Yunaniπτηνόςptēnós,"bersayap".[45][46]Tennant, yang memiliki keuntungan dari jumlah residu yang jauh lebih besar, melanjutkan penelitiannya dan mengidentifikasi dua unsur yang sebelumnya belum ditemukan dalam residu hitam tersebut, iridium dan osmium.[10][19]Dia memperoleh kristal merah tua (kemungkinanNa2[IrCl6]·nH2O) melalui serangkaian reaksi dengannatrium hidroksidadanasam klorida.[46]Dia menamainya iridium dariIris(Ἶρις), dewi pelangi bersayap Yunani dan utusan dewa Olimpus, karena banyakgaramyang dia peroleh memiliki warna kuat.[c][47]Penemuan unsur baru ini didokumentasikan dalam sebuah surat kepadaRoyal Societypada 21 Juni 1804.[10][48]
Pengerjaan logam dan aplikasi
[sunting|sunting sumber]Ilmuwan Britania RayaJohn G. Childrenadalah orang pertama yang meleburkan sampel iridium pada tahun 1813 dengan bantuan "baterai galvanik terbesar yang pernah dibuat" (pada waktu itu).[10]Orang pertama yang memperoleh iridium dengan kemurnian tinggi adalahRobert Harepada tahun 1842. Dia menemukan bahwa iridium memiliki kepadatan sekitar 21,8 g/cm3(0,79 lb/cu in) dan mencatat bahwa logam tersebut hampir tidak dapat dibentuk dan sangat keras. Peleburan pertama dalam jumlah yang cukup besar dilakukan olehHenri Sainte-Claire DevilledanJules H. Debraypada tahun 1860. Mereka membutuhkan pembakaran lebih dari 300 liter (79 US gal) gasO2danH2murni untuk setiap 1 kilogram (2,2 pon) iridium.[10]
Kesulitan ekstrem dalam peleburan logam ini membatasi kemungkinan penanganan iridium.John I. Hawkinssedang mencari titik halus dan keras untuk ujung pulpen, dan pada tahun 1834 dia berhasil membuat pena emas dengan ujung iridium. Pada tahun 1880,John HollanddanWilliam L. Dudleymampu meleburkan iridium dengan menambahkanfosforusdan mematenkan prosesnya di Amerika Serikat; perusahaan Britania RayaJohnson Mattheykemudian menyatakan bahwa mereka telah menggunakan proses serupa sejak 1837 dan telah menyajikan iridium yang menyatu di sejumlahPameran Dunia.[10]Penggunaan pertama paduan iridium dengan rutenium dalamtermokopeldilakukan oleh Otto Feussner pada tahun 1933. Ini memungkinkan pengukuran suhu tinggi di udara hingga 2.000 °C (3.630 °F).[10]
Di Munich, Jerman pada tahun 1957Rudolf L. Mössbauer,dalam apa yang disebut sebagai salah satu "percobaan penting dalam fisika abad ke-20",[49]menemukan emisi dan penyerapansinar gamayang beresonansi dan bebas-rekoiloleh beberapa atom dalam sebuah sampel logam padat yang hanya mengandung191Ir.[50]Fenomena ini, yang dikenal sebagaiefek Mössbauermengantarnya padaPenghargaan Nobel Fisikapada tahun 1961, di usianya yang ke-32 tahun, hanya tiga tahun setelah dia menerbitkan penemuannya.[51]
Keterjadian
[sunting|sunting sumber]Bersama dengan semua unsur yang memilikiberat atomlebih tinggi daribesi,iridium hanya terbentuk secara alami melaluiproses-r(penangkapan neutron cepat) dalamsupernovadantabrakan bintang neutron.[52][53]
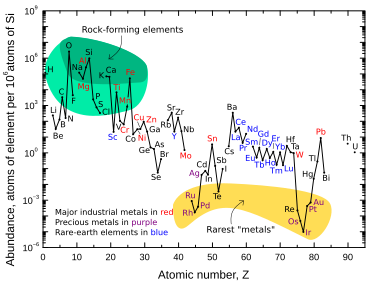

Iridium adalah salah satu dari sembilan unsur stabil paling tidak melimpah di kerak Bumi, memiliki fraksi massa rata-rata 0,001ppmdi batuan kerak;platina10 kali lebih melimpah,emas40 kali lebih melimpah, sertaperakdanraksa80 kali lebih melimpah.[9]Teluriumkira-kira sama melimpahnya dengan iridium.[9]Berbeda dengan kelimpahannya yang rendah di batuan kerak, iridium relatif umum ditemukan dimeteorit,dengan konsentrasi 0,5 ppm atau lebih.[55]Konsentrasi keseluruhan iridium di tanah dianggap jauh lebih tinggi daripada yang diamati pada batuan kerak, tetapi karena kepadatan dan sifatsiderofil( "mencintai besi" ) iridium, ia turun di bawah kerak dan masuk keinti Bumiketika planet ini masih cair.[34]
Iridium ditemukan di alam sebagai unsur yang tidak digabungkan atau dalampaduanalami; terutama paduan iridium–osmium,osmiridium(kaya osmium), daniridosmium(kaya iridium).[19]Dalam endapannikeldantembaga,logam golongan platina terjadi sebagaisulfida(yakni (Pt,Pd)S'' ";),telurida(yakni PtBiTe),antimonida(PdSb), danarsenida(yakniPtAs2). Dalam semua senyawa ini, platina ditukar dengan sejumlah kecil iridium dan osmium. Seperti semua logam golongan platina, iridium dapat ditemukan secara alami dalam paduan dengan nikel mentah atautembaga mentah.[56]Sejumlah mineral dominan iridium, dengan iridium sebagai unsur pembentuk spesies, telah diketahui. Mereka sangatlah langka dan sering mewakili analog iridium dari yang diberikan di atas. Contohnya adalah irasit dan kuproiridsit, untuk menyebutkan beberapa.[57][58][59]Di dalam kerak Bumi, iridium ditemukan pada konsentrasi tertinggi dalam tiga jenis struktur geologi: kawah tumbukan, endapan beku (intrusi kerak dari bawah), dan endapan yang dikerjakan ulang dari salah satu endapan beku. Cadangan primer terbesar yang diketahui berada dikompleks batuan beku BushvelddiAfrika Selatan,[60](dekat struktur tumbukan terbesar yang diketahui,struktur tumbukan Vredefort) meskipun endapan tembaga–nikel besar dekatNorilskdiRusia,danCekungan Sudbury(juga sebuah kawah tumbukan) diKanadajuga merupakan sumber iridium yang signifikan. Beberapa cadangan yang lebih kecil ditemukan di Amerika Serikat.[60]Iridium juga ditemukan dalam endapan sekunder, dikombinasikan dengan platina dan logam golongan platina lainnya dalam endapanaluvial.Endapan aluvial yang digunakan oleh orang-orangpra-KolumbusdiDepartemen Chocó,Kolombiamasih menjadi sumber logam golongan platina. Hingga tahun 2003, cadangan dunia belum diperkirakan.[19]
Oseanografi laut
[sunting|sunting sumber]Iridium ditemukan dalam organisme laut,sedimen,dan kolom air. Kelimpahan iridium dalam air laut[61]dan organisme[62]relatif rendah, karena ia tidak mudah membentukkompleks klorida.[62]Kelimpahannya dalam organisme adalah sekitar 20bagian per triliun,atau sekitar limatingkat besaranlebih kecil daripada dibatuan sedimenpadabatas Kapur–Paleogen (K–T).[62]Konsentrasi iridium dalam air laut dan sedimen laut peka terhadapoksigenasi laut,suhu air laut, serta berbagai proses geologis dan biologis.[63]
Iridium dalam sedimen dapat berasal daridebu kosmik,gunung berapi,presipitasidari air laut, proses mikroba, ataulubang hidrotermal,[63]dan kelimpahannya dapat menjadi indikasi kuat dari sumbernya.[63][64]Ia cenderung berasosiasi dengan logam fero lainnya dalamnodul mangan.[61]Iridium adalah salah satu unsur karakteristik batuan ekstraterestrial, dan, bersama dengan osmium, dapat digunakan sebagai unsur pelacak untuk material meteoritik dalam sedimen.[65][66]Misalnya, sampel inti dariSamudra Pasifikdengan tingkat iridium yang tinggi memperkirakan adanyatumbukan Eltaninsekitar 2,5 juta tahun yang lalu.[8]
Beberapakepunahan massal,sepertikepunahan Kapur,dapat diidentifikasi dengan konsentrasi iridium yang sangat tinggi dalam sedimen, dan ini dapat dikaitkan dengantumbukan asteroidbesar.[67]
Kehadiran batas Kapur–Paleogen
[sunting|sunting sumber]
Batas Kapur–Paleogen66 juta tahun yang lalu, menandai batas temporal antara periodeKapurdanPaleogendalamwaktu geologis,diidentifikasi oleh adanyastratumtipislempung kaya iridium.[68]Pada tahun 1980, sebuah tim yang dipimpin olehLuis W. Alvarezmengusulkan bahwa iridium ini berasal dari luar angkasa, menghubungkannya dengan sebuah tumbuhkanasteroidataukomet.[68]Teori mereka, yang dikenal sebagaihipotesis Alvarez,kini diterima secara luas untuk menjelaskan kepunahandinosaurusnon-unggas. Struktur kawah tumbukan besar yang terkubur dengan perkiraan usia sekitar 66 juta tahun kemudian diidentifikasi di tempat yang sekarang disebutSemenanjung Yucatán(kawah Chicxulub).[69][70]Dewey M. McLean dan yang lainnya berpendapat bahwa iridium mungkin berasal darigunung berapi,karena intiBumikaya akan iridium, dan beberapa gunung berapi aktif sepertiPiton de la Fournaise,di pulauRéunion,masih melepaskan iridium.[71][72]
Produksi
[sunting|sunting sumber]| Tahun | Konsumsi (ton) |
Harga (USD)[73] |
|---|---|---|
| 2001 | 2,6 | $415,25/ozt($13,351/g) |
| 2002 | 2,5 | $294,62/ozt($9,472/g) |
| 2003 | 3,3 | $93,02/ozt($2,991/g) |
| 2004 | 3,60 | $185,33/ozt($5,958/g) |
| 2005 | 3,86 | $169,51/ozt($5,450/g) |
| 2006 | 4,08 | $349,45/ozt($11,235/g) |
| 2007 | 3,70 | $444,43/ozt($14,289/g) |
| 2008 | 3,10 | $448,34/ozt($14,414/g) |
| 2009 | 2,52 | $420,4/ozt($13,52/g) |
| 2010 | 10,40 | $642,15/ozt($20,646/g) |
| 2011 | 9,36 | $1.035,87/ozt($33,304/g) |
| 2012 | 5,54 | $1.066,23/ozt($34,280/g) |
| 2013 | 6,16 | $826,45/ozt($26,571/g) |
| 2014 | 6,1 | $556,19/ozt($17,882/g) |
| 2015 | 7,81 | $544/ozt($17,5/g) |
| 2016 | 7,71 | $586,90/ozt($18,869/g) |
| 2017 | n.d. | $908,35/ozt($29,204/g) |
| 2018 | n.d. | $1.293,27/ozt($41,580/g) |
| 2019 | n.d. | $1.485,80/ozt($47,770/g) |
| 2020 | n.d. | $1.633,51/ozt($52,519/g) |
| 2021 | n.d. | $5.400,00/ozt($173,614/g) |
Produksi iridium di seluruh dunia adalah sekitar 7.500 kilogram (16.500 pon).[74]Harganya tinggi dan bervariasi (lihat tabel). Faktor-faktor ilustrasi yang dapat memengaruhi harganya meliputi kelebihan pasokan krus Ir[73][75] dan perubahan teknologiLED.[76]
Logam platina muncul bersamaan sebagai bijih encer. Iridium adalah salah satu logam platina yang lebih langka: untuk setiap 190 ton platina yang diperoleh dari bijih, hanya 7,5 ton iridium yang diisolasi.[77]Untuk memisahkan logam tersebut, mereka harus terlebih dahulu dibawa ke dalamlarutan.Dua metode untuk melarutkan bijih yang mengandung Ir adalah (i) fusi padatan dengannatrium peroksidadiikuti dengan ekstraksi kaca yang dihasilkan dalamair rajadan (ii) ekstraksi padatan dengan campuranklorindanasam klorida.[34][60]Dari ekstrak yang larut, iridium dipisahkan dengan mengendapkanamonium heksakloroiridat((NH4)2IrCl6) padat atau dengan mengekstraksiIrCl2−6dengan amina organik.[78]Metode pertama mirip dengan prosedur yang digunakan Tennant dan Wollaston untuk pemisahan aslinya. Metode kedua dapat direncanakan sebagaiekstraksi cair–cairkontinu sehingga lebih cocok untuk produksi skala industri. Dalam kedua kasus, produk yang dihasilkan, sebuah garam iridium klorida, direduksi dengan hidrogen, menghasilkan logam iridium sebagai bubuk atauspons,yang sesuai dengan teknikmetalurgi bubuk.[79][80]Iridium juga diperoleh secara komersial sebagai produk sampingan dari penambangan dan pengolahannikeldantembaga.Selamapemurnian tembagadan nikel, beberapa logam mulia seperti perak, emas, danlogam golongan platinasertaseleniumdanteluriumakan mengendap di dasar sel sebagailumpur anoda,yang menjadi titik awal untuk ekstraksinya.[73]
| Negara | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Dunia | 7.720 | 7.180 | 7.540 | 7.910 | 8.170 |
| 6.624 | 6.057 | 6.357 | 6.464 | 6.786 | |
| 598 | 619 | 586 | 845 | 836 | |
| 300 | 200 | 400 | 300 | 300 | |
| 200 | 300 | 200 | 300 | 250 |
Aplikasi
[sunting|sunting sumber]Area utama penggunaan iridium adalah elektroda untuk memproduksi klorin dan produk agresif lainnya,OLED,krus,katalis(misalnyaasam asetat), dan ujung pengapian untuk busi.[77]
Logam dan paduan Ir
[sunting|sunting sumber]Ketahanan terhadap panas dan korosi adalah dasar untuk beberapa penggunaan iridium dan paduannya.
Karena titik leburnya, kekerasannya, danketahanan korosinyayang tinggi, iridium digunakan untuk membuatkrus.Krus semacam itu digunakan dalamproses Czochralskiuntuk menghasilkan kristal tunggal oksida (sepertisafir) untuk digunakan dalam perangkat memori komputer dan dalam laser benda padat.[82][83]Kristal tersebut, sepertigarnet gadolinium galiumdan garnet itrium galium, akan tumbuh dengan meleburkan muatan oksida campuran pra-sinter di bawah kondisi pengoksidasi pada suhu hingga 2.100 °C (3.810 °F).[10]
Suku cadang mesin pesawat terbang tertentu yang berumur panjang terbuat dari paduan iridium, dan paduan iridium–titaniumdigunakan untuk pipa air-dalam karena ketahanan korosinya.[19]Iridium digunakan untukpemintalmulti-pori,di mana leburan polimer plastik diekstrusi untuk membentuk serat, sepertirayon.[84]Osmium–iridium digunakan untuk keseimbangan dan untuk bantalankompas.[10]
Karena ketahanannya terhadap erosi busur, paduan iridium digunakan oleh beberapa produsen untuk kontak listrikbusi,[82][85]dan busi berbasis iridium digunakan secara khusus dalampenerbangan.
Katalisis
[sunting|sunting sumber]Senyawa iridium digunakan sebagaikatalisdalamproses Cativauntukkarbonilasimetanolmenghasilkanasam asetat.[86][87]
Kompleks Iridium sering aktif untukhidrogenasi asimetrisbaik denganhidrogenasitradisional[88]maupunhidrogenasi transfer.[89]Sifat ini adalah dasar dari rute industri keherbisidakiral(S)-metolaklor.Seperti yang dilakukan oleh Syngenta pada skala 10.000 ton/tahun, kompleks [Ir(COD)Cl]2dengan adanyaligan Josiphos.[90]
Pencitraan medis
[sunting|sunting sumber]Radioisotopiridium-192adalah salah satu dari dua sumber energi terpenting untuk digunakan dalamradiografi-γindustri untukpengujian nondestruktifberbagailogam.[91][92]Selain itu,192Irdigunakan sebagai sumberradiasi gamauntuk pengobatan kanker menggunakanbrakiterapi,suatu bentuk radioterapi di mana sumber radioaktif yang disegel akan ditempatkan di dalam atau di samping area yang membutuhkan perawatan. Perawatan khusus meliputi brakiterapi prostat dosis tinggi, brakiterapi saluran empedu, dan brakiterapi serviks intrakaviter.[19]Iridium-192 biasanya diproduksi melalui aktivasi neutron dari isotopiridium-191dalam logam iridium yang melimpah secara alami.[93]
Fotokatalisis dan OLED
[sunting|sunting sumber]Kompleks Iridium adalah komponen kunci dariOLEDputih. Kompleks serupa digunakan dalamfotokatalisis.[94]
Ilmiah
[sunting|sunting sumber]
Sebuah paduan 90% platina dan 10% iridium digunakan pada tahun 1889 untuk membuat massaKilogramdanMeter Prototipe Internasional,disimpan olehBiro Internasional untuk Ukuran dan Timbangandi dekatParis.[19]Batang meter diganti sebagai definisi satuan dasar panjang pada tahun 1960 oleh sebuah garis dalamspektrum atomkripton,[d][95]tetapi prototipe kilogram tetap menjadi standar massa internasionalhingga 20 Mei 2019,ketika kilogram didefinisikan ulang dalam satuankonstanta Planck.[96]
Historis
[sunting|sunting sumber]
Paduan iridium–osmium digunakan padaujungpulpen.Penggunaan utama iridium yang pertama adalah pada tahun 1834 pada ujung pena yang dipasang pada emas.[10]Sejak tahun 1944, pulpenParker 51yang terkenal dilengkapi dengan ujung pena yang ujungnya terbuat dari paduan rutenium dan iridium (dengan 3,8% iridium). Bahan ujung pulpen modern masih secara konvensional disebut "iridium", meski jarang memiliki iridium di dalamnya; logam lain sepertirutenium,osmium,danwolframtelah menggantikannya.[97]
Sebuah paduan iridium–platina digunakan untuklubang sentuhatau potongan ventilasimeriam.Menurut laporanPameran Paris tahun 1867,salah satu bagian yang dipamerkan olehJohnson and Matthey"telah digunakan dalam senjata Whitworth selama lebih dari 3000 putaran, dan hampir tidak menunjukkan tanda-tanda aus. Mereka yang mengetahui masalah terus-menerus dan biaya ini yang disebabkan oleh pemakaian bagian ventilasi meriam saat dalam dinas aktif, akan menghargai adaptasi penting ini".[98]
Pigmenhitam iridium,yang terdiri dari iridium yang sangat halus, digunakan untuk mengecatporselendengan warna hitam pekat; dikatakan bahwa "semua warna hitam porselen lainnya akan tampak abu-abu di sampingnya".[99]
Pencegahan
[sunting|sunting sumber]Iridium dalam bentuk logam curah tidak penting secara biologis atau berbahaya bagi kesehatan karena kurangnya reaktivitas dengan jaringan; hanya ada sekitar 20bagian per triliuniridium dalam jaringan manusia.[19]Seperti kebanyakan logam, bubuk iridium yang dihaluskan dapat berbahaya untuk ditangani, karena ia bersifat iritan dan dapat menyala di udara.[60]Pada tahun 2015, sangat sedikit yang diketahui mengenai toksisitas senyawa iridium,[100]terutama karena ia sangat jarang digunakan sehingga hanya sedikit orang yang bersentuhan dengannya, dan mereka yang melakukannya hanya dengan jumlah yang sangat kecil. Namun, garam yang larut, seperti iridium halida, dapat berbahaya karena unsur selain iridium atau karena iridium itu sendiri.[25]Pada saat yang sama, sebagian besar senyawa iridium tidak larut, yang membuat penyerapan ke dalam tubuh menjadi sulit.[19]
Salah satu radioisotop iridium,192Ir, berbahaya, seperti isotop radioaktif lainnya. Satu-satunya cedera yang dilaporkan terkait dengan iridium menyangkut paparan radiasi yang tidak disengaja dari192Ir yang digunakan dalambrakiterapi.[25]Radiasi gama berenergi tinggi dari192Ir dapat meningkatkan risiko kanker. Paparan eksternal dapat menyebabkan luka bakar,keracunan radiasi,dan kematian. Menelan192Ir dapat membakar lapisan lambung dan usus.[101]192Ir,192mIr, dan194mIr cenderung mengendap dihati,dan dapat menimbulkan bahaya kesehatan dari radiasigamadanbeta.[55]
Catatan
[sunting|sunting sumber]- ^Pada suhu kamar dan tekanan atmosfer standar, iridium telah dihitung memiliki kepadatan 22,65 g/cm3(0,818 lb/cu in), 0,04 g/cm3(0,0014 lb/cu in) lebih tinggi dari osmium yang diukur melalui cara yang sama.[5]Namun, nilai kristalografi sinar-X eksperimental dianggap paling akurat, dan dengan demikian iridium dianggap sebagai unsur terpadat kedua.[6]
- ^Keadaan oksidasi iridium yang paling umum dicetak tebal. Kolom kanan mencantumkan satu senyawa yang mewakili untuk setiap keadaan oksidasi.
- ^Iridiumsecara harfiah berarti "pelangi".
- ^Definisi meter diubah lagi pada tahun 1983. Saat ini meter didefinisikan sebagai jarak yang ditempuh cahaya dalam ruang hampa selama selang waktu⅟299,792,458detik.
Referensi
[sunting|sunting sumber]- ^(Indonesia)"Iridium".KBBI Daring.Diakses tanggal17 Juli2022.
- ^abcWang, Guanjun; Zhou, Mingfei; Goettel, James T.; Schrobilgen, Gary G.; Su, Jing; Li, Jun; Schlöder, Tobias; Riedel, Sebastian (2014). "Identification of an iridium-containing compound with a formal oxidation state of IX".Nature.514(7523): 475–477.Bibcode:2014Natur.514..475W.doi:10.1038/nature13795.PMID25341786.
- ^Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds".CRC Handbook of Chemistry and Physics(PDF)(edisi ke-86). Boca Raton (FL): CRC Press.ISBN0-8493-0486-5.
- ^Weast, Robert (1984).CRC, Handbook of Chemistry and Physics.Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110.ISBN0-8493-0464-4.
- ^Helmenstine, Anne Marie (6 Mei 2022)."What is the Densest Element on the Periodic Table?".Thoughtco.com.Diakses tanggal15 Juli2023.
- ^Arblaster, J. W. (1989)."Densities of Osmium and Iridium Recalculations Based upon a Review of the Latest Crystallographic Data".Platinum Metals Rev.33(1): 14–16.
- ^Becker, Luann (2002)."Repeated Blows"(PDF).Scientific American.286(3): 77–83.Bibcode:2002SciAm.286c..76B.doi:10.1038/scientificamerican0302-76.PMID11857903.Diakses tanggal15 Juli2023.
- ^abKyte, Frank T.; Zhiming Zhou;John T. Wasson(1981). "High noble metal concentrations in a late Pliocene sediment".Nature.292(5822): 417–420.Bibcode:1981Natur.292..417K.doi:10.1038/292417a0.ISSN0028-0836.
- ^abcdefghijklmnGreenwood, N. N.; Earnshaw, A. (1997).Chemistry of the Elements(edisi ke-2). Oxford: Butterworth–Heinemann. hlm. 1113–1143, 1294.ISBN978-0-7506-3365-9.OCLC213025882.
- ^abcdefghijklmnoHunt, L. B. (1987)."A History of Iridium".Platinum Metals Review.31(1): 32–41.
- ^Kittel, C. (2004).Introduction to Solid State Physics(edisi ke-7). Wiley-India.ISBN978-81-265-1045-0.
- ^Arblaster, J. W. (1995)."Osmium, the Densest Metal Known".Platinum Metals Review.39(4): 164. Diarsipkan dariversi aslitanggal 27 September 2011.Diakses tanggal15 Juli2023.
- ^Cotton, Simon (1997).Chemistry of Precious Metals.Springer-Verlag New York, LLC. hlm. 78.ISBN978-0-7514-0413-5.
- ^Lide, D. R. (1990).CRC Handbook of Chemistry and Physics
 (edisi ke-70). Boca Raton (FL):CRC Press.ISBN9780849304712.
(edisi ke-70). Boca Raton (FL):CRC Press.ISBN9780849304712.
- ^Arblaster, J. W. (1989)."Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data"(PDF).Platinum Metals Review.33(1): 14–16. Diarsipkan dariversi aslitanggal 7 Februari 2012.Diakses tanggal15 Juli2023.
- ^US 3293031A,Cresswell, Peter & Rhys, David, diterbitkan tanggal 20/12/1966
- ^Darling, A. S. (1960)."Iridium Platinum Alloys - A Critical Review Of Their Constitution And Properties".Platinum Metals Review.4(1): 18–26.Reviewed in"Iridium–Platinum Alloys".Nature.186(4720): 211. 1960.Bibcode:1960Natur.186Q.211..doi:10.1038/186211a0
 .
.
- ^Biggs, T.; Taylor, S. S.; van der Lingen, E. (2005). "The Hardening of Platinum Alloys for Potential Jewellery Application".Platinum Metals Review.49(1): 2–15.doi:10.1595/147106705X24409
 .
.
- ^abcdefghijEmsley, J. (2003)."Iridium".Nature's Building Blocks: An A–Z Guide to the Elements.Oxford, England, UK:Oxford University Press.hlm.201–204.ISBN978-0-19-850340-8.
- ^Emsley, John (2011).Nature's Building Blocks: An A–Z Guide to the Elements(edisi ke-New). New York: Oxford University Press.ISBN978-0-19-960563-7.
- ^abPerry, D. L. (1995).Handbook of Inorganic Compounds.CRC Press. hlm.203–204.ISBN978-1439814611.
- ^Lagowski, J. J., ed. (2004).Chemistry Foundations and Applications.2.Thomson Gale. hlm.250–251.ISBN978-0028657233.
- ^ Munson, Ronald A. (Februari 1968)."The Synthesis of Iridium Disulfide and Nickel diarsenide having the Pyrite Structure"(PDF).Inorganic Chemistry.7(2): 389–390.doi:10.1021/ic50060a047.
- ^abcdeAudi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003),"The NUBASEevaluation of nuclear and decay properties ",Nuclear Physics A,729:3–128,Bibcode:2003NuPhA.729....3A,doi:10.1016/j.nuclphysa.2003.11.001
- ^abcMager Stellman, J. (1998)."Iridium".Encyclopaedia of Occupational Health and Safety.International Labour Organization. hlm.63.19.ISBN978-92-2-109816-4.OCLC35279504.
- ^Robinson, R.; Thoennessen, M. (2012). "Discovery of tantalum, rhenium, osmium, and iridium isotopes".Atomic Data and Nuclear Data Tables.98(5): 911–932.arXiv:1109.0526
 .Bibcode:2012ADNDT..98..911R.doi:10.1016/j.adt.2011.09.003.
.Bibcode:2012ADNDT..98..911R.doi:10.1016/j.adt.2011.09.003.
- ^Chereminisoff, N. P. (1990).Handbook of Ceramics and Composites.CRC Press. hlm. 424.ISBN978-0-8247-8006-7.
- ^Jung, D.; Demazeau, Gérard (1995). "High Oxygen Pressure and the Preparation of New Iridium (VI) Oxides with Perovskite Structure:Sr2MIrO6(M = Ca, Mg) ".Journal of Solid State Chemistry.115(2): 447–455.Bibcode:1995JSSCh.115..447J.doi:10.1006/jssc.1995.1158.
- ^Gong, Y.; Zhou, M.; Kaupp, M.; Riedel, S. (2009). "Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII".Angewandte Chemie International Edition.48(42): 7879–7883.doi:10.1002/anie.200902733.PMID19593837.
- ^Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001).Inorganic Chemistry(edisi ke-1). Academic Press.ISBN978-0-12-352651-9.OCLC47901436.
- ^Esteruelas, Miguel A.; López, Ana M.; Oliván, Montserrat (2016). "Polyhydrides of Platinum Group Metals: Nonclassical Interactions and σ-Bond Activation Reactions".Chemical Reviews.116(15): 8770–8847.doi:10.1021/acs.chemrev.6b00080
 .PMID27268136.
.PMID27268136.
- ^Černý, R.; Joubert, J.-M.; Kohlmann, H.; Yvon, K. (2002). "Mg6Ir2H11,a new metal hydride containing saddle-likeIrH5−4and square-pyramidalIrH4−5hydrido complexes ".Journal of Alloys and Compounds.340(1–2): 180–188.doi:10.1016/S0925-8388(02)00050-6.
- ^Gulliver, D. J.; Levason, W. (1982). "The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states".Coordination Chemistry Reviews.46:1–127.doi:10.1016/0010-8545(82)85001-7.
- ^abcdeRenner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; et al. (2002). "Platinum group metals and compounds".Ullmann's Encyclopedia of Industrial Chemistry.Wiley.doi:10.1002/14356007.a21_075.ISBN978-3527306732.
- ^Crabtree, R. H.(1979). "Iridium compounds in catalysis".Accounts of Chemical Research.12(9): 331–337.doi:10.1021/ar50141a005.
- ^Crabtree, R. H.(2005).The Organometallic Chemistry of the Transition Metals(PDF).Wiley.ISBN978-0471662563.OCLC224478241.Diarsipkan dariversi asli(PDF)tanggal 19 November 2012.
- ^Janowicz, A. H.; Bergman, R. G. (1982). "Carbon-hydrogen activation in completely saturated hydrocarbons: direct observation of M + R-H → M(R)(H)".Journal of the American Chemical Society.104(1): 352–354.doi:10.1021/ja00365a091.
- ^Hoyano, J. K.; Graham, W. A. G. (1982). "Oxidative addition of the carbon-hydrogen bonds of neopentane and cyclohexane to a photochemically generated iridium(I) complex".Journal of the American Chemical Society.104(13): 3723–3725.doi:10.1021/ja00377a032.
- ^Hartwig, John F. (2011). "Regioselectivity of the Borylation of Alkanes and Arenes".Chemical Society Reviews.40(4): 1992–2002.doi:10.1039/c0cs00156b.PMID21336364.
- ^abcWeeks, Mary Elvira (1932). "The discovery of the elements. VIII. The platinum metals".Journal of Chemical Education.American Chemical Society (ACS).9(6): 1017–1034.Bibcode:1932JChEd...9.1017W.doi:10.1021/ed009p1017.ISSN0021-9584.Weeks, M. E. (1968).Discovery of the Elements
 (edisi ke-7). Journal of Chemical Education. hlm.385–407.ISBN978-0-8486-8579-9.OCLC23991202.
(edisi ke-7). Journal of Chemical Education. hlm.385–407.ISBN978-0-8486-8579-9.OCLC23991202.
- ^Donald McDonald, Leslie B. Hunt (1982).A History of Platinum and its Allied Metals.Johnson Matthey Plc. hlm.7–8.ISBN978-0-905118-83-3.
- ^Dixon, Joshua; Brownrigg, William (1801).The literary life of William Brownrigg. To which are added an account of the coal mines near Whitehaven: And Observations on the means of preventing epidemic fevers.hlm. 52. Diarsipkan dariversi aslitanggal 24 Maret 2017.
- ^Watson, Wm; Brownrigg, William (1749). "Several Papers concerning a New Semi-Metal, Called Platina; Communicated to the Royal Society by Mr. Wm. Watson F. R. S".Philosophical Transactions.46(491–496): 584–596.Bibcode:1749RSPT...46..584W.doi:10.1098/rstl.1749.0110
 .
.
- ^Marggraf, Andreas Sigismund (1760).Versuche mit dem neuen mineralischen Körper Platina del pinto genannt.Diarsipkan dariversi aslitanggal 24 Maret 2017.
- ^Thomson, T.(1831).A System of Chemistry of Inorganic Bodies.1.Baldwin & Cradock, London; and William Blackwood, Edinburgh. hlm.693.
- ^abGriffith, W. P. (2004)."Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries".Platinum Metals Review.48(4): 182–189.doi:10.1595/147106704x4844
 .
.
- ^Weeks, M. E. (1968).Discovery of the Elements
 (edisi ke-7). Journal of Chemical Education. hlm.414–418.ISBN978-0-8486-8579-9.OCLC23991202.
(edisi ke-7). Journal of Chemical Education. hlm.414–418.ISBN978-0-8486-8579-9.OCLC23991202.
- ^Tennant, S. (1804)."On Two Metals, Found in the Black Powder Remaining after the Solution of Platina".Philosophical Transactions of the Royal Society of London.94:411–418.doi:10.1098/rstl.1804.0018
 .JSTOR107152.
.JSTOR107152.
- ^Trigg, G. L. (1995). "Recoilless Emission and Absorption of Radiation".Landmark Experiments in Twentieth Century Physics.Courier Dover Publications. hlm. 179–190.ISBN978-0-486-28526-9.OCLC31409781.
- ^Mössbauer, R. L.(1958). "Gammastrahlung in Ir191".Zeitschrift für Physik A(dalam bahasa Jerman).151(2): 124–143.Bibcode:1958ZPhy..151..124M.doi:10.1007/BF01344210.
- ^Waller, I. (1964)."The Nobel Prize in Physics 1961: presentation speech".Nobel Lectures, Physics 1942–1962.Elsevier.
- ^"History/Origin of Chemicals".NASA.Diakses tanggal16 Juli2023.
- ^Chen, Hsin-Yu; Vitale, Salvatore; Foucart, Francois (1 Oktober 2021). "The Relative Contribution to Heavy Metals Production from Binary Neutron Star Mergers and Neutron Star–Black Hole Mergers".The Astrophysical Journal Letters.American Astronomical Society.920(1): L3.arXiv:2107.02714
 .Bibcode:2021ApJ...920L...3C.doi:10.3847/2041-8213/ac26c6.hdl:1721.1/142310.ISSN2041-8205.
.Bibcode:2021ApJ...920L...3C.doi:10.3847/2041-8213/ac26c6.hdl:1721.1/142310.ISSN2041-8205.
- ^Scott, E. R. D.; Wasson, J. T.; Buchwald, V. F. (1973). "The chemical classification of iron meteorites—VII. A reinvestigation of irons with Ge concentrations between 25 and 80 ppm".Geochimica et Cosmochimica Acta.37(8): 1957–1983.Bibcode:1973GeCoA..37.1957S.doi:10.1016/0016-7037(73)90151-8.
- ^ab"Iridium"(PDF).Human Health Fact Sheet.Argonne National Laboratory. 2005. Diarsipkan dariversi asli(PDF)tanggal 4 Maret 2012.Diakses tanggal16 Juli2023.
- ^Xiao, Z.; Laplante, A. R. (2004). "Characterizing and recovering the platinum group minerals—a review".Minerals Engineering.17(9–10): 961–979.Bibcode:2004MiEng..17..961X.doi:10.1016/j.mineng.2004.04.001.
- ^"Cuproiridsite CuIr2S4"(PDF).Hanbook of mineralogy.org.Diakses tanggal16 Juli2023.
- ^Vitaly A. Stepanov; Valentina E. Kungurova; Vitaly I. Gvozdev (2010)."Irasite Discovery in Copper-Nickel Ores of Shanuch Deposit (KAMCHATKA)"(PDF).New Data on Minerals.45:23.Diakses tanggal16 Juli2023.
- ^Garuti, Giorgio; Gazzotti, Moreno; Torres-Ruiz, Jose (1995)."Iridium, Rhodium, and Platinum Sulfides in Chromitites from the Ultramafic Massifs of Finero, Italy, and Ojen, Spain"(PDF).The Canadian Mineralogist.33:509–520.Diakses tanggal16 Juli2023.
- ^abcdSeymour, R. J.; O'Farrelly, J. I. (2012). "Platinum-Group Metals".Kirk Othmer Encyclopedia of Chemical Technology.Wiley.doi:10.1002/0471238961.1612012019052513.a01.pub3.ISBN978-0471238966.
- ^abGoldberg, Hodge; Kay, V; Stallard, M; Koide, M (1986). "Some comparative marine chemistries of platinum and iridium".Applied Geochemistry.1(2): 227–232.Bibcode:1986ApGC....1..227G.doi:10.1016/0883-2927(86)90006-5.
- ^abcWells, Boothe (1988). "Iridium in marine organisms".Geochimica et Cosmochimica Acta.52(6): 1737–1739.Bibcode:1988GeCoA..52.1737W.doi:10.1016/0016-7037(88)90242-6.
- ^abcSawlowicz, Z (1993). "Iridium and other platinum-group elements as geochemical markers in sedimentary environments".Palaeogeography, Palaeoclimatology, Palaeoecology.104(4): 253–270.Bibcode:1993PPP...104..253S.doi:10.1016/0031-0182(93)90136-7.
- ^Crocket, Macdougall; Harriss, R (1973). "Gold, palladium and iridium in marine sediments".Geochimica et Cosmochimica Acta.37(12): 2547–2556.Bibcode:1973GeCoA..37.2547C.doi:10.1016/0016-7037(73)90264-0.
- ^Peucker-Ehrenbrink, B (2001). "Iridium and Osmium as Tracers of Extraterrestrial Matter in Marine Sediments".Accretion of Extraterrestrial Matter Throughout Earth's History.hlm. 163–178.doi:10.1007/978-1-4419-8694-8_10.ISBN978-1-4613-4668-5.
- ^Barker, J; Edward, A (1968). "Accretion rate of cosmic matter from iridium and osmium contents of deep-sea sediments".Geochimica et Cosmochimica Acta.32(6): 627–645.Bibcode:1968GeCoA..32..627B.doi:10.1016/0016-7037(68)90053-7.
- ^Colodner, D; Edmond, J (1992). "Post-depositional mobility of platinum, iridium and rhenium in marine sediments".Nature.358(6385): 402–404.Bibcode:1992Natur.358..402C.doi:10.1038/358402a0.
- ^abAlvarez, L. W.;Alvarez, W.; Asaro, F.; Michel, H. V. (1980)."Extraterrestrial cause for the Cretaceous–Tertiary extinction"(PDF).Science.208(4448): 1095–1108.Bibcode:1980Sci...208.1095A.CiteSeerX10.1.1.126.8496
 .doi:10.1126/science.208.4448.1095.PMID17783054.
.doi:10.1126/science.208.4448.1095.PMID17783054.
- ^Hildebrand, A. R.; Penfield, Glen T.; Kring, David A.; Pilkington, Mark; Zanoguera, Antonio Camargo; Jacobsen, Stein B.; Boynton, William V. (1991). "Chicxulub Crater; a possible Cretaceous/Tertiary boundary impact crater on the Yucatan Peninsula, Mexico".Geology.19(9): 867–871.Bibcode:1991Geo....19..867H.doi:10.1130/0091-7613(1991)019<0867:CCAPCT>2.3.CO;2.
- ^Frankel, C. (1999).The End of the Dinosaurs: Chicxulub Crater and Mass Extinctions
 .Cambridge University Press.ISBN978-0-521-47447-4.OCLC40298401.
.Cambridge University Press.ISBN978-0-521-47447-4.OCLC40298401.
- ^Ryder, G.; Fastovsky, D. E.; Gartner, S. (1996).The Cretaceous-Tertiary Event and Other Catastrophes in Earth History.Geological Society of America. hlm.47.ISBN978-0-8137-2307-5.
- ^Toutain, J.-P.; Meyer, G. (1989). "Iridium-Bearing Sublimates at a Hot-Spot Volcano (Piton De La Fournaise, Indian Ocean)".Geophysical Research Letters.16(12): 1391–1394.Bibcode:1989GeoRL..16.1391T.doi:10.1029/GL016i012p01391.
- ^abcPlatinum-Group Metals.U.S. Geological Survey Mineral Commodity Summaries
- ^Singerling, Sheryl A.; Schulte, Ruth F. (Agustus 2021). "Platinum-Group Metals".2018 Minerals Yearbook(PDF).USGS.hlm. 57.11.
- ^Hagelüken, C. (2006)."Markets for the catalysts metals platinum, palladium, and rhodium"(PDF).Metall.60(1–2): 31–42. Diarsipkan dariversi asli(PDF)tanggal 4 Maret 2009.
- ^ "Platinum 2013 Interim Review"(PDF).Platinum Today.Johnson Matthey.Diakses tanggal16 Juli2023.
- ^abRyan, Marge (16 November 2022)."Recycling and thrifting: the answer to the iridium question in electrolyser growth".
- ^Gilchrist, Raleigh (1943). "The Platinum Metals".Chemical Reviews.32(3): 277–372.doi:10.1021/cr60103a002.
- ^Ohriner, E. K. (2008). "Processing of Iridium and Iridium Alloys".Platinum Metals Review.52(3): 186–197.doi:10.1595/147106708X333827
 .
.
- ^Hunt, L. B.; Lever, F. M. (1969)."Platinum Metals: A Survey of Productive Resources to industrial Uses"(PDF).Platinum Metals Review.13(4): 126–138. Diarsipkan dariversi asli(PDF)tanggal 29 Oktober 2008.Diakses tanggal16 Juli2023.
- ^"Mineral Yearbook 2020 tables-only release".USGS.Diakses tanggal16 Juli2023.
- ^abHandley, J. R. (1986)."Increasing Applications for Iridium".Platinum Metals Review.30(1): 12–13.
- ^Crookes, W.(1908). "On the Use of Iridium Crucibles in Chemical Operations".Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character.80(541): 535–536.Bibcode:1908RSPSA..80..535C.doi:10.1098/rspa.1908.0046
 .JSTOR93031.
.JSTOR93031.
- ^Egorova, R. V.; Korotkov, B. V.; Yaroshchuk, E. G.; Mirkus, K. A.; Dorofeev N. A.; Serkov, A. T. (1979). "Spinnerets for viscose rayon cord yarn".Fibre Chemistry.10(4): 377–378.doi:10.1007/BF00543390.
- ^Graff, Muriel; Kempf, Bernd; Breme, Jürgen (23 Desember 2005). "Iridium Alloy for Spark Plug Electrodes".Materials for Transportation Technology.Weinheim, FRG: Wiley-VCH Verlag GmbH & Co. KGaA. hlm. 1–8.doi:10.1002/3527606025.ch1.ISBN9783527301249.
- ^Cheung, H.; Tanke, R. S.; Torrence, G. P. (2000). "Acetic acid".Ullmann's Encyclopedia of Industrial Chemistry.Wiley.doi:10.1002/14356007.a01_045.ISBN978-3527306732.
- ^Jones, Jane H. (2000)."The cativa™ process for the manufacture of acetic acid".Platinum Metals Review.44(3): 94–105.
- ^Roseblade, S. J.; Pfaltz, A. (2007). "Iridium-catalyzed asymmetric hydrogenation of olefins".Accounts of Chemical Research.40(12): 1402–1411.doi:10.1021/ar700113g.PMID17672517.
- ^Ikariya, Takao; Blacker, A. John (2007). "Asymmetric Transfer Hydrogenation of Ketones with Bifunctional Transition Metal-Based Molecular Catalysts†".Accounts of Chemical Research.40(12): 1300–1308.doi:10.1021/ar700134q.PMID17960897.
- ^Matthias Beller, Hans-Ulrich Blaser, ed. (2012).Organometallics as Catalysts in the Fine Chemical Industry.Topics in Organometallic Chemistry.42.Berlin, Heidelberg: Springer.ISBN978-3-642-32832-9.
- ^Halmshaw, R. (1954). "The use and scope of Iridium 192 for the radiography of steel".British Journal of Applied Physics.5(7): 238–243.Bibcode:1954BJAP....5..238H.doi:10.1088/0508-3443/5/7/302.
- ^Hellier, Chuck (2001).Handbook of Nondestructive Evlaluation.The McGraw-Hill Companies.ISBN978-0-07-028121-9.
- ^Jean Pouliot; Luc Beaulieu (2010). "13 - Modern Principles of Brachytherapy Physics: From 2-D to 3-D to Dynamic Planning and Delivery". Dalam Richard T. Hoppe; Theodore Locke Phillips; Mack Roach.Leibel and Phillips Textbook of Radiation Oncology(edisi ke-3). W.B. Saunders. hlm. 224–244.doi:10.1016/B978-1-4160-5897-7.00013-5.ISBN9781416058977.
- ^Ulbricht, Christoph; Beyer, Beatrice; Friebe, Christian; Winter, Andreas; Schubert, Ulrich S. (2009). "Recent Developments in the Application of Phosphorescent Iridium(III) Complex Systems".Advanced Materials.21(44): 4418–4441.Bibcode:2009AdM....21.4418U.doi:10.1002/adma.200803537.
- ^Penzes, W. B. (2001)."Time Line for the Definition of the Meter".National Institute for Standards and Technology.Diakses tanggal16 Juli2023.
- ^Kutipan bagian umum:Recalibration of the U.S. National Prototype Kilogram,R.S.Davis, Journal of Research of the National Bureau of Standards,90,No. 4,July–August1985 (5.5MB PDFDiarsipkan1 Februari 2017 diWayback Machine.); danThe Kilogram and Measurements of Mass and Force,Z.J.Jabbour dkk., J. Res. Natl. Inst. Stand. Technol.106,2001,25–46(3.5MB PDF)
- ^Mottishaw, J. (1999)."Notes from the Nib Works—Where's the Iridium?".The PENnant.XIII(2).
- ^Crookes, W., ed. (1867)."The Paris Exhibition".The Chemical News and Journal of Physical Science.XV:182.
- ^Pepper, J. H. (1861).The Playbook of Metals: Including Personal Narratives of Visits to Coal, Lead, Copper, and Tin Mines, with a Large Number of Interesting Experiments Relating to Alchemy and the Chemistry of the Fifty Metallic Elements.Routledge, Warne, and Routledge. hlm.455.
- ^Iavicoli, Ivo; Leso, Veruscka (2015). "Iridium".Handbook on the Toxicology of Metals.hlm. 855–878.doi:10.1016/B978-0-444-59453-2.00040-8.ISBN9780444594532.
- ^"Radioisotope Brief: Iridium-192 (Ir-192)"(PDF).Radiation Emergencies.Centers for Disease Control and Prevention. 18 Agustus 2004.Diakses tanggal16 Juli2023.
Pranala luar
[sunting|sunting sumber]- (Inggris)IridiumdiThe Periodic Table of Videos(Universitas Nottingham)
- (Inggris)Iridium dalam Encyclopædia Britannica
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


