Ikatan pi

Dalamkimia,ikatan pi(ikatan π) adalahikatan kimiakovalenyang dua cuping orbital atom yang berlektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya yang juga berlektron tunggal. Hanya terdapat satubidang simpuldari orbital yang melewati duainti atom.
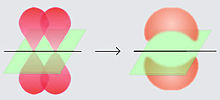
Huruf Yunaniπberasal dari namaorbital pkarena simetri orbital ikatan pi adalah sama dengan orbital p ketika dilihat dari sumbu ikatan. Orbital p biasanya terlibat dalam ikatan sejenis ini. Orbital d juga dianggap terlibat dalam ikatan pi, tetapi tidaklah seperlunya benar, walaupun konsep ikatan orbital d sesuai dengan hipervalensi.
Ikatan pi biasanya lebih lemah dariikatan sigmakarena rapatan elektronnya lebih jauh dariinti atomyang bermuatan positif, sehingga memerlukan lebih banyak energi. Dari sudut pandangmekanika kuantum,kelemahan ikatan ini dijelaskan oleh ketumpangtindihan yang sangat sedikit di antara orbital p oleh karena orientasinya yang paralel.
Walaupun ikatan pi lebih lemah dari ikatan sigma, ikatan pi sering kali merupakan komponen dari ikatan rangkap bersamaan dengan ikatan sigma. Kombinasi dari ikatan sigma dan pi lebih kuat dari ikatan pi dan sigma yang berdiri sendiri. Kekuatan ikatan yang bertambah dari ikatan rangkap diindikasikan oleh banyak pengamatan, tetapi yang paling menonjol adalah kontraksi panjang ikatan. Sebagai contoh, dalam kimia organik,panjang ikatkarbon-karbon padaetanaadalah 154pm,etilena133 pm, danasetilena120 pm.
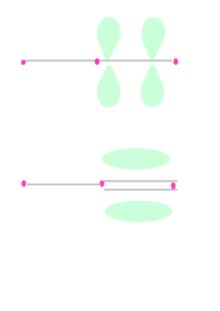

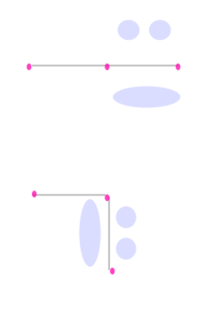
Selain ikatan sigma, sebuah pasangan atom yang dihubungkan denganikatan rangkap duamemiliki satu ikatan pi danikatan rangkap tigamemiliki dua ikatan pi. Ikatan pi dihasilkan dari tumpang tindih orbital-orbital. Ikatan pi memiliki sifat yang lebih baur dari ikatan sigma. Elektron-elektron pada ikatan pi kadang kala dirujuk sebagai elektron pi. Fragmen molekul yang dihubungkan dengan ikatan pi tidak dapat diputar tanpa memutuskan ikatan pi tersebut, karena perputaran akan merusak orientasi paralel dari orbital-orbital p yang membentuk ikatan pi.
Kasus khusus
[sunting|sunting sumber]Ikatan pi tidak seperlunya menghubungkan sepasang atom yang juga memiliki ikatan sigma.
Pada beberapa kompleks logam, interaksi pi antara atom logam dengan orbital antiikat pialkanadanalkenamembentuk ikatan pi.
Dalam beberapa kasus ikatan rangkap banyak antara dua atom, tidak terdapat ikatan sigma sama sekali, yang ada hanyalah ikatan pi. Contohnya meliputidiferri heksakarbonil(Fe2(CO)6),dikarbon(C2) danboranaB2H2.Dalam senyawa-senyawa ini, ikatan pusat hanya terdiri dari ikatan pi, dan agar mencapai wilayah tumpang tindih yang maksimum, panjang ikatan menjadi lebih pendek dari yang diperkirakan.[1]
Lihat pula
[sunting|sunting sumber]Referensi
[sunting|sunting sumber]- ^Bond length and bond multiplicity: σ-bond prevents short π-bondsEluvathingal D. Jemmis, Biswarup Pathak, R. Bruce King, Henry F. Schaefer IIIChemical Communications,2006,2164 - 2166Abstract
