Nikel
28Ni Nikel | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Sepotong nikel berukuran 3 cm | |||||||||||||||||||||||||||||||||||||||||
Garis spektrum nikel | |||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /nikêl/[1] | ||||||||||||||||||||||||||||||||||||||||
| Penampilan | berkilau, metalik, dan perak dengan semburat emas | ||||||||||||||||||||||||||||||||||||||||
| Nikel dalamtabel periodik | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Nomor atom(Z) | 28 | ||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 10 | ||||||||||||||||||||||||||||||||||||||||
| Periode | periode 4 | ||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | ||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | ||||||||||||||||||||||||||||||||||||||||
| Berat atom standar(Ar) |
| ||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Ar] 4s23d8atau[Ar] 4s13d9(lihat teks) | ||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 16, 2atau2, 8, 17, 1 | ||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||
| FasepadaSTS(0 °C dan 101,325kPa) | padat | ||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 1728K(1455 °C, 2651 °F) | ||||||||||||||||||||||||||||||||||||||||
| Titik didih | 3003 K (2730 °C, 4946 °F) | ||||||||||||||||||||||||||||||||||||||||
| Kepadatanmendekatis.k. | 8,908 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| saat cair, padat.l. | 7,81 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 17,48kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 379 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 26,07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −2, −1, 0, +1,[2]+2,+3, +4[3](oksida agakbasa) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,91 | ||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 737,1 kJ/mol ke-2: 1753,0 kJ/mol ke-3: 3395 kJ/mol (artikel) | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 124pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 124±4 pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 163 pm | ||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka(fcc) | ||||||||||||||||||||||||||||||||||||||||
| Kecepatan suarabatang ringan | 4900 m/s (padas.k.) | ||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 13,4 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 90,9 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 69,3 nΩ·m (suhu 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Arah magnet | feromagnetik | ||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 200 GPa | ||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 76 GPa | ||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 180 GPa | ||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 4,0 | ||||||||||||||||||||||||||||||||||||||||
| Skala Vickers | 638 MPa | ||||||||||||||||||||||||||||||||||||||||
| Skala Brinell | 667–1600 MPa | ||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||
| Penemuandan isolasi pertama | Axel F. Cronstedt(1751) | ||||||||||||||||||||||||||||||||||||||||
| Isotop nikelyang utama | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Nikeladalahunsur kimiametalik dalamtabel periodikyang memiliki simbolNidannomor atom28. Nikel adalahlogamberwarna putih keperak–perakan sedikit semburat keemasan. Nikel termasuklogam transisi,dan memiliki sifat keras sertaulet.[4]Nikel juga tergolong dalam grup logam besi-kobalt, yang dapat menghasilkan paduan yang sangat berharga.[5]Nikel murni berbentuk bubuk untuk memaksimalkanluas permukaanreaktif, memiliki aktivitas kimia yang signifikan, tetapi potongan yang besar lambat bereaksi dengan udara dalamkondisi normalkarena lapisan teroksidasi terbentuk di permukaan dan mencegah korosi lebih lanjut (pasivasi). Meski begitu, nikel murni hanya ditemukan dikerak bumidalam jumlah kecil, biasanya di batuan ultrabasa,[6][7]dan di dalam meteorit besi atau siderit yang tidak terpapar oksigen saat berada di luar atmosfer Bumi.
Nikel di dalam meteorit ditemukan bersama dengan besi, yang berasal darisupernova.Campuran besi–nikel diperkirakan menyusuninti luardaninti dalambumi.[8]
Penggunaan nikel (sebagai paduan nikel-besi) dimulai sejak 3500 SM. Nikel pertama kali diklasifikasikan sebagai unsur kimia pada tahun 1751 olehAxel Fredrik Cronstedt,yang awalnya mengirabijihtersebut sebagai mineraltembaga,di tambangkobaltdiLos,Hälsingland,Swedia.Nama elemen ini berasal dariperinakal dari mitologi penambang Jerman, Nickel (mirip denganNick Lama), yang mempersonifikasikan fakta bahwa bijih tembaga–nikel tidak bisa dimurnikan menjadi tembaga. Sumber nikel yang penting secara ekonomi adalah bijihbesilimonit,yang mengandung 1–2% nikel. Mineral bijih nikel penting lainnya termasukpentlanditdan campuran silikat alami yang kaya nikel yang dikenal sebagaigarnierit.Lokasi produksi utama terletak diwilayah SudburydiKanada(yang diperkirakan berasal dari meteorit),Kaledonia Baru,danNorilskdiRusia.
Nikel secara perlahanteroksidasioleh udara pada suhu normal dan dianggap tahan korosi. Dalam sejarah, nikel digunakan untuk pelapisan besi dankuningan,melapisi peralatan kimia, dan membuat paduan tertentu yang mempertahankan polesan perak tinggi, sepertiperak Jerman.Sekitar 9% digunakan untuk lapisan nikel tahan korosi. Benda yang dilapisi nikel terkadang memicualergi nikel.Nikel banyak digunakan dalamuang logam,walaupun kenaikan harga telah menyebabkan penggantian nikel dengan logam yang lebih murah dalam beberapa tahun terakhir.
Nikel adalah salah satu dari empat elemen (yang lainnya adalahbesi,kobalt,dangadolinium)[9]yang bersifatferomagnetikpada suhu normal.Magnetpermanen Alnico yang mengandung nikel memiliki kekuatan sedang antara magnet permanen besi danmagnet tanah jarang.Perpaduan nikel, krom dan besi menghasilkan baja tahan karat (stainless steel) yang banyak diaplikasikan pada peralatan dapur (sendok, dan peralatan memasak), ornamen-ornamenrumahdangedung,serta komponenindustri.Nikel penting pada zaman modern, terutama untukpaduan;sekitar 68% digunakan untuk baja tahan karat. 10% digunakan untuk paduan nikel–tembaga, 7% untuk baja paduan, 3% untuk pengecoran, 9% untuk pelapisan dan 4% dalam penggunaan lain, yang termasuk sektorbateraiyang cepat berkembang.[10]Sebagai suatu senyawa, nikel memiliki kegunaan pembuatan bahan kimia khusus, sepertikatalisuntukhidrogenasi(untuk ini digunakannikel Raney),katodauntuk baterai,pigmen,dan perawatan permukaan logam.[11]Nikel merupakan nutrisi yang penting untuk sebagianmikroorganismedan tumbuhan yang memilikienzimdengan nikel sebagaisitus aktifnya.
Karakteristik[sunting|sunting sumber]
Sifat atom dan fisik[sunting|sunting sumber]

Nikel adalah logam putih keperakan dengan sedikit semburat keemasan dengan polesan tinggi. Ini adalah salah satu dari empat elemen yang bisa menjadi magnet pada atau mendekati suhu kamar, bersama dengan besi,kobalt,dangadolinium,jika didekatkan dengan sebuah magnet.Suhu Curienikel adalah 355 °C (671 °F), artinya nikel menjadi non-magnetis diatas suhu Curie.[13]Sel satuan nikel adalahkubus-berpusat mukadengan parameter kisi 0,352nm,yang membentukjari-jari atom0,124 nm. Struktur kristal ini stabil pada tekanan lebih dari 70GPa.Nikel termasuk dalam kelompoklogam transisi.Nikel memiliki sifat keras, mudah dibentuk danulet,dan memilikikonduktivitas listrikdanpanasyang relatif tinggi untuk logam-logam transisi.[4]Kekuatan tekannikel yang tinggi sebesar 34 GPa, diperkirakan bisa membuat kristal ideal, tidak pernah diperoleh dalam material sebenarnya karena pembentukan dan pergerakandislokasi;namun, tekanan itu telah dicapai dalamnanopartikelNi.[14]
Konfigurasi elektron[sunting|sunting sumber]
Atom nikel memiliki duakonfigurasi elektron,[Ar] 3d84s2dan [Ar] 3d94s1.Jumlah energinya sangat dekat - simbol [Ar] mengacu pada struktur inti yang berbentuk sepertiargon.Ada beberapa ketidaksepakatan tentang konfigurasi yang memiliki energi paling rendah.[15]Buku pelajaran kimia mengutip konfigurasi elektron nikel sebagai [Ar] 4s23d8,[16]bisa ditulis sebagai [Ar] 3d84s2.[17]Konfigurasi ini sesuai denganaturan urutan energi Madelung,yang memprediksi 4s terisi sebelum 3d. Hal ini didukung oleh fakta eksperimental bahwa tingkat energi terendah dari atom nikel adalah tingkat energi 3d84s2,khususnya tingkat energi 3d8(3F) 4s23F, J = 4.[18]
Namun, masing-masing dua konfigurasi terbagi menjadi beberapa tingkat energi karenastruktur yang halus,[18]dan kedua kelompok tingkat energi tersebut tumpang tindih. Energi rata-rata tingkat dengan konfigurasi [Ar] 3d94s1lebih rendah daripada energi rata-rata tingkat dengan konfigurasi [Ar] 3d84s2.Karena ini, penelitian tentang perhitungan atom mengutip konfigurasi tingkat dasar nikel sebagai [Ar] 3d94s1.[15]
Isotop[sunting|sunting sumber]
Bobot atomsetiap isotop nikel berkisar dari 48 u (48Ni) sampai 78 u (78Ni).
Nikel yang dapat ditemukan secara alami terdiri dari limaisotopstabil;58Ni,60Ni,61Ni,62Ni dan 64Ni. Isotop58Ni paling banyak ditemukan (68.077%kelimpahan alami). Isotop yang lebih berat dari62Ni tidak dapat dibentuk denganfusi nuklirtanpa kehilangan energi untuk fusi.
Nikel-62memilikienergi pengikatan intirata-rata tertinggi per nukleon dari setiap nuklida, pada 8,7946 MeV/nukleon.[19]Energi ikatnya lebih besar dari56Fedan58Fe,unsur-unsur yang lebih banyak ditemukan daripada62Ni yang sering salah dikutip sebagai memiliki nuklida yang memiliki ikatan paling erat.[20]Walaupun ini memprediksi nikel-62 sebagai unsur berat paling banyak dialam semesta,tingkatfotodisintegrasinikel yang relatif tinggi di dalam bintang menyebabkan besi menjadi elemen yang paling melimpah.[20]
Isotop stabil nikel-60 adalah produk dariradionuklidabesipunah60Fe,yangmeluruhdenganwaktu paruh2,6 juta tahun. Karena60Fe memiliki waktu paruh yang sangat lama, persistensi Fe pada material ditata suryadapat menghasilkan variasi komposisi isotop60Ni yang dapat dideteksi. Oleh karena itu, kelimpahan60Ni di bendaluar angkasadapat memberikan wawasan tentang asal-usul tata surya dan sejarahnya.
Setidaknya 26radioisotopnikel telah ditemukan, yang paling stabil adalah59Ni denganwaktu paruh76.000 tahun,63Ni dengan waktu paruh 100 tahun, dan56Ni dengan waktu paruh 6 hari. Semua sisa isotopradioaktifmemiliki waktu paruh kurang dari 60 jam dan sebagian besar memiliki waktu paruh kurang dari 30 detik. Elemen ini juga memiliki satustatus meta.[21]
Nikel-56 yang radioaktif diproduksi melaluiproses pembakaran silikondan kemudian dibebaskan dalam jumlah besar dalamsupernovatipe Ia.Bentukkurva cahayasupernova ini pada masa-tengah hingga akhir berhubungan dengan peluruhan melaluipenangkapan elektronnikel-56 menjadi kobalt-56 dan akhirnya menjadi besi-56.[22]Nickel-59 adalahradionuklidakosmogenikdengan umur panjang dengan waktu paruh 76.000 tahun.59Ni memiliki banyak kegunaan dalamgeologi isotop.59Ni telah digunakan untuk menentukan umurmeteoritdi bumi dan untuk menentukan kelimpahan debu luar angkasa dalam es dan sedimen. Waktu paruh nikel-78 adalah 110 milidetik, dan diyakini sebagai isotop penting dalamnukleosintesis(pembuatan) dalam supernova unsur yang lebih berat daripada besi.[23]Nuklida48Ni, ditemukan pada tahun 1999, adalah isotop unsur berat yang memiliki proton yang paling banyak diketahui. Dengan 28protondan 20neutron,48Ni memiliki "bilangan ajaibganda ", seperti halnya78Ni dengan 28protondan 50neutron.Oleh karena itu, keduanya stabil untuk sebuah nuklida dengan ketidakseimbangan proton-neutron yang besar.[21][24]
Keberadaan[sunting|sunting sumber]

Di Bumi, nikel paling sering muncul denganbelerangdanbesidi dalam mineralpentlandit,denganbelerangdi dalam mineralmillerit,denganarsendi dalam mineralnikelin,dan dengan arsen danbelerangdi dalamgalenanikel.[25]Nikel banyak ditemukan pada meteorit besi atau siderit sebagai mineralkamasitdantaenit.Nikel menjadi ciri komponen yang membedakan meteorit dari mineral lainnya.[5]Meteorit besi atau siderit dapat mengandung alloy besi dan nikel berkadar 5-25%.[5]Keberadaan nikel dalam meteorit pertama kali ditemukan pada tahun 1799 olehJoseph-Louis Proust,seorang ahli kimia dariPrancisyang kemudian bekerja diSpanyol.Proust menganalisis sampel meteorit dariCampo del Cielo(Argentina), yang diperoleh pada tahun 1783 oleh Miguel Rubín de Celis. Dia menemukan nikel (sekitar 10%) bersama dengan besi di meteoritnya.[26]
Sebagian besar nikel ditambang dari dua jenis deposit bijih, yaitulaterit,denganlimonitnikel sebagai campuran mineral bijih utama, (Fe,Ni)O(OH), dangarnierit(campuran berbagai nikel hidro dan silikat kaya nikel), dan endapansulfidamagmatik, di mana mineral bijih utamanya adalahpentlandit:(Ni,Fe)9S8.
IndonesiadanAustraliadiperkirakan memiliki cadangan terbesar, yaitu 43,6% dari total cadangan dunia.[27]
Sumber daya alamyang sudah diidentifikasi dengan rata-rata 1% nikel atau lebih mengandung 130 juta ton nikel (sekitar dua kali lipat dari cadangan yang diketahui). Sekitar 60% berada di dalam minerallateritdan 40% di dalam endapan sulfida.[28]
Berdasarkan buktigeofisika,sebagian besar nikel di Bumi berada diinti luardandalamBumi.Kamasitdantaenitadalah paduan besi dan nikel yang terbentuk secara alami. Untuk mineral kamasit, paduan besi dan nikel biasanya dalam proporsi 90:10 hingga 95:5, walaupun material lain (sepertikobaltataukarbon) mungkin ada, sedangkan untuk mineral taenit, kandungan nikelnya berkisar antara 20% dan 65%. Mineral kamasit dan taenit juga ditemukan dimeteorit besi-nikel.[29]
Sifat lain[sunting|sunting sumber]
Nikel adalah logam yang ringan, mudah ditempa, sedikitferromagnetis,dan merupakan konduktor yang agak baik terhadap panas dan listrik.[5]Nikel juga tahan terhadap oksidasi, mudah ditarik oleh magnet, larut dalamasam nitrit,tidak larut dalamairdanamonia,dan sedikit larut dalam hidroklorik dan asam belerang.[5]Rapat jenisnya8,902, danberat jenis8,8 untuk logam padat dan 9,04 untuk kristal tunggal.[5]
Senyawa[sunting|sunting sumber]
Bilangan oksidasinikel yang paling banyak ditemui adalah +2. Senyawa Ni0,Ni+,dan Ni3+telah diketahui dengan baik, dan bilangan oksidasi exotis Ni2−,Ni1−,dan Ni4+telah diproduksi dan dipelajari.[30]
Nikel(0)[sunting|sunting sumber]
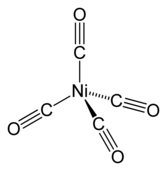
Nikel tetrakarbonil(Ni(CO)4) adalah cairan yang mudah menguap dan sangat beracun pada suhu ruangan. Nikel tetrakarbonil ditemukan olehLudwig Mond.[31]Saat dipanaskan, kompleksnya terurai kembali menjadi nikel dankarbon monoksida:
Ni(CO)4⇌ Ni + 4 CO
Perilaku ini digunakan dalamproses Monduntuk memurnikan nikel, seperti dijelaskan di atas. Nikel(0) kompleksbis(siklooktadiena)nikel(0)yang terkait adalah katalis yang berguna dalam kimia organonikel karenaligansiklooktadiena(atau kod) mudah tergeser.
Nikel(I)[sunting|sunting sumber]
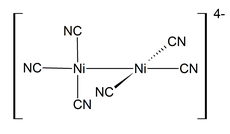
Kompleks nikel(I) jarang ditemukan, salah satu contohnya adalah kompleks tetrahedral NiBr(PPh3)3.Banyak kompleks nikel(I) memiliki ikatan Ni-Ni, seperti K4[Ni2(CN)6], yangdiamagnetikdan berwarna merah tua, disiapkan dengan mereduksi K2[Ni2(CN)6] denganamalgam natrium(paduanraksadannatrium). Senyawa ini teroksidasi dalam air, yang membebaskan H2.[32]
Telah diperkirakan bahwa bilangan oksidasi nikel(I) penting untukenzimyang mengandung nikel, seperti[NiFe]-hidrogenase,yang mengkatalisisreduksireversibel proton menjadi H2.[33]
Nikel(II)[sunting|sunting sumber]

Nikel(II) membentuk senyawa dengan semuaanionumum, termasuksulfida,sulfat,karbonat,hidroksida,karboksilat,danhalida.Nikel(II) sulfatdiproduksi dalam jumlah besar dengan melarutkan logam nikel atau oksida dalamasam sulfat,membentuk hexa- dan heptahidrat[34]yang berguna untuk pelapisan nikel elektrik. Garam umum nikel, sepertiklorida,nitrat,dan sulfat, larut dalam air menghasilkan larutan hijau dari logam kompleks aquo[Ni(H2O)6]2+.
Keempat halida tersebut membentuk senyawa nikel, yaitu padatan dengan molekul yang memiliki pusat Ni oktahedral.Nikel(II) kloridapaling banyak ditemui, dan perilakunya seperti halida lainnya. Nikel(II) klorida diproduksi dengan melarutkan nikel atau oksidanya dalamasam klorida.Biasanya dijumpai sebagai heksahidrat hijau, rumusnya biasanya ditulis NiCl2•6H2O. Ketika dilarutkan dalam air, garam ini membentuklogam kompleks aquo[Ni(H2O)6]2+.Dehidrasi NiCl2•6H2O menghasilkan NiCl2anhidratberwarna kuning.[35]

Beberapa kompleks nikel(II) tetrakoordinat, misalnyabis(triphenylphosphine)nikel klorida,ada dalam geometritetrahedraldanbujur sangkar.Kompleks tetrahedral bersifatparamagnetik,sedangkan kompleks bidang persegidiamagnetik.Dalam memiliki sifat kesetimbangan magnet dan pembentukan kompleks oktahedral, keduanya berbeda dengan kompleks divalen dari logam golongan 10 yang lebih berat, yaitu paladium(II) dan platinum(II), yang hanya membentuk geometri bidang persegi.[30]
Nickelocenedikenal memiliki 20elektron.Ini menjadikan nickelocene relatif tidak stabil.[butuh rujukan]
Nikel(III) dan (IV)[sunting|sunting sumber]

Ada beberapa senyawa Ni(III) yang telah diketahui, contohnya adalah Nikel(III) trihalofosfin (NiIII(PPh3)X3).[36]Ni(III) membentuk garam sederhana denganfluorida[37]atau ion oksida. Ni(III) dapat distabilkan olehliganσ-donor sepertitioldanfosfina.[32]
Ni(IV) terdapat dalam campuran BaNiO3oksida, sedangkan Ni(III) terdapat dalam nikel oksida hidroksida, yang digunakan sebagai sebuahkatodedalam banyakbaterai isi ulang,termasuk jenis baterainikel-kadmium,nikel-besi,nikel hidrogen,dannikel metal hidrida,dan digunakan oleh produsenbaterai Li-iontertentu.[38]Ni(IV) merupakanbilangan oksidasidari nikel yang langka dan sangat sedikit senyawa telah diketahui hingga saat ini.[39][40][41][42]
Sejarah[sunting|sunting sumber]
Karena bijih nikel mudah disalahartikan sebagai bijih perak, pemahaman tentang logam ini dan penggunaannya hanya ada sejakabad pertengahan.Namun, penggunaan nikel yang tidak disengaja telah ditemukan sejak 3500 SM.PerunggudariSuriahmengandung 2% nikel.[43]BeberapamanuskripTiongkok kuno menunjukkan bahwa "tembaga putih" (kupronikel/nikolit), dikenal sebagai baitong) digunakan di Tiongkok antara 1700–1400SM.Tembaga putih Paktong ini diekspor keInggrispada awal abad ke-17, tetapi kandungan nikel dari paduan ini baru ditemukan pada tahun 1822.[44]Koin paduan nikel-tembaga dicetak oleh raja BaktriaAgathocles,Euthydemus IIdanPantaleonpada abad ke-2 SM, mungkin dari kupronikel dari Tiongkok.[45]

Di Jerman, padaabad pertengahan,mineral merah ditemukan diErzgebirge(Pegunungan Ore) yang menyerupai bijih tembaga. Namun, ketika penambang tidak dapat mengekstraksi tembaga apapun, mereka menyalahkanperinakal dari mitologi Jerman, Nikel (mirip denganNick Tua), untuk menimpa tembaga. Mereka menyebut bijih iniKupfernickeldari bahasa JermannyaKupferuntuk tembaga.[46][47][48][49]Bijih ini sekarang dikenal sebagainikelin,yaitu mineralarsenidanikel. Pada 1751, Baron Axel Fredrik Cronstedt mencoba mengekstraksi tembaga dari kupfernickel di sebuah tambangkobaltdi desaLos,Swedia.Dia tidak bisa menghasilkan tembaga, namun sebagai gantinya menghasilkan logam putih yang dia beri nama sesuai denganperiyang memberikan namanya ke mineralnya, nikel.[50]Dalam bahasa Jerman modern, Kupfernickel atau Kupfer-Nickel menunjukkan paduan kupronikel.[4]
Awalnya, nikel hanya berasal dari Kupfernickel yang langka. Mulai tahun 1824, nikel diperoleh sebagai produk sampingan dari produksi pewarnabiru kobalt.Peleburan nikel skala besar dimulai diNorwegiapada tahun 1848 daripirhotityang kaya nikel. Penambahan nikel dalam produksi baja pada tahun 1889 meningkatkan permintaan nikel, dan endapan nikel di Kaledonia Baru, ditemukan pada tahun 1865, menyediakan sebagian besar pasokan nikel dunia antara tahun 1875 dan 1915. Penemuan endapan besar di Basin Sudbury,Kanadapada tahun 1883, diNorilsk-Talnakh,Rusiapada tahun 1920, dan diTerumbu Merensky,Afrika Selatanpada tahun 1924, memungkinkan produksi nikel dalam skala besar.[44]
Penggunaan dalam koin[sunting|sunting sumber]

Selain koin Baktria yang sudah disebutkan di atas, nikel belum digunakan sebagai komponenkoinsampai pertengahan abad ke-19.[butuh rujukan]
Kanada[sunting|sunting sumber]
99,9% koin nikel lima sen digunakan diKanada(produsen nikel terbesar di dunia pada saat itu) selama tahun-tahun non-perang dari 1922 hingga 1981; kandungan logam membuat koin-koin ini bermagnetik.[51]Selama periode perang 1942-1945, sebagian besar atau semua nikel dikeluarkan dari koin Kanada dan AS untuk disimpan untuk pembuatan baju zirah dari besi.[52]Kanada menggunakan 99,9% nikel dari tahun 1968 dengan koin bernilai lebih tinggi hingga tahun 2000.[53]
Swiss[sunting|sunting sumber]
Koin nikel yang hampir murni pertama kali digunakan pada tahun 1881 diSwiss.[54]
Britania Raya[sunting|sunting sumber]
Birminghamtelah membuat koin nikel sekitar tahun 1833 untuk diperdagangkan diMalaysia.[55]
Amerika Serikat[sunting|sunting sumber]
DiAmerika Serikat,istilah "nikel" atau "nikel" awalnya diterapkan padasen tembaga-nikel Flying Eagle,yang menggantikan tembaga dengan 12% nikel pada tahun 1857–1858, kemudiansen Kepala Indiamenggunakan paduan yang sama dari tahun 1859 hingga 1864. Pada tahun 1865,nikel tiga senmulai dibuat, dengan kandungan nikel meningkat menjadi 25%. Pada tahun 1866,nikel perisai lima sen(25% nikel, 75% tembaga) sudah menyesuaikan dengan penunjukannya. Seiring dengan proporsi paduan, istilah ini telah digunakan hingga saat ini di Amerika Serikat.[butuh rujukan]
Penggunaan saat ini[sunting|sunting sumber]
Pada abad ke-21, harga nikel yang tinggi telah menyebabkan beberapa penggantian logam pada koin di seluruh dunia. Koin yang masih dibuat dengan paduan nikel adalah koin satu dan duaeuro,koin 5¢, 10¢, 25¢, dan 50¢Amerika Serikat,dan koin 20p, 50p, £1, dan £2Britania Raya.Paduan nikel dalam koin 5p dan 10p Inggris diganti dengan baja berlapis nikel mulai tahun 2012, yang menyebabkan masalahalergi nikelbagi sebagian orang dan kontroversi publik.[54]
Produksi nikel[sunting|sunting sumber]

3,3 juta ton (t) nikel per tahun diperkirakan diproduksi di seluruh dunia. Negara produsen nikel terbesar pada tahun 2022 meliputiIndonesia(1.600.000 t),Filipina(330.000 t),Rusia(22.000 t),Kaledonia Baru(190.000 t),Australia(160.000 t), danKanada(130.000 t).[57]Deposit nikel terbesar di Eropa (selain Rusia) terletak diFinlandiadanYunani.Sumber daya yang telah diidentifikasi dengan rata-rata 1% nikel atau lebih mengandung setidaknya 130 juta ton nikel. Kira-kira 60% ada di dalam mineral laterit dan 40% berada di dalam endapan sulfida. Selain itu, sumber daya nikel di dalam laut terdapat di kerak mangan yang mencakupi sebagian besar dasar laut, terutama di sebuah daerah diSamudra PasifikbernamaZona Clarion Clippertondalam bentuknodul polimetalikyang tercecer di dasar laut pada kedalaman 3,5–6 km di bawahpermukaan laut.[58][59]Nodul ini terdiri dari berbagailogam tanah jarangdan perkiraan kandungan nikel dari nodul ini adalah 1,7%.[60]Dengan kemajuan dalamsains moderndanteknik,saat ini regulasi sedang ditetapkan olehOtoritas Dasar Laut Internasionaluntuk memastikan bahwa pengumpulan nodul ini tidak merusak lingkungan dan mematuhiTujuan Pembangunan BerkelanjutanolehPerserikatan Bangsa-Bangsa.[61]

Satu-satunya tempat diAmerika Serikatdi mana nikel telah ditambang secara menguntungkan adalahRiddle,Oregon,di mana ada beberapa mil persegi endapan permukaan garnierit yang mengandung nikel. Tambang ditutup pada tahun 1987.[62][63]Proyek pertambangan Eagle adalah sebuah pertambangan nikel baru di semenanjung Michigan. Pembangunan selesai pada tahun 2013, dan telah dioperasikan sejak kuartal ketiga 2014.[64]Pada tahun operasi penuh pertama, pertambangan Eagle telah memproduksi 18.000 t.[64]
Pengolahan nikel[sunting|sunting sumber]

Nikel diperoleh melaluimetalurgi ekstraktif:nikel diekstraksi dari bijih dengan proses pemanggangan dan reduksi konvensional yang menghasilkan logam dengan kemurnian 75%. Untuk banyak penggunaan baja tahan karat, kemurnian 75% dapat digunakan tanpa pemurnian lebih lanjut, tergantung pada pengotornya.[butuh rujukan]

Pada proses tradisional, sebagian besar bijih sulfida diproses menggunakan prosespirometalurgiuntuk menghasilkan matte untuk pemurnian lebih lanjut. Kemajuan terbaru dalam teknikhidrometalurgimenghasilkan logam nikel yang jauh lebih murni. Pada proses tradisional, sebagian besar endapan sulfida diproses dengan konsentrasi melalui prosesflotasi buihyang diikuti dengan ekstraksi pirometalurgi. Dalam proses hidrometalurgi, bijih nikel sulfida dikonsentrasikan dengan flotasi (flotasi diferensial jika rasio Ni/Fe terlalu rendah) dan kemudian dilebur. Nikel mattenya diproses lebih lanjut denganproses Sherritt-Gordon.Pertama, tembaga dihilangkan dengan menambahkanhidrogen sulfida,yang meninggalkan konsentrat kobalt dan nikel. Kemudian, ekstraksi pelarut digunakan untuk memisahkan kobalt dan nikel, dengan kemurnian nikel lebih dari 99%.
Electrorefining[sunting|sunting sumber]
Proses pemurnian umum yang kedua adalah pencucian matte logam ke dalam larutan garam nikel, diikuti dengan perolehan nikel elektrolitik dari larutan dengan melapiskannya kekatodesebagai nikel elektrolitik.
Proses Mond[sunting|sunting sumber]

Logam termurni diperoleh dari nikel oksida melaluiproses Mond,dengan kemurnian lebih dari 99,99%.[65]Prosesnya dipatenkan oleh Ludwig Mond dan telah digunakan dalam industri sejak awal abad ke-20. Dalam proses ini, nikel direaksikan dengankarbon monoksidadengan katalis belerang pada suhu sekitar 40–80 °C untuk membentuknikel karbonil.Besi menghasilkan besi pentakarbonil, tetapi reaksi ini memerlukan waktu yang lama. Jika perlu, nikel dapat dipisahkan dengandistilasi.Dikobalt oktakarboniljuga dibentuk dalam distilasi nikel sebagaiproduk sampingan,tetapi terurai menjaditetrakobalt dodekakarbonilpada suhu reaksi untuk menghasilkan padatan yang tidak mudah menguap.[66]
Nikel diperoleh dari nikel karbonil melalui salah satu dari dua proses. Pada proses pertama, nikel karbonil dilewatkan melalui ruang besar pada suhu tinggi di mana puluhan ribu bola nikel, yang disebut pelet, diaduk secara terus-menerus. Karbonil terurai dan mendepositkan nikel murni ke dalam bola nikel. Pada proses kedua, nikel karbonil diuraikan dalam ruang kecil pada suhu 230 °C untuk menghasilkan bubuk nikel yang halus. Hasil samping karbon monoksida disirkulasi ulang dan digunakan kembali. Produk nikel yang sangat murni dikenal sebagai "karbonil nikel".[67]
Nilai logam[sunting|sunting sumber]
Harga pasar nikel melonjak sepanjang tahun 2006 dan awal bulan 2007; pada 5 April 2007, logam tersebut diperdagangkan dengan harga US$52.300/tonatau $52,3/kg (Rp 475.530/kg).[68]Harga kemudian turun secara dramatis, dan pada September 2017, logam tersebut diperdagangkan pada $11.000/ton, atau $11/kg (Rp 145.750/kg).[69]
Koin nikel ASmengandung 1,1 g nikel, bernilai 6,5 sen (Rp 590) pada April 2007, bersama dengan 3,75 gram tembaga senilai sekitar 3 sen (Rp 270), dengan total nilai logam lebih dari 9 sen (diatas Rp 800). Karena nilai nominal nikel adalah 5 sen (Rp 455), koin nikel menjadi target yang menarik untuk dilebur oleh orang-orang yang ingin menjual logam dengan keuntungan. Namun,United States Mint,untuk mengantisipasi target ini, menerapkan aturan sementara baru pada 14 Desember 2006, untuk komentar publik selama 30 hari, yang mengkriminalisasi pencairan dan ekspor koin sen dan nikel.[70]Pelanggar dikenakan denda hingga $10.000 dan atau penjara maksimal lima tahun.[butuh rujukan]
Pada tanggal 19 September 2013, nilai logam dalam koin nikel AS (termasuk tembaga dan nikel) adalah $0,045 (Rp 513), 90% dari nilai nominal (Rp 570).[71]
Pengolahan melalui pirometalurgi[sunting|sunting sumber]
Berdasarkan tahapan proses, pengolahan nikel dapat dilakukan dalam tiga tahapan proses, yaitu preparasi, pemisahan, dan pewatering. Kegiatan pengolahan ini bertujuan untuk membebaskan dan memisahkan mineral berharga dari mineral yang tidak berharga atau mineral pengotor sehingga setelah dilakukan proses pengolahan dihasilkan konsentrat yang bernilai tinggi dan tailing yang tidak berharga. Metode yang dipakai bermacam-macam tergantung dari sifatkimia,sifatfisika,sifat mekanik darimineralitu sendiri.[5]
Secara umum, mineral bijih di alam ini dibagi dalam 2 (dua) jenis yaitu mineral sulfida dan mineral oksida. Begitu pula dengan bijih nikel, ada sulfida dan ada oksida. Masing-masing mempunyai karakteristik sendiri dan cara pengolahannya pun juga tidak sama. Dalam bahasan kali ini akan dibatasi pengolahan bijih nikel dari mineral oksida (laterit).[5]
Bijih nikel dari mineral oksida (laterit) ada dua jenis yang umumnya ditemui yaitu saprolit danlimonitdengan berbagai variasi kadar. Perbedaan menonjol dari 2 jenis bijih ini adalah kandunganbesidanmagnesium.Bijih saprolit mempunyai kandungan besi rendah dan magnesium tinggi sedangkanlimonitsebaliknya. Bijih saprolit dibagi menjadi 2 berdasarkan kadarnya, yaitu HGSO (High Grade Saprolit Ore) dan LGSO (Low Grade Saprolit Ore), biasanya HGSO mempunyai kadar nikel ≥ 2% sedangkan LGSO mempunyai kadar nikel < 2%. Adapun tahap-tahap yang dilakukan untuk melakukan proses pengolahan nikel melalui beberapa tahap utama yaitu, crushing, pengering, pereduksi, peleburan, pemurni, dan granulasi dan pengemasan.[5]
Kominusi[sunting|sunting sumber]
Kominusi adalah suatu proses untuk mengubah ukuran suatu bahan galian menjadi lebih kecil, hal ini bertujuan untuk memisahkan atau melepaskan bahan galian tersebut dari mineral pengotor yang melekat bersamanya.[5][5]Kominusi bahan galian meliputi kegiatan berikut:
- Crushingyaitu suatu proses yang bertujuan untuk meliberalisasi mineral yang diinginkan agar terpisah dengan mineral pengotor yang lain. Dimana proses ini bertujuan juga untuk reduksi ukuran dari bahan galian/bijih yang langsung dari tambang (ROM = run of mine) dan berukuran besar-besar (diameter sekitar 100 cm) menjadi ukuran 20–25 cm bahkan bisa sampai ukuran 2,5 cm.[5]Alat yang digunakanpada primary crusher dan secondary crusher yaitu antara lain:
- Jaw crusher
- Gyratory crusher
- Cone crusher
- Roll crusher
- Impact crusher
- Rotary breaker
- Hammer mill
- Grindingadalah tahap pengurangan ukuran dalam batas ukuran halus yang diinginkan. Tujuan grinding yaitu mengadakan liberalisasi mineral berharga, mendapatkan ukuran yang memenuhi persyaratan industri, dan mendapatkan ukuran yang memenuhi persyaratan proses.[5]
Sizing[sunting|sunting sumber]
Merupakan proses pemilahan bijih yang telah melalui proses kominusi sesuai ukuran yang dibutuhkan. Kegiatan sizing meliputi screening yaitu pemisahan berdasarkan ukuran.[5]Sizing dibagi menjadi dua, antara lain:
Pengayakan/penyaringan[sunting|sunting sumber]
Pengayakan atau penyaringan (screening/sieving) adalah proses pemisahan secara mekanik berdasarkan perbedaan ukuran partikel. Pengayakan (screening) dipakai dalam skala industri, sedangkan penyaringan (sieving) dipakai untuk skala laboratorium.[5]Produk dari proses pengayakan/penyaringan ada 2 (dua), yaitu antara lain:
- Ukuran lebih besar daripada ukuran lubang-lubang ayakan (oversize).
- Ukuran yang lebih kecil daripada ukuran lubang-lubang ayakan (undersize).
Saringan (sieve) yang sering dipakai di laboratorium yaitu antara lain:
- Hand sieve
- Vibrating sieve series/Tyler vibrating sieve
- Sieve shaker/rotap
- Wet and dry sieving
Sedangkan ayakan (screen) yang berskala industri yaitu antara lain:
- Stationary grizzly
- Roll grizzly
- Sieve bend
- Revolving screen
- Vibrating screen (single deck, double deck, triple deck, etc.)
- Shaking screen
- Rotary shifter
Klasifikasi[sunting|sunting sumber]
Klasifikasi (classification) adalah proses pemisahan partikel berdasarkan kecepatan pengendapannya dalam suatu media (udara atau air). Klasifikasi dilakukan dalam suatu alat yang disebut classifier.[5]Produk dari proses klasifikasi ada 2 (dua), yaitu antara lain:
- Produk yang berukuran kecil/halus (slimes) mengalir di bagian atas disebut overflow.
- Produk yang berukuran lebih besar/kasar (sand) mengendap di bagian bawah (dasar) disebut underflow.
Proses pemisahan dalam classifier dapat terjadi dalam tiga cara (concept), yaitu:
- Partition concept
- Tapping concept
- Rein concept
Pengeringan[sunting|sunting sumber]
Pengeringan (drying) adalah proses untuk membuang seluruh kandung air dari padatan yang berasal dari konsentrat dengan carapenguapan(evaporization/evaporation).[5]Peralatan atau cara yang dipakai ada bermacam-macam, yaitu antara lain:
- Hearth type drying/air dried/air baked, yaitu pengeringan yang dilakukan di atas lantai oleh sinar matahari dan harus sering diaduk (dibolak-balik).
- Shaft drier, ada dua macam, yaitu:
- Tower drier, material (mineral) yang basah dijatuhkan di dalam saluran silindris vertikal yang dialiri udara panas (800 °C–1000 °C).
- Rotary drier, material yang basah dialirkan ke dalam silinder panjang yang diputar pada posisi agak miring dan dialiri udara panas yang berlawanan arah.
Kalsinasi dan reduksi di tanur pereduksi[sunting|sunting sumber]
Tujuannya untuk menghilangkan kandungan air di dalam bijih, mereduksi sebagian nikel oksida menjadi nikel logam, dan sulfidasi. Setelah proses drying selesai, bijih nikel yang tersimpan di gudang bijih kering pada dasarnya belumlah kering secara sempurna, karena itulah tahapan ini bertujuan untuk menghilangkan kandungan air bebas dan air kristal serta mereduksi nikel oksida menjadi nikel logam. Proses ini berlangsung dalam tanur reduksi. Bijih dari gudang dimasukkan dalam tanur reduksi dengan komposisi pencampuran menggunakan ratio tertentu untuk menghasilkan komposisi silika magnesia dan besi yang sesuai dengan operasional tanur listrik. Selain itu dimasukkan pula batubara yang berfungsi sebagai bahan pereduksi pada tanur reduksi maupun pada tanur pelebur. Untuk mengikat nikel dan besi reduksi yang telah tereduksi agar tidak teroksidasi kembali oleh udara maka ditambahkanlah belerang. Hasil akhir dari proses ini disebut kalsin yang bertemperatur sekitar 7000 °C.[5]
Peleburan di tanur listrik[sunting|sunting sumber]
Untuk melebur kalsin hasil kalsinasi/reduksi sehingga terbentuk fasa lelehan matte dan slag. Kalsin panas yang keluar dari tanur reduksi sebagai umpan tanur pelebur dimasukkan kedalam surge bin lalu kemudian dibawa dengan transfer car ke tempat penampungan. Furnace bertujuan untuk melebur kalsin hingga terbentuk fase lelehan matte dan slag. Dinding furnace dilapisi dengan batu tahan api yang didinginkan dengan media air melalui balok tembaga. Matte dan slag akan terpisah berdasarkan berat jenisnya. Slag kemudian diangkut ke lokasi pembuangan dengan kendaraan khusus.[5]
Pengkayaan di tanur pemurni[sunting|sunting sumber]
Bertujuan untuk menaikkan kadar Ni di dalam matte dari sekitar 27% menjadi di atas 75%. Matte yang memiliki berat jenis lebih besar dari slag diangkut ke tanur pemurni / converter untuk menjalani tahap pemurnian dan pengayaan. Proses yang terjadi dalam tanur pemurni adalah peniupan udara dan penambahan silika. Silika ini akan mengikat besi oksida dan membentuk ikatan yang memiliki berat jenis lebih rendah dari matte sehingga menjadi mudah untuk dipisahkan.[5]
Granulasi dan pengemasan[sunting|sunting sumber]
Untuk mengubah bentuk matte dari logam cair menjadi butiran-butiran yang siap diekspor setelah dikeringkan dan dikemas. Matte dituang kedalam tandis sembari secara terus menerus disemprot dengan air bertekanan tinggi. Proses ini menghasilkan nikel matte yang dingin yang berbentuk butiran-butiran halus. Butiran-butiran ini kemudian disaring, dikeringkan dan siap dikemas.[5]
Penggunaan[sunting|sunting sumber]

Saat ini, nikel digunakan sebagai berikut: 68% digunakan untuk baja tahan karat; 10% dalam paduan nonferrous; 9% dalampelapisan listrik;7% dalam baja paduan; 3% di pengecoran; dan 4% digunakan dalam penggunaan lainnya (termasuk baterai).[10]
Banyak produk menggunakan nikel, termasukbaja tahan karat,magnet alnico,koin,baterai isi ulang,senar gitar listrik, kapsul mikrofon, pelapisan pipa,[72]dan paduan khusus seperti permaloi, elinvar, dan invar. Nikel digunakan untuk pelapisan dan sebagai pewarna hijau di kaca. Nikel sebagian besar merupakan logam paduan, dan penggunaan utamanya adalah pada baja nikel dan besi cor nikel, yang biasanya meningkatkan kekuatan tarik, ketangguhan, dan batas elastis. Nikel banyak digunakan di paduan lainnya, termasuk kuningan nikel dan perunggu dan paduan dengantembaga,kromium,aluminium,timbal,kobalt,perak,danemas(Inconel, Incoloy, Monel, Nimonic).[73]

Karena ketahanannya terhadap korosi, nikel kadang digunakan sebagai pengganti perak dalam penggunaan dekoratif. Nikel juga kadang digunakan di beberapa negara setelah tahun 1859 sebagai logam koin murah (lihat di bagianPenggunaan dalam koin), tetapi pada abad ke-20, nikel digantikan dengan paduan baja tahan karat (yaitu besi) yang lebih murah, kecuali di Amerika Serikat dan Kanada.[74]
Nikel adalah agen paduan yang sangat baik untuk logam mulia tertentu dan digunakan dalamuji apisebagai pengumpul elemen dalamgolongan platina.Dengan demikian, nikel mampu mengumpulkan sepenuhnya keenam elemen dalam golongan platina dari bijih, dan mengumpulkan sebagianemas.Tambang nikel besar dapat terlibat dalam pemulihan elemen dalam golongan platina (terutamaplatinadanpaladium); contohnya diNorilskdiRusiadan Basin Sudbury diKanada.
Busa nikel atau jaring nikel digunakan dalam elektroda untuk difusi gas untuksel tunamalkali.[75][76]
Nikel dan paduannya sering digunakan sebagai katalis untukreaksi hidrogenasi.Nikel Raney,paduan nikel-aluminium yang terbagi dengan halus, merupakan salah satu bentuk umum, meskipun katalis terkait juga digunakan, termasuk katalis tipe Raney.
Nikel adalah bahan magnetostriktif alami, artinya, jika adamedan magnet,bahan tersebut mengalami sedikit perubahan panjang.[77][78]Magnetostriksinikel sekitar -50 ppm, yang menunjukkan bahwa nikel berkontraksi.
Nikel digunakan sebagai pengikat dalam industri semenwolframkarbida atau logam keras dan digunakan dalam proporsi 6% sampai 12% berat. Nikel membuatwolfram karbidabermagnet dan menambah ketahanan korosi pada bagian yang disemen, meskipun kekerasannya lebih kecil dibandingkan dengan pengikat kobalt.[79]
63Ni, denganwaktu paruh100,1 tahun, berguna dalam perangkatkrytronsebagai pemancarpartikel beta(elektron berkecepatan tinggi) untuk membuationisasidengan elektroda tetap-hidup lebih andal.[80][81][82]
Sekitar 27% dari semua produksi nikel ditujukan untukteknik,10% untuk bangunan dan konstruksi, 14% untuk produk tubular, 20% untuk barang logam, 14% untuk transportasi, 11% untuk barang elektronik, dan 5% untuk penggunaan lain.[10]
Paduannikel Raneybanyak digunakan untukhidrogenasiminyaktak jenuhuntuk membuatmargarin.Margarin buruk dan minyak sisa mungkin mengandung nikel sebagai kontaminan. Forte dkk. menemukan bahwa pasien diabetes tipe 2 memiliki 0,89[82]ng/ml Ni dalam darah dibandingkan dengan 0,77[82]ng/ml pada subjek kontrol.[83]
Paduan nikel[sunting|sunting sumber]
- Alnico (aluminium,kobalt); digunakan dalammagnet
- Alumel(mangan,aluminium,silikon)
- Brightray (20%kromium,besi,tanah jarang); awalnya untuk dudukan katup keras
- Chromel (kromium)
- Cupronickel (perunggu,tembaga)
- Feronikel (besi)
- Perak Jerman (tembaga,seng)
- Hastelloy (molibdenum,kromium,terkadangtungsten)
- Inconel(chromium,besi)
- Inconel 686 (kromium,molibdenum,tungsten)
- Logam monel (tembaga,besi,mangan)
- Nichrome (kromium)
- Nikel-karbon (karbon)
- Nikrosil (kromium,silikon,magnesium)
- Nimonic (chromium,cobalt,titanium), digunakan padabilahturbinmesin jet
- Nisil (silikon)
- Nitinol (titanium,paduan memori bentuk)
- Paduan "lunak" secara magnetis
- Mu-logam (besi)
- Permalloy (besi,molibdenum)
- Supermalloy (molibdenum)
- Kuningan(tembaga,seng,mangan)
- Nikelhidrida(hidrogen)
- Baja tahan karat(kromium,molibdenum,karbon,mangan,belerang,fosfor,silikon)
- Koin perak(nikel)
Peranan biologis[sunting|sunting sumber]
Walaupun tidak diketahui sampai tahun 1970-an, nikel memiliki peran penting dalam kehidupan beberapa tumbuhan, eubacteria, archaebacteria, danjamur.[84][85][86]Enzim nikel sepertiureasedianggap sebagai faktor virulensi pada beberapa organisme.[87][88]Urease mengkatalisis hidrolisisureauntuk membentukamoniadankarbamat.[84][85]Hidrogenase NiFedapat mengkatalisis oksidasi H2untuk membentukprotondanelektron,dan juga dapat mengkatalisis reaksi balik, yaitu reduksi proton untuk membentuk gas hidrogen.[84][85]Sebuah koenzim nikel-tetrapirrol,kofaktor F430,ada dalam metilkoenzim Mreduktase, yang dapat mengkatalisis pembentukanmetana,atau reaksi sebaliknya, dalamarkeametanogenik(dalam keadaan oksidasi+1).[89]Salah satu enzim dehidrogenasekarbon monoksidaterdiri dari gugus Fe-Ni-S.[90]Enzim pembawa nikel lainnya termasuk kelas bakteri langka enzimsuperoksida dismutase[91]danglioksalase Ipada bakteri dan beberapa parasittrypanosomaleukariotik[92](pada organisme tingkat tinggi, termasukragidanmamalia,enzim ini mengandung Zn2+divalen).[93][94][95][96][97]
Nikel dari makanan dapat mempengaruhi kesehatan manusia melalui infeksi dari bakteri yang bergantung pada nikel, tetapi nikel mungkin merupakan nutrisi penting untuk bakteri yang berada diusus besar,yang berfungsi sebagaiprebiotik.[98]US Institute of Medicine belum mengkonfirmasi bahwa nikel adalah nutrisi penting bagi manusia, oleh karena itu,Asupan Kebutuhan Gizi(AKG) maupun Asupan yang Memadai belum ditetapkan.Batas Atas Asupandari nikel dari makanan adalah 1000µg/hari sebagai garam nikel terlarut. Asupan nikel dari makanan diperkirakan adalah 70 sampai 100 µg/hari, dari itu, kurang dari 10% diserap. Apa yang diserap diekskresikan dalamurine.[99]Jumlah nikel yang relatif besar - sebanding dengan perkiraan konsumsi rata-rata di atas -melindike dalam makanan yang dimasak dalam panci stainless steel. Contohnya, jumlah nikel yang terlindi setelah satu porsi saus tomat dimasak 10 kali rata-rata 88 µg.[100][101]
Nikel yang dilepaskan dari letusan gunung berapi diSiberian Trapsdiduga membantu pertumbuhanMethanosarcinales,yaitu genus arkaea euryarchaeote yang menghasilkan metana selamaperistiwa kepunahan Perm-Trias,peristiwa kepunahan terbesar yang pernah tercatat.[102]
Toksisitas[sunting|sunting sumber]
| Bahaya | |
|---|---|
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H317,H351,H372,H402,H412 | |
| P201,P202,P260,P264,P270,P272,P273,P280,P302+352,P308+313,P333+313,P363,P405,P501[103] | |
Kecuali dinyatakan lain, data di atas berlaku padasuhu dan tekanan standar(25 °C [77 °F], 100 kPa). | |
| Referensi | |
Sumber utama paparan nikel adalah konsumsi oral, karena nikel sangat penting bagi tanaman.[104]Nikel ditemukan secara alami dalam makanan dan air, dan dapat meningkat jumlahnya karenapolusimanusia. Misalnya, keran berlapis nikel dapat mencemari air dan tanah;air limbahindustripertambangandan peleburan dapat mengandung nikel; makanan dimasak dengan peralatan masak paduan baja nikel atau disajikan di piring berpigmen nikel dapat mengandung nikel. Atmosfer mungkin tercemar oleh industri pemurnian bijih nikel dan pembakaranbahan bakar fosil.Manusia dapat menyerap nikel langsung dari asap rokok dan kontak kulit dengan perhiasan,sampo,deterjen, dankoin.Bentuk paparan kronis yang kurang umum adalah melaluihemodialisiskarena jejak ion nikel dapat diserap ke dalam plasma dari aksipengelatanalbumin.[butuh rujukan]
Paparan harian rata-rata tidak menimbulkan ancaman bagi kesehatan manusia. Sebagian besar nikel yang diserap setiap hari oleh manusia dikeluarkan oleh ginjal dan dikeluarkan dari tubuh melaluiurine atau dibuang melaluisaluran pencernaantanpa diserap. Nikel bukanlah racun kumulatif, tetapi dosis yang lebih besar atau paparan inhalasi kronis mungkin berbahaya, bahkankarsinogenik,dan menimbulkanbahaya pekerjaan.[105]
Senyawa nikel diklasifikasikan sebagai karsinogen manusia[106][107][108][109]berdasarkan peningkatan risiko kanker pernapasan yang diamati dalam studi epidemiologi pekerja penyulingan bijih sulfida.[110]Hal ini didukung oleh hasil positif dari bioassay NTP dengan sub-sulfida Ni dan Ni oksida padatikus.[111][112]Data manusia dan hewan menunjukkan tidak adanya karsinogenisitas melalui konsumsi oral dan karsinogenisitas terbatas senyawa nikel yang menyebabkan tumor pernapasan setelah terhirup.[113][114]Logam nikel diduga sebagai karsinogen;[106][107][108]ada konsistensi antara risiko kanker pernapasan normal pada pekerja yang sebagian besar terpapar nikel logam[110]dan tidak adanya tumor pernapasan pada studi karsinogenisitas dengan inhalasi nikel pada tikus dengan bubuk logam nikel.[115]Dalam studi inhalasi hewan pengerat dengan berbagai senyawa nikel dan logam nikel, peningkatan peradangan paru dengan dan tanpa hiperplasia ataufibrosiskelenjar getah beningbronkial diamati.[109][111][115][116]Dalam penelitian dengan tikus, konsumsi oral garam nikel terlarut dalam air dapat menyebabkan kematianperinatalpada hewan hamil.[117]Apakah efek ini relevan dengan manusia masih belum jelas karena studi epidemiologi pada pekerja wanita yang terpapar nikel belum menunjukkan efek toksisitas perkembangan yang merugikan.[118][119][120][121]
Orang dapat terpapar nikel di tempat kerja melalui penghirupan, konsumsi, dan kontak dengan kulit atau mata.Administrasi Keselamatan dan Kesehatan Kerja(OSHA) telah menetapkan batas legal (batas paparan yang diizinkan) dalam tempat kerja sebesar 1 mg/m3per 8 jam kerja, kecuali nikel karbonil.National Institute for Occupational Safety and Health(NIOSH) menetapkan batas paparan yang direkomendasikan (REL) sebesar 0,015 mg/m3 per 8 jam hari kerja. Pada 10 mg/m3, nikelberbahaya bagi kehidupan dan kesehatan.[122]Nikel karbonil[Ni(CO)4] adalah gas yang sangat beracun. Toksisitas karbonil logam berasal dari toksisitas logam dan pembuangan gaskarbon monoksidadari gugus fungsi karbonil; nikel karbonil juga mudah meledak di udara.[123][124]
Orang yangsensitifmungkin menunjukkanalergi kontak kulit terhadap nikelyang dikenal sebagaidermatitiskontak. Orang yang sangat sensitif juga dapat bereaksi terhadap makanan dengan kandungan nikel yang tinggi.[125]Sensitivitas terhadap nikel juga dapat ditemukan pada pasien denganpompholyx.Nikel adalah alergen kontak yang paling banyak dialami orang di seluruh dunia, sebagian alerginya karena penggunaannya dalam perhiasan untuktindik telinga.[126]Alergi nikel yang mempengaruhi telinga yang ditindik sering kali ditandai dengan kulit yang merah dan gatal. Sekarang, banyak anting dibuat tanpa nikel atau nikel rendah lindi[127]untuk mengatasi masalah ini. Jumlah yang diperbolehkan dalam produk yang bersentuhan dengan kulit manusia sekarang diatur dalamUni Eropa.Pada tahun 2002, para peneliti menemukan bahwa nikel yang terlindi oleh koin 1 dan 2 Euro jauh melebihi standar tersebut. Ini diyakini sebagai hasil dari reaksigalvanik.[128]Nickel terpilih sebagai Allergen of the Year pada tahun 2008 oleh American Contact Dermatitis Society.[129]Pada Agustus 2015, American Academy of Dermatology menyatakan tentang keamanan nikel: "Diperkirakan bahwa dermatitis kontak, yang mencakup sensitisasi nikel, menyumbang sekitar $1,918 miliar (sekitar Rp 25,8 triliun) dan mempengaruhi hampir 72,29 juta orang."[125]
Laporan menunjukkan bahwa aktivasi faktor induksi hipoksia (HIF-1) yang diinduksi nikel dan peningkatan regulasi gen yang diinduksi hipoksia disebabkan oleh penipisanaskorbatintraseluler. Penambahan askorbat ke media kultur meningkatkan level askorbat intraseluler dan membalikkan stabilisasi yang diinduksi logam dari ekspresi gen yang bergantung pada HIF-1 dan HIF-1α.[130][131]
Lihat pula[sunting|sunting sumber]
Referensi[sunting|sunting sumber]
- ^(Indonesia)"Nikel".KBBI Daring.Diakses tanggal17 Juli2022.
- ^Pfirrmann, Stefan; Limberg, Christian; Herwig, Christian; Stößer, Reinhard; Ziemer, Burkhard (2009). "A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps".Angewandte Chemie International Edition.48(18): 3357–61.doi:10.1002/anie.200805862.PMID19322853.
- ^Carnes, Matthew; Buccella, Daniela; Chen, Judy Y.-C.; Ramirez, Arthur P.; Turro, Nicholas J.; Nuckolls, Colin; Steigerwald, Michael (2009). "A Stable Tetraalkyl Complex of Nickel(IV)".Angewandte Chemie International Edition.48(2): 290–4.doi:10.1002/anie.200804435.PMID19021174.
- ^abcHammond, C.R.; Lide, C. R. (2018). "The elements". Dalam Rumble, John R.CRC Handbook of Chemistry and Physics(edisi ke-99th). Boca Raton, FL:CRC Press.hlm. 4.22.ISBN9781138561632.
- ^abcdefghijklmnopqrstu"INVENTARISASI SUMBERDAYA ALAM KABUPATEN KONAWE UTARA, PROVINSI SULAWESI TENGGARA".ResearchGate.Diakses tanggal2020-09-01.
- ^Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C., ed. (1990)."Nickel"(PDF).Handbook of Mineralogy.Vol. I. Chantilly, VA, US: Mineralogical Society of America.ISBN978-0962209703.
- ^"Nickel: Nickel mineral information and data".Mindat.org.Diarsipkan dariversi aslitanggal March 3, 2016.Diakses tanggal2016-03-02.
- ^Stixrude, Lars; Waserman, Evgeny; Cohen, Ronald (November 1997). "Composition and temperature of Earth's inner core".Journal of Geophysical Research.102(B11): 24729–24740.Bibcode:1997JGR...10224729S.doi:10.1029/97JB02125.
- ^Coey, J. M. D.; Skumryev, V.; Gallagher, K. (1999). "Rare-earth metals: Is gadolinium really ferromagnetic?".Nature.401(6748): 35–36.Bibcode:1999Natur.401...35C.doi:10.1038/43363.
- ^abc"Nickel Use In Society".Nickel Institute.Diarsipkan dariversi aslitanggal September 21, 2017.
- ^"Nickel Compounds – The Inside Story".Nickel Institute.Diarsipkan dariversi aslitanggal 2018-08-31.
- ^Shiozawa, Hidetsugu; Briones-Leon, Antonio; Domanov, Oleg; Zechner, Georg; et al. (2015)."Nickel clusters embedded in carbon nanotubes as high performance magnets".Scientific Reports.5:15033.Bibcode:2015NatSR...515033S.doi:10.1038/srep15033.PMC4602218
 .PMID26459370.
.PMID26459370.
- ^Kittel, Charles (1996).Introduction to Solid State Physics.Wiley. hlm. 449.ISBN978-0-471-14286-7.
- ^Sharma, A.; Hickman, J.; Gazit, N.; Rabkin, E.; Mishin, Y. (2018)."Nickel nanoparticles set a new record of strength".Nature Communications.9(1): 4102.Bibcode:2018NatCo...9.4102S.doi:10.1038/s41467-018-06575-6.PMC6173750
 .PMID30291239.
.PMID30291239.
- ^abScerri, Eric R.(2007).The periodic table: its story and its significance
 .Oxford University Press. hlm.239–240.ISBN978-0-19-530573-9.
.Oxford University Press. hlm.239–240.ISBN978-0-19-530573-9.
- ^Miessler, G.L. and Tarr, D.A. (1999)Inorganic Chemistry2nd ed., Prentice–Hall. p. 38.ISBN0138418918.
- ^Petrucci, R.H. et al. (2002)General Chemistry8th ed., Prentice–Hall. p. 950.ISBN0130143294.
- ^abNIST Atomic Spectrum DatabaseDiarsipkanMarch 20, 2011, diWayback Machine.To read the nickel atom levels, type "Ni I" in the Spectrum box and click on Retrieve data.
- ^Shurtleff, Richard; Derringh, Edward (1989)."The Most Tightly Bound Nuclei".American Journal of Physics.57(6): 552.Bibcode:1989AmJPh..57..552S.doi:10.1119/1.15970.Diarsipkan dariversi aslitanggal May 14, 2011.Diakses tanggalNovember 19,2008.
- ^abFewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy".American Journal of Physics.63(7): 653.Bibcode:1995AmJPh..63..653F.doi:10.1119/1.17828.
- ^abAudi, Georges; Bersillon, Olivier; Blachot, Jean;Wapstra, Aaldert Hendrik(2003),"The NUBASE evaluation of nuclear and decay properties",Nuclear Physics A,729:3–128,Bibcode:2003NuPhA.729....3A,doi:10.1016/j.nuclphysa.2003.11.001
- ^Pagel, Bernard Ephraim Julius (1997)."Further burning stages: evolution of massive stars"
 .Nucleosynthesis and chemical evolution of galaxies.hlm.154–160.ISBN978-0-521-55958-4.
.Nucleosynthesis and chemical evolution of galaxies.hlm.154–160.ISBN978-0-521-55958-4.
- ^Castelvecchi, Davide (April 22, 2005)."Atom Smashers Shed Light on Supernovae, Big Bang".Diarsipkan dariversi aslitanggal July 23, 2012.Diakses tanggalNovember 19,2008.
- ^W, P. (October 23, 1999)."Twice-magic metal makes its debut – isotope of nickel".Science News.Diarsipkan dariversi aslitanggal May 24, 2012.Diakses tanggalSeptember 29,2006.
- ^National Pollutant Inventory – Nickel and compounds Fact SheetDiarsipkanDecember 8, 2011, diWayback Machine.. Npi.gov.au. Retrieved on January 9, 2012.
- ^Calvo, Miguel (2019).Construyendo la Tabla Periódica.Zaragoza, Spain: Prames. hlm. 118.ISBN978-84-8321-908-9.
- ^"Nickel reserves worldwide by country 2020".Statista(dalam bahasa Inggris).Diakses tanggal29 Maret2021.
- ^Kuck, Peter H."Mineral Commodity Summaries 2019: Nickel"(PDF).United States Geological Survey. Diarsipkan dariversi asli(PDF)tanggal April 21, 2019.Diakses tanggalMarch 18,2019.
- ^Rasmussen, K. L.; Malvin, D. J.; Wasson, J. T. (1988). "Trace element partitioning between taenite and kamacite – Relationship to the cooling rates of iron meteorites".Meteoritics.23(2): a107–112.Bibcode:1988Metic..23..107R.doi:10.1111/j.1945-5100.1988.tb00905.x.
- ^abGreenwood, Norman N.; Earnshaw, A. (1997),Chemistry of the Elements(edisi ke-2), Oxford: Butterworth-Heinemann,ISBN0-7506-3365-4
- ^"The Extraction of Nickel from its Ores by the Mond Process".Nature.59(1516): 63–64. 1898.Bibcode:1898Natur..59...63..doi:10.1038/059063a0
 .
.
- ^abcHousecroft, C. E.; Sharpe, A. G. (2008).Inorganic Chemistry(edisi ke-3rd). Prentice Hall. hlm. 729.ISBN978-0131755536.
- ^Housecroft, C. E.; Sharpe, A. G. (2012).Inorganic Chemistry(edisi ke-4th). Prentice Hall.ISBN978-0273742753.
- ^Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David and Beyersmann, Detmar (2005) "Nickel Compounds" inUllmann's Encyclopedia of Industrial Chemistry.Wiley-VCH, Weinheim.doi:10.1002/14356007.a17_235.pub2
- ^courseherohttps:// coursehero /file/50214125/97174482-COBALT-IIdocx/.Diakses tanggal2024-01-19.Tidak memiliki atau tanpa
|title=(bantuan) - ^Jensen, K. A. (1936). "Zur Stereochemie des koordinativ vierwertigen Nickels".Zeitschrift für Anorganische und Allgemeine Chemie.229(3): 265–281.doi:10.1002/zaac.19362290304.
- ^Court, T. L.; Dove, M. F. A. (1973). "Fluorine compounds of nickel(III)".Journal of the Chemical Society, Dalton Transactions(19): 1995.doi:10.1039/DT9730001995.
- ^"Imara Corporation Launches; New Li-ion Battery Technology for High-Power Applications".Green Car Congress. December 18, 2008. Diarsipkan dariversi aslitanggal December 22, 2008.Diakses tanggalJanuary 22,2009.
- ^Spokoyny, Alexander M.; Li, Tina C.; Farha, Omar K.; Machan, Charles M.; She, Chun xing; Stern, Charlotte L.; Marks, Tobin J.; Hupp, Joseph T.; Mirkin, Chad A. (28 June 2010). "Electronic Tuning of Nickel-Based Bis(dicarbollide) Redox Shuttles in Dye-Sensitized Solar Cells".Angew. Chem. Int. Ed.49(31): 5339–5343.doi:10.1002/anie.201002181.PMID20586090.
- ^Hawthorne, M. Frederick (1967). "(3)-1,2-Dicarbollyl Complexes of Nickel(III) and Nickel(IV)".Journal of the American Chemical Society.89(2): 470–471.doi:10.1021/ja00978a065.
- ^Camasso, N. M.; Sanford, M. S. (2015). "Design, synthesis, and carbon-heteroatom coupling reactions of organometallic nickel(IV) complexes".Science.347(6227): 1218–20.Bibcode:2015Sci...347.1218C.CiteSeerX10.1.1.897.9273
 .doi:10.1126/science.aaa4526.PMID25766226.
.doi:10.1126/science.aaa4526.PMID25766226.
- ^Baucom, E. I.; Drago, R. S. (1971). "Nickel(II) and nickel(IV) complexes of 2,6-diacetylpyridine dioxime".Journal of the American Chemical Society.93(24): 6469–6475.doi:10.1021/ja00753a022.
- ^Rosenberg, Samuel J. (1968).Nickel and Its Alloys.National Bureau of Standards.[pranala nonaktif permanen]
- ^abMcNeil, Ian (1990)."The Emergence of Nickel".An Encyclopaedia of the History of Technology.Taylor & Francis. hlm.96–100.ISBN978-0-415-01306-2.
- ^Needham, Joseph;Wang, Ling; Lu, Gwei-Djen; Tsien, Tsuen-hsuin; Kuhn, Dieter and Golas, Peter J. (1974)Science and civilisation in ChinaDiarsipkanMay 3, 2016, diWayback Machine.. Cambridge University Press.ISBN0-521-08571-3,pp. 237–250.
- ^Chambers Twentieth Century Dictionary,p888, W&R Chambers Ltd., 1977.
- ^Baldwin, W. H. (1931). "The story of Nickel. I. How" Old Nick's "gnomes were outwitted".Journal of Chemical Education.8(9): 1749.Bibcode:1931JChEd...8.1749B.doi:10.1021/ed008p1749.
- ^Baldwin, W. H. (1931)."The story of Nickel. II. Nickel comes of age".Journal of Chemical Education.8(10): 1954.Bibcode:1931JChEd...8.1954B.doi:10.1021/ed008p1954.
- ^Baldwin, W. H. (1931)."The story of Nickel. III. Ore, matte, and metal".Journal of Chemical Education.8(12): 2325.Bibcode:1931JChEd...8.2325B.doi:10.1021/ed008p2325.
- ^Weeks, Mary Elvira(1932). "The discovery of the elements: III. Some eighteenth-century metals".Journal of Chemical Education.9(1): 22.Bibcode:1932JChEd...9...22W.doi:10.1021/ed009p22.
- ^"Industrious, enduring–the 5-cent coin".Royal Canadian Mint. 2008. Diarsipkan dariversi aslitanggal January 26, 2009.Diakses tanggalJanuary 10,2009.
- ^Molloy, Bill (November 8, 2001)."Trends of Nickel in Coins – Past, Present and Future".The Nickel Institute. Diarsipkan dariversi aslitanggal September 29, 2006.Diakses tanggalNovember 19,2008.
- ^kgi-admin (2023-03-24)."Nickel production in Canada and major projects".Mining Technology(dalam bahasa Inggris).Diakses tanggal2024-01-15.
- ^abLacey, Anna (June 22, 2013)."A bad penny? New coins and nickel allergy".BBC Health Check.Diarsipkan dariversi aslitanggal August 7, 2013.Diakses tanggalJuly 25,2013.
- ^"nikkelen dubbele wapenstuiver Utrecht".nederlandsemunten.nl.Diarsipkan dariversi aslitanggal January 7, 2015.Diakses tanggalJanuary 7,2015.
- ^Kelly, T. D.; Matos, G. R."Nickel Statistics"(PDF).U.S. Geological Survey. Diarsipkan dariversi asli(PDF)tanggal August 12, 2014.Diakses tanggal2014-08-11.
- ^"Mineral Commodity Summaries 2023 - Nickel"[Rangkuman Komoditas Mineral 2023 - Nikel](PDF).US Geological Survey.Diakses tanggal2 Maret2023.
- ^"Nickel"(PDF).U.S. Geological Survey, Mineral Commodity Summaries.Januari 2013. Diarsipkan dariversi asli(PDF)tanggal 9 Mei 2013.Diakses tanggal20 September2013.
- ^Gazley, Michael F.; Tay, Stephie; Aldrich, Sean."Polymetallic Nodules".Research Gate.New Zealand Minerals Forum.Diakses tanggal27 Januari2021.
- ^Mero, J. L. (1 Januari 1977). "Chapter 11 Economic Aspects of Nodule Mining".Elsevier Oceanography Series.15:327–355.doi:10.1016/S0422-9894(08)71025-0.ISBN9780444415240.
- ^International Seabed Authority."Strategic Plan 2019-2023"(PDF).isa.org.International Seabed Authority. Diarsipkan dariversi asli(PDF)tanggal 2022-04-12.Diakses tanggal27 Januari2021.
- ^"The Nickel Mountain Project"(PDF).Ore Bin.15(10): 59–66. 1953. Diarsipkan dariversi asli(PDF)tanggal February 12, 2012.Diakses tanggalMay 7,2015.
- ^"Environment Writer: Nickel".National Safety Council. 2006. Diarsipkan dariversi aslitanggal 2006-08-28.Diakses tanggalJanuary 10,2009.
- ^ab"Operations & Development".Lundin Mining Corporation. Diarsipkan dariversi aslitanggal November 18, 2015.Diakses tanggalAugust 10,2014.
- ^Mond, L.; Langer, K.; Quincke, F. (1890)."Action of carbon monoxide on nickel".Journal of the Chemical Society.57:749–753.doi:10.1039/CT8905700749.
- ^Kerfoot, Derek G. E. (2005), "Nickel",Ullmann's Encyclopedia of Industrial Chemistry,Weinheim: Wiley-VCH,doi:10.1002/14356007.a17_157
- ^Neikov, Oleg D.; Naboychenko, Stanislav; Gopienko, Victor G & Frishberg, Irina V (January 15, 2009).Handbook of Non-Ferrous Metal Powders: Technologies and Applications.Elsevier. hlm. 371–.ISBN978-1-85617-422-0.Diarsipkan dariversi aslitanggal May 29, 2013.Diakses tanggalJanuary 9,2012.
- ^"LME nickel price graphs".London Metal Exchange. Diarsipkan dariversi aslitanggal February 28, 2009.Diakses tanggalJune 6,2009.
- ^"London Metal Exchange".LME. Diarsipkan dariversi aslitanggal September 20, 2017.
- ^United States Mint Moves to Limit Exportation & Melting of CoinsDiarsipkanMay 27, 2016, diWayback Machine., The United States Mint, press release, December 14, 2006
- ^"United States Circulating Coinage Intrinsic Value Table".Coininflation. Diarsipkan dariversi aslitanggal June 17, 2016.Diakses tanggalSeptember 13,2013.
- ^American Plumbing Practice: From the Engineering Record (Prior to 1887 the Sanitary Engineer.) A Selected Reprint of Articles Describing Notable Plumbing Installations in the United States, and Questions and Answers on Problems Arising in Plumbing and House Draining. With Five Hundred and Thirty-six Illustrations.Engineering record. 1896. hlm.119.Diakses tanggalMay 28,2016.
- ^Davis, Joseph R. (2000)."Uses of Nickel".ASM Specialty Handbook: Nickel, Cobalt, and Their Alloys.ASM International. hlm. 7–13.ISBN978-0-87170-685-0.
- ^Kloprogge, J. Theo; Ponce, Concepcion P; Loomis, Tom (2020).The Periodic Table: Nature's Building Blocks: An Introduction to the Naturally Occurring Elements, Their Origins and Their Uses.Amsterdam: Elsevier. hlm. 383.ISBN9780128215388.
- ^Kharton, Vladislav V. (2011).Solid State Electrochemistry II: Electrodes, Interfaces and Ceramic Membranes.Wiley-VCH. hlm. 166–.ISBN978-3-527-32638-9.Diarsipkan dariversi aslitanggal September 10, 2015.Diakses tanggalJune 27,2015.
- ^Bidault, F.; Brett, D. J. L.; Middleton, P. H.; Brandon, N. P."A New Cathode Design for Alkaline Fuel Cells (AFCs)"(PDF).Imperial College London. Diarsipkan dariversi asli(PDF)tanggal 2011-07-20.
- ^Magnetostrictive Materials Overview.University of California, Los Angeles.
- ^Angara, Raghavendra (2009).High Frequency High Amplitude Magnetic Field Driving System for Magnetostrictive Actuators.Umi Dissertation Publishing. hlm. 5.ISBN9781109187533.
- ^Cheburaeva, R. F.; Chaporova, I. N.; Krasina, T. I. (1992). "Structure and properties of tungsten carbide hard alloys with an alloyed nickel binder".Soviet Powder Metallurgy and Metal Ceramics.31(5): 423–425.doi:10.1007/BF00796252.
- ^"Krytron Pulse Power Switching Tubes".Silicon Investigations. 2011. Diarsipkan dariversi aslitanggal 2011-07-16.
- ^Bormashov, V. S.; et al. (April 2018). "High power density nuclear battery prototype based on diamond Schottky diodes".Diamond and Related Materials.84:41–47.doi:10.1016/j.diamond.2018.03.006.
- ^abcUhm, Y. R.; et al. (June 2016). "Study of a Betavoltaic Battery Using Electroplated Nickel-63 on Nickel Foil as a Power Source".Nuclear Engineering and Technology.48(3): 773–777.doi:10.1016/j.net.2016.01.010.
- ^Khan, Abdul Rehman; Awan, Fazli Rabbi (January 8, 2014)."Metals in the pathogenesis of type 2 diabetes".Journal of Diabetes and Metabolic Disorders.13(1): 16.doi:10.1186/2251-6581-13-16.PMC3916582
 .PMID24401367.
.PMID24401367.
- ^abcSydor, Andrew; Zamble, Deborah (2013). Banci, Lucia, ed.Nickel Metallomics: General Themes Guiding Nickel Homeostasis.Dordrecht: Springer. hlm. 375–416.ISBN978-94-007-5561-1.
- ^abcAstrid Sigel; Helmut Sigel; Roland K. O. Sigel, ed. (2008).Nickel and Its Surprising Impact in Nature.Metal Ions in Life Sciences.2.Wiley.ISBN978-0-470-01671-8.
- ^Zamble, Deborah;Rowińska-Żyrek, Magdalena; Kozlowski, Henryk (2017).The Biological Chemistry of Nickel.Royal Society of Chemistry.ISBN978-1-78262-498-1.
- ^Covacci, Antonello; Telford, John L.; Giudice, Giuseppe Del; Parsonnet, Julie; Rappuoli, Rino (1999-05-21)."Helicobacter pyloriVirulence and Genetic Geography ".Science.284(5418): 1328–1333.Bibcode:1999Sci...284.1328C.doi:10.1126/science.284.5418.1328.PMID10334982.
- ^Cox, Gary M.; Mukherjee, Jean; Cole, Garry T.; Casadevall, Arturo; Perfect, John R. (2000-02-01)."Urease as a Virulence Factor in Experimental Cryptococcosis".Infection and Immunity.68(2): 443–448.doi:10.1128/IAI.68.2.443-448.2000.PMC97161
 .PMID10639402.
.PMID10639402.
- ^Stephen W., Ragdale (2014). "Chapter 6.Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane".Dalam Peter M.H. Kroneck; Martha E. Sosa Torres.The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment.Metal Ions in Life Sciences.14.Springer. hlm. 125–145.doi:10.1007/978-94-017-9269-1_6.ISBN978-94-017-9268-4.PMID25416393.
- ^Wang, Vincent C.-C.; Ragsdale, Stephen W.; Armstrong, Fraser A. (2014). "Chapter 4. Investigations of the Efficient Electrocatalytic Interconversions of Carbon Dioxide and Carbon Monoxide by Nickel-Containing Carbon Monoxide Dehydrogenases". Dalam Peter M.H. Kroneck; Martha E. Sosa Torres.The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment.Metal Ions in Life Sciences.14.Springer. hlm. 71–97.doi:10.1007/978-94-017-9269-1_4.ISBN978-94-017-9268-4.PMC4261625
 .PMID25416391.
.PMID25416391.
- ^Szilagyi, R. K.; Bryngelson, P. A.; Maroney, M. J.; Hedman, B.; et al. (2004). "S K-Edge X-ray Absorption Spectroscopic Investigation of the Ni-Containing Superoxide Dismutase Active Site: New Structural Insight into the Mechanism".Journal of the American Chemical Society.126(10): 3018–3019.doi:10.1021/ja039106v.PMID15012109.
- ^Greig N; Wyllie S; Vickers TJ; Fairlamb AH (2006)."Trypanothione-dependent glyoxalase I in Trypanosoma cruzi".Biochemical Journal.400(2): 217–23.doi:10.1042/BJ20060882.PMC1652828
 .PMID16958620.
.PMID16958620.
- ^Aronsson A-C; Marmstål E; Mannervik B (1978). "Glyoxalase I, a zinc metalloenzyme of mammals and yeast".Biochemical and Biophysical Research Communications.81(4): 1235–1240.doi:10.1016/0006-291X(78)91268-8.PMID352355.
- ^Ridderström M; Mannervik B (1996)."Optimized heterologous expression of the human zinc enzyme glyoxalase I".Biochemical Journal.314(Pt 2): 463–467.doi:10.1042/bj3140463.PMC1217073
 .PMID8670058.
.PMID8670058.
- ^Saint-Jean AP; Phillips KR; Creighton DJ; Stone MJ (1998). "Active monomeric and dimeric forms of Pseudomonas putida glyoxalase I: evidence for 3D domain swapping".Biochemistry.37(29): 10345–10353.doi:10.1021/bi980868q.PMID9671502.
- ^Thornalley, P. J. (2003). "Glyoxalase I—structure, function and a critical role in the enzymatic defence against glycation".Biochemical Society Transactions.31(Pt 6): 1343–1348.doi:10.1042/BST0311343.PMID14641060.
- ^Vander Jagt DL (1989). "Unknown chapter title". Dalam D Dolphin; R Poulson; O Avramovic.Coenzymes and Cofactors VIII: Glutathione Part A.New York: John Wiley and Sons.
- ^Zambelli, Barbara; Ciurli, Stefano (2013). "Chapter 10. Nickel: and Human Health". Dalam Astrid Sigel; Helmut Sigel; Roland K. O. Sigel.Interrelations between Essential Metal Ions and Human Diseases.Metal Ions in Life Sciences.13.Springer. hlm. 321–357.doi:10.1007/978-94-007-7500-8_10.ISBN978-94-007-7499-5.PMID24470096.
- ^Nickel. IN:Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and CopperDiarsipkanSeptember 22, 2017, diWayback Machine.. National Academy Press. 2001, PP. 521–529.
- ^Kamerud KL; Hobbie KA; Anderson KA (August 28, 2013)."Stainless Steel Leaches Nickel and Chromium into Foods During Cooking".Journal of Agricultural and Food Chemistry.61(39): 9495–501.doi:10.1021/jf402400v.PMC4284091
 .PMID23984718.
.PMID23984718.
- ^Flint GN; Packirisamy S (1997). "Purity of food cooked in stainless steel utensils".Food Additives & Contaminants.14(2): 115–26.doi:10.1080/02652039709374506.PMID9102344.
- ^Schirber, Michael (July 27, 2014)."Microbe's Innovation May Have Started Largest Extinction Event on Earth".Space.Astrobiology Magazine. Diarsipkan dariversi aslitanggal July 29, 2014.Diakses tanggalJuly 29,2014.
.... That spike in nickel allowed methanogens to take off.
- ^"Nickel 203904".Sigma Aldrich. Diarsipkan dariversi aslitanggal January 26, 2020.Diakses tanggalJanuary 26,2020.
- ^Haber, Lynne T; Bates, Hudson K; Allen, Bruce C; Vincent, Melissa J; Oller, Adriana R (2017). "Derivation of an oral toxicity reference value for nickel".Regulatory Toxicology and Pharmacology.87:S1–S18.doi:10.1016/j.yrtph.2017.03.011
 .PMID28300623.
.PMID28300623.
- ^Butticè, Claudio (2015). "Nickel Compounds". Dalam Colditz, Graham A.The SAGE Encyclopedia of Cancer and Society(edisi ke-Second). Thousand Oaks: SAGE Publications, Inc. hlm. 828–831.ISBN9781483345734.
- ^abIARC (2012)."Nickel and nickel compounds"DiarsipkanSeptember 20, 2017, diWayback Machine.inIARC Monogr Eval Carcinog Risks Hum.Volume 100C. pp. 169–218..
- ^abGlobally Harmonised System of Classification and Labelling of Chemicals (GHS)DiarsipkanAugust 29, 2017, diWayback Machine., 5th ed., United Nations, New York and Geneva, 2013..
- ^abRegulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on Classification, Labelling and Packaging of Substances and Mixtures, Amending and Repealing Directives 67/548/EEC and 1999/45/EC and amending Regulation (EC) No 1907/2006 [OJ L 353, 31.12.2008, p. 1].Annex VIDiarsipkanMarch 14, 2019, diWayback Machine.. Accessed July 13, 2017.
- ^abNational Toxicology Program. (2016)."Report on Carcinogens"DiarsipkanSeptember 20, 2017, diWayback Machine., 14th ed. Research Triangle Park, NC: U.S. Department of Health and Human Services, Public Health Service..
- ^ab"Report of the International Committee on Nickel Carcinogenesis in Man".Scandinavian Journal of Work, Environment & Health.16(1 Spec No): 1–82. 1990.doi:10.5271/sjweh.1813
 .JSTOR40965957.PMID2185539.
.JSTOR40965957.PMID2185539.
- ^abNational Toxicology Program (1996). "NTP Toxicology and Carcinogenesis Studies of Nickel Subsulfide (CAS No. 12035-72-2) in F344 Rats and B6C3F1 Mice (Inhalation Studies)".National Toxicology Program Technical Report Series.453:1–365.PMID12594522.
- ^National Toxicology Program (1996). "NTP Toxicology and Carcinogenesis Studies of Nickel Oxide (CAS No. 1313-99-1) in F344 Rats and B6C3F1 Mice (Inhalation Studies)".National Toxicology Program Technical Report Series.451:1–381.PMID12594524.
- ^Cogliano, V. J; Baan, R; Straif, K; Grosse, Y; Lauby-Secretan, B; El Ghissassi, F; Bouvard, V; Benbrahim-Tallaa, L; Guha, N; Freeman, C; Galichet, L; Wild, C. P (2011)."Preventable exposures associated with human cancers".JNCI Journal of the National Cancer Institute.103(24): 1827–39.doi:10.1093/jnci/djr483.PMC3243677
 .PMID22158127.
.PMID22158127.
- ^Heim, K. E; Bates, H. K; Rush, R. E; Oller, A. R (2007). "Oral carcinogenicity study with nickel sulfate hexahydrate in Fischer 344 rats".Toxicology and Applied Pharmacology.224(2): 126–37.doi:10.1016/j.taap.2007.06.024.PMID17692353.
- ^abOller, A. R; Kirkpatrick, D. T; Radovsky, A; Bates, H. K (2008). "Inhalation carcinogenicity study with nickel metal powder in Wistar rats".Toxicology and Applied Pharmacology.233(2): 262–75.doi:10.1016/j.taap.2008.08.017.PMID18822311.
- ^National Toxicology Program (1996). "NTP Toxicology and Carcinogenesis Studies of Nickel Sulfate Hexahydrate (CAS No. 10101-97-0) in F344 Rats and B6C3F1 Mice (Inhalation Studies)".National Toxicology Program Technical Report Series.454:1–380.PMID12587012.
- ^Springborn Laboratories Inc. (2000). "An Oral (Gavage) Two-generation Reproduction Toxicity Study in Sprague-Dawley Rats with Nickel Sulfate Hexahydrate." Final Report. Springborn Laboratories Inc., Spencerville. SLI Study No. 3472.4.
- ^Vaktskjold, A; Talykova, L. V; Chashchin, V. P; Nieboer, E; Thomassen, Y; Odland, J. O (2006). "Genital malformations in newborns of female nickel-refinery workers".Scandinavian Journal of Work, Environment & Health.32(1): 41–50.doi:10.5271/sjweh.975
 .PMID16539171.
.PMID16539171.
- ^Vaktskjold, A; Talykova, L. V; Chashchin, V. P; Odland, Jon Ø; Nieboer, E (2008). "Spontaneous abortions among nickel-exposed female refinery workers".International Journal of Environmental Health Research.18(2): 99–115.doi:10.1080/09603120701498295.PMID18365800.
- ^Vaktskjold, A; Talykova, L. V; Chashchin, V. P; Odland, J. O; Nieboer, E (2007)."Small-for-gestational-age newborns of female refinery workers exposed to nickel".International Journal of Occupational Medicine and Environmental Health.20(4): 327–38.doi:10.2478/v10001-007-0034-0.PMID18165195.
- ^Vaktskjold, A; Talykova, L. V; Chashchin, V. P; Odland, J. O; Nieboer, E (2008). "Maternal nickel exposure and congenital musculoskeletal defects".American Journal of Industrial Medicine.51(11): 825–33.doi:10.1002/ajim.20609.PMID18655106.
- ^"CDC – NIOSH Pocket Guide to Chemical Hazards – Nickel metal and other compounds (as Ni)".cdc.gov.Diarsipkan dariversi aslitanggal July 18, 2017.Diakses tanggal2015-11-20.
- ^Stellman, Jeanne Mager (1998).Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations.International Labour Organization. hlm. 133–.ISBN978-92-2-109816-4.Diarsipkan dariversi aslitanggal May 29, 2013.Diakses tanggalJanuary 9,2012.
- ^Barceloux, Donald G.; Barceloux, Donald (1999). "Nickel".Clinical Toxicology.37(2): 239–258.doi:10.1081/CLT-100102423.PMID10382559.
- ^abPosition Statement on Nickel SensitivityDiarsipkanSeptember 8, 2015, diWayback Machine.. American Academy of Dermatology(August 22, 2015)
- ^Thyssen J. P.; Linneberg A.; Menné T.; Johansen J. D. (2007). "The epidemiology of contact allergy in the general population—prevalence and main findings".Contact Dermatitis.57(5): 287–99.doi:10.1111/j.1600-0536.2007.01220.x.PMID17937743.
- ^Dermal Exposure: Nickel AlloysDiarsipkanFebruary 22, 2016, diWayback Machine.Nickel Producers Environmental Research Association (NiPERA), accessed 2016 Feb.11
- ^Nestle, O.; Speidel, H.; Speidel, M. O. (2002). "High nickel release from 1- and 2-euro coins".Nature.419(6903): 132.Bibcode:2002Natur.419..132N.doi:10.1038/419132a.PMID12226655.
- ^Dow, Lea (June 3, 2008)."Nickel Named 2008 Contact Allergen of the Year".Nickel Allergy Information.Diarsipkan dariversi aslitanggal 2009-02-03.
- ^Salnikow, k.; Donald, S. P.; Bruick, R. K.; Zhitkovich, A.; et al. (September 2004). "Depletion of intracellular ascorbate by the carcinogenic metal nickel and cobalt results in the induction of hypoxic stress".Journal of Biological Chemistry.279(39): 40337–44.doi:10.1074/jbc.M403057200
 .PMID15271983.
.PMID15271983.
- ^Das, K. K.; Das, S. N.; Dhundasi, S. A. (2008)."Nickel, its adverse health effects and oxidative stress"(PDF).Indian Journal of Medical Research.128(4): 117–131.PMID19106437.Diarsipkan dariversi asli(PDF)tanggal 2009-04-10.Diakses tanggalAugust 22,2011.
Pranala luar[sunting|sunting sumber]
- WebElements – Ni
- Article in Nature on nickel emitted by euro coins
- [2]
- European Nickel plc
- [3]
- Tutorial - joining nickel alloys (pdf format)
- http://ardra.biz/sain-teknologi/mineral/pengolahan-mineral/tahap-proses-pengolahan-bijih-nikel-laterite/
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


