Reaksi hidrasi

Reaksi hidrasiadalah suatureaksi kimiadi mana suatu zat dikombinasikan denganair.Dalamkimia organik,air ditambahkan pada substrat tak jenuh, biasanya merupakan suatualkenaataualkuna.Jenis reaksi ini digunakan secara industri untuk menghasilkanetanol,isopropanol,and 2-butanol.[1]
Kimia anorganik
[sunting|sunting sumber]
Hidrasi merupakan proses penting dalam banyak aplikasi; Salah satu contohnya adalah produksisemen Portlandoleh ikatan silangkalsium oksidadansilikatyang diinduksi oleh air. Hidrasi adalah proses dimana zat pengering berfungsi.
Kimia organik
[sunting|sunting sumber]Konversi epoksida menjadi glikol
[sunting|sunting sumber]Beberapa miliar kilogrametilen glikoldiproduksi setiap tahun oleh hidrasietilen oksida:
- C2H4O + H2O → HO–CH2CH2–OH
Katalis asam biasanya digunakan dalam reaksi ini.[2]
Alkena
[sunting|sunting sumber]Untuk hidrasialkena,persamaan reaksikimia yang umum adalah sebagai berikut:
Sebuah gugushidroksil(OH−) menempel pada salah satu karbon padaikatan rangkap dua,dan sebuahproton(H+) menambah pada karbon ikatan rangkap lainnya. Reaksi ini sangat eksotermik. Pada langkah pertama, alkena bertindak sebagai nukleofil dan menyerang proton, mengikutiaturan Markovnikov.Pada langkah kedua sebuah molekul H2O terikat pada karbon yang lain, yang lebih tersubstitusi. Atomoksigenpada titik ini memiliki tiga ikatan dan membawa muatan positif (yaitu, molekulnya adalahoksonium). Molekul air lainnya datang dan mengambil proton tambahan. Reaksi ini cenderung menghasilkan banyak produk samping yang tidak diinginkan, (misalnyadietil eterdalam proses pembuatanetanol) dan dalam bentuk sederhana yang dijelaskan di sini tidak dianggap sangat berguna untuk produksi alkohol.
Dua pendekatan diambil. Secara tradisional alkena diolah denganasam sulfatuntuk menghasilkan alkil sulfatester.Dalam kasus produksi etanol, langkah ini bisa dituliskan:
- H2SO4+ C2H4→ C2H5-O-SO3H
Selanjutnya, ester sulfat ini dihidrolisis untuk meregenerasi asam sulfat dan melepaskan etanol:
- C2H5-O-SO3H + H2O → H2SO4+ C2H5OH
Rute dua langkah ini disebut "proses tidak langsung".

Dalam "proses langsung", asam tersebut memancarkan alkena, dan air bereaksi dengan karboksi yang baru mulai ini untuk menghasilkan alkohol. Proses langsung lebih populer karena lebih sederhana. Katalis asam meliputiasam fosfatdan beberapaasampadat.[1] berikut ini adalah contoh reaksi hidrasi 1-metilsikloheksena menjadi 1-metilsikloheksanol:

Banyak rute alternatif tersedia untuk memproduksi alkohol, termasukreaksi hidroborasi–oksidasi,reaksi oksimerkurasi–reduksi,hidrasi Mukaiyama,reduksi keton dan aldehida serta sebagai metodefermentasibiologis.
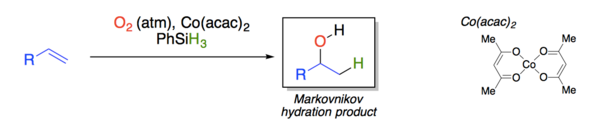
Alkuna
[sunting|sunting sumber]Asetilenaterhidrasi untuk menghasilkanasetaldehida:[3]Prosesnya biasanya bergantung pada katalis raksa dan telah dihentikan di Barat namun masih dipraktekkan di Tiongkok. Pusat Hg2+mengikat padaikatan rangkap tigaC≡C, yang kemudian diserang oleh air. Reaksinya adalah:

Hidrasi substrat lain
[sunting|sunting sumber]Setiap senyawa organik tak jenuh rentan terhadap hidrasi. Nitril mengalami hidrasi untuk menghasilkan amida:
- H2O + RCN → RC(O)NH2
Reaksi ini digunakan dalam produksiakrilamida.
Aldehida dan sampai batas tertentu bahkan keton, hidrat sampaidiolgeminal. Reaksi ini terutama dominan untukformaldehida,yang, dengan adanya air, hadir secara signifikan sebagai dihidroksimetana.
Reaksi konseptual serupa meliputihidroaminasidan hidroalkoksilasi, yang melibatkan penambahan amina dan alkohol ke alkena.
Lihat pula
[sunting|sunting sumber]Referensi
[sunting|sunting sumber]- ^abFalbe, Jürgen; Bahrmann, Helmut; Lipps, Wolfgang; Mayer, Dieter (2005), "Alcohols, Aliphatic",Ullmann's Encyclopedia of Industrial Chemistry,Weinheim: Wiley-VCH,doi:10.1002/14356007.a01_279.
- ^Siegfried Rebsdat; Dieter Mayer (2005), "Ethylene Glycol",Ullmann's Encyclopedia of Industrial Chemistry,Weinheim: Wiley-VCH,doi:10.1002/14356007.a10_101
- ^Marc Eckert, Gerald Fleischmann, Reinhard Jira, Hermann M. Bolt, Klaus Golka "Acetaldehyde" inUllmann's Encyclopedia of Industrial Chemistry,2006, Wiley-VCH, Weinheim.doi:10.1002/14356007.a01_031.pub2.

![{\displaystyle {\ce {RRCH=CH2 ->[{\ce {H2O}}][{\ce {asam}}] RRCH(-OH)-CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5b95887b0953f174eaf6db9954c357c04860d094)

