Katalisis


Katalisisadalah proses peningkatanlajureaksi kimiadengan menambahkan zat yang dikenal sebagaikatalis.[1][2]Katalis tidak akan terkonsumsi dalam reaksi dan tetap tidak berubah setelahnya. Jika reaksi berlangsung cepat dan katalis didaur ulang dengan cepat, jumlah katalis yang sangat kecil seringkali cukup;[3]pencampuran, luas permukaan, dan suhu merupakan faktor penting dalam laju reaksi. Katalis umumnya bereaksi dengan satu atau lebih reaktan untuk membentukzat antarayang selanjutnya menghasilkan produk reaksi akhir, dalam proses regenerasi katalis.
Katalisis dapat diklasifikasikan sebagai katalisishomogen,di mana komponennya terdispersi dalam fase yang sama (biasanya gas atau cair) dengan reaktan, atauheterogen,di mana komponennya tidak berada dalam fase yang sama.Enzimdan biokatalis lainnya sering dianggap sebagai kategori ketiga.
Katalisis terdapat dalam berbagai jenisindustri kimia.[4]Diperkirakan bahwa 90% dari semua produk kimia yang diproduksi secara komersial melibatkan katalis pada tahap tertentu dalam proses pembuatannya.
Kata "katalis" berasal daribahasa Yunaniκαταλύειν,kataluein,yang berarti "melonggarkan" atau "melepaskan". Konsep katalisis ditemukan oleh kimiawanElizabeth Fulhame,berdasarkan karya novelnya dalam eksperimen reduksi−oksidasi.[5][6]
Prinsip umum
[sunting|sunting sumber]Contoh
[sunting|sunting sumber]Salah satu contohnya adalah efek katalis untuk mempercepat dekomposisihidrogen peroksidamenjadi air danoksigen:
- 2 H2O2→ 2 H2O + O2
Reaksi ini dapat berlangsung karena produk reaksi lebih stabil daripada senyawa awal, tetapi penguraian ini sangat lambat sehingga larutan hidrogen peroksida tersedia secara komersial. Dengan adanya katalis sepertimangan dioksida,reaksi ini akan berlangsung jauh lebih cepat. Efek ini mudah dilihat karena adanyabuihoksigen.[7]Katalis itu tidak akan terkonsumsi dalam reaksi tersebut, dan dapat diperoleh kembali dalam keadaan yang sama dan digunakan kembali tanpa batas. Dengan demikian, mangan dioksida dikatakanmengatalisisreaksi ini. Pada organisme hidup, reaksi ini dikatalisis olehenzim(protein yang berfungsi sebagai katalis) sepertikatalase.
Satuan
[sunting|sunting sumber]Satuan turunan SIuntuk mengukuraktivitas katalitisdari suatu katalis adalahkatal,yang diukur dalam mol per detik. Produktivitas suatu katalis dapat dinotasikan denganbilangan perputaran(atau TON) dan aktivitas katalitis denganfrekuensi perputaran(TOF), yang merupakan TON per satuan waktu. Satuan yang setara dalam biokimia adalahsatuan enzim.Untuk informasi lebih lanjut mengenai efisiensi katalisis enzimatis, lihat artikelenzim.
Mekanisme reaksi katalitis
[sunting|sunting sumber]Secara umum, reaksi kimia lebih cepat terjadi dengan adanya katalis karena katalis menyediakanmekanisme reaksi(jalur reaksi) alternatif yang memilikienergi aktivasilebih rendah daripada mekanisme tanpa katalis. Dalam mekanisme yang dikatalisis, katalis biasanya bereaksi dan membentukzat antara,yang kemudian meregenerasi katalis asli dalam proses tersebut.[8][9][10][11]
Sebagai contoh sederhana yang terjadi pada fase gas, reaksi 2 SO2+ O2→ 2 SO3dapat dikatalisis dengan penambahannitrogen monoksida.Reaksi ini terjadi dalam dua langkah:
- 2NO + O2→ 2NO2(menentukan laju)
- NO2+ SO2→ NO + SO3(cepat)
Katalis NO diregenerasi. Laju keseluruhan adalah laju langkah lambat[11]
- v = 2k1[NO]2[O2].
Contohkatalisis heterogenadalah reaksioksigendanhidrogenpada permukaantitanium dioksida(TiO2,atautitania) untuk menghasilkan air.Mikroskop penerowongan payaranmenunjukkan bahwa molekul tersebut mengalamiadsorpsidandisosiasi.Atom O dan H yang terdisosiasi dan terikat pada permukaan berdifusibersama. Keadaan reaksi zat antara adalah: HO2,H2O2,kemudian H3O2dan produk reaksi (dimer molekul air), setelah molekul air terdesorpsidari permukaan katalis.[12][13]
Energetika reaksi
[sunting|sunting sumber]
Katalis akan membuka jalur yang berbeda dari reaksi tanpa katalis. Jalur ini memilikienergi aktivasiyang lebih rendah. Akibatnya, lebih banyak tumbukan molekul memiliki energi yang dibutuhkan untuk mencapai keadaan transisi. Oleh karena itu, katalis dapat mengaktifkan reaksi yang seharusnya diblokir atau diperlambat oleh penghalang kinetik. Katalis dapat meningkatkan laju reaksi atau selektivitas, atau mengaktifkan reaksi pada suhu yang lebih rendah. Efek ini dapat diilustrasikan dengan diagramprofil energi.
Dalamreaksi elementeryang dikatalisis, katalistidakakan mengubah luas suatu reaksi: merekatidakberpengaruh padakesetimbangan kimiadari suatu reaksi. Rasio laju reaksi maju dan mundur tidak akan terpengaruh (lihat pulatermodinamika).Hukum termodinamika keduamenjelaskan mengapa katalis tidak mengubah kesetimbangan kimia suatu reaksi. Anggap bahwa ada sebuah katalis yang menggeser kesetimbangan. Memperkenalkan katalis ke sistem akan menghasilkan sebuah reaksi untuk pindah ke kesetimbangan baru, menghasilkan energi. Produksi energi adalah hasil yang diperlukan karena reaksi hanya bersifat spontan hanya jikaenergi bebas Gibbsdihasilkan, dan jika tidak ada penghalang energi, maka katalis tidak diperlukan. Kemudian, menghilangkan katalis juga akan menghasilkan reaksi, menghasilkan energi; yaitu penambahan dan proses kebalikannya, penghilangan, keduanya akan menghasilkan energi. Jadi, katalis yang dapat mengubah kesetimbangan adalahmesin gerak abadi,yang bertentangan dengan hukum termodinamika.[14]Dengan demikian, katalistidakmengubah konstanta kesetimbangan. (Akan tetapi, katalis dapat mengubah konsentrasi kesetimbangan dengan mereaksikannya pada langkah berikutnya. Katalis tersebut kemudian dikonsumsi selama reaksi berlangsung, sehingga ia juga merupakan reaktan. Ilustrasinya adalahhidrolisisesteryang dikatalisis oleh basa, di manaasam karboksilatyang dihasilkan akan segera bereaksi dengan katalis basa sehingga kesetimbangan reaksi akan bergeser ke arah hidrolisis.)
Katalis akan menstabilkan keadaan transisi lebih dari ia menstabilkan bahan awal. Ia akan mengurangi penghalang kinetik dengan mengurangiperbedaanenergi antara bahan awal dan keadaan transisi. Iatidakmengubah perbedaan energi antara bahan awal dan produk (penghalang termodinamika), atau energi yang tersedia (ini disediakan oleh lingkungan sebagai panas atau cahaya).
Konsep terkait
[sunting|sunting sumber]Beberapa yang disebut katalis sebenarnya adalahprakatalis.Prakatalis akan berubah menjadi katalis dalam reaksi. Misalnya,katalis WilkinsonRhCl(PPh3)3kehilangan satu ligan trifenilfosfina sebelum memasuki siklus katalitis yang sebenarnya. Prakatalis lebih mudah disimpan tetapi mudah diaktifkandi tempat.Karena langkah praaktivasi ini, banyak reaksi katalitis melibatkanperiode induksi.
Dalamkatalisis kooperatif,spesies kimia yang meningkatkan aktivitas katalitis disebutkokatalisataupromoter.
Dalamkatalisis tandem,dua atau lebih katalis yang berbeda digabungkan dalam reaksi satu pot.
Dalamautokatalisis,katalisadalahproduk dari reaksi keseluruhan, berbeda dengan semua jenis katalisis lain yang dibahas dalam artikel ini. Contoh paling sederhana dari autokatalisis adalah reaksi tipe A + B → 2 B, dalam satu atau beberapa langkah. Reaksi keseluruhan hanyalah A → B, sehingga B adalah produk. Tetapi karena B juga merupakan reaktan, ia mungkin ada dalam persamaan laju dan mempengaruhi laju reaksi. Seiring berjalannya reaksi, konsentrasi B meningkat dan dapat mempercepat reaksi sebagai katalis. Akibatnya, reaksi itu mempercepat dirinya sendiri atau dikatalisis secara otomatis. Contohnya adalah hidrolisis sebuahestersepertiaspirinmenjadiasam karboksilatdanalkohol.Dengan tidak adanya katalis asam tambahan, produk asam karboksilat akan mengatalisis hidrolisis.
Katalis sebenarnya dapat bekerja bersama-sama dengankatalis pengorbanan.Katalis sebenarnya akan dikonsumsi dalam reaksi elementer dan diubah menjadi bentuk yang dinonaktifkan. Katalis pengorbanan akan meregenerasi katalis sebenarnya untuk siklus lain. Katalis pengorbanan akan dikonsumsi dalam reaksi, dan dengan demikian, ia sebenarnya bukanlah katalis, melainkan reagen. Misalnya,osmium tetroksida(OsO4) adalah reagen yang baik untuk dihidroksilasi, tetapi sangat beracun dan mahal. Dalamdihidroksilasi Upjohn,katalis pengorbananN-metilmorfolina N-oksida(NMMO) meregenerasi OsO4,dan hanya OsO4dalam jumlah katalitis yang diperlukan.
Klasifikasi
[sunting|sunting sumber]Katalisis dapat diklasifikasikan sebagaihomogen atau heterogen.Katalisis homogenadalah di mana komponen reaksinya terdispersi dalam fase yang sama (biasanya gas atau cair) dengan molekulreaktan.Katalisis heterogenadalah di mana komponen reaksinya tidak berada dalam fase yang sama.Enzimdan biokatalis lainnya sering dianggap sebagai kategori ketiga. Prinsip mekanistis serupa berlaku untuk heterogen, homogen, dan biokatalisis.
Katalisis heterogen
[sunting|sunting sumber]

Katalis heterogen bertindak dalamfaseyang berbeda darireaktan.Sebagian besar katalis heterogen adalahpadatanyang bekerja pada substrat dalamcampuran reaksicairatau gas. Katalis heterogen yang penting meliputizeolit,alumina,[15]oksida orde-tinggi, karbon grafit,oksidalogam transisi,logam sepertinikel Raneyuntuk hidrogenasi, danvanadium(V) oksidauntuk oksidasibelerang dioksidamenjadibelerang trioksidamelaluiproses kontak.[16]
Beragam mekanismereaksi pada permukaantelah diketahui, tergantung pada bagaimana adsorpsi berlangsung (Langmuir–Hinshelwood,Eley–Rideal,dan Mars–van Krevelen).[17]Luas permukaan total padatan memiliki efek penting pada laju reaksi. Semakin kecil ukuran partikel katalis, semakin besar luas permukaan untuk massa partikel tertentu.
Katalis heterogen memilikibagian aktif,yaitu atom atau permukaan kristal tempat reaksi sebenarnya terjadi. Bergantung pada mekanismenya, bagian aktif dapat berupa permukaan logam yang terbuka rata, tepi kristal dengan valensi logam yang tidak sempurna, atau kombinasi rumit dari keduanya. Jadi, tidak hanya sebagian besar volume tetapi juga sebagian besar permukaan katalis heterogen mungkin tidak aktif secara katalitis. Mencari tahu sifat bagian aktif memerlukan penelitian yang menantang secara teknis. Dengan demikian, penelitian empiris untuk menemukan kombinasi logam baru untuk katalisis terus berlanjut.
Misalnya, dalamproses Haber,besiyang dibelah halus berfungsi sebagai katalis untuk sintesisamoniadarinitrogendanhidrogen.Gasyang bereaksi akan teradsorpsike bagian aktif pada partikel besi. Setelah diadsorpsi secara fisik, reagen itu menjalanikemisorpsiyang menghasilkan disosiasi menjadi spesies atom yang teradsorpsi, dan ikatan baru antara fragmen yang dihasilkan terbentuk sebagian karena kedekatannya.[18]Dengan cara ini,ikatan rangkap tigayang sangat kuat dalam nitrogen akan terputus, yang akan sangat jarang terjadi pada fase gas karena energi aktivasinya yang tinggi. Dengan demikian, energi aktivasi dari keseluruhan reaksi diturunkan, dan laju reaksinya meningkat.[19]Tempat lain di mana katalis heterogen digunakan adalah dalam oksidasi belerang dioksida pada vanadium(V) oksida untuk produksiasam sulfat.[16]
Katalis heterogen biasanya "didukung",yang berarti katalis itu akan tersebar pada bahan kedua yang meningkatkan efektivitas atau meminimalkan biayanya. Dukungan akan mencegah atau meminimalkan aglomerasi dan penyinteran partikel katalis kecil, membuka lebih banyak area permukaan, sehingga katalis memiliki aktivitas spesifik (per gram) yang lebih tinggi bila didukung. Kadang-kadang, pendukung itu hanyalah permukaan tempat katalis disebarkan untuk menambah luas permukaan. Lebih sering, pendukung dan katalis berinteraksi, mempengaruhi reaksi katalitis. Pendukung juga dapat digunakan dalam sintesis nanopartikel dengan menyediakan tempat bagi masing-masing molekul katalis untuk berikatan secara kimiawi. Pendukung adalah bahan berpori dengan luas permukaan yang tinggi, dengan yang paling sering adalahalumina,zeolitatau berbagai jeniskarbon aktif.Terdapat pula heberapa pendukung khusus, sepertisilikon dioksida,titanium dioksida,kalsium karbonat,danbarium sulfat.[20]
Dalam reaksi bubur, katalis heterogen dapat hilang dengan pelarutan.
Banyak katalis heterogen sebenarnya adalah nanomaterial.Katalis berbasis nanomaterialdengan aktivitas peniruan enzim secara kolektif disebut sebagainanozim.[21]
Elektrokatalis
[sunting|sunting sumber]Dalam kontekselektrokimia,khususnya dalam rekayasasel bahan bakar,berbagai katalis yang mengandung logam digunakan untuk meningkatkan lajusetengah reaksiyang terdiri dari sel bahan bakar. Salah satu jenis elektrokatalis sel bahan bakar yang umum didasarkan padananopartikelplatinayang didukung pada partikelkarbonyang sedikit lebih besar. Saat bersentuhan dengan salah satuelektrodadalam sel bahan bakar, platina ini akan meningkatkan laju reduksioksigenbaik menjadi air ataupun menjadihidroksidaatauhidrogen peroksida.
Katalisis homogen
[sunting|sunting sumber]Katalis homogen berfungsi dalam fase yang sama dengan reaktan. Katalis homogen biasa dilarutkan dalam pelarut dengan substrat. Salah satu contoh katalisis homogen melibatkan pengaruhH+padaesterifikasiasam karboksilat, seperti pembentukanmetil asetatdariasam asetatdanmetanol.[22]Proses volume tinggi yang membutuhkan katalis homogen meliputihidroformilasi,hidrosililasi,hidrosianasi.Untuk kimiawan anorganik, katalisis homogen sering identik dengankatalis organologam.[23]Banyak dari katalis homogen yang tidak bersifat organologam, diilustrasikan dengan penggunaan garam kobalt yang mengatalisis oksidasip-xilenamenjadiasam tereftalat.
Organokatalisis
[sunting|sunting sumber]Walaupun logam transisi kadang-kadang menarik sebagian besar perhatian dalam studi katalisis, molekul organik kecil tanpa logam juga dapat menunjukkan sifat katalitis, seperti yang terlihat dari fakta bahwa banyakenzimyang kekurangan logam transisi. Biasanya, katalis organik membutuhkan pemuatan yang lebih tinggi (jumlah katalis per satuan jumlah reaktan, dinyatakan dalammol%jumlah zat) daripada katalis berbasis (ion) logam transisi, tetapi katalis ini biasanya tersedia secara komersial dalam jumlah besar, membantu menurunkan biaya. Pada awal tahun 2000-an, organokatalis ini dianggap sebagai "generasi baru" dan dapat bersaing dengan katalis tradisional yang mengandung (ion)logam.Organokatalis seharusnya beroperasi seperti enzim bebas logam yang menggunakan, misalnya, interaksi nonkovalen seperti pengikatan hidrogen.Disiplin organokatalisis dibagi menjadi aplikasi organokatalis kovalen (misalnyaprolina,DMAP) dan nonkovalen (misalnyaorganokatalisis tiourea) yang masing-masing mengacu padapengikatandan interaksi katalis-substratyang disukai. Penghargaan Nobel Kimia 2021 diberikan bersama kepada Benjamin List dan David W.C. MacMillan "untuk pengembangan organokatalisis asimetris."[24]
Fotokatalisis
[sunting|sunting sumber]Fotokatalisis adalah suatu fenomena di mana katalis dapat menerima cahaya untuk menghasilkankeadaan tereksitasiyang mempengaruhi reaksiredoks.[25]Oksigen singletbiasanya diproduksi melalui fotokatalisis. Fotokatalis adalah komponen darisel surya tersensitisasi pewarna.
Enzim dan biokatalis
[sunting|sunting sumber]Dalam biologi,enzimadalah katalis berbasis protein dalammetabolismedankatabolisme.Sebagian besar biokatalis adalah enzim, tetapi kelas biomolekul berbasis nonprotein lainnya juga menunjukkan sifat katalitis sepertiribozim,dandeoksiribozimyang sintetis.[26]
Biokatalis dapat dianggap sebagai perantara antara katalis homogen dan heterogen, meskipun enzim yang larut secara tegas adalah katalis homogen dan enzim yang terikatmembranadalah katalis heterogen. Beberapa faktor yang mempengaruhi aktivitas enzim (dan katalis lainnya) meliputi suhu, pH, serta konsentrasi enzim, substrat, dan produk. Reagen yang sangat penting dalam reaksi enzimatis adalah air, yang merupakan produk dari banyak reaksi pembentukan ikatan dan reaktan dalam banyak proses pemutusan ikatan.
Dalambiokatalisis,enzim digunakan untuk menyiapkan banyak bahan kimia komoditas, sepertisirop jagung fruktosa tinggidanakrilamida.
Beberapaantibodi monoklonalyang target pengikatannya adalah molekul stabil yang menyerupai keadaan transisi reaksi kimia dapat berfungsi sebagai katalis lemah untuk reaksi kimia tersebut dengan menurunkan energi aktivasinya.[27]Antibodi katalitis semacam itu terkadang disebut "abzim".
Pentingnya katalis
[sunting|sunting sumber]
Diperkirakan bahwa 90% dari semua produk kimia yang diproduksi secara komersial melibatkan katalis pada tahap tertentu dalam proses pembuatannya.[29]Pada tahun 2005, proses katalitis menghasilkan produk bernilai sekitar AS$900 miliar di seluruh dunia.[30]Katalisis sangatlah meresap sehingga subarea-subarea tidak mudah diklasifikasikan. Beberapa area konsentrasi tertentu disurvei di bawah ini.
Pemrosesan energi
[sunting|sunting sumber]Pemurnianminyak bumimenggunakan katalisis secara intensif untukalkilasi,perengkahan katalitis(memecah hidrokarbon rantai panjang menjadi potongan yang lebih kecil), reformasinaftadanreformasi uap(konversihidrokarbonmenjadigas sintetis). Bahkan, knalpot dari pembakaran bahan bakar fosil diolah melalui katalisis:Konverter katalitis,biasanya terdiri dariplatinadanrodium,memecah beberapa produk sampingan yang lebih berbahaya dari knalpot mobil.
- 2 CO + 2 NO → 2 CO2+ N2
Berkaitan dengan bahan bakar sintetis, sebuah proses yang telah dikenal lama namun tetap penting adalahsintesis hidrokarbon Fischer–Tropschdari gas sintetis, yang diproses sendiri melaluireaksi pergeseran air–gas,yang dikatalisis oleh besi.Reaksi Sabatierdapat menghasilkanmetanadari karbon dioksida dan hidrogen.Biodieseldanbahan bakar hayatiterkait membutuhkan pemrosesan melalui anorganik dan biokatalis.
Sel bahan bakarmengandalkan katalis untuk reaksi anodik dan katodik.Pemanasan katalitisdapat menghasilkan panas tanpa nyala dari pasokan bahan bakar yang mudah terbakar.
Bahan kimia curah
[sunting|sunting sumber]
Beberapa bahan kimia skala terbesar diproduksi melalui oksidasi katalitis, seringkali menggunakanoksigen.Contohnya meliputiasam nitrat(dariamonia),asam sulfat(daribelerang dioksidamenjadibelerang trioksidamelaluiproses kontak),asam tereftalat(dari p-xilena),asam akrilat(daripropilenaataupropana), danakrilonitril(dari propana dan amonia).[17]
Produksi amonia adalah salah satu proses skala terbesar dan paling padat energi. Dalamproses Haber,nitrogendigabungkan dengan hidrogen melalui katalis besi oksida.[31]Metanoldibuat darikarbon monoksidaatau karbon dioksida tetapi menggunakan katalis tembaga–seng.
Polimer curah yang berasal darietilenadan propilena sering dibuat melaluikatalisis Ziegler–Natta.Poliester, poliamida, danisosianatditurunkan melaluikatalisis asam–basa.
Sebagian besar proseskarbonilasimembutuhkan katalis logam, contohnya ialahproses asam asetat Monsantodanhidroformilasi.
Bahan kimia murni
[sunting|sunting sumber]Banyak daribahan kimia murniyang disiapkan melalui katalisis; beberapa metodenya meliputi proses yang dilakukan pada industri berat serta proses yang lebih khusus yang akan sangat mahal dalam skala besar. Contohnya ialahreaksi Heckdanreaksi Friedel–Crafts.Karena sebagian besar senyawa bioaktif adalahkiral,banyak obat-obatan diproduksi melalui katalisis enansioselektif (sintesis asimetriskatalitis). (R)-1,2-Propandiol, prekursorlevofloksasinantibakteri, dapat disintesis secara efisien dari hidroksiaseton dengan menggunakan katalis berdasarkan kompleksBINAP–rutenium, dalamhidrogenasi asimetris Noyori:[32]

Lingkungan
[sunting|sunting sumber]Katalisis dapat memengaruhi lingkungan dengan meningkatkan efisiensi proses industri, tetapi katalisis juga memainkan peran langsung dalam lingkungan. Salah satu contoh perannya yang penting adalah peran katalitis dariradikal bebasklorindalam pemecahanozon.Radikal-radikal ini dibentuk oleh aksiradiasiultraungupadaklorofluorokarbon(CFC).
- Cl·+ O3→ ClO·+ O2
- ClO·+ O·→ Cl·+ O2
Penggunaan katalis
[sunting|sunting sumber]Pemrosesan makanan
[sunting|sunting sumber]Salah satu aplikasi katalisis yang paling jelas adalahhidrogenasi(reaksi dengan gashidrogen) lemak menggunakan katalisnikeluntuk menghasilkanmargarin.[33]Banyak bahan makanan lainnya disiapkan melalui biokatalisis (lihat di bawah).
Esterifikasi dan interesterifikasi
[sunting|sunting sumber]Reaksiesterifikasimemerlukan katalis asam atau katalis basa untuk mempercepat reaksi antaragliseroldenganasam lemakuntuk menghasilkanmonogliserida,digliserida,dan air. Katalis diberikan pada suhu pemanasan antara 210°Chingga 230 °C. Rasio antara gliserol dan asam lemak dalam reaksi akan menentukan komposisi monogliserida. Sedangkan komposisi digliserida ditentukan oleh reaksi interesterifikasi yang melibatkan gliserol, lemak atau minyak dan katalis basa sepertikalsium hidroksida.Reaksi interesterifikasi hanya membutuhkan gliserol dalam jumlah yang lebih sedikit dibandingkan dengan reaksi interesterifikasi dengan asam lemak.[34]
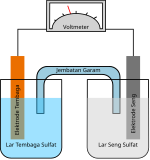
Pembuatan sel bahan bakar
[sunting|sunting sumber]Katalis digunakan untuk mempercepat reaksi pada sistemelektrodayang membentuksel bahan bakar.Setiap sel elektroda merupakansel elektrokimiayang secara berkelanjutan mengubahenergi kimiadalambahan bakardanoksidanmenjadi air dan menghasilkanenergi listrik.Proses pembuatan sel bahan bakar melibatkan sistem elektroda-elektrolityang mengalami reaksielektrokimia.Elektrolit digunakan untuk menghantarkanmuatan listrikdari elektroda negatif (anoda) ke elektroda positif (katoda) sehingga menghasilkanarus listrikdanenergi panas.[35]Katalis yang digunakan di dalam elektroda ialah lapisanplatina.[36]
Reaksi alkilasi Friedel–Crafts
[sunting|sunting sumber]Reaksi alkilasi Friedel–Craftsmenggunakan prinsipsubstitusi elektrofilik aromatik.Reaksi kimia dihasilkan melaluialkilasibenzena denganalkil halidamenggunakan katalisasam Lewisyang kuat. Jenis katalis yang umum digunakan ialahaluminium kloridaataubesi klorida.[37]
Fermentasi
[sunting|sunting sumber]Manusia telah menggunakan enzim sebagai katalisfermentasi makanansejakzaman prasejarah.Enzimkhamirtelah lama digunakan untuk melakukan fermentasigula buahmenjadialkohol.Enzim pada bakteriStreptococcus thermophilus,Lactobacillus bulgaricus,danLactobacillus acidophilusdigunakan untuk membuatyoghurt.Enzim juga digunakan sebagai katalis dalam pembuatanbirdaribiji-bi gian,pembuatanadonanrotidengan khamir dan fermentasiair kelapamenjadicuka.[38]Keunggulan penggunaan enzim sebagai katalis ialah sifatnya yang tidak berubah meski telah mengalami reaksi kimia. Selain itu, enzim melakukan percepatan reaksi kimia dengan tetap mempertahankan kedudukan normal darikesetimbangan kimia.[39]
Sintesis tabung nano karbon
[sunting|sunting sumber]Katalis logam digunakan untuk melakukan sintesis padatabung nano karbonyang dapat terkendali. Tabung nano karbon digunakan untuk membuat peralatan dengan sifat nanoelektronik. Proses nukleasi dan perumbuhan tabung nano karbon memerlukan bantuan katalis logam.[40]
Sejarah
[sunting|sunting sumber]Istilah "katalis", secara luas didefinisikan sebagai segala sesuatu yang meningkatkan laju suatu proses, berasal daribahasa Yunaniκαταλύειν,yang berarti "membatalkan", atau "melepaskan", atau "mengambil". Konsep katalisis ditemukan oleh kimiawanElizabeth Fulhamedan dijelaskan dalam sebuah buku tahun 1794, berdasarkan karya novelnya dalam reaksi reduksi–oksidasi.[5][6][41]Reaksi kimia pertama dalam kimia organik yang secara sadar menggunakan katalis dipelajari pada tahun 1811 olehGottlieb Kirchhoff,yang menemukan konversi pati menjadi glukosa yang dikatalisis oleh asam. Istilahkatalisiskemudian digunakan olehJöns Jakob Berzeliuspada tahun 1835[42]untuk menjelaskan reaksi yang dipercepat oleh zat yang tidak berubah setelah reaksi.Fulhame,yang mendahului Berzelius, bekerja dengan air sebagai kebalikan dari logam dalam eksperimen reduksinya. Kimiawan abad ke-18 lainnya yang bekerja dalam katalisis adalahEilhard Mitscherlich[43]yang menyebutnya sebagai proseskontak,danJohann Wolfgang Döbereiner[44][45]yang berbicara mengenaiaksi kontak.Dia mengembangkanlampu Döbereiner,sebuahpemantikberbahan dasarhidrogendan sponsplatina,yang sukses secara komersial pada tahun 1820-an dan masih hidup hingga saat ini.Humphry Davymenemukan penggunaan platina dalam katalisis.[46]Pada tahun 1880-an,Wilhelm OstwalddiUniversitas Leipzigmemulai penyelidikan sistematis terhadap reaksi yang dikatalisis oleh adanya asam dan basa, dan menemukan bahwa reaksi kimia terjadi pada laju yang terbatas dan laju ini dapat digunakan untuk menentukan kekuatan asam dan basa. Karena pekerjaan ini, Ostwald dianugerahiPenghargaan Nobel Kimiatahun 1909.[47]Vladimir Ipatieffmelakukan beberapa reaksi skala industri paling awal, termasuk penemuan dan komersialisasi oligomerisasi dan pengembangan katalis untuk hidrogenasi.[48]
Inhibitor, toksin, dan promotor
[sunting|sunting sumber]Zat tambahan yang menurunkan laju reaksi disebutinhibitor reaksijika reversibel danracun katalisjika ireversibel.[1]Promotor adalah zat yang meningkatkan aktivitas katalitis, meskipun mereka sendiri bukan katalis.[49]
Inhibitor kadang-kadang disebut sebagai "katalis negatif" karena menurunkan laju reaksi.[50]Namun istilah inhibitor lebih disukai karena mereka tidak bekerja dengan memasukkan jalur reaksi dengan energi aktivasi yang lebih tinggi; ini tidak akan menurunkan laju karena reaksi akan terus terjadi melalui jalur yang tidak dikatalisis. Sebaliknya, mereka bertindak baik dengan menonaktifkan katalis ataupun dengan menghilangkan perantara reaksi seperti radikal bebas.[8][50]Dalam katalisisheterogen,pengokasanakan menghambat katalis, yang ditutupi oleh produk sampinganpolimer.
Inhibitor dapat memodifikasi selektivitas selain laju. Misalnya, dalam hidrogenasialkunamenjadialkena,katalispaladium(Pd) yang sebagian "diracuni" dengantimbal(II) asetat(Pb(CH3CO2)2) dapat digunakan.[51]Tanpa penonaktifan katalis, alkena yang dihasilkan akan terhidrogenasi lebih lanjut menjadialkana.[52][53]
Inhibitor dapat menghasilkan efek ini dengan, misalnya, meracuni secara selektif hanya pada jenis bagian aktif tertentu. Mekanisme lainnya adalah modifikasi geometri permukaan. Misalnya, dalam operasi hidrogenasi, bidang besar permukaan logam berfungsi sebagai tempat katalisishidrogenolisissementara tempat yang mengatalisishidrogenasitak jenuh berukuran lebih kecil. Dengan demikian, racun yang menutupi permukaan secara acak akan cenderung menurunkan jumlah bidang besar yang tidak terkontaminasi tetapi meninggalkan bagian yang lebih kecil secara proporsional, sehingga mengubah selektivitas hidrogenasi vs. hidrogenolisis. Banyak mekanisme lain juga dimungkinkan.
Promotor dapat menutupi permukaan untuk mencegah produksi alas kokas, atau bahkan secara aktif menghilangkan bahan tersebut (misalnya, renium pada platina dalamplatformasi). Mereka dapat membantu dispersi bahan katalitis atau mengikat reagen.
Lihat pula
[sunting|sunting sumber]- Reaksi kimia
- Abzim
- Adjuvan Farmasi
- Autokatalisis
- BIG-NSE(Sekolah Pascasarjana Ilmu Pengetahuan Alam dan Teknik Berlin)
- Catalysis Science & Technology(jurnal kimia)
- Elektrokatalis
- Enzim SUMO
- Fotokatalisis
- Katalis industri
- Katalis transfer fase
- Katalisis asam(meliputi Katalisis basa)
- Katalisis batas fase
- Katalisis enzim
- Konsep murburn
- Mikroskop gaya prob Kelvin
- Pemicu lingkungan
- Reagen pembatas
- Ribozim(biokatalis RNA)
- Reduksi diprogram suhu
- Spektroskopi desorpsi termal
- Teori resonansi katalitis
Referensi
[sunting|sunting sumber]- ^ab"Catalyst".IUPAC Compendium of Chemical Terminology.Oxford: Blackwell Scientific Publications. 2009.doi:10.1351/goldbook.C00876.ISBN978-0-9678550-9-7.
- ^Masel, Richard I (2001).Chemical Kinetics and Catalysis.New York: Wiley-Interscience.ISBN0-471-24197-0.
- ^Lerner, Louise (2011)."7 things you may not know about catalysis".Laboratorium Nasional Argonne.
- ^Carroll, Gregory T.; Kirschman, David L. (23 Januari 2023)."Catalytic Surgical Smoke Filtration Unit Reduces Formaldehyde Levels in a Simulated Operating Room Environment".ACS Chemical Health & Safety(dalam bahasa Inggris).30(1): 21–28.doi:10.1021/acs.chas.2c00071.ISSN1871-5532.
- ^abLaidler, Keith J.; Cornish-Bowden, Athel (1997).""Elizabeth Fulhame and the discovery of catalysis: 100 years before Buchner "(PDF).Dalam Cornish-Bowden, Athel.New beer in an old bottle: Eduard Buchner and the growth of biochemical knowledge.Valencia: Universitat de Valencia. hlm. 123–126.ISBN9788437033280.Diarsipkan dariversi asli(PDF)tanggal 23 Januari 2015.Diakses tanggal17 Juni2023.
- ^abRayner-Canham, Marelene; Rayner-Canham, Geoffrey William (2001).Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century
 .American Chemical Society.ISBN978-0-8412-3522-9.
.American Chemical Society.ISBN978-0-8412-3522-9.
- ^"Genie in a Bottle".Universitas Minnesota.2 Maret 2005. Diarsipkan dariversi aslitanggal 5 April 2008.
- ^abLaidler, K.J. dan Meiser, J.H. (1982)Physical Chemistry,Benjamin/Cummings, hlm. 425.ISBN0-618-12341-5.
- ^Laidler, Keith J.; Meiser, John H. (1982).Physical Chemistry.Benjamin/Cummings. hlm. 424–425.ISBN0-8053-5682-7.
- ^Atkins, Peter; de Paula, Julio (2006).Atkins' Physical Chemistry(edisi ke-8). W.H.Freeman. hlm.839.ISBN0-7167-8759-8.
- ^abSteinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (1999).Chemical Kinetics and Dynamics(edisi ke-2). Prentice Hall. hlm.147–150.ISBN0-13-737123-3.
Konsentrasi katalis [C] muncul dalam ekspresi laju, tetapi tidak dalam rasio kesetimbangan.
- ^Jacoby, Mitch (16 Februari 2009)."Making Water Step by Step".Chemical & Engineering News.hlm. 10.
- ^Matthiesen J, Wendt S, Hansen JØ, Madsen GK, Lira E, Galliker P, Vestergaard EK, Schaub R, Laegsgaard E, Hammer B, Besenbacher F (2009). "Observation of All the Intermediate Steps of a Chemical Reaction on an Oxide Surface by Scanning Tunneling Microscopy".ACS Nano.3(3): 517–26.CiteSeerX10.1.1.711.974
 .doi:10.1021/nn8008245.ISSN1520-605X.PMID19309169.
.doi:10.1021/nn8008245.ISSN1520-605X.PMID19309169.
- ^Robertson, A.J.B. (1970)Catalysis of Gas Reactions by Metals.Logos Press, London.
- ^Shafiq, Iqrash; Shafique, Sumeer; Akhter, Parveen; Yang, Wenshu; Hussain, Murid (23 Juni 2020). "Recent developments in alumina supported hydrodesulfurization catalysts for the production of sulfur-free refinery products: A technical review".Catalysis Reviews.64:1–86.doi:10.1080/01614940.2020.1780824
 .ISSN0161-4940.
.ISSN0161-4940.
- ^abHousecroft, Catherine E.; Sharpe, Alan G. (2005).Inorganic Chemistry(edisi ke-2). Pearson Prentice-Hall. hlm. 805.ISBN0130-39913-2.
- ^abKnözinger, Helmut dan Kochloefl, Karl (2002) "Heterogeneous Catalysis and Solid Catalysts" in Ullmann'sEncyclopedia of Industrial Chemistry,Wiley-VCH, Weinheim.DOI:10.1002/14356007.a05_313
- ^"17.6: Catalysts and Catalysis".Chemistry LibreTexts(dalam bahasa Inggris). 26 Februari 2016.Diakses tanggal17 Juni2023.
- ^"Chemistry of Vanadium".Chemistry LibreTexts(dalam bahasa Inggris). 3 Oktober 2013.Diakses tanggal17 Juni2023.
- ^Chadha, Utkarsh; Selvaraj, Senthil Kumaran; Ashokan, Hridya; Hariharan, Sai P.; Mathew Paul, V.; Venkatarangan, Vishal; Paramasivam, Velmurugan (8 Februari 2022). "Complex Nanomaterials in Catalysis for Chemically Significant Applications: From Synthesis and Hydrocarbon Processing to Renewable Energy Applications".Advances in Materials Science and Engineering(dalam bahasa Inggris).2022:e1552334.doi:10.1155/2022/1552334
 .ISSN1687-8434.
.ISSN1687-8434.
- ^Wei, Hui; Wang, Erkang (21 Juni 2013). "Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes".Chemical Society Reviews(dalam bahasa Inggris).42(14): 6060–93.doi:10.1039/C3CS35486E.ISSN1460-4744.PMID23740388.
- ^Behr, Arno (2002) "Organometallic Compounds and Homogeneous Catalysis" in Ullmann'sEncyclopedia of Industrial Chemistry,Wiley-VCH, Weinheim.DOI:10.1002/14356007.a18_215
- ^Elschenbroich, C. (2006)Organometallics.Wiley-VCH: Weinheim.ISBN978-3-527-29390-2
- ^"The Nobel Prize in Chemistry 2021".NobelPrize.org.
- ^Melchiorre, Paolo (2022). "Introduction: Photochemical Catalytic Processes".Chemical Reviews.122(2): 1483–1484.doi:10.1021/acs.chemrev.1c00993.PMID35078320Periksa nilai
|pmid=(bantuan). - ^Nelson, D.L. and Cox, M.M. (2000)Lehninger, Principles of BiochemistryEd. ke-3. Worth Publishing: New York.ISBN1-57259-153-6.
- ^Catalytic Antibodies Simply Explained.Documentroot (6 Maret 2010). Diakses tanggal 18 Juni 2023.
- ^Solovev, Alexander A.; Sanchez, Samuel; Mei, Yongfeng; Schmidt, Oliver G. (2011)."Tunable catalytic tubular micro-pumps operating at low concentrations of hydrogen peroxide"(PDF).Physical Chemistry Chemical Physics.13(21): 10131–35.Bibcode:2011PCCP...1310131S.doi:10.1039/C1CP20542K.PMID21505711.Diarsipkan dariversi asli(PDF)tanggal 28 Maret 2019.
- ^"Recognizing the Best in Innovation: Breakthrough Catalyst".R&D Magazine,September 2005, hlm. 20.
- ^1.4.3 Industrial Process EfficiencyDiarsipkan17 Mei 2008 diWayback Machine.. climatetechnology.gov
- ^Smil, Vaclav (2004).Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production(edisi ke-1). Cambridge, MA: MIT.ISBN9780262693134.
- ^Dub, Pavel A.; Gordon, John C. (2018). "The role of the metal-bound N–H functionality in Noyori-type molecular catalysts".Nature Reviews Chemistry.2(12): 396–408.doi:10.1038/s41570-018-0049-z.
- ^Clark, Jim (Oktober 2013)."Types of catalysis".Chemguide.
- ^Mamuaja 2017,hlm. 22.
- ^Gustian, Asdim, dan Maryanti 2016,hlm. 1.
- ^Gustian, Asdim, dan Maryanti 2016,hlm. 3.
- ^Gustian, Asdim, dan Maryanti 2016,hlm. 8.
- ^Susanti dan Fibriana 2017,hlm. 3.
- ^Susanti dan Fibriana 2017,hlm. 2.
- ^Setiabudi, A., Hardian, R., dan Muzakir, A., (2012).Karakterisasi Material: Prinsip dan Aplikasinya dalam Penelitian Kimia.Bandung: UPI Press. hlm. 74.ISBN979-978-435-2.
- ^Bård Lindström and Lars J. Petterson (2003) "A brief history of catalysis"Cattech,7(4): 130–38.
- ^Berzelius, J.J. (1835)Årsberättelsen om framsteg i fysik och kemi[Laporan tahunan kemajuan fisika dan kimia]. Stockholm, Sweden: Royal Swedish Academy of Sciences. Setelah mengulas penelitian Eilhard Mitscherlich mengenai pembentukan eter, Berzelius membuat istilahkatalys(katalisis) dihalaman 245:
Asli:Jag skall derföre, för att begagna en i kemien välkänd härledning, kalla den kropparskatalytiska kraft,sönderdelning genom denna kraftkatalys,likasom vi med ordet analys beteckna åtskiljandet af kroppars beståndsdelar medelst den vanliga kemiska frändskapen.
Terjemahan:Oleh karena itu, saya akan menggunakan derivasi terkenal dalam kimia, menyebut badan katalitis yaitu, zatgaya katalitisdan penguraian benda lain olehkatalisisgaya ini, seperti yang kita artikan dengananalisiskata pemisahan konstituen dari tubuh oleh afinitas kimia biasa.
- ^Mitscherlich, E. (1834)."Ueber die Aetherbildung"[Pada pembentukan eter].Annalen der Physik und Chemie.31(18): 273–82.Bibcode:1834AnP...107..273M.doi:10.1002/andp.18341071802.
- ^Döbereiner (1822)."Glühendes Verbrennen des Alkohols durch verschiedene erhitzte Metalle und Metalloxyde"[Pembakaran pijar alkohol oleh berbagai logam dan oksida logam yang dipanaskan].Journal für Chemie und Physik.34:91–92.
- ^Döbereiner (1823)."Neu entdeckte merkwürdige Eigenschaften des Platinsuboxyds, des oxydirten Schwefel-Platins und des metallischen Platinstaubes"[Sifat luar biasa yang baru ditemukan dari platina suboksida, platina sulfida teroksidasi, dan debu platina metalik].Journal für Chemie und Physik.38:321–26.
- ^Davy, Humphry (1817)."Some new experiments and observations on the combustion of gaseous mixtures, with an account of a method of preserving a continued light in mixtures of inflammable gases and air without flame".Philosophical Transactions of the Royal Society of London.107:77–85.doi:10.1098/rstl.1817.0009
 .
.
- ^Roberts, M.W. (2000). "Birth of the catalytic concept (1800–1900)".Catalysis Letters.67(1): 1–4.doi:10.1023/A:1016622806065.
- ^Nicholas, Christopher P. (21 Agustus 2018). "Dehydration, Dienes, High Octane, and High Pressures: Contributions from Vladimir Nikolaevich Ipatieff, a Father of Catalysis".ACS Catalysis.8(9): 8531–39.doi:10.1021/acscatal.8b02310
 .
.
- ^Dhara SS; Umare SS (2018).A Textbook of Engineering Chemistry.India: S. Chand Publishing. hlm. 66.ISBN9789352830688.
- ^abLaidler, K.J. (1978)Physical Chemistry with Biological Applications,Benjamin/Cummings. hlm. 415–17.ISBN0-8053-5680-0.
- ^(2016) "Palladium Catalyst for Partial Reduction of Acetylenes".Org. Synth.;Coll. Vol.5:880.
- ^Jencks, W.P. (1969)Catalysis in Chemistry and EnzymologyMcGraw-Hill, New York.ISBN0-07-032305-4
- ^Bender, Myron L; Komiyama, Makoto dan Bergeron, Raymond J (1984)The Bioorganic Chemistry of Enzymatic CatalysisWiley-Interscience, Hoboken, A.S.ISBN0-471-05991-9
- IUPAC,Compendium of Chemical Terminology,edisi ke-2 ( "Buku Emas" ) (1997). Versi koreksi daring: (2006–) "catalyst".
- Gustian, I., Asdim, dan Maryanti, E. (2016).Pengantar Sintesis dan Karakterisasi Membran Sel Bahan Bakar Berbasiskan Polimer(PDF).Bengkulu: Badan Penerbitan Fakultas Pertanian Universitas Bengkulu.ISBN978-602-9071-19-1.Diarsipkan dariversi asli(PDF)tanggal 27 Januari 2021.Diakses tanggal18 Juni2023.
- Mamuaja, Christine F. (2017).Lipida(PDF).Manado: Unsrat Press.ISBN978-979-3660- 81-3.
- Susanti, R., dan Fibriana, F. (2017).Teknologi Enzim(PDF).Yogyakarta: Penerbit ANDI.ISBN978-979-29-6276-5.Diarsipkan dariversi asli(PDF)tanggal 21 September 2018.Diakses tanggal18 Juni2023.
- Widi, Restu Kartiko (2018).Pemanfaatan Material Anorganik: Pengenalan dan Beberapa Inovasi di Bidang Penelitian(PDF).Yogyakarta: Deepublish.ISBN978-602-475-528-7.
Pranala luar
[sunting|sunting sumber]- (Inggris)Science Aid: KatalisisHalaman untuk sains tingkat SMA
- (Inggris)W.A. Presentasi Herrmann Technische Universität
- (Inggris)Katalis Alumit, Laboratorium Kameyama-Sakurai, Jepang
- (Inggris)Kimia Anorganik dan Gugus Katalisis, Universitas Utrecht, Belanda
- (Inggris)Pusat Kimia Permukaan dan Katalisis
- (Inggris)Gugus Karbon & Katalis, Universitas Concepcion, Chili
- (Inggris)Pusat Pengaktifan Teknologi Baru Melalui Katalisis, Pusat Inovasi Kimia NSF, AS
- (Inggris)"Gelembung menghidupkan katalis kimia",majalah Science News daring, 6 April 2009.