Alcheni
Glialchenisonoidrocarburi(cioècomposti organicicostituiti solamente daatomidicarbonioeidrogeno) aciclici contenenti esattamente undoppio legameC=C.[1]Gli alcheni fanno parte della classe delleolefine,alla quale appartengono anche icicloalchenie ipolieni.[2]
Hannoformula brutaCnH2n.[1]
Il più semplice alchene esistente è l'etilene(o etene), aventeformulaCH2=CH2,dal quale si ottiene ilpolietileneattraversopolimerizzazione per addizione.
| Nome | Formula molecolare | Numero di atomi di carbonio | Massa molare | Numero CAS | Formula di struttura |
|---|---|---|---|---|---|
| Etilene (o etene) |
C2H4 | 2 | 28,054 g/mol | 74-85-1 | 
|
| Propilene (o propene) |
C3H6 | 3 | 42,08 g/mol | 115-07-1 | 
|
| 1-Butilene (o 1-butene) |
C4H8 | 4 | 56,11 g/mol | 106-98-9 | 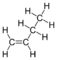
|
| 1-Pentene | C5H10 | 5 | 70,13 g/mol | 109-67-1 | 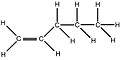
|
Come nel caso deglialcani,gli atomi di carbonio sono uniti tra loro attraversolegami covalentia formare unacatenaaperta, lineare o ramificata; una coppia di atomi di carbonio adiacenti è però unita da un legame covalente doppio.
I due atomi di carbonio coinvolti nel doppio legame presentanoorbitaliibrididi tiposp2;questo fa sì che i tre atomi legati ad ognuno di essi si trovino ai tre vertici di un triangolo grosso modo equilatero. I due triangoli sono inoltre allineati lungo l'asse del legame e tra loro complanari.
Un legame C-C è di tipoσ,formato dalla sovrapposizione di due orbitali ibridisp2lungo l'asse del legame; il secondo legame è di tipoπ,formato dalla sovrapposizione in direzione perpendicolare all'asse del legame dei due orbitalipnon coinvolti nell'ibridazione.
A differenza di quanto accade neglialcani,la rotazione attorno al doppio legame è impedita. Questo, quando ognuno dei carboni coinvolti nel doppio legame reca sostituenti diversi, crea coppie diisomeri geometrici,che vengono distinti l'uno dall'altro tramite i prefissi "cis-" e "trans-" (si veda la voceformula chimica).
La presenza del doppio legame carbonio-carbonio conferisce agli alcheni una reattività superiore a quella dei corrispondentialcani.Tale reattività si esplica principalmente in reazioni di addizione, che prevedono l'apertura del doppio legame e la sua conversione in due legami semplici. L'addizione di una molecola di alchene ad un'altra identica, ripetuta virtualmente all'infinito produce un esempio dipolimero.
Nomenclatura IUPAC
modificaLa nomenclaturaIUPACdeglialchenisegue regole simili a quella deglialcani,tuttavia occorre evidenziare alcune differenze:
- quando si individua la catena principale della molecola, questa deve includere i due atomi di carbonio coinvolti nel doppio legame.
- il nome che viene dato alla catena principale è simile a quanto previsto per gli alcani, ma il suffisso-anoviene sostituito dal suffisso-ene(etene, propene, butene, pentene, esene, eptene, ottene, etc...)
- nel numerare la catena principale, il numero più basso possibile dovrà essere assegnato ai due atomi di carbonio coinvolti nel doppio legame.
- quando ognuno dei due atomi coinvolti nel doppio legame ha legati a sé due sostituenti diversi, l'alchene presentaisomeriageometrica. Per distinguere i due isomeri si fa ricorso ai prefissicis-,quando i due sostituenti più ingombranti di ogni atomo si trovano sul medesimo lato del doppio legame, etrans-,quando i due sostituenti più ingombranti di ogni atomo si trovano sui lati opposti del doppio legame. (Esempi alle pagineisomeriaeformula chimica).
Fonti industriali
modificaI due principali processi industriali di produzione degli alcheni sono ilcrackingcatalitico a letto fluido (FCC, Fluid Catalytic Cracking) e losteam cracking.Il primo è un processo proprio alle raffinerie, il secondo è un processo petrolchimico e produce essenzialmenteetileneepropilene. La preparazione di1-alchenilineari con un numero pari di atomi dicarbonio(1-dodecene, 1-tetradecene, 1-esadecene, etc.), impiegati nell'industria dei detergenti, viene condotta perpolimerizzazionecontrollata dell'etenecon i catalizzatori di Ziegler-Natta.
Test per gli alcheni
modificaCome riconoscere gli alcheni
Reazione riconoscimento con Br2
Gli alcheni sono facilmente trasformabili dal cloro o dal bromo (lo iodio generalmente non reagisce) in dialogenuri, composti saturi che contengono 2 atomi di alogeno legati a due atomi di carbonio adiacenti. La reazione di addizione elettrofila avviene miscelando i due reagenti in presenza di un solvente inerte e procede velocemente a temperatura ambiente o anche più bassa. Si devono, anzi, evitare temperature più alte, un eccesso di alogeno e l’esposizione alla luce UV, poiché in queste condizioni la sostituzione potrebbe diventare una reazione secondaria importante. Il saggio è positivo (conferma della presenza di un doppio legame) se scompare la colorazione rossa dell’acqua di bromo (sia il dialogenuro che si forma, sia l’alchene sono incolori).
Alcuni agenti ossidanti trasformano gli alcheni in “glicoli”, composti organici che contengono due gruppi “– OH”, caratteristici degli alcoli. La reazione, nota come ossidrilazione, corrisponde all’addizione di due gruppi ossidrilici al doppio legame. Per il riconoscimento del doppio legame si utilizza, come agente ossidante, una soluzione diluita neutra o leggermente basica di permanganato di potassio. La reazione viene condotta a temperatura ambiente. Si devono evitare sia le alte temperature, sia l’aggiunta di acidi perché in queste condizioni può avvenire la scissione del doppio legame. Il saggio è positivo se scompare la soluzione violetta del KMnO4sostituita da un precipitato bruno di biossido di manganese.
Preparazioni per sintesi
modificaIn laboratorio gli alcheni possono essere preparati per
- disidratazione deglialcoli
R-CH2-CH2OH → R-CH=CH2
- la reazione è catalizzata con agenti disidratanti quali l'allumina,l'anidride fosforicao l'acido solforico;in quest'ultimo caso, la formazione dell'etereè concorrenziale a quella dell'alchene; con alcuni alcoli è possibile indirizzare l'esito finale agendo sulle condizioni di reazione
- deidroalogenazione deglialogenuri alchilici(β-eliminazione)
R-CH2-CH2X +base→ R-CH=CH2(X = Cl, Br, I)
- la base generalmente usata in questi casi è l'idrossido di potassioin soluzione dietanolo;l'uso di basi insoluzione acquosaè meno efficace, dato che l'alogenuro alchilico è poco solubile in acqua.
- Glialogenuri alchiliciterziari sono i più reattivi, seguono i secondari e quindi i primari. Tra gli alogenuri, a parità di gruppo alchilico, gliiodurisono i più reattivi, seguiti daibromurie quindi daicloruri.
- Sia in questo caso, come nella disidratazione degli alcoli, verrà perso preferenzialmente l'idrogeno che porta alla formazione dell'alchene più stabile, cioè quello più sostituito - vale a dire quello che reca più gruppi alchilici possibile sui carboni impegnati nel doppio legame.
- dealogenazione dei dialogenuri vicinali
R-CH-CH2 | | + Zn → R-CH=CH2(X = Cl, Br, I) X X
- reazione di Wittig(daGeorg Wittig,che l'ha messa a punto nel1954), cioè l'accoppiamento tra un'aldeideo unchetoneed un'ilidedelfosforo,quest'ultima preparatain situper reazione tra unafosfina(di solito la trifenilfosfina) ed un alogenuro alchilico, seguita dal trattamento con una base molto forte (un alchillitio nell'esempio)
Ph Ph | | 1. Ph-P + R-CH2-X → Ph-P+-CH2X- | | | Ph Ph R
Ph Ph | | 2. Ph-P+-CH2X-+ R-Li → Ph-P+-CH-ilide di fosforo | | | | Ph R Ph R
Ph Ph | | 3. Ph-P+-CH-+ R'-C=O → R'-C=C-H + Ph-P=O | | | | | | Ph R R' R'R Ph
- Phrappresenta convenzionalmente il gruppofenile,cioè unbenzeneprivo di un atomo di idrogeno, C6H5-
- La scelta dell'alogenuro alchilico e del chetone permette la sintesi dell'alchene desiderato.
È una reazione tra un diene ed un alchene sostituito con gruppi elettron-attrattori (dettodienofilo); produce un alchene ciclico.
ROOCCOOR \ / CH2=CHROOCCOORCH-CH \ + \ / → / \ CH=CH2CH=CHCH2CH2 \ / CH=CH
- rientra nel novero delle cosiddettereazioni elettrocicliche.
- reazione di Copeoeliminazione di Cope
È una reazione di eliminazione con cui, tramite riscaldamento, si trasforma un ossido di un'ammina terziaria in un alchene e unaN,N-dialchilidrossilammina.
Reazioni tipiche
modificaLa maggior parte della reattività degli alcheni si esplica attraverso reazioni di addizione al doppio legame. Tale addizione può avvenire con meccanismoionico(addizione elettrofila) oradicalico.
- addizione di idrogeno(formazione dialcani)
RR'C=CHR "+ H2→ RR'CH-CH2R "
- avviene a temperature e pressioni non elevate in presenza di catalizzatori metallici quali ilplatino,ilpalladioo ilnichel,producendo l'alcanocorrispondente.
- L'efficienza del catalizzatore è direttamente legata alla sua dispersione ed alla sua capacità di adsorbire l'alchene; è probabile che l'adsorbimento trasferisca al metallo parte della densità elettronica del doppio legame, che risulta così indebolito e maggiormente attaccabile dall'idrogeno.
- addizione di alogeno
RR'C=CHR "+ X2→ RR'CX-CXHR "X = Cl, Br
- È una reazione immediata e completa a temperatura ambiente, al punto che una soluzione dibromointetracloruro di carbonioè usata come reagente per caratterizzare gli alcheni, dato che in loro presenza subisce un immediatoviraggioda arancione intenso ad incolore.
- L'addizione di alogeno ad un doppio legame procede con il meccanismo qui indicato, in cui si ha dapprima formazione di uno ionebromoniociclico che viene successivamente aperto da un anione bromuro che lo approccia dal lato opposto inserendosi su uno o l'altro dei due atomi dicarbonioin funzione dell'ingombro sterico.
- il meccanismo proposto spiega perché l'addizione di un alogeno ad un cicloalchene produce solo l'isomerotrans-1,2 dialogenato e non ilcis.Un'addizione di questo genere è dettaanti(in opposto allasin,in cui l'addizione avviene sullo stesso lato del doppio legame).
- formazione di aloidrine
RR'C=CHR "+ X2+ H2O → RR'C-CHR " | | X = Cl, Br X OH
- È un'ulteriore conferma della formazione dello ione ciclico intermedio illustrato nel meccanismo precedente.
- Quando l'alogeno è addizionato all'alchene in presenza di acqua, insieme al prodotto di alogenazione si ottiene anche il corrispondente alcol 2-alogenato (noto anche comecloridrinaobromidrina,a seconda dell'alogeno impiegato), per apertura dello ione ciclico intermedio ad opera di uno ione OH-.
- addizione di acidi alogenidrici(formazione dialogenuri alchilici)
RR'C=CHR "+ H-X → RR'CX-CH2R "(X = Cl, Br, I)
- È una reazione che avviene facendo gorgogliare l'acido alogenidrico secco nell'alchene o in una soluzione dell'alchene in un solvente organico polare; si evita l'acqua perché potrebbe competere nell'addizione con l'acido e quindi convertire l'alchene nell'alcolcorrispondente.
- Quando l'alchene non è simmetrico, l'addizione di una molecola di acido alogenidrico può portare a due diversi prodotti; secondo la regola diMarkovnikov,enunciata nel1869in seguito allo studio sistematico di diverse reazioni di addizione, si osserva chel'idrogeno dell'acido si lega preferenzialmente all'atomo di carbonio che già ha più idrogeni legati a sé,ad esempio
CH3-CH=CH2+ HCl → CH3-CH-CH3e nonCH3-CH2-CH2 | | Cl Cl
- Questo orientamento si spiega ipotizzando che la reazione di addizione si svolga secondo un meccanismo in due passaggi. Nel primo, l'alchene somma a sé lo ione H+dell'acido formando uncarbocatione(non ciclico, come nel caso dell'addizione di alogeni, perché l'idrogenonon ha elettroni esterni per formare legami supplementari), il quale va successivamente a legarsi all'anione. L'addizione di H+secondo laregola di Markovnikovproduce preferenzialmente il carbocatione più stabile:
CH3-CH=CH2+ H+→ CH3-CH-CH3carbocatione secondario: più stabile +
CH3-CH2-CH2+carbocatione primario: meno stabile
- ilcarbocationemeno stabile inoltre subisce trasposizione modificandosi in un isomero più stabile.
- In presenza diperossidiil meccanismo della reazione di addizione non è più ionico, bensìradicalico,l'effetto è quello di rovesciare l'orientamento dell'addizione e dare quindi un prodottooppostoa quello previsto dalla regola di Markovnikov. Questo perché la particella che si somma all'alchene non è più lo ione H+,bensì il radicale X.
CH3-CH=CH2+ X.→ CH3-CH-CH2radicale secondario: più stabile .| X
CH3-CH-CH2.radicale primario: meno stabile | X
- il radicale formatosi si unisce poi ad un radicale H.completando l'addizione.
- addizione di acqua(idratazione, formazione dialcoli)
RR'C=CHR "+ H-X → RR'CX-CH2R "(X = Cl, Br, I)
- con un meccanismo simile a quanto visto per l'addizione di acidi alogenidrici, gli alcheni, in presenza di un acido catalizzatore che normalmente è l'acido solforicosommano una molecola di acqua dando l'alcol corrispondente.
- L'orientamento dell'addizione segue la regola di Markovnikov, quindi tenderanno a formarsi preferenzialmente alcoli secondari e terziari, ad esempio
CH3-CH=CH2+ H2O → CH3-CH-CH3e nonCH3-CH2-CH2 | | OH OH
- la sintesi di alcoli con un orientamento anti-Markovnikov dagli alcheni è un processo più complesso, che richiede due passaggi e prende il nome diidroborazione-ossidazione.Consiste nell'addizionare all'alchene unboranoed ossidarlo successivamente conperossido di idrogenoin ambiente alcalino
1. CH3-CH=CH2+ (BH3)2→ CH3-CH2-CH2 | BH2
2. CH3-CH2-CH2+ H2O2→ CH3-CH2-CH2 | | BH2OH
- addizione di alchili(alchilazione, dimerizzazione, polimerizzazione)
- Ilcarbocationeche si forma per addizione di uno ione H+ad un alchene può, in funzione delle condizioni di reazione e della sua struttura, addizionarsi ad un'altra molecola di alchene, formando un carbocatione più grosso il quale può o perdere uno ione H+e trasformarsi in un alchene o, sua volta, proseguire l'addizione e portare ad unpolimero.La reazione viene condotta trattando l'alchene conacido solforicoconcentrato oacido fosforicoconcentrato.
- Un esempio è la dimerizzazione del 2-metil-2-propene (più noto comeisobutene)
+ 1. CH3-C=CH2+ H+→ CH3-C-CH3 | | CH3CH3
CH3 + | + 2. CH3-C-CH3+ CH3-C=CH2→ CH3-C-CH2-C-CH3 | | | | CH3CH3CH3CH3
CH3CH3 | + | 3. CH3-C-CH2-C-CH3→ CH3-C-CH=C-CH3+ H+ | | | | CH3CH3CH3CH3
- Similmente, se il carbocatione viene formato in presenza di unalcano,il carbocatione può strappare uno ione idruro (H-) all'alcano per neutralizzare la propria carica e trasformarsi in un alcano a sua volta, ad esempio
CH3CH3CH3CH3 | + | | | 3a. CH3-C-CH2-C-CH3+ CH3-CH → CH3-C-CH2-CH-CH3+ CH3-C+ | | | | | | CH3CH3CH3CH3CH3CH3
- L'addizione di unradicalead un alchene dà il via ad una reazione di addizione a catena che porta alpolimerocorrispondente. Comeiniziatore,cioè come composto capace di generare radicali che diano inizio alla reazione, viene generalmente impiegato unperossido.
1. R-O-O-R → R-O.
2. R-O.+ CH2=CH2→ R-O-CH2-CH2.
3. R-O-CH2-CH2.+ CH2=CH2→ R-O-CH2-CH2-CH2-CH2.
n....-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-...
- formazione didioli
R-CH=CH-R' + KMnO4→ R-CH-CH-R' | | OH OH
- il doppio legame tende anche ad aprirsi perossidazione;il trattamento con agenti ossidanti molto blandi, ad esempio ilpotassio permanganatoin soluzione fortementealcalinapermette di fermare l'ossidazione ad uno stadio iniziale, convertendo l'alchene nel corrispondentediolo.
- addizione di carbene(ciclizzazione)
R-CH=CH-R' + CH2N2→ R-CH---CH-R' \ / CH2
- ilcarbeneè una particella poco stabile che può esistere in due forme, una di queste è il biradicale.CH2.che, con i suoi due elettroni spaiati è in grado di inserirsi nel doppio legame di un alchene convertendolo in unciclopropano.
- Il carbene viene solitamente generatoin situdalla decomposizione deldiazometano,CH2N2,attivata dalla luce.
- Similmente, il trattamento di un alchene concloroformioeidrossido di sodioporta alla conversione dell'alchene nel corrispondente 1,1-diclorociclopropano a seguito dell'inserimento sul doppio legame deldiclorocarbene:CCl2generato dall'azione dell'idrossido di sodio sul cloroformio.
- formazione diepossidi
R-CH=CH-R' + RCO-O-OH (peracido) → R-CH—CH-R' \ / O
- similmente al carbene, anche unatomodiossigeno,con i suoi due elettroni spaiati, è in grado di inserirsi in un doppio legame trasformando l'alchene nel corrispondenteepossido.Fonte usuale di ossigeno atomico a questo scopo sono iperacidi,cioè acidi carbossilici che contengono un atomo di ossigeno aggiuntivo, con una struttura analoga a quella dell'acqua ossigenata.
- sostituzioneradicalica
- Anche gli alcheni, come glialcanipossono subire reazioni di sostituzione ad opera diradicali;la stabilità creata dallarisonanzafavorisce la sostituzione in posizioneallilica,cioè sui carboni adiacenti a quelli impegnati nel doppio legame
.. R-CH2-CH=CH2→ R-CH-CH=CH2↔ R-CH=CH-CH2
- demolizione ossidativa (ozonolisi)
- Il trattamento con ossidanti forti, quali l'ozonoo ilpotassio permanganatoin soluzione acida, porta ad una rottura del doppio legame in prossimità del quale l'alchene si spezza in due frammenti che possono esserechetoni,acidi carbossilicieanidride carbonica,in funzione della forza dell'agente ossidante e della struttura dell'alchene
R R' R R' \ / \ \ C=C + O3→ C=O + C=O / \ / / R H R OH
R H R \ / \ C=C + O3→ C=O + CO2 / \ / R H R
- l'identificazione dei frammenti è un modo per determinare la struttura dell'alchene di partenza.
Alcheni lineari a n atomi di carbonio
modificaNote
modificaBibliografia
modifica- T. W. Graham Solomons,Chimica organica,2ª ed., Bologna, Zanichelli, 2001, pp. 47-50, 197-229,ISBN88-08-09414-6.
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley,Industrial organic chemistry,4ª ed., Wiley-VCH, 2003, pp. 59-90,ISBN3-527-30578-5.
Voci correlate
modificaAltri progetti
modifica- Wikizionariocontiene il lemma di dizionario «alcheni»
- Wikimedia Commonscontiene immagini o altri file sualcheni
Collegamenti esterni
modifica- Esercizi sulla Nomenclatura degli alcheni,su mnemochimica.it.
- Esperienze in laboratorio - Gli alcheni,suitchiavari.org.
| Controllo di autorità | Thesaurus BNCF21153·LCCN(EN)sh85094589·GND(DE)4001207-4·BNF(FR)cb11948674t(data)·J9U(EN,HE)987007546028505171·NDL(EN,JA)00562061 |
|---|