Acido borico
| Acido borico | |
|---|---|
 | |
 | |
| NomeIUPAC | |
| acido borico | |
| Nomi alternativi | |
| acido ortoborico acido triossoborico(III) | |
| Caratteristiche generali | |
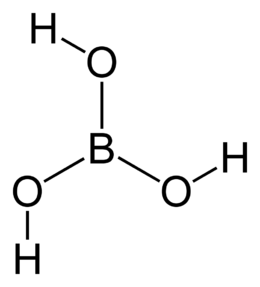
| Formula brutaomolecolare | H3BO3oppure B(OH)3 |
| Massa molecolare(u) | 61,84 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 233-139-2 |
| PubChem | 7628 |
| DrugBank | DBDB11326 |
| SMILES | B(O)(O)O |
| Proprietà chimico-fisiche | |
| Densità(g/cm3,inc.s.) | 1,44 (20 °C) |
| Solubilitàinacqua | 46,5 g/l (20 °C) |
| Temperatura di fusione | 171 °C (444 K) (decomposizione) |
| Temperatura di ebollizione | 300 °C (573 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 360 |
| Consigli P | 201-308+313[1] |
L'acido borico,oacido ortoborico(più raramenteacido boracico[2]), ugualmenteacido boriconella nomenclaturaIUPAC,[3]è unossiacidodelborotrivalente,di formula H3BO3o B(OH)3ed è unacido molto debole.Esiste in natura in forma di cristalli incolori o polvere bianca; è solubile in acqua, specialmente a caldo.
È usato spesso come antisettico, insetticida, disinfettante, ritardante di fiamma e in laboratorio per la preparazione di alcune soluzioni, come ilTBE(tris-borato-EDTA).
L'acido borico è utilizzato nell'industria del vetro, nella lavorazione degli smalti, delle vernici, della pelle, della carta, degli adesivi e degli esplosivi. È inoltre iniettato nelmoderatoredelle centrali nucleari BWR o PWR in virtù della natura di assorbitore neutronico di unisotopodel boro per effettuare gli arresti rapidi (SCRAM).
Preparazione
[modifica|modifica wikitesto]È l'acidoottenuto peridratazionedell'anidride borica. L'acido borico, tuttavia, è prodotto soprattutto dai minerali delboratoper effetto della reazione conacido solforico.La più grande fonte di borati nel mondo è la miniera diBoron,inCalifornia.
Proprietà
[modifica|modifica wikitesto]
Allo stato isolato lamolecolaH3BO3è planare (l'atomo B èibridatosp2), con simmetriaC3h[4]emomento dipolarenullo. L'acido borico è solubile in acqua bollente. A circa 170 °C avviene una disidratazione che trasforma l'acido ortoborico inacido metaboricoHBO2.Fonde a circa 236 °C, e quando viene riscaldato a circa 300 °C avviene un'ulteriore disidratazione con la formazione diacido tetraboricoH2B4O7.
È unacido debole,la cuicostante di dissociazione acidaKaè5,81×10−10.Insoluzione acquosadiluita (dal 3% al 5% circa) viene utilizzato comedisinfettante;tale soluzione prende il nome di acqua borica e viene tuttalpiù usata dopo bagni in acque ricche diplanctone per contrastare l'alcalinitàdi saponi, comeantisettico,antimicotico,fungicidae inoculistica(occhiarrossati econgiuntiviti). Nelle industrie chimiche che producono sostanze alcaline (comeidrossido di sodioo potassio), l'acido borico è usato nelle postazioni di primo soccorso per il lavaggio oculare in caso di contatto accidentale con gli alcali.
È anche usato come assorbitore nellecentrali nucleari,disciolto nell'acqua in cui sono immerse le barre combustibili, per catturare i neutroni emessi durante lafissione,per ridurre e tenere sotto controllo la velocità delle reazioni nucleari.
Tossicologia
[modifica|modifica wikitesto]In dositossichel'acqua borica può provocarevomito,diarrea,emorragieedolori viscerali.Secondo loIUCLIDDataset pubblicato dallaCommissione europeain relazione all'acido borico, quest'ultimo, in alte dosi, mostra una significativa tossicità nello sviluppo eteratogenicitàin feti e prole di conigli, ratti e topi, causando difetti cardiovascolari, modificazioni scheletriche, e modeste lesioni renali.[5]Di conseguenza, nell'agosto 2008, con il 30° adeguamento al progresso tecnico della direttiva 67/548/CEE, la CE ha deciso di modificare la sua classificazione in "Tossico per la riproduzione" di categoria 2 con le frasi di rischio R60 (può ridurre la fertilità) e R61 (può danneggiare i bambini non ancora nati).
Riconoscimento
[modifica|modifica wikitesto]Alsaggio alla fiammadà colorazione verde smeraldo. L'acido borico è solubile in acqua. Una cartina indicatrice allacurcumabagnata con una sua soluzione cloridrica assume colorazione rosa per essiccamento. Riscaldato fonde assumendo l'aspetto di una massa traslucida.
Note
[modifica|modifica wikitesto]- ^scheda dell'acido borico suIFA-GESTIS(archiviato dall'url originaleil 16 ottobre 2019).
- ^boracifero,sutreccani.it - Vocabolario on line,Istituto dell'Enciclopedia Italiana.URL consultato il 29 maggio 2017.
- ^(EN) PubChem,Boric Acid,supubchem.ncbi.nlm.nih.gov.URL consultato il 22 aprile 2024.
- ^(EN) J. Steven Ogden e Nigel A. Young,The characterisation of molecular boric acid by mass spectrometry and matrix isolation infrared spectroscopy,inJournal of the Chemical Society, Dalton Transactions,n. 6, 1988, pp. 1645,DOI:10.1039/dt9880001645.URL consultato il 6 giugno 2022.
- ^European Chemical Bureau - ECB,Boric Acid IUCLID Dataset(PDF)[collegamento interrotto],Commissione Europea.
Voci correlate
[modifica|modifica wikitesto]Altri progetti
[modifica|modifica wikitesto] Wikimedia Commonscontiene immagini o altri file suacido borico
Wikimedia Commonscontiene immagini o altri file suacido borico
Collegamenti esterni
[modifica|modifica wikitesto]- (EN)boric acid,suEnciclopedia Britannica,Encyclopædia Britannica, Inc.
- Sito italiano sull'acido borico,suacidoborico.it.
- (EN)ChemSub Online: Acido borico,suchemsub.online.fr.
| Controllo di autorità | Thesaurus BNCF21199·LCCN(EN)sh85015848·GND(DE)4146369-9·BNF(FR)cb133323241(data)·J9U(EN,HE)987007283387305171 |
|---|