CCR5
| Recettore C-C per le chemochine di tipo 5 | |
|---|---|
 | |
| Gene | |
| HUGO | CCR5CC-CKR-5; CCCKR5; CCR-5; CD195; CKR-5; CKR5; CMKBR5; IDDM22 |
| Locus | Chr. 3p21.31 |
| Proteina | |
| UniProt | P51681 |
CCR5,acronimo perC-C chemokine receptor type 5(recettore C-C per le chemochine di tipo 5) e nota anche comeCD195,è unaproteinapresente sullamembranadeileucocitie coinvolta nelsistema immunitariocomerecettoreper lechemochine,con il ruolo di attirare in specificitessutieorganiilinfociti T.Molte forme diHIV,ilvirusresponsabile dell'AIDS,utilizzano nelle fasi iniziali questo recettore per entrare nelle cellule da infettare. Esistono soggetti portatori di una particolaremutazionedelgene,CCR5-Δ32, che li protegge dall'infezioneda parte di queste forme virali.
In tali soggetti il geneCCR5,localizzato sulcromosoma 3,risulta mutato perdelezionedi una particolare porzione del materiale genetico; leforme omozigotiche,ovvero i soggetti che presentano entrambi gliallelimutati, risultano resistenti ai ceppi virali diHIV-1 R5 tropici[1].
Funzione
[modifica|modifica wikitesto]CCR5 appartiene alla famiglia deirecettoriß per lechemochineed è unaproteina integrale di membrana[2][3].Si tratta di unrecettore accoppiato a proteine Ge lega specificatamente la famigliaCCdelle chemochine[2].
Iligandinaturali del recettore sonoRANTES,unfattore chemotatticoconosciuto anche come CCL5[4][5][6]eMIP(macrophage inflammatory protein) 1αe 1β,note anche rispettivamente comeCCL3eCCL4.Interagisce inoltre conCCL3L1[5][7].
Il gene èespressosoprattutto neilinfociti T,neimacrofagi,nellecellule dendritichee nellamicrogliae, sebbene il suo esatto ruolo nella funzione immunitaria normale non sia stato chiarito, si ritiene che abbia un ruolo nellarisposta infiammatoriaalle infezioni.
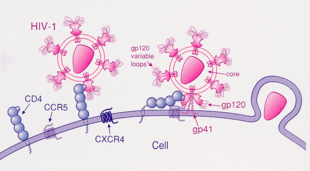
1) La proteina viralegp120legaCD4
2) La regione variabile digp120lega il corecettore, solitamente CCR5 o CXCR4
3) HIV entra nella cellula
Ruolo nell'infezione da HIV
[modifica|modifica wikitesto]I corecettori cheHIVutilizza per il suo ingresso nelle cellule sono CCR5 e/oCXCR4;sebbene numerosi recettori che le chemochine possano agire da corecettori virali, è CCR5 quello più importante nella storia naturale dell'infezione. I suoi ligandi fisiologici sonoRANTES,MIP-1βeMIP-1α,i quali sono in grado di eliminare l'infezione da HIV-1in vitro.Nei soggetti infettati da HIV, i ceppi che utilizzano CCR5 per l'ingresso nella cellula sono quelli maggiormente isolati nelle fasi iniziali dell'infezione[8];ciò suggerisce che tali virus abbiano un vantaggio selettivo durante la trasmissione o la fase acuta della malattia. Inoltre, almeno metà dei pazienti infettati ospita solo virus R5-tropici durante l'intero corso dell'infezione.
Un nuovo gruppo di farmaci, gliantagonisti del recettore CCR5,è stato realizzato con lo scopo di interferire nell'interazione tra HIV e tale recettori; tra questi vi sonoPRO 140,Vicriviroc,AplaviroceMaraviroc.Uno dei problemi limitanti in questo approccio terapeutico è che, nonostante CCR5 sia il corecettore maggiormente coinvolto nell'infezione, questo non è l'unico. Tuttavia, valutando la resistenza virale a AD101, un antagonista molecolare di CCR5, si è osservato che i virus resistenti non cambiano corecettore bersaglio, bensì continuano a utilizzare CCR5, anche utilizzando domini alternativi di legame o legando il recettore con maggiore affinità.
La variante Δ32
[modifica|modifica wikitesto]CCR5-Δ32,denominato ancheCCR5-D32oCCR5 delta 32,è unavariante allelicadi CCR5[9][10].
CCR5-Δ32 è unamutazionedeletivache ha un impatto specifico sulle funzioni dei linfociti T[11].La presenza di almeno una copia di tale gene mutato (eterozigosi) è stata rilevata in circa il 4-16% degli individui di discendenza europea, la presenza di entrambe le copie del gene mutato (omozigosi), in circa il 0,16-2,5% degli individui di discendenza europea[12].Si era speculato che tale allele potesse aver favorito laselezione naturaledurante laPeste neranei paesi dell'Europa settentrionale, ma studi più recenti hanno escluso questa possibilità, rivelando l'assenza di un ruolo protettivo in tale contesto[13].Si ritiene che questa mutazione possa aver premesso una protezione dalvaiolodurante leepidemiein Europa[13],soprattutto nelle maggiori città commerciali e in luoghi isolati comeIslandaeAzzorre[14],e che tale situazione abbia favorito un aumento dellaprevalenzadella mutazione[9].
Si pensa che inAntica Grecia,in aree come quella diCorinto,lo sviluppo dellaprostituzioneabbia portato alla diffusione di un'infezione simile a quella da HIV, con unquadro clinicosimil-influenzale e una successivaimmunodepressione.Allora nulla si sapeva sulla diffusione di questa malattia, ma si ritiene che anche laPeste di Atenee successive epidemie avutesi neiBalcanipossano essere state favorite da mutazioni genetiche[15].La mutazione CCR5-Δ32, tuttavia, è stata rilevata anche in campioni di sangue dell'età del bronzo,a tassi comparabili con quelli della popolazione europea moderna[16].
Questa mutazione ha un effetto negativo sulla funzione dei linfociti T, ma sembra svolgere un ruolo protettivo nei confronti delVariola viruse diHIV.LaYersinia pestis,agente eziologico dellapeste bubbonica,è stata dimostrata in laboratorio non associabile a CCR5. I soggetti con la mutazione Δ32 sono sani, e ciò suggerisce che il gene CCR5 sia piuttosto superfluo; tuttavia CCR5 pare svolgere un ruolo protettivo nei confronti delvirus del Nilo occidentalee gli studi clinici hanno dimostrato che i soggetti Δ32 hanno un rischio sproporzionatamente più alto di contrarre questa infezione[17],dimostrando che non tutte le funzioni di CCR5 possono essere compensate da altri recettori.
Nonostante la grandevariabilità geneticadi CCR5 nelle sue regioni codificanti, la delezione di 32pbporta a un recettore non funzionante, che previene l'ingresso nella cellula dei ceppi virali HIV R5-tropici; la presenza di tale mutazione inomozigosifornisce una forte protezione nei confronti dell'infezione da HIV[18].Tale allele è stato trovato nel 5-14% degli europei, ma è raro presso gli africani e gli asiatici[19];la sua presenza fa diminuire il numero di proteine CCR5 presenti nellamembrana cellularedel linfocita T CD4+,con effetti sui tassi di progressione dell'infezione da HIV. Numerosi studi condotti su persone infettate da HIV hanno dimostrato che la presenza di una copia di CCR5-Δ32 ritarda l'insorgenza diAIDSper almeno due anni. È inoltre possibile che una persona con questa mutazione possa non venir infettata dai ceppi HIV R5-tropici[20].
Dal punto di vista terapeutico si è pensato di sfruttare questa condizione per la realizzazione dianticorpi monoclonaliche blocchino l'espressione genicadi CCR5, da utilizzare in soggetti infettati daHIV-1[21].In vitroè stato dimostrato che i linfociti T, modificati per non presentare CCR5 e mescolati con linfociti T normali, sono portati a prendere il sopravvento nellacoltura cellularequando HIV attacca e uccide le cellule normali[21].
Tale ipotesi fu valutatain vivoin un paziente con AIDS, Timothy Ray Brown, che sviluppò contestualmente unaleucemia mieloide acutae che fu trattato conchemioterapia;ricevette quindi untrapianto di cellule staminali ematopoieticheda un donatore con omozigosi per CCR5-Δ32. Dopo due anni dal trattamento il paziente risultò in salute, con un livello indosabile divirioninel sangue, nel cervello e nell'epitelio rettale[22][23].Prima del trapianto il paziente presentava anche bassi livelli di HIV XR4-tropici, che non usano CCR5 per l'ingresso nella cellula; tuttavia, successivamente al trapianto, anche questi ceppi virali divennero indosabili[23].Tale evento è spiegabile con l'osservazione che le cellule che esprimono la variante Δ32 risultano carenti, nella membrana cellulare, sia di CCR5, sia diCXCR4,conferendo una resistenza a un ampio numero di varianti di HIV[24].Nel 2010, dopo tre anni dal trattamento, il paziente risultò ancora resistente al virus e fu dichiarato guarito[25].
Nel 2009 è iniziato uno studio clinico su pazienti sieropositivi per valutare l'utilizzo di unaterapia genicache consiste nel trasporto della variante CCR5-Δ32 tramite unanucleasizinc fingernelle cellule prelevate dal paziente; la reinfusione di queste cellule potrebbe rivelarsi una potenziale opzione nel trattamento dell'HIV[26][27].
Note
[modifica|modifica wikitesto]- ^Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber CM, Saragosti S, Lapoumeroulie C, Cognaux J, Forceille C, Muyldermans G, Verhofstede C, Burtonboy G, Georges M, Imai T, Rana S, Yi Y, Smyth RJ, Collman RG, Doms RW, Vassart G, Parmentier M,Resistance to HIV-1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene,inNature,vol. 382, n. 6593, agosto 1996, pp. 722–5,DOI:10.1038/382722a0,PMID8751444.
- ^abGenetics Home Reference(archiviato dall'url originaleil 24 settembre 2009).
- ^Samson M, Labbe O, Mollereau C, Vassart G, Parmentier M,Molecular cloning and functional expression of a new human CC-chemokine receptor gene,inBiochemistry,vol. 35, n. 11, marzo 1996, pp. 3362–7,DOI:10.1021/bi952950g,PMID8639485.
- ^Slimani H, Charnaux N, Mbemba E, Saffar L, Vassy R, Vita C, Gattegno L,Interaction of RANTES with syndecan-1 and syndecan-4 expressed by human primary macrophages,inBiochim. Biophys. Acta,vol. 1617, 1–2, ottobre 2003, pp. 80–8,DOI:10.1016/j.bbamem.2003.09.006,PMID14637022.
- ^abStruyf S, Menten P, Lenaerts JP, Put W, D'Haese A, De Clercq E, Schols D, Proost P, Van Damme J,<2170::AID-IMMU2170>3.0.CO;2-DDiverging binding capacities of natural LD78beta isoforms of macrophage inflammatory protein-1alpha to the CC chemokine receptors 1, 3 and 5 affect their anti-HIV-1 activity and chemotactic potencies for neutrophils and eosinophils,inEur. J. Immunol.,vol. 31, n. 7, luglio 2001, pp. 2170–8,DOI:10.1002/1521-4141(200107)31:7<2170::AID-IMMU2170>3.0.CO;2-D,PMID11449371.
- ^Proudfoot AE, Fritchley S, Borlat F, Shaw JP, Vilbois F, Zwahlen C, Trkola A, Marchant D, Clapham PR, Wells TN,The BBXB motif of RANTES is the principal site for heparin binding and controls receptor selectivity,inJ. Biol. Chem.,vol. 276, n. 14, aprile 2001, pp. 10620–6,DOI:10.1074/jbc.M010867200,PMID11116158.
- ^Miyakawa T, Obaru K, Maeda K, Harada S, Mitsuya H,Identification of amino acid residues critical for LD78beta, a variant of human macrophage inflammatory protein-1alpha, binding to CCR5 and inhibition of R5 human immunodeficiency virus type 1 replication,inJ. Biol. Chem.,vol. 277, n. 7, febbraio 2002, pp. 4649–55,DOI:10.1074/jbc.M109198200,PMID11734558.
- ^Anderson J, Akkina R,Complete Knockdown of CCR5 by lentiviral vector-expressed siRNAs and protection of transgenic macrophages against HIV-1 infection,inGene Therapy,vol. 14, n. 14, 2007, pp. 1287–1297,DOI:10.1038/sj.gt.3302958,PMID17597795.
- ^abGalvani AP, Slatkin M,Evaluating plague and smallpox as historical selective pressures for the CCR5-Delta 32 HIV-resistance allele,inProc. Natl. Acad. Sci. U.S.A.,vol. 100, n. 25, dicembre 2003, pp. 15276–9,DOI:10.1073/pnas.2435085100,PMC299980,PMID14645720.
- ^Stephens JC, Reich DE, Goldstein DB, Shin HD, Smith MW, Carrington M, Winkler C, Huttley GA, Allikmets R, Schriml L, Gerrard B, Malasky M, Ramos MD, Morlot S, Tzetis M, Oddoux C, di Giovine FS, Nasioulas G, Chandler D, Aseev M, Hanson M, Kalaydjieva L, Glavac D, Gasparini P, Kanavakis E, Claustres M, Kambouris M, Ostrer H, Duff G, Baranov V, Sibul H, Metspalu A, Goldman D, Martin N, Duffy D, Schmidtke J, Estivill X, O'Brien SJ, Dean M,Dating the origin of the CCR5-Delta32 AIDS-resistance allele by the coalescence of haplotypes,inAm. J. Hum. Genet.,vol. 62, n. 6, giugno 1998, pp. 1507–15,DOI:10.1086/301867,PMC1377146,PMID9585595.
- ^Buseyne F, Janvier G, Teglas JP, Ivanoff S, Burgard M, Bui E, Mayaux MJ, Blanche S, Rouzioux C, Rivière Y,Impact of heterozygosity for the chemokine receptor CCR5 32-bp-deleted allele on plasma virus load and CD4 T lymphocytes in perinatally human immunodeficiency virus-infected children at 8 years of age,inJ. Infect. Dis.,vol. 178, n. 4, ottobre 1998, pp. 1019–23,DOI:10.1086/515660,PMID9806029.
- ^John Novembre, Alison P Galvani e Montgomery Slatkin,The Geographic Spread of the CCR5 Δ32 HIV-Resistance Allele,inPLOS Biology,18 ottobre 2005.
- ^abFaure E, Royer-Carenzi M,Is the European spatial distribution of the HIV-1-resistant CCR5-Delta32 allele formed by a breakdown of the pathocenosis due to the historical Roman expansion?,inInfect. Genet. Evol.,vol. 8, n. 6, dicembre 2008, pp. 864–74,DOI:10.1016/j.meegid.2008.08.007,PMID18790087.
- ^Freitas T, Brehm A, Fernandes AT,Frequency of the CCR5-delta32 mutation in the Atlantic island populations of Madeira, the Azores, Cabo Verde, and São Tomé e Príncipe,inHum. Biol.,vol. 78, n. 6, dicembre 2006, pp. 697–703,DOI:10.1353/hub.2007.0011,PMID17564248.
- ^Mirko D. Grmek,Diseases in the Ancient Greek World,marzo 1991.
- ^Hedrick PW, Verrelli BC,"Ground truth" for selection on CCR5-Delta32,inTrends Genet.,vol. 22, n. 6, giugno 2006, pp. 293–6,DOI:10.1016/j.tig.2006.04.007,PMID16678299.
- ^Glass WG, McDermott DH, Lim JK, Lekhong S, Yu SF, Frank WA, Pape J, Cheshier RC, Murphy PM,CCR5 deficiency increases risk of symptomatic West Nile virus infection,inJ. Exp. Med.,vol. 203, n. 1, gennaio 2006, pp. 35–40,DOI:10.1084/jem.20051970,PMC2118086,PMID16418398.
- ^Duncan SR, Scott S, Duncan CJ,Reappraisal of the historical selective pressures for the CCR5-Delta32 mutation,inJ. Med. Genet.,vol. 42, n. 3, marzo 2005, pp. 205–8,DOI:10.1136/jmg.2004.025346,PMC1736018,PMID15744032.
- ^Sabeti PC, Walsh E, Schaffner SF, Varilly P, Fry B, Hutcheson HB, Cullen M, Mikkelsen TS, Roy J, Patterson N, Cooper R, Reich D, Altshuler D, O'Brien S, Lander ES,The case for selection at CCR5-Delta32,inPLoS Biol.,vol. 3, n. 11, novembre 2005, pp. e378,DOI:10.1371/journal.pbio.0030378,PMC1275522,PMID16248677.
- ^Delta32 Genetic Testing(PDF), suBriefing paper for AFAO members,Australian Federation of AIDS Organisations, 1º giugno 2007.URL consultato il 22 gennaio 2011(archiviato dall'url originaleil 19 marzo 2012).
- ^abSteinberger P, Andris-Widhopf J, Bühler B, Torbett BE, Barbas CF,Functional deletion of the CCR5 receptor by intracellular immunization produces cells that are refractory to CCR5-dependent HIV-1 infection and cell fusion,inProc. Natl. Acad. Sci. U.S.A.,vol. 97, n. 2, gennaio 2000, pp. 805–10,DOI:10.1073/pnas.97.2.805,PMC15412,PMID10639161.
- ^Schoofs M,A Doctor, a Mutation and a Potential Cure for AIDS,inThe Wall Street Journal,7 novembre 2008.URL consultato il 15 dicembre 2010.
- ^abHütter G, Nowak D, Mossner M, Ganepola S, Müssig A, Allers K, Schneider T, Hofmann J, Kücherer C, Blau O, Blau IW, Hofmann WK, Thiel E,Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation,inN. Engl. J. Med.,vol. 360, n. 7, febbraio 2009, pp. 692–8,DOI:10.1056/NEJMoa0802905,PMID19213682.
- ^Agrawal L, Lu X, Qingwen J, VanHorn-Ali Z, Nicolescu IV, McDermott DH, Murphy PM, Alkhatib G,Role for CCR5Delta32 protein in resistance to R5, R5X4, and X4 human immunodeficiency virus type 1 in primary CD4+ cells,inJ. Virol.,vol. 78, n. 5, marzo 2004, pp. 2277–87,DOI:10.1128/JVI.78.5.2277-2287.2004,PMC369216,PMID14963124.
- ^Allers K, Hütter G, Hofmann J, Loddenkemper C, Rieger K, Thiel E, Schneider T,Evidence for the cure of HIV infection by CCR5Δ32/Δ32 stem cell transplantation,inBlood,vol. 117, n. 10, dicembre 2010, pp. 2791–2799,DOI:10.1182/blood-2010-09-309591,PMID21148083.
- ^Autologous T-Cells Genetically Modified at the CCR5 Gene by Zinc Finger Nucleases SB-728 for HIV (Zinc-Finger),suclinicaltrials.gov,U.S. National Institutes of Health, 9 dicembre 2009.URL consultato il 30 dicembre 2009.
- ^Nicholas Wade,Zinc Fingers Could Be Key to Reviving Gene Therapy,inThe New York Times,28 dicembre 2009.URL consultato il 30 dicembre 2009.
Bibliografia
[modifica|modifica wikitesto]- Wilkinson D,Cofactors provide the entry keys. HIV-1,inCurr. Biol.,vol. 6, n. 9, 1997, pp. 1051–3,DOI:10.1016/S0960-9822(02)70661-1,PMID8805353.
- Broder CC, Dimitrov DS,HIV and the 7-transmembrane domain receptors,inPathobiology,vol. 64, n. 4, 1997, pp. 171–9,DOI:10.1159/000164032,PMID9031325.
- Choe H, Martin KA, Farzan M, Sodroski J, Gerard NP, Gerard C,Structural interactions between chemokine receptors, gp120 Env and CD4,inSemin. Immunol.,vol. 10, n. 3, 1998, pp. 249–57,DOI:10.1006/smim.1998.0127,PMID9653051.
- Sheppard HW, Celum C, Michael NL, O'Brien S, Dean M, Carrington M, Dondero D, Buchbinder SP,HIV-1 infection in individuals with the CCR5-Delta32/Delta32 genotype: acquisition of syncytium-inducing virus at seroconversion,inJ. Acquir. Immune Defic. Syndr.,vol. 29, n. 3, 2002, pp. 307–13,PMID11873082.
- Freedman BD, Liu QH, Del Corno M, Collman RG,HIV-1 gp120 chemokine receptor-mediated signaling in human macrophages,inImmunol. Res.,vol. 27, 2–3, 2004, pp. 261–76,DOI:10.1385/IR:27:2-3:261,PMID12857973.
- Esté JA,Virus entry as a target for anti-HIV intervention,inCurr. Med. Chem.,vol. 10, n. 17, 2004, pp. 1617–32,DOI:10.2174/0929867033457098,PMID12871111.
- Gallo SA, Finnegan CM, Viard M, Raviv Y, Dimitrov A, Rawat SS, Puri A, Durell S, Blumenthal R,The HIV Env-mediated fusion reaction,inBiochim. Biophys. Acta,vol. 1614, n. 1, 2003, pp. 36–50,DOI:10.1016/S0005-2736(03)00161-5,PMID12873764.
- Zaitseva M, Peden K, Golding H,HIV coreceptors: role of structure, posttranslational modifications, and internalization in viral-cell fusion and as targets for entry inhibitors,inBiochim. Biophys. Acta,vol. 1614, n. 1, 2003, pp. 51–61,DOI:10.1016/S0005-2736(03)00162-7,PMID12873765.
- Lee C, Liu QH, Tomkowicz B, Yi Y, Freedman BD, Collman RG,Macrophage activation through CCR5- and CXCR4-mediated gp120-elicited signaling pathways,inJ. Leukoc. Biol.,vol. 74, n. 5, 2004, pp. 676–82,DOI:10.1189/jlb.0503206,PMID12960231.
- Yi Y, Lee C, Liu QH, Freedman BD, Collman RG,Chemokine receptor utilization and macrophage signaling by human immunodeficiency virus type 1 gp120: Implications for neuropathogenesis,inJ. Neurovirol.,10 Suppl 1, 2004, pp. 91–6,PMID14982745.
- Seibert C, Sakmar TP,Small-molecule antagonists of CCR5 and CXCR4: a promising new class of anti-HIV-1 drugs,inCurr. Pharm. Des.,vol. 10, n. 17, 2004, pp. 2041–62,DOI:10.2174/1381612043384312,PMID15279544.
- Cutler CW, Jotwani R,Oral mucosal expression of HIV-1 receptors, co-receptors, and alpha-defensins: tableau of resistance or susceptibility to HIV infection?,inAdv. Dent. Res.,vol. 19, n. 1, 2006, pp. 49–51,DOI:10.1177/154407370601900110,PMID16672549.
- Ajuebor MN, Carey JA, Swain MG,CCR5 in T cell-mediated liver diseases: what's going on?,inJ. Immunol.,vol. 177, n. 4, 2006, pp. 2039–45,PMID16887960.
- Lipp M, Müller G,Shaping up adaptive immunity: the impact of CCR7 and CXCR5 on lymphocyte trafficking,inVerhandlungen der Deutschen Gesellschaft für Pathologie,vol. 87, 2006, pp. 90–101,PMID16888899.
- Balistreri CR, Caruso C, Grimaldi MP, Listì F, Vasto S, Orlando V, Campagna AM, Lio D, Candore G,CCR5 receptor: biologic and genetic implications in age-related diseases,inAnn. N. Y. Acad. Sci.,vol. 1100, 2007, pp. 162–72,DOI:10.1196/annals.1395.014,PMID17460174.
- Madsen HO, Poulsen K, Dahl O, Clark BF, Hjorth JP,Retropseudogenes constitute the major part of the human elongation factor 1 alpha gene family,inNucleic Acids Res.,vol. 18, n. 6, 1990, pp. 1513–6,DOI:10.1093/nar/18.6.1513,PMC330519,PMID2183196.
- Uetsuki T, Naito A, Nagata S, Kaziro Y,Isolation and characterization of the human chromosomal gene for polypeptide chain elongation factor-1 alpha,inJ. Biol. Chem.,vol. 264, n. 10, 1989, pp. 5791–8,PMID2564392.
- Whiteheart SW, Shenbagamurthi P, Chen L, Cotter RJ, Hart GW,Murine elongation factor 1 alpha (EF-1 alpha) is posttranslationally modified by novel amide-linked ethanolamine-phosphoglycerol moieties. Addition of ethanolamine-phosphoglycerol to specific glutamic acid residues on EF-1 alpha,inJ. Biol. Chem.,vol. 264, n. 24, 1989, pp. 14334–41,PMID2569467.
- Ann DK, Wu MM, Huang T, Carlson DM, Wu R,Retinol-regulated gene expression in human tracheobronchial epithelial cells. Enhanced expression of elongation factor EF-1 alpha,inJ. Biol. Chem.,vol. 263, n. 8, 1988, pp. 3546–9,PMID3346208.
- Brands JH, Maassen JA, van Hemert FJ, Amons R, Möller W,The primary structure of the alpha subunit of human elongation factor 1. Structural aspects of guanine-nucleotide-binding sites,inEur. J. Biochem.,vol. 155, n. 1, 1986, pp. 167–71,DOI:10.1111/j.1432-1033.1986.tb09472.x,PMID3512269.
Voci correlate
[modifica|modifica wikitesto]Collegamenti esterni
[modifica|modifica wikitesto]- UniProt,suUniProt.URL consultato il 20 agosto 2023.
