Cromato


Ilcromatoè l'anione,derivante dalladissociazionedell'acido cromico,insoluzione acquosaè inequilibriocon ilbicromatoodicromato:
In entrambe le specie lostato di ossidazionedel cromo è +6 e sono quelle cui fa riferimento la dicituracromo esavalente,nota ai più per i casi diinquinamentoambientale.
La presenza di cromato o di dicromato è strettamente legata alpH:in ambientebasicopredomina il cromato (giallo) mentre ad alti valori diattivitàidrogenionica(pH inferiore a 7) prevale il dicromato di colore arancione.
Preparazione
[modifica|modifica wikitesto]Icomposticontenenti questi anioni vengono generalmente preparati perossidazionedelcromotrivalente:
Reattività
[modifica|modifica wikitesto]Cromati e dicromati sono energiciossidanti(Eº=1,33V)e per questo hanno un largo utilizzo inlaboratoriodi sintesi eanalisi.
Insieme alpermanganatoil dicromato è uno dei reattivi principali nelletitolazioniredox.Le titolazionidicromatometriche,al contrario di quellepermanganometriche,necessitano l'utilizzo diindicatoripoiché la riduzione del dicromato porta alla formazione di Cr3+,il quale dà alla soluzione un colore verde poco intenso. Tra gli indicatori più utilizzati:ferroina,acidoN-fenilantranilicoedifenilamminosolfonato.
Il cromato forma conAg+unsaleinsolubileche viene sfruttato per la determinazione del punto finale nell'argentometria secondo Mohr.Il cromo(VI) è in grado di ossidare ladifenilcarbazide.I prodotti della reazione di ossidoriduzione, Cr(III) e difenilcarbazone, reagiscono tra loro formando un complesso color magenta utilizzato nell'analisi spettrofotometrica.
I composti utilizzati sono generalmente i salipotassici.
I cromati e i bicromati reagiscono con l'acqua ossigenata H2O2sia in ambiente alcalino, che in ambiente acido, dando prodotti in cui una o più unità perossidiche [-O–O-] vanno a sostituire uno o più ossigeni [-O-][1].In soluzione acida si forma subito il perossocomplesso CrO5azzurro scuro, ossia O=Cr(O2)2;questo in soluzione acquosa è piuttosto instabile ma, essendo neutro e unacido di Lewis,può venire estratto inetereche con esso forma un labileaddotto.Questo procedimento costituisce anche un saggio di riconoscimento di cromati e bicromati (Barresville)[2].Aggiungendopiridina,che è unabase di Lewismigliore, questa sposta l'etere dando uncomplessodello stesso tipo, ma più stabile.
Struttura
[modifica|modifica wikitesto]Lo ione cromato ètetraedrico:
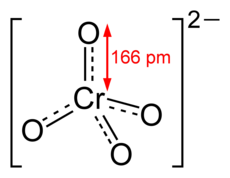
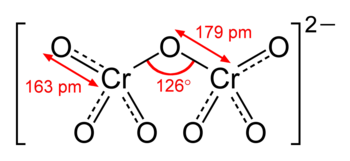
Il dicromato è formato da due tetraedri che hanno un vertice in comune (l'ossigeno a ponte dellegameCr−O−Cr):
Note
[modifica|modifica wikitesto]- ^F.A. Cotton e G. Wilkinson,ADVANCED INORGANIC CHEMISTRY,Fifth Edition, Wiley Interscience, 1988, pp.695-6,ISBN0-471-84997-9.
- ^G. Gioia Lobbia e G. Novara,ANALISI QUALITATIVA E COMPLEMENTI DI CHIMICA,Bulgarini, 1988, p. 253.
Bibliografia
[modifica|modifica wikitesto]- I. Bertinie F. Mani,Chimica Inorganica,CEDAM,ISBN88-13-16199-9.
- G. D. Christian,Chimica analitica,Piccin,ISBN88-299-0464-3.
Voci correlate
[modifica|modifica wikitesto]Altri progetti
[modifica|modifica wikitesto] Wikimedia Commonscontiene immagini o altri file sucromato
Wikimedia Commonscontiene immagini o altri file sucromato
| Controllo di autorità | Thesaurus BNCF32178 |
|---|



