Fingolimod
| Fingolimod | |
|---|---|
 | |
 | |
| NomeIUPAC | |
| 2-amino-2-[2-(4-octilfenil)etil]propan-1,3-diolo idrocloruro | |
| Caratteristiche generali | |
| Formula brutaomolecolare | C19H33NO2 |
| Massa molecolare(u) | 307.471 g/mol |
| Numero CAS | |
| Codice ATC | L04 |
| PubChem | 107970 |
| DrugBank | DBDB08868 |
| SMILES | CCCCCCCCC1=CC=C(C=C1)CCC(CO)(CO)N |
| Dati farmacologici | |
| Modalità di somministrazione | Orale |
| Dati farmacocinetici | |
| Emivita | ore |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315-319-335-412 |
| Consigli P | 261-273-305+351+338[1] |
IlFingolimod(INNcon il nome in codiceFTY720) è un farmaco ad azioneimmunosoppressiva,che venne dato in licenza dallaMitsubishi Tanabe Pharma Corporation[2]e successivamente sviluppato nei laboratori dellaNovartisInternational AG[3],che ha aperto un nuovo e promettente approccio terapeutico nellasclerosi multipla(SM).[4]
Esso deriva dalmiriocinomyrocin[5](ISP-1) che è un metabolita dai funghiIsaria sinclairiieMyrothecium verrucaria.[6] Si tratta di una struttura analoga allasfingosinache vienefosforilatadallesfingosinakinasidella cellula (soprattutto la sfingosina chinasi 2).[7][8][9]
Il farmaco agirebbe sequestrando ilinfocitideilinfonodi,impedendo loro di migrare nelsistema nervosocentrale per determinare le risposte autoimmuni come accade nella sclerosi multipla. Esso è stato originariamente proposto come unfarmaco antirigetto,indicato nel decorso del post-trapianto.
Il fingolimod è unprofarmaco.[10]Si ritiene che il meccanismo d'azione del metabolita attivo (fosfo-fingolimod), sia dovuto alla sua attività modulatrice su uno dei cinque recettori della sfingosina-1-fosfato: l'S1PR1.[11].
È stata evidenziata per il fingolimod un'azione stimolante sul processo di riparazione delle celluleglialie delle cellule precursori dopo un insulto; sono inoltre riportati per il farmaco effetti di antagonista sul recettore deicannabinoidi[12]e di inibitore dellaPLAc[13]ed anche un effetto inibitore dellaceramidesintetasi.[14]
Caratteristiche strutturali e fisiche
[modifica|modifica wikitesto]Il fingolimod cloridrato è una polvere praticamente bianca facilmente solubile in acqua, in alcool eglicole propilenico.Ha un peso molecolare di 343,93.
Diversi studi hanno descritto la sintesi chimica del farmaco e dei suoi analoghi.[15] Già nel 1999 ricercatori giapponesi hanno individuato nella dimensione dei gruppialchilicie nella configurazione assoluta delcarbonioquaternario la capacità di determinare l'attività immunosoppressiva.[16]
Studi distructure-activity relationship(SAR), fatti sugli omologhi e sui derivati parzialmente sintetici del myriocin, hanno mostrato che la configurazione del carbonio posto tra il gruppo 3-idrossi e il 14-chetone, il doppio legame in posizione 6, e il gruppo 4-idrossi, non erano importanti per la sua attività; così si è pensato alla semplificazione della struttura nel tentativo di ridurre la tossicità e migliorare la maneggevolezza del farmaco.[17]
Il fingolimod (2-amino-2-[2 - (4-ottile-fenil) etil] -1,3-propandiolo cloridrato) è un analogo sintetico strutturale di S1P, unliso-fosfolipidenaturale.[18]
Storia
[modifica|modifica wikitesto]
Nel 1992 un gruppo di ricerca giapponese ha individuato un principio attivo di origine naturale ad azione immunosoppressiva, il myriocin (ISP-I),[6][19]dal quale si è ottenuto con modifiche chimiche il FTY720 (Fingolimod), caratterizzato da migliore tollerabilità.
Il Myriocin è stato isolato da un brodo di coltura di un tipo di funghi entomopatogeni (sinclairii Isaria), tradizionalmente usati nella medicina popolare cinese come elisir di lunga vita.[20] I risultati dei primi test in vitro (test direazione linfocitaria mista) e lo screening in vivo sul ratto con un modello sperimentale sul tempo di sopravvivenza delle cellule cutanee (skin graft) hanno dimostrato la notevole azione immunosoppressiva di questo farmaco.[21]
La molecola di fingolimod fu sintetizzata, per la prima volta, da ricercatori dellaYoshitomi Pharmaceuticalsnel 1995; nel 1997 la società giapponese cede il brevetto allaNovartis.[22] Il farmaco venne inizialmente utilizzato in test clinici in combinazione con laciclosporinaper sopprimere la reazione dirigettodopotrapianto renale.
Il 22 settembre 2010 il fingolimod è diventato il primo farmaco orale approvato dallaFood and Drug Administrationcon il nomeGilenya,capace di ridurre le recidive e la progressione della disabilità nei pazienti con forme recidivanti disclerosi multipla.[23]
Il farmaco, dopo solo 3 mesi dal suo lancio negli Stati Uniti, ha realizzato vendite per 13 milioni di dollari, con più di duemila pazienti trattati e mille medici prescrittori.[24]Alcuni medici dellaCleveland Clinic,uno dei centri al mondo più importanti nel campo della ricerca medica, hanno inserito il fingolimod tra le innovazioni di maggior impatto in campo sanitario per il 2010.[25]
Il 20 gennaio 2011 ilCommittee for Medicinal Products for Human UseCHMPdell'EMAha espresso parere positivo all'approvazione di fingolimod,[26]che così diventerà la prima terapia orale per la sclerosi multipla (SM) approvata nei paesi dell'Unione europea.Il parere positivo si applica alla terapia dei pazienti con sclerosi multipla di tipo recidivante-remittente (la più frequente) ad alta attività di malattia nonostante il trattamento coninterferone betao di pazienti con sclerosi multipla recidivante-remittente grave a rapida evoluzione.
Il parere positivo definitivo dell'EMA è previsto dopo tre mesi l'approvazione dell'EMA. Germania, Regno Unito, Francia, Paesi Bassi e Italia dovrebbero essere i primi paesi europei in cui il farmaco sarà disponibile. In Italia la commercializzazione è prevista entro la fine del 2011.[24]
Il 9 marzo 2011 il Ministero della Salute canadese ha approvato il fingolimod come terapia di seconda linea nei soggetti che non rispondono o sono intolleranti a terapie per la SM; il farmaco sarà reperibile in farmacia in Canada dal 1º aprile 2011.[27]
Il 17 marzo 2011 la Commissione Europea,[28]facendo seguito al parere positivo espresso in data 21 gennaio 2011 dal comitato dell'agenzia europea del farmaco per i prodotti medicinali per uso umano, ha approvato definitivamente il farmaco Gilenya® (fingolimod) al dosaggio giornaliero di 0,5 mg come terapia della sclerosi multipla recidivante-remittente nei soggetti resistenti all'interferon-beta o nei soggetti con forme di malattia recidivante-remittente grave a rapida evoluzione.[29]
Nel settembre 2011 ilGileniadi Novartis è stato approvato in Giappone per la prevenzione delle ricadute e per ritardare la progressione della disabilità fisica negli adulti con sclerosi multipla (SM).[30]
InGran BretagnailNICE(National Institute for Health and Clinical Excellence) nel dicembre 2011 ha negato la rimborsabilità al farmaco ritenendo le prove fin qui prodotte dalla Novartis insufficienti a dimostrare il vantaggio terapeutico rispetto alla terapia solitamente usata sui parametri standard di costo/beneficio (QUALY e ICER).[31]Nell'aprile 2012 il NICE emetterà un parere definitivo l'inserimento del farmaco nel prontuario inglese dopo una pubblica consultazione con tutte le parti interessante quali associazioni di pazienti, azienda produttrice, ecc.[32]
Al gennaio 2012 sono circa 25 000 i pazienti trattati con il farmaco, che pare abbia dimezzato il tasso di ricadute ad un anno.[33]
In Italia
[modifica|modifica wikitesto]L'Italia ha partecipato all'arruolamento di 250 pazienti nello studio internazionaleTRANSFORMS,primo trial di confronto diretto con un trattamento standard per lasclerosi multiplache ha coinvolto 172 centri di 18 Paesi.[34] Lo studio era concepito:
- trattamento con gruppo di controllo attivo (Interferon beta-1a);
- Endpoint primario: studio di sicurezza ed efficacia;
- Modello dello studio: Gruppi in parallelo, mascherati, in doppio cieco.
Il titolo ufficiale dello studio, che ha coinvolto 22 centri in Italia,[35]è:A 12-month Study Comparing the Efficacy and Safety of Two Doses of Fingolimod Versus Interferon β-1a in Patients With Relapsing-remitting Multiple Sclerosis With Optional Extension Phase;questo studio ha generato 2 importanti pubblicazioni scientifiche.[36][37]
A partire dal 7 dicembre 2011[38]il fingolimod, in confezione da 28 capsule, diventa prescrivibile con nota (nota n. 65) e rimborsato dal SSN italiano, con un prezzo per ogni confezione di 2970,72. €.[39] L'indicazione ufficialmente approvata nella G. U. n. 272 del 22 novembre 2011 è:[38]
«Il dosaggio giornaliero di fingolimod è 0,5 mg come terapia per la SM nelle persone con sclerosi multipla recidivante-remittente ad alta attività di malattia nonostante il trattamento con interferone beta, o in persone con sclerosi multipla recidivante-remittente grave a rapida evoluzione.»
Farmacocinetica
[modifica|modifica wikitesto]Assorbimento
[modifica|modifica wikitesto]IlTmaxdel fingolimod è di 12-16 ore, mentre labiodisponibilitàorale è del 93%. Il cibo non interferisce con l'assorbimento. Losteady-stateplasmaticoè raggiunto dopo circa 1-2 mesi di somministrazione orale una volta al giorno, con una concentrazione plasmatica all'equilibrio pari a circa 10 volte quella della dose iniziale.[40]
Distribuzione
[modifica|modifica wikitesto]Il fingolimod è molto ben distribuito neiglobuli rossi;il fingolimod-fosfato è captato per il 17% nei globuli rossi ed entrambi sono legati alleproteinedel plasma per il 99.7%; questo legame non è modificato dall'insufficienza epatica o renale. Ha un volume apparente di distribuzione di 1200±260 L e presenta una distribuzione uniforme in tutti i tessuti.[41]
Metabolismo
[modifica|modifica wikitesto]La biotrasformazione del farmaco nei soggetti umani segue 3 vie metaboliche:
- fosforilazionestereoselettivadell'enantiomeroattivo di fingolimod-fosfato.
- biotrasformazioneossidativaattraverso ilcitocromoP450 con l'isoenzima4F2, e con conseguente degradazione degli acidi grassi a metaboliti inattivi.
- formazione di metaboliti farmacologicamente inattivi, analoghi deiceramidinonpolaridi fingolimod. Il farmaco è metabolizzato soprattutto dal CYP4F2, ed in misura minore dagli isoenzimi CYP2D6, 2E1, 3A4, and 4F12. Il metabolismo del fingolimod non sostanzialmente alterato dalla presenza di sostanze inibitrici di singoli isoenzimi citocromiali.
Con la somministrazione di farmaco marcato con14C, questo si ritrova (dopo 816 ore) come tale nel plasma nel 23.3%, come fingolimod fosfato nel 10,3%, e come metaboliti inattivi nell'8,3%.[40]
Eliminazione
[modifica|modifica wikitesto]Laclearancedel fingolimod è di 6.3±2.3 L/h, con unaemivitaterminale di 6-9 giorni. Dopo singola dose orale l'81% del farmaco viene escreto con le urine sotto forma di metaboliti inattivi, mentre il fingolimod-fosfato viene interamente escreto con le feci.[40]
Farmacodinamica
[modifica|modifica wikitesto]Il S1P interagisce con 5 sottotipi conosciuti dei recettori del S1P (S1P 1-5), questi sono presenti in tutto l'organismo, ciò spiega la varietà di processi fisiologici cui sono coinvolti naturalmente i recettori S1Ps.[42] I recettori S1P 1-3 si trovano nel sistema cardiovascolare, nel sistema nervoso centrale e nel sistema immunitario. L'attivazione di questi recettori sulla muscolatura liscia e nelle cellule endoteliali vascolari regola l'omeostasi della permeabilità cellulare delle cellule endoteliari. L'attivazione dei recettori S1P 1 sumiocitiatrialiregola lafrequenza cardiaca.Il recettore S1P 4 è generalmente presente nei tessutiemopoieticie nei linfoidi, mentre il S1P 5 si esprime nella sostanza bianca del sistema nervoso centrale (SNC).[42]
Il farmaco fingolimod (FTY720) è un profarmaco che viene fosforilato in vivo dalla sfingosina chinasi a fingolimod-fosfato, che è il composto farmacologicamente attivo. Esso è noto si lega a 4 dei 5 recettori S1P (S1P1,2,3,4)[43]ed agendo come antagonista di questi sottotipi recettoriali, impedisce ai linfociti di spostarsi dagli organi linfoidi al sistema nervoso centrale.[44]
Il legame in particolare con il recettore S1P1 blocca l'internalizzazione del recettore, il farmaco inibisce la migrazione dei linfociti provocata dal S1P; il legame con S1P uno è di particolare importanza per il meccanismo di azione di Fingolimod nella sclerosi multipla. Il S1P 1 è altamente espresso sui linfociti T e B ed è responsabile della regolazione della uscita di linfociti da tessuto linfoide. Il legame di fingolimod-fosfato con il S1P 1 porta alla down-regolazione del recettore e la conseguente sequestro dei linfociti nei tessuti linfatici, prevenendo il loro riciclo e riducendone la conta dei linfociti periferici.[5][43] Si presume che il fingolimod (FTY720), grazie al suo metabolita attivo(S)-FTY720-P, induca sequestro dei linfociti per l'inibizione dell'espressione del recettore S1P/S1P1-dependente dei linfociti dai tessuti dei linfoidi secondari e dal timo. Interessante il fatto che il farmaco non distrugge nessuna popolazione linfocitaria.[42][45]
La funzione immunitaria che si basa sucellule Tnaive e cellule della memoria centrale, come nel caso di alcune infezioniviralie nel comune raffreddore, può essere ridotta o ritardata. Nella SM la teoria più accreditata ritiene che una penetrazione autoaggressiva dilinfocitinelsistema nervoso centralecontribuisce all'infiammazione e ai danni neurali che si creano nella malattia. Il fingolimod è capace di sequestrare i linfociti nei tessuti linfoidi. Inoltre i recettori S1P 1, soprattutto espressi nel sistema nervoso centrale, hanno dimostrato di modulare la neurogenesi e la funzione neurale. Fingolimod ha dimostrato di attraversare labarriera emato-encefalicain modelli animali accumulandosi nellasostanza biancadel sistema nervoso centrale.[46]Pertanto, il fingolimod può avere la capacità di facilitare il ripristino della funzionalità delle cellule nervose e anche di una riparazione endogena come supplemento del SNC in pazienti con SM.[42]
Il fingolimod agisce sequestrando ilinfocitineilinfonodiin modo selettivo e reversibile, riducendone il numero di quelli che riescono a raggiungere ilSNC,dove possono scatenare una reazione infiammatoria che è causa della malattia. Quando il trattamento viene interrotto il numero dei linfociti torna al valore iniziale.[47]
Clinica
[modifica|modifica wikitesto]Il FTY720 mostra essere altamente efficace su modelli ditrapiantoallogenicosperimentale e su modelli dimalattie autoimmunicome l'encefalomieliteautoimmune, l'artritecollagene-indotta, enefrite lupica.[5] Poiché il fingolimod possiede un nuovo meccanismo d'azione mai osservato prima con altri farmaci immunosoppressivi, si ritiene questa sostanza possa permettere un nuovo originale approccio terapeutico per le malattie autoimmuni ed in particolare per la sclerosi multipla.[5]
Sclerosi multipla
[modifica|modifica wikitesto]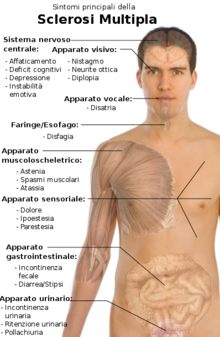

Uno studio di fase II ha confrontato l'efficacia e la sicurezza a 6 mesi di due dosi di FTY720 (1,25 mg e 5 mg) verso placebo. La dose di 1,5 mg è stata efficace come quella da 5 mg, con minori effetti collaterali. Inoltre, i segni dell'infiammazione alla risonanza magnetica sono state significativamente meno presenti e le recidive sono state inferiori rispetto al gruppo placebo.[48]
Il farmaco è stato studiato in due importanti trials sovranazionali (mega-trials), che sono: il TRANSFORMS[36][37]e il FREEDOMS.[49] I risultati positivi dei due studi hanno fornito una conoscenza completa dell'efficacia e tollerabilità di fingolimod.[50]
- Lo studio internazionale TRANSFORMS prevedeva una somministrazione settimanale di Interferone beta-1a per via intramuscolare (Avonex) confrontata con dosi di FTY720 a 12 mesi. Sono stati arruolati 1.292 pazienti con sclerosi multipla recidivante. La riduzione della percentuale di recidive è stata del 52% (nel gruppo 0,5 mg) e del 32% (nel gruppo 1,25 mg) rispetto al gruppo trattato con interferone. Inoltre, il Fingolimod è stato generalmente ben tollerato, sebbene le infezioni delle alte vie respiratorie e la stanchezza si sono verificate più frequentemente che nel gruppo interferone, mentre la malattia simil-influenzale sono stati più numerosi quest'ultimo.[51]
- Lo studio FREEDOMS ha incluso 1.272 pazienti ed è durato per oltre 24 mesi, ha confrontato l'efficacia di FTY720 a due diversi dosaggi (1,25 e 0,5 mg) contro placebo. Il tasso di recidive rispetto al gruppo placebo è diminuito del 54% (nel gruppo 0,5 mg) e il 60% (nel gruppo 1,25 mg), mentre la progressione della disabilità nell'arco di 24 mesi è stato rallentato del 30% (nel gruppo 0,5 mg) e del 32% (nel gruppo 1,25 mg).[52]
Negli studi clinici, il trattamento con fingolimod ha determinato una riduzione statisticamente significativa delle lesioni attive rilevate allarisonanza magnetica(RMN), è questo un dato oggettivo.
Il profilo di sicurezza e tollerabilità del farmaco è stato studiato in oltre 2.600 pazienti, alcuni dei quali sono arrivati al settimo anno di trattamento, per un totale di oltre 4.500 pazienti/anno di esposizione al farmaco.
Dati preliminari prodotti da uno studio pubblicato nell'aprile 2010[53]suggerirebbero come il fingolimod può aver un ruolo nel rafforzare il processo di rimielinizzazione nel SNC. Infatti, il trattamento con fingolimod somministrato sperimentalmente successivamente alla demielinizzazione indotta su cellule (gliali) del SNC con perdita dimielinae morte deglioligodendrociti,ha migliorato il fenomeno della rimielinizzazione. In particolare l'attività del farmaco si è estesa alle cellule OPC e agli oligodendrociti maturi, inoltre ha svolto attività anche a livello di altre cellule gliali. Il legame del fingolimod al suo recettore specifico, S1P, spiegherebbe i suoi effetti rimielinizzanti essendo questi mediati principalmente attraverso dei sottotipi del recettore S1P1 e S1P5.
Trapianto renale
[modifica|modifica wikitesto]Il fingolimod è attivamente studiato in modelli umani in vitro e animali ditrapianto renale.[54][55][56]
In uno studio clinico di fase III di trapianto renale il fingolimod non è risultato essere superiore rispetto al gruppo di controllo conmicofenolato mofetile.[55]
Il fingolimod è stato testato in combinazione con laciclosporinaper evitare la reazione da rigetto conseguente al trapianto renale. Nella fase di sperimentazione clinica di fase III ha mostrato, tuttavia, degli effetti collaterali oculari (edema maculare),[57]in particolare nei pazientidiabeticicon predisposizione allaretinopatia diabetica.
Indicazioni
[modifica|modifica wikitesto]Approvate
[modifica|modifica wikitesto]Secondo il foglietto illustrativo approvato dallaFood and Drug Administrationstatunitense:
«Il fingolimod è un modulatore dei recettori della sfingosina 1-fosfato ed è indicato per il trattamento di pazienti con forme recidivanti di sclerosi multipla per ridurre la frequenza delle esacerbazioni cliniche e di ritardare l'accumulo di disabilità fisica.[58]»
Nel settembre 2011 l'FDA ha approvato il farmaco per il trattamento delle forme di Sclerosi Multipla recidivanti, come trattamento di prima linea, alla dose di 0.5 mg al giorno.[59]
Secondo il foglietto illustrativo dell'Agenzia europea per i medicinali:[60]
«Gilenya è indicato in monoterapia, come farmaco modificante la malattia, nella sclerosi multipla: recidivante-remittente ad elevata attività nei seguenti gruppi di pazienti adulti:
- Pazienti con una elevata attività di malattia nonostante la terapia con interferone-beta.
- Questi pazienti possono essere definiti come coloro che non hanno risposto ad un ciclo terapeutico completo ed adeguato (normalmente almeno un anno di trattamento) con interferone beta. I pazienti devono avere avuto almeno 1 recidiva nell'anno precedente mentre erano in terapia, e presentare almeno 9 lesioni iperintense in T2 alla RM cerebrale o almeno 1 lesione captante gadolinio. Un paziente non responder può anche essere definito come un paziente che presenta, rispetto all'anno precedente, un tasso di recidive invariato o aumentato o che presenta recidive gravi.
oppure:
- Pazienti con sclerosi multipla recidivante-remittente grave ad evoluzione rapida, definita
- da due o più recidive disabilitanti in un anno, e con 1 o più lesioni captanti gadolinio alla RM cerebrale
- con un aumento significativo del carico lesionale in T2 rispetto ad una precedente RM recentemente effettuata.»
Off-label
[modifica|modifica wikitesto]Uno studio del 2013, in modo preliminare, mostra un potenziale utilizzo del farmaco neltumore del colonassociato acolite.[61]
Effetti collaterali
[modifica|modifica wikitesto]Gli effetti collaterali più frequenti del farmaco sono:[26]
- cefalea,
- incremento deglienzimi epatici,
- influenza,
- diarrea,
- mal di schiena e
- tosse.
Altri effetti del fingolimod sono:
- riduzione della frequenza cardiaca eblocco atrio-ventricolare,transitori e generalmente asintomatici,[62]all'inizio del trattamento,
- lieve aumento della pressione arteriosa,[63]
- edema maculare[49]e
- lieve broncocostrizione.[64]
Il tasso complessivo diinfezioni,comprese quelle gravi, è stato simile nei vari gruppi di trattamento. Si è, però, osservato un lieve aumento di infezioni delle vie respiratorie inferiori (principalmente bronchiti).[64]
Il numero dineoplasieriportato è comparabile tra i gruppi di pazienti trattati con fingolimod e i gruppi di controllo.[65] Nei tumori epiteliali ha mostrato un basso potenziale oncogenico.[66] Uno studio indica che il fingolimod può avere anche un ruolo potenziale come farmaco anticancro.[67]
Il fingolimod è stato associato ad infezioni potenzialmente fatali ed anchebradicardia,cancro della pelle e, recentemente, un caso diencefalitefocaleemorragica.Due soggetti sono deceduti, uno a causa di un'infezione cerebrale daherpesvirused un secondo paziente a causa di unozoster;anche se non è chiaro se il farmaco sia stato responsabile di questi eventi.[68]
Tossicologia
[modifica|modifica wikitesto]Controindicazioni
[modifica|modifica wikitesto]Nessuna controindicazione nota.[40]
Dosi terapeutiche
[modifica|modifica wikitesto]La dose raccomandata di fingolimod è di 0,5 mg, da assumersi per via orale una volta al giorno. Dopo la somministrazione della prima dose, i pazienti devono essere osservati per 6 ore allo scopo di controllare segni e sintomi dibradicardia. Il fingolimod può essere assunto con o senza cibo.[40]
Sovradosaggio
[modifica|modifica wikitesto]L'assunzione di dosi superiori a 0.5 mg è associata a una maggiore incidenza di reazioni avverse, senza che si registrino benefici aggiuntivi.[40]
Gravidanza e allattamento
[modifica|modifica wikitesto]Il fingolimod può essere usato ingravidanzasolo se il potenziale beneficio giustifica il rischio potenziale per ilfeto.[40]
Nell'allattamento l'assunzione del farmaco va evitata.[40]
Avvertenze
[modifica|modifica wikitesto]L'EMEAdetta le norme per l'uso del farmaco in questo documento, dal titolo: "Condizioni o restrizioni per quanto riguarda l'uso sicuro ed efficace del medicinale che devono essere implementate in ciascun stato membro."[69]
Tra queste: l'uso del farmaco richiede alla prima somministrazione un controllo del soggetto per 6 ore inDay Hospital,in modo da verificare cambiamenti della frequenza cardiaca sempre possibili con il farmaco; inoltre il soggetto va preliminarmente studiato con: l'esecuzione di unECG secondo Holterper 24 ore, esami ematochimici, visita dermatologica e oculistica, ed altro.[70]
È stato segnalato il primo caso di morte conseguente all'assunzione di figolimod da parte delNeLM news serviceorganizzazione delNational Health Serviceinglese, anche se la relazione di causa ed effetto non è stata ben stabilita.[71]Successivamente è stato riportato un altro caso.[72]
Procedura di revisione
[modifica|modifica wikitesto]In data 20 gennaio 2012 l'EMA, con il suo Comitato Scientifico per i Prodotti Medicinali per Uso Umano (CHMP) ha iniziato una revisione, che si concluderà a marzo del 2012, del rischio e dei vantaggi del farmaco sottolineando la necessità di un attento monitoraggio cardiovascolare dopo la prima dose somministrata.[73]Il procedimento è scaturito per la morte di un pazientestatunitenseche aveva ricevuto il farmaco meno di 24 ore prima del decesso.[74]
Secondo la"The National MS Society"i casi di decesso, al gennaio 2012, sono in tutto il mondo sei; non è però stata per nessuno stabilita la relazione di causa/effetto, in totale nel mondo al gennaio 2012 sono 33 000 le persone che assumono il farmaco.[75]
Leucoencefalopatia multifocale progressiva
[modifica|modifica wikitesto]Il 16 aprile 2012 in un comunicato stampa la Novartis informa che un paziente in terapia con Fingolimod ha sviluppato una infezione cerebrale pericolosa per la vita del paziente:leucoencefalopatia multifocale progressiva. L'Agenzia Europea del Farmaco (EMA) ha richiesto a Novartis di produrre un resoconto dettagliato su questo trattamento orale, in tempi brevi, per decidere eventualmente di sospendere momentaneamente la commercializzazione del farmaco.[76]
Pediatria
[modifica|modifica wikitesto]In pediatria non è stata stabilita la sicurezza e l'efficacia di impiego del farmaco.[40]
Insufficienza epatica
[modifica|modifica wikitesto]In caso di grave insufficienza epatica aumentano gli effetti collaterali, pertanto prima di iniziare la terapia con fingolimod va valuta la funzionalità epatica.[40]
Disturbi del ritmo cardiaco
[modifica|modifica wikitesto]Il farmaco determina diminuzione dellafrequenza cardiacae dellaconduzione atrioventricolaredopo la prima dose; pertanto va effettuato prima di iniziare la terapia unECGbasale, specie nei pazienti a rischio dibradiaritmia.[41]
Edema maculare
[modifica|modifica wikitesto]Una valutazione oftalmologica deve essere effettuata prima di iniziare il fingolimod e in 3-4 mesi dopo l'inizio del trattamento e durante la terapia con il farmaco. I pazienti con diabete mellito o una storia diuveitesono a maggior rischio di complicanze aftalmologiche per questo devono essere sottoposti a regolari valutazioni olftalmologiche.[41]
Insufficienza respiratoria
[modifica|modifica wikitesto]Il farmaco diminuisce la risposta ai test di funzionalità polmonare, laspirometriae la valutazione della capacità di diffusione polmonare per ilmonossido di carbonio(DLCO), vanno eseguiti quando le condizioni cliniche lo richiedono.[40]
Sindrome emofagocitica
[modifica|modifica wikitesto]In data 11 novembre 2013 sono stati segnalati dall'AIFAdue casi fatali disindrome emofagocitica(haemophagocytic syndrome, HPS), in soggetti in cura con fingolimod a 0,5 mg al dì.[77]
Interazioni
[modifica|modifica wikitesto]Il fingolimod e il fingolimod-fosfato sono in grado di indurre il proprio e/o il metabolismo di farmaci che sono metabolizzati dai citocromi: CYP3A4, CYP1A2, CYP4F2 e MDR1 (P-glicoproteina) mRNA e CYP3A, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 e con l'attività del CYP4F2 negli epatociti umani.[40]
Con i farmaci antiaritmici di Classe IA e di Classe III, il fingoilimod può determinare disturbi del ritmo cardiaco.[40]
Va evitata la somministrazione di vaccini vivi attenuati durante e due mesi dopo l'interruzione del trattamento fingolimod, a causa del rischio di infezione.[40]
Esistono interazioni che fanno aumentare del 70% le concentrazioni plasmatiche del ketoconazolo questo impone un monitoraggio durante la somministrazione del fingolimod con questo antifungino.[40]
La farmacocinetica di fingolimod dopo dose singola non è alterata durante la somministrazione concomitante con ciclosporina. Inoltre, non ha effetti clinicamente rilevanti con i seguenti farmaci:baclofen,gabapentin,ossibutinina,amantadina,modafinil,amitriptilina,pregabalinecorticosteroidi.[40]
Analisi della letteratura pubblicata / in progress
[modifica|modifica wikitesto]- Studi in corso sul farmaco:n. 29[78]
- Linee Guidasul farmaco:nessuna[79]
- Metanalisisul farmaco:nessuna[79]
- RCT(Randomized controlled trial)) sul farmaco:n. 30[79]
- Reviewsul farmaco:n. 112[79]
Note
[modifica|modifica wikitesto]- ^Sigma Aldrich; rev. del 05.07.2013, riferita al cloridrato
- ^Entro l’anno in Italia la prima pillola contro la sclerosi multipla | Online-news,suonline-news.it.URL consultato il 21 ottobre 2011(archiviato dall'url originaleil 13 novembre 2011).
- ^hugin.info(PDF).
- ^Brinkmann V, Billich A, Baumruker T,et al.,Fingolimod (FTY720): discovery and development of an oral drug to treat multiple sclerosis,inNat Rev Drug Discov,vol. 9, n. 11, novembre 2010, pp. 883–97,DOI:10.1038/nrd3248,PMID21031003.
- ^abcd(JA) Chiba K,[New therapeutic approach for autoimmune diseases by the sphingosine 1-phosphate receptor modulator, fingolimod (FTY720)],inYakugaku Zasshi,vol. 129, n. 6, giugno 2009, pp. 655–65,PMID19483408.
- ^abNakagawa M, Hsu YH, Hirota A, Shima S, Nakayama M,Myrocin C, a new diterpene antitumor antibiotic from Myrothecium verrucaria. I. Taxonomy of the producing strain, fermentation, isolation and biological properties,inJ. Antibiot.,vol. 42, n. 2, febbraio 1989, pp. 218–22,PMID2494145.
- ^Paugh SW, Payne SG, Barbour SE, Milstien S, Spiegel S,The immunosuppressant FTY720 is phosphorylated by sphingosine kinase type 2,inFEBS Lett,vol. 554, 1–2, 2003, pp. 189–93,DOI:10.1016/S0014-5793(03)01168-2,PMID14596938.
- ^Billich A, Bornancin F, Dévay P, Mechtcheriakova D, Urtz N, Baumruker T,Phosphorylation of the immunomodulatory drug FTY720 by sphingosine kinases,inJ Biol Chem,vol. 278, n. 48, 2003, pp. 47408–15,DOI:10.1074/jbc.M307687200,PMID13129923.Free full textArchiviatoil 13 giugno 2008 inInternet Archive.
- ^T Sanchez, T Estrada-Hernandez, JH Paik, MT Wu, K Venkataraman, V Brinkmann, K Claffey e T Hla,Phosphorylation and action of the immunomodulator FTY720 inhibits vascular endothelial cell growth factor-induced vascular permeability.,inThe Journal of biological chemistry,vol. 278, n. 47, 2003, pp. 47281–90,DOI:10.1074/jbc.M306896200,PMID12954648.
- ^Foss FW, Mathews TP, Kharel Y,et al.,Synthesis and biological evaluation of sphingosine kinase substrates as sphingosine-1-phosphate receptor prodrugs,inBioorg. Med. Chem.,vol. 17, n. 16, agosto 2009, pp. 6123–36,DOI:10.1016/j.bmc.2009.04.015,PMC2793099,PMID19632123.
- ^Hla T, Lee MJ, Ancellin N, Paik JH, Kluk MJ,Lysophospholipids--receptor revelations,inScience,vol. 294, n. 5548, 2001, pp. 1875–8,DOI:10.1126/science.1065323,PMID11729304.
- ^Paugh SW, Cassidy MP, He H, Milstien S, Sim-Selley LJ, Spiegel S, Selley DE,Sphingosine and its analog, the immunosuppressant 2-amino-2-(2-[4-octylphenyl]ethyl)-1,3-propanediol, interact with the CB1 cannabinoid receptor.,inMol Pharmacol.,vol. 70, n. 1, 2006, pp. 41–50,DOI:10.1124/mol.105.020552,PMID16571654.
- ^Payne SG, Oskeritzian CA, Griffiths R, Subramanian P, Barbour SE, Chalfant CE, Milstien S, Spiegel S.,The immunosuppressant drug FTY720 inhibits cytosolic phospholipase A2 independently of sphingosine-1-phosphate receptors.,inBlood,vol. 109, n. 3, 2007, pp. 1077–85,DOI:10.1182/blood-2006-03-011437,PMC1785128,PMID17008548.
- ^Berdyshev EV, Gorshkova I, Skobeleva A, Bittman R, Lu X, Dudek SM, Mirzapoiazova T, Garcia JG, Natarajan V.,FTY720 inhibits ceramide synthases and up-regulates dihydrosphingosine 1-phosphate formation in human lung endothelial cells.,inJournal of Biological Chemistry,vol. 284, n. 9, 2009, pp. 5467–77,DOI:10.1074/jbc.M805186200,PMC2645812,PMID19119142.
- ^B.Sivaraman, A.Senthilmurugan, I.S.Aidhen,Weinreb Amide Based New Synthetic Equivalents for Convenient Access to Immunosuppressive Agent FTY720 and Analogues,inSynlett,vol. 2841, 2007, p. 2841,DOI:10.1055/s-2007-990961.
- ^M Kiuchi, K Adachi, T Kohara, K Teshima, Y Masubuchi, T Mishina e T Fujita,Synthesis and biological evaluation of 2,2-disubstituted 2-aminoethanols: analogues of FTY720.,inBioorganic & medicinal chemistry letters,vol. 8, n. 1, 1998, pp. 101–6,DOI:10.1016/S0960-894X(97)10188-3,PMID9925439.
- ^K Adachi e K Chiba,FTY720 story. Its discovery and the following accelerated development of sphingosine 1-phosphate receptor agonists as immunomodulators based on reverse pharmacology.,inPerspectives in medicinal chemistry,vol. 1, 2007, pp. 11–23,PMC2754916,PMID19812733.
- ^Kiuchi M, Adachi K, Kohara T,et al.,Synthesis and immunosuppressive activity of 2-substituted 2-aminopropane-1,3-diols and 2-aminoethanols,inJ. Med. Chem.,vol. 43, n. 15, luglio 2000, pp. 2946–61,PMID10956203.
- ^Hsu YH, Hirota A, Shima S,et al.,Myrocin C, a new diterpene antitumor antibiotic from Myrothecium verrucaria. II. Physico-chemical properties and structure determination,inJ. Antibiot.,vol. 42, n. 2, febbraio 1989, pp. 223–9,PMID2925513.
- ^K Adachi e K Chiba,FTY720 story. Its discovery and the following accelerated development of sphingosine 1-phosphate receptor agonists as immunomodulators based on reverse pharmacology.,inPerspectives in medicinal chemistry,vol. 1, 2007, pp. 11–23,PMC2754916,PMID19812733.
- ^Fujita, T., Yoneta, M., Hirose, R., Sasaki, S., Inoue, K., Kiuchi, M., Hirase, S., Adachi, K., Arita, M. and Chiba, K.,Simple compounds, 2-alkyl-2-amino-1,3-propanediols have potent immunosuppressive activity.,inBioorg. Med. Chem. Lett.,vol. 5, 1995, pp. 847–52,DOI:10.1016/0960-894X(95)00126-E.
- ^Garber K,Infections cast cloud over Novartis' MS therapy,inNat. Biotechnol.,vol. 26, n. 8, agosto 2008, pp. 844–5,DOI:10.1038/nbt0808-844,PMID18688218.
- ^FDA press release on approval of Gilenya
- ^ab(EN)Pillola anti sclerosi multipla: attesa in Italia entro la fine del 2011 | Direttanews.it,sudirettanews.it.
- ^Stampa articolo - Pagine di servizio - DoctorNews,sudoctornews.it.
- ^ab(EN)www.ema.europa.eu(PDF), suema.europa.eu.
- ^(EN)MS Society of Canada - News in Research,sumssociety.ca(archiviato dall'url originaleil 15 marzo 2011).
- ^(EN)www.ema.europa.eu,suema.europa.eu(archiviato dall'url originaleil 14 aprile 2018).
- ^Associazione Italiana Sclerosi Multipla,suaism.it.
- ^(EN)Novartis receives approval in Japan for two innovative therapies, Gilenya® in MS and Ilaris® in CAPS,sunovartis.com.URL consultato il 28 settembre 2011(archiviato dall'url originaleil 29 settembre 2011).
- ^(EN)MS drug not cost effective, says latest draft guidance,sunice.org.uk.
- ^(EN)PHARMASTAR:: Sclerosi multipla, nuovo no del Nice a fingolimod,supharmastar.it.
- ^PHARMASTAR:: Sclerosi multipla, comunicato Ema su fingolimod,supharmastar.it.
- ^(EN)Efficacy and Safety of Fingolimod in Patients With Relapsing-Remitting Multiple Sclerosis With Optional Extension Phase - Full Text View - ClinicalTrials.gov,suclinicaltrials.gov.
- ^(EN)Efficacy and Safety of Fingolimod in Patients With Relapsing-Remitting Multiple Sclerosis With Optional Extension Phase - Full Text View - ClinicalTrials.gov,suclinicaltrials.gov.
- ^abTwiss J, Doward LC, McKenna SP, Eckert B,Interpreting scores on multiple sclerosis-specific patient reported outcome measures (the PRIMUS and U-FIS),inHealth Qual Life Outcomes,vol. 8, 2010, p. 117,DOI:10.1186/1477-7525-8-117,PMC2964544,PMID20937112.
- ^abCohen JA, Barkhof F, Comi G,et al.,Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis,inN. Engl. J. Med.,vol. 362, n. 5, febbraio 2010, pp. 402–15,DOI:10.1056/NEJMoa0907839,PMID20089954.
- ^abAssociazione Italiana Sclerosi Multipla,suaism.it.URL consultato il 30 novembre 2011.
- ^Gazzetta n. 272 del 22 novembre 2011 - AGENZIA ITALIANA DEL FARMACO,sugazzettaufficiale.biz.URL consultato il 30 novembre 2011.
- ^abcdefghijklmnop(EN)DailyMed: About DailyMed,sudailymed.nlm.nih.gov.
- ^abc(EN)DailyMed: About DailyMed,sudailymed.nlm.nih.gov.
- ^abcdChun J, Hartung HP,Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis,inClin Neuropharmacol,vol. 33, n. 2, 2010, pp. 91–101,DOI:10.1097/WNF.0b013e3181cbf825,PMID20061941.
- ^abBillich A, Bornancin F, Dévay P, Mechtcheriakova D, Urtz N, Baumruker T,Phosphorylation of the immunomodulatory drug FTY720 by sphingosine kinases,inJ. Biol. Chem.,vol. 278, n. 48, novembre 2003, pp. 47408–15,DOI:10.1074/jbc.M307687200,PMID13129923.
- ^Baumrucker, T et al.,FTY720, an immunomodulatory sphingolipid mimetic: translation of a novel mechanism into clinical benefit in multiple sclerosis.,inExpert Opin Investig Drugs,vol. 16, n. 3, 2007, pp. 283–289,DOI:10.1517/13543784.16.3.283,PMID17302523.
- ^Chiba K, Matsuyuki H, Maeda Y, Sugahara K,Role of sphingosine 1-phosphate receptor type 1 in lymphocyte egress from secondary lymphoid tissues and thymus,inCell. Mol. Immunol.,vol. 3, n. 1, febbraio 2006, pp. 11–9,PMID16549044.
- ^Foster CA, Howard LM, Schweitzer A,et al.,Brain penetration of the oral immunomodulatory drug FTY720 and its phosphorylation in the central nervous system during experimental autoimmune encephalomyelitis: consequences for mode of action in multiple sclerosis,inJ. Pharmacol. Exp. Ther.,vol. 323, n. 2, novembre 2007, pp. 469–75,DOI:10.1124/jpet.107.127183,PMID17682127.
- ^Immunologia SCLEROSI MULTIPLA, ULTIMI RISULTATI SU FINGOLIMOD notizie di salute su Immunologia,suitaliasalute.leonardo.it.
- ^(EN)Oral Fingolimod (FTY720) for Relapsing Multiple Sclerosis — NEJM,sunejm.org.
- ^abKappos L, Radue EW, O'Connor P,et al.,A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis,inN. Engl. J. Med.,vol. 362, n. 5, febbraio 2010, pp. 387–401,DOI:10.1056/NEJMoa0909494,PMID20089952.
- ^Immunologia SCLEROSI MULTIPLA, ULTIMI RISULTATI SU FINGOLIMOD notizie di salute su Immunologia,suitaliasalute.leonardo.it.
- ^(EN)Oral Fingolimod or Intramuscular Interferon for Relapsing Multiple Sclerosis — NEJM,sunejm.org.
- ^(EN)A Placebo-Controlled Trial of Oral Fingolimod in Relapsing Multiple Sclerosis — NEJM,sunejm.org.
- ^Miron VE, Ludwin SK, Darlington PJ,et al.,Fingolimod (FTY720) enhances remyelination following demyelination of organotypic cerebellar slices,inAm. J. Pathol.,vol. 176, n. 6, giugno 2010, pp. 2682–94,DOI:10.2353/ajpath.2010.091234,PMID20413685.
- ^Zhou PJ, Wang H, Shi GH, Wang XH, Shen ZJ, Xu D,Immunomodulatory drug FTY720 induces regulatory CD4(+)CD25(+) T cells in vitro,inClin. Exp. Immunol.,vol. 157, n. 1, luglio 2009, pp. 40–7,DOI:10.1111/j.1365-2249.2009.03942.x,PMC2710591,PMID19659769.
- ^abWesthoff TH, Schmidt S, Glander P,et al.,The impact of FTY720 (fingolimod) on vasodilatory function and arterial elasticity in renal transplant patients,inNephrol. Dial. Transplant.,vol. 22, n. 8, agosto 2007, pp. 2354–8,DOI:10.1093/ndt/gfm313,PMID17526535.
- ^Park SI, Felipe CR, Machado PG,et al.,Pharmacokinetic/pharmacodynamic relationships of FTY720 in kidney transplant recipients,inBraz. J. Med. Biol. Res.,vol. 38, n. 5, maggio 2005, pp. 683–94,PMID15917949.
- ^Saab G, Almony A, Blinder KJ, Schuessler R, Brennan DC,Reversible cystoid macular edema secondary to fingolimod in a renal transplant recipient,inArch. Ophthalmol.,vol. 126, n. 1, gennaio 2008, pp. 140–1,DOI:10.1001/archophthalmol.2007.23,PMID18195237.
- ^(EN)DailyMed: About DailyMed,sudailymed.nlm.nih.gov.
- ^Fda approva fingolimod per la sclerosi multipla | FocusSalute,sufocussalute.it.
- ^www.ema.europa.eu-RCP Fingolimod(PDF), suema.europa.eu.
- ^http://www.news-medical.net/news/20130110/1463/Italian.aspx,sunews-medical.net.URL consultato il 14 gennaio 2013(archiviato dall'url originaleil 5 aprile 2013).
- ^Egom EE, Ke Y, Musa H,et al.,FTY720 prevents ischemia/reperfusion injury-associated arrhythmias in an ex vivo rat heart model via activation of Pak1/Akt signaling,inJ. Mol. Cell. Cardiol.,vol. 48, n. 2, febbraio 2010, pp. 406–14,DOI:10.1016/j.yjmcc.2009.10.009,PMID19852968.
- ^Horga A, Castilló J, Montalban X,Fingolimod for relapsing multiple sclerosis: an update,inExpert Opin Pharmacother,vol. 11, n. 7, maggio 2010, pp. 1183–96,DOI:10.1517/14656561003769866,PMID20367536.
- ^abBrinkmann V, Baumruker T,Pulmonary and vascular pharmacology of sphingosine 1-phosphate,inCurr Opin Pharmacol,vol. 6, n. 3, giugno 2006, pp. 244–50,DOI:10.1016/j.coph.2005.12.004,PMID16563863.
- ^Takabe K, Paugh SW, Milstien S, Spiegel S,"Inside-out" signaling of sphingosine-1-phosphate: therapeutic targets,inPharmacol. Rev.,vol. 60, n. 2, giugno 2008, pp. 181–95,DOI:10.1124/pr.107.07113,PMC2695666,PMID18552276.
- ^Herzinger T, Kleuser B, Schäfer-Korting M, Korting HC,Sphingosine-1-phosphate signaling and the skin,inAm J Clin Dermatol,vol. 8, n. 6, 2007, pp. 329–36,PMID18039015.
- ^Peyruchaud O,Novel implications for lysophospholipids, lysophosphatidic acid and sphingosine 1-phosphate, as drug targets in cancer,inAnticancer Agents Med Chem,vol. 9, n. 4, maggio 2009, pp. 381–91,PMID19442039.
- ^Gilenya® (fingolimod)Archiviatoil 19 gennaio 2011 inInternet Archive.
- ^Condizioni o restrizioni per quanto riguarda l'uso sicuro ed efficace del medicinale che devono essere implementate in ciascun stato membro(PDF), suema.europa.eu,EMEA.URL consultato il 24 gennaio 2012.
- ^Associazione Italiana Sclerosi Multipla - Forum,suaism.it.
- ^(EN)Novartis investigating patient death following first dose of fingolimod - NeLM,,sunelm.nhs.uk.URL consultato il 15 dicembre 2011(archiviato dall'url originalel'8 gennaio 2012).
- ^J. Lindsey, K. Haden-Pinneri; N. Memon; L. Buja,Sudden unexpected death on fingolimod.,inMult Scler,febbraio 2012,DOI:10.1177/1352458512438456,PMID22300970.
- ^www.agenziafarmaco.gov.it(PDF), suagenziafarmaco.gov.it.
- ^(EN)Associazione Italiana Sclerosi Multipla,suaism.it.
- ^(EN)Possible Safety Issue Being Investigated with Novartis Pill Gilenya: National MS Society,sunationalmssociety.org(archiviato dall'url originaleil 24 maggio 2012).
- ^News[collegamento interrotto],susclerosimultipla.com.
- ^AIFA,Sindrome emofagocitica (Haemophagocytic syndrome, HPS) segnalata in pazienti trattati con fingolimod (Gilenya)(PDF), suagenziafarmaco.gov.it,/www.agenziafarmaco.gov.it, 11 novembre 2013.URL consultato il 21 novembre 2013.
- ^(EN)Search of: fingolimod - List Results - ClinicalTrials.gov,suclinicaltrials.gov.
- ^abcdRicerca effettuata su Pubmed il 5 febbraio 2011.
Bibliografia
[modifica|modifica wikitesto]- Angelo Sghirlanzoni,Terapia Delle Malattie Neurologiche,Springer, 3 aprile 2010, pp. 113–,ISBN978-88-470-1119-9.
- Alireza Minagar,The Neurobiology of Multiple Sclerosis,Academic Press, 7 giugno 2007, pp. 582–,ISBN978-0-12-373736-6.
- Manzoor M. Khan,Immunopharmacology,Springer, 24 ottobre 2008, pp. 95–,ISBN978-0-387-77975-1.
- Sandra Siehler e Graeme Milligan,G Protein-Coupled Receptors: Structure, Signaling, and Physiology,Cambridge University Press, 2010, pp. 390–,ISBN978-0-521-11208-6.
- Cedric S. Raine, Henry F. McFarland e Reinhard Hohlfeld,Multiple sclerosis: a comprehensive text,Elsevier Health Sciences, 2 luglio 2008, pp. 327–,ISBN978-0-7020-2811-3.
- accessdate E. J. Corey, Barbara Czakó e László Kürti,Molecules and Medicine,John Wiley & Sons, 2007,ISBN978-0-470-26096-8.
- David Rog,Multiple Sclerosis: Answers at Your Fingertips,Class Publishing Ltd, 1º aprile 2009, pp. 121–,ISBN978-1-85959-218-2.
- Antony D. Buss e Mark S. Butler,Natural Product Chemistry for Drug Discovery,Royal Society of Chemistry, 15 gennaio 2010, pp. 341–,ISBN978-0-85404-193-0.
- Martin Hofrichter,Industrial Applications,Springer, 28 ottobre 2010, pp. 179–,ISBN978-3-642-11457-1.URL consultato il 16 febbraio 2011.
- Roland Martin,Molecular Basis of Multiple Sclerosis: The Immune System,Springer, 29 settembre 2010, pp. 282–,ISBN978-3-642-14152-2.
- Lydia P. Davenport,Stem cell research advances,Nova Biomedical Books, 2007,ISBN978-1-60021-519-3.
- Bernhard Ryffel e Franco Di Padova,Th 17 cells: role in inflammation and autoimmune disease,Springer, 2009, pp. 194–,ISBN978-3-7643-8680-1.
Voci correlate
[modifica|modifica wikitesto]Altri progetti
[modifica|modifica wikitesto] Wikimedia Commonscontiene immagini o altri file suFingolimod
Wikimedia Commonscontiene immagini o altri file suFingolimod
 Wikinotiziecontiene l'articoloSclerosi multipla: disponibile a breve un nuovo farmaco
Wikinotiziecontiene l'articoloSclerosi multipla: disponibile a breve un nuovo farmaco
Collegamenti esterni
[modifica|modifica wikitesto]- (EN)Scheda tecnica approvata dall'FDA del Gilenya(PDF), supharma.us.novartis.com.
- (EN)Sito ufficiale Novartis,sunovartisclinicaltrials.com.URL consultato il 25 gennaio 2011(archiviato dall'url originaleil 3 febbraio 2011).
- (EN)Sito ufficiale Novartis del Gilenya negli Usa,sugilenya.com.
- (EN)News Novartis sul Gilenya,sumultivu.prnewswire.com.
- Ass. Italiana Sclerosi MultiplapaginaFingolimod,suaism.it.