Fosfine
Lefosfinesono un gruppo di composti delfosforoche comprendono lafosfinaPH3e i varicomposti organofosforiciche ne derivano per sostituzione di uno o più idrogeni con altri gruppi organici R.[1]Le fosfine sono molto importanti come leganti incomposti organometallici,perché le loro proprietà elettroniche esterichepossono essere variate entro limiti molto ampi cambiando i sostituenti R, modificando così anche le proprietà dei complessi formati. Molti complessi organometallici ecatalizzatoriomogeneicontengono leganti fosfinici. Esempi ben noti sono ilcomplesso di Vaskatrans-[Ir(CO)Cl(PPh3)2], ilcatalizzatore di WilkinsonRhCl(PPh3)3e ilcatalizzatore di Crabtree[Ir(COD)(PCy3)(py)]+.
Classificazione ed esempi
[modifica|modifica wikitesto]Si possono avere tre famiglie di fosfine, RPH2,R2PH e R3P, chiamate rispettivamente fosfine primarie, secondarie e terziarie. Inoltre, a seconda della struttura e della complessità molecolare, le fosfine si possono classificare come segue.
- Fosfine semplici,di formula generale PR3,sono le più note e utilizzate. Alcuni esempi sono illustrati di seguito. Funzionano di regola come leganti monodentati, con il fosforo legato ad un singolo metallo, ma in casi particolari possono anche legarsi a ponte tra due metalli, con il fosforo pentacoordinato.[2]

PMe2Ph =dimetilfenilfosfina. 
PBu3= tributilfosfina. 
PCy3= tricicloesilfosfina.
- Difosfine,dove la struttura molecolare comprende due atomi di fosforo che possonochelareuno stesso metallo. Ad esempio esiste tutta una serie di fosfine di formula generale R2P(CH2)nPR2(n= 1-16) dove le proprietà di coordinazione dipendono dalla lunghezza della catena. Fosfine poco flessibili comedppm(n= 1) hanno difficoltà a chelare uno stesso metallo, e fungono spesso dalegante a pontetra due metalli diversi. Fosfine conn= 2 e 3 comedppeedpppchelano molto facilmente uno stesso metallo perché si formano cicli a 5 e sei termini favoriti termodinamicamente.

Dppm = bis(difenilfosfino)metano. 
Dppe = 1,2-bis(difenilfosfino)etano. 
Dppp = 1,3-bis(difenilfosfino)propano.
- Fosfine polidentate,che contengono più di due atomi di fosforo. Sono illustrati due esempi con tre atomi di fosforo, entrambi noti con l'abbreviazionetriphos.Il composto2è un legante detto a tripode, con la caratteristica di legarsi a metalli occupando tre posizioni di coordinazione adiacenti.

1Triphos =Bis-(2-difenilfosfinoetil)-fenilfosfina. 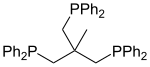
2Triphos =1,1,1-Tris(difenilfosfinometil)etano.
- Fosfine chirali.Sono in genere difosfine che fanno parte di molecole asimmetriche. Fosfinechiralisono importanti nellacatalisi asimmetrica.Alcuni esempi sono illustrati di seguito.

Chiraphos= (2S,3S)-(–)-Bis(difenilfosfino)butano. 
BINAP= 2,2'-bis(difenilfosfino)-1,1'-binaftile. 
DIPAMP= Bis[(2-metossifenil)fenilfosfino]etano.
Proprietà generali
[modifica|modifica wikitesto]La fosfina PH3è gassosa, mentre la maggior parte delle fosfine sono liquidi incolori, insolubili in acqua, con un odore agliaceo forte e penetrante. Le fosfine sono molto tossiche; la tossicità diminuisce al crescere del peso molecolare.[3]
Sintesi
[modifica|modifica wikitesto]Le fosfine terziarie si possono produrre in vari modi.[3][4]Una possibilità è per reazione traPCl3ereattivi di Grignard,ad esempio:
- PCl3+ 3RMgCl → PR3+ 3MgCl2
Un'altra possibilità è per addizione di composti insaturi a PH3:
- PH3+ 3H2C=CHR → P(CH2CH2R)3
La sintesi di fosfine con sostituenti diversi richiede metodi specifici.[4]
Reattività
[modifica|modifica wikitesto]Le fosfine reagiscono principalmente comenucleofili,comeriducentie comebasi.[3]La nucleofilia si evidenzia ad esempio dalle loro reazioni conalogenuri alchiliciper formare sali di fosfonio. Nellareazione di Staudingerlatrifenilfosfinaagisce sia da nucleofilo che da riducente, provocando la trasformazione di un'azideinammina.Analoghe capacità nucleofile e riducenti si osservano anche nellareazione di Mitsunobuche convertealcoliinesteri.A causa delle loro capacità riducenti, le fosfine sono facilmente ossidabili; può bastare la semplice esposizione all'aria per formare i corrispondenti fosfinossidi. Come basi, le fosfine risultano molto importanti come leganti nei composti organometallici.
Proprietà elettroniche delle fosfine come leganti
[modifica|modifica wikitesto]L'atomo di fosforo delle fosfine possiede una coppia di elettroni non condivisa che può essere utilizzata formare unlegame σcon un metallo. Le fosfine possiedono quindi capacità σ-donatrici analoghe a quelle dell'ammoniacae delleammine.A differenza delle ammine, le fosfine sono anche π-accettrici (π-acide). È stato molto dibattuto quali siano gli orbitali accettori delle fosfine, concludendo che gli orbitali σ* dei legami P–R sono più importanti degli orbitali d dell'atomo di fosforo.[5] Sia le proprietà σ-donatrici che quelle π-accettrici possono essere ampiamente modulate cambiando i sostituenti R. Ad esempio, tramite misure dispettroscopia IRsi è potuto stabilire che le proprietà π-accettrici calano nell'ordine:[6]
- PF3> P(OPh)3> P(OMe)3> PPh3> PMe3
dove Ph = fenile e Me = metile. Anche learsine(AsR3), lestibine(SbR3) e ifosfiti(P(OR)3) possiedono proprietà σ-donatrici e π-accettrici simili alle fosfine.
Ingombro sterico delle fosfine come leganti
[modifica|modifica wikitesto]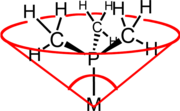
Cambiando i sostituenti R cambia anche l'ingombro stericorichiesto dalle varie fosfine. Questo limita il numero di fosfine che è possibile coordinare ad un metallo. Ad esempio, attorno ad un metallo possono di solito coordinarsi due PCy3(Cy = cicloesile), tre o quattro PPh3,e cinque o sei PMe3.L'ingombro sterico delle fosfine viene valutato tramite l'angolo conico di Tolman,θ, che è l'angolo del cono che si ottiene considerando come vertice il centro del metallo coordinato, e come superficie del cono quella necessaria a contenere tutti gli atomi del legante PR3.Nell'esempio illustrato nella figura, si ha che per PMe3l'angolo conico è 118°.
Confronto tra fosfine e ammine
[modifica|modifica wikitesto]Le fosfine sono i composti del fosforo analoghi alleammine.In entrambi i casi la geometria della molecola è apiramide trigonale,anche se nel caso del fosforo l'angolo C–E–C (E = N, P) è più piccolo, almeno in assenza di effetti sterici. Ad esempio per la trimetilfosfina l'angolo C–P–C è 98,6° e diventa 109,7° quando i gruppi metile sono sostituiti da gruppiter-butile.La barriera d'inversione è molto più elevata rispetto alle ammine corrispondenti, e di conseguenza nel caso di fosfine con tre sostituenti diversi si possono isolare i dueisomeri otticiche risultano termicamente stabili. In genere le fosfine risultano menobasichedelle ammine corrispondenti. Ad esempio PH4+hapKa= −14 mentre NH4+ha pKa= 9,21; HPMe3+ha pKa= 8,65 rispetto a 9,76 per HNMe3+.Tuttavia latrifenilfosfina(pKa2,73) è più basica dellatrifenilammina(pKa−5), dato che ildoppietto solitariodell'azoto in NPh3è parzialmente delocalizzato sui tre anelli aromatici. La reattività delle fosfine è analoga a quella delle ammine per quanto riguarda lanucleofiliaper la formazione di sali di fosfonio con struttura generale PR3+X−.Questa proprietà è sfruttata nellareazione di Appelper convertirealcoliinalogenuri alchilici.Le fosfine siossidanofacilmente a fosfinossidi, mentre le amine sono più difficili da ossidare. Anche per questo motivo le fosfine si trovano raramente in natura.
Note
[modifica|modifica wikitesto]Bibliografia
[modifica|modifica wikitesto]- (EN) R. H. Crabtree,The Organometallic Chemistry of the Transition Metals,4ª ed., Hoboken (NJ), John Wiley & Sons, 2005,ISBN0-471-66256-9.
- (EN) R. Engel e J.-L. I. Cohen,Phosphorus: Organophosphorus Chemistry,inEncyclopedia of Inorganic Chemistry,2ª ed., John Wiley & Sons, 2006,DOI:10.1002/0470862106.ia187,ISBN9780470862100.
- (EN) A. D. McNaught e A. Wilkinson (a cura di),Phosphines,inIUPAC. Compendium of Chemical Terminology,2ª ed., Oxford, Blackwell Scientific Publications, 1997,DOI:10.1351/goldbook,ISBN0-9678550-9-8.
- T. Pechmann, C. D. Brandt e H. Werner,<3909::AID-ANIE3909>3.0.CO;2-2Breaking the Rule: Synthesis and Molecular Structure of Dinuclear Rhodium Complexes with Bridging and Semibridging Trialkylphosphane Ligands,inAngew. Chem. Int. Ed. Engl.,vol. 39, n. 21, 2000, pp. 3909-3911,DOI:10.1002/1521-3773(20001103)39:21<3909::AID-ANIE3909>3.0.CO;2-2.URL consultato il 12 novembre 2011.
- (EN) A. Schier e H. Schmidbaur,P-donor Ligands,inEncyclopedia of Inorganic Chemistry,Wiley, 2006,DOI:10.1002/0470862106.ia177.
- (EN) J. Svara e N. Weferling,Phosphorus Compounds, Organic,inUllmann's Encyclopedia of Industrial Chemistry,Wiley-VCH, 2002,DOI:10.1002/14356007.a19_545.
Altri progetti
[modifica|modifica wikitesto] Wikimedia Commonscontiene immagini o altri file suFosfine
Wikimedia Commonscontiene immagini o altri file suFosfine
| Controllo di autorità | GND(DE)4174379-9 |
|---|
