Glicolisi
Laglicolìsi[1]è un processometabolicoattraverso il quale, in condizioni dianaerobiosi non stretta,una molecola diglucosioviene scissa in due molecole dipiruvatoal fine di generare molecole a più alta energia, come 2 molecole diATPe 2 molecole diNADHper ogni molecola di glucosio utilizzata. Il termine deriva dalgreco antico,γλυκύς (glykýs), che significa «dolce», e λύσις (lýsis), che significa «scissione».[2]
La glicolisi o via diEmbden-Meyerhof-Parnasè il mezzo per ottenereenergiapiù sfruttato in natura, soprattutto grazie alla sua anaerobioticità, sebbene non sia il piùefficiente.[3]Probabilmente esso si sviluppò con i primiprocarioti[4][5]circa 3,5 miliardi di anni fa.[6][7]
In una prima fase del processo, composta da cinque passaggi, viene consumata energia (fase di consumo energetico) per ottenere dal glucosio molecole di un derivato del glucosio a più alta energia (gliceraldeide-3-fosfato), che verranno poi trasformate nella fase successiva, composta di altri cinque passaggi, in molecole nettamente meno energetiche dipiruvato,con produzione di energia superiore a quella consumata nella prima fase. Il processo nel suo insieme è quindi di tipocatabolico,cioè in cui molecole più complesse ed energetiche, vengono trasformate in altre più semplici e meno energetiche, con accumulo di energia.
Le reazioni che compongono la glicolisi, ciascunacatalizzatada uno specificoenzima,avvengono nelcitoplasmadellecellule;solo in alcuniprotozoi[8]come itripanosomi[9][10]eleishmanie[11]avvengono in un organulo apposito, chiamatoglicosoma.[12][13]
Con il termine 'glicolisi' ci si riferisce di solito allavia di Embden-Meyerhof-Parnas,dai nomi diGustav Embden,[14]Otto Meyerhof[15][16][17]eJakub Parnas,[18][19][20]i tre biochimici che maggiormente contribuirono a chiarirne il meccanismo, ma ci si può riferire anche allavia di Entner-Doudoroffe a varie vie metaboliche eterofermentative e omofermentative.
Scoperta della glicolisi
[modifica|modifica wikitesto]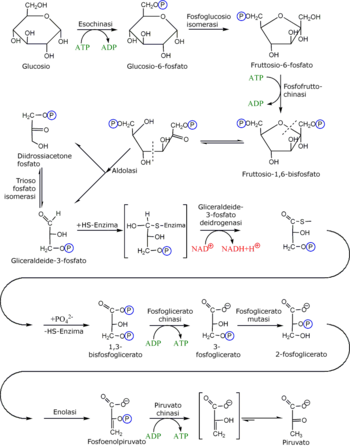
L'individuazione della via di degradazione deiglucidifu uno dei primi grandi temi affrontati nell'Ottocentodalla nascentebiochimica.[21][22][23]Si può dire che la disciplina si sia sviluppata di pari passo con la scoperta progressiva di dettagli sempre maggiori sullefermentazioni,di cui la glicolisi è parte integrante.
I primi studi su questi processi iniziarono nell'anno1860,quandoLouis Pasteur[24][25][26][27]individuò imicroorganismicome responsabili delle fermentazioni.[28]Nel1897HanseEduard Buchner[29][30][31]scoprirono per puro caso che le fermentazioni possono avvenire anche solo in presenza di semplici estratti cellulari[32],smentendo ildogmaipotizzato da Pasteur, secondo cui i processi metabolici fossero possibili solo all'interno di una strutturavivente,come una cellula.[28]
Nel1905Arthur Harden[33][34][35]eWilliam Young,[36][37]andando più nel dettaglio, individuarono le due frazioni subcellulari necessarie per lo svolgimento di una fermentazione: una frazionetermosensibilead altopeso molecolare(quella contenente glienzimi) ed una non termosensibile a basso peso molecolare (contenenteADP,ATP,NAD+e altricofattori).
Nei primi decenni delNovecentosi studiarono intensamente gli estratti cellulari dimuscolielieviti,responsabili delle fermentazionilatticaedalcolica,che si scoprì successivamente condividere la maggior parte degli enzimi e dei metaboliti. Le difficoltà maggiori in questi studi erano essenzialmente legate alla breveemivitadegli intermedi metabolici, che impediva di analizzare il processo in manierastabile.Ilpathway,in ogni caso, fu completamente caratterizzato nel1940,attraverso i contributi vari di Gustav Embden, Otto Meyerhof, Jakub Parnas,Carl Neuberg,[38][39][40]Otto Warburg[41][42][43],GertyeCarl Cori.[44][45][46]
Aspetti generali
[modifica|modifica wikitesto]La reazione completa della glicolisi è la seguente:[47]
- C6H12O6+ 2 NAD++ 2 ADP + 2 Pi→ 2 NADH + 2 C3H4O3+ 2 ATP + 2 H2O + 2 H+.
In tutti gli organismi, che non prevedono ulteriori degradazioni delpiruvato,il processo ha una resa energetica di due molecole diATPper ogni molecola di glucosio (Glc) o per qualsiasi altro zucchero esoso degradabile da questavia metabolica.[48]Ilcatabolismoglucidico degli organismi che svolgono comunemente lefermentazioni,come ilieviti,dunque, si ferma al piruvato (che solitamente viene convertito in altre forme senza che ciò comporti ulterioriguadagnienergetici).
Per gli organismi superiori, come ad esempio imammiferi,la glicolisi è invece solo ilprimo passaggiodella degradazione degli zuccheri.[49]Le due molecole diATPda essa ottenute sono solo una piccola parte del totale delle molecole diATPottenibili a partire da una molecola di glucosio, che possono arrivare fino a 30/32.[48]Le cellule in grado di svolgere i successivipathwayaerobici (come ilciclo di Krebs), dunque, sono in grado di processare il piruvato, ossidandolo fino ad ottenereanidride carbonicaedacqua(catena di trasporto degli elettroni).[50]Anche in questi organismi, in ogni caso, la glicolisi può diventare l'unicopathway (quando vi è carenza d'ossigeno) senza che il piruvato sia ulteriormente ossidato. Ciò può avvenire in caso di sforzo intenso (soprattutto nei tessuti energeticamente più esigenti, come imuscoli): in questo caso, il piruvato viene convertito adacido latticoper riconvertire il NADH a NAD+e bilanciarne le concentrazioni cellulari.[47]
La glicolisi può essere suddivisa in due fasi: la prima fase è dettafase di investimento,la seconda è lafase di rendimento.
Fase di investimento
[modifica|modifica wikitesto]Nella fase di investimento, il glucosio vienefosforilatoa glucosio-6-fosfato ed infine scisso in due molecole di gliceraldeide-3-fosfato; ciò avviene attraverso l'utilizzo di due molecole diATP.I primi cinque passaggi della via metabolica, dunque, comportano un consumo netto di energia.[51]
| Fase | Substrato | Enzima | Classe dell'enzima | Descrizione | ||
|---|---|---|---|---|---|---|
| 1 | Glucosio | Glc | Esochinasi | HK | Transferasi | Questa fase utilizzaATPper fosforilare il glucosio. Questa reazione presenta unaΔGmolto bassa: per questo motivo, la reazione è irreversibile. Necessaria è la presenza diMg2+il quale rende possibile la reazione sequestrando in un complesso le cariche negative dei fosfati dell'ATP.[52] |
| 2 | Glucosio-6-fosfato | G6P | Fosfoglucosio isomerasi | PGI | Isomerasi | Il cambiamento di struttura è ottenuto attraverso unareazione redox,nella quale l'aldeideviene ridotta adalcoled ilcarbonioadiacente è ossidato a diventare unchetone.Sebbene la reazione non abbia una ΔG molto favorevole, è molto efficiente a causa delle basse concentrazioni di fruttosio-6-fosfato, metabolizzato molto velocemente nel passaggio seguente (questo fenomeno è comprensibile per lalegge di azione di massa).[53] |
| 3 | Fruttosio-6-fosfato | F6P | Fosfofruttochinasi | PFK-1 | Transferasi | In questo passaggio c'è nuovamente dispendio di energia attraverso un'altra molecola diATP.Talespesapuò essere giustificata in due modi: il processo glicolitico da qui in poi è irreversibile e l'energia fornita al glucide lo destabilizza.[54]
La reazione è attivata da alti livelli di AMP e Pi (quindi richiesta energetica da parte della cellula) mentre è inibita da alte concentrazioni diATPe di citrato. Anche qui è importante la presenza di Mg2+. |
| 4 | Fruttosio 1,6-bisfosfato | F1,6BP | Aldolasi | ALDO | Liasi | La molecola, destabilizzata dalla precedente reazione, è passibile di scissione da parte dell'aldolasi in due molecole glucidiche da tre atomi di carbonio: diidrossiacetone fosfato egliceraldeide 3-fosfato.[55] |
| 5 | Diidrossiacetone fosfato | DHAP | Trioso fosfato isomerasi | TPI | Isomerasi | La trioso fosfato isomerasi converte rapidamente il DHAP in gliceraldeide 3-fosfato.[56] |
Fase di rendimento
[modifica|modifica wikitesto]Nella seconda fase, quella di rendimento, le due molecole di gliceraldeide-3-fosfato vengono trasformate in due molecole dipiruvatocon conseguente produzione di quattro molecole diATPe due diNADH(per riduzione del NAD+), le quali permettono di rigenerare anche ilpooldi molecole riducenti presenti nella cellula. Questa seconda fase, dunque, vede un recupero di energia, che porta l'interopathwayglicolitico ad un guadagno netto di energia.[57]
| Fas | Substrato | Enzima | Classe dell'enzima | Descrizione | ||
|---|---|---|---|---|---|---|
| 6 | Gliceraldeide 3-fosfato | GADP | Gliceraldeide 3-fosfato deidrogenasi | GAP | Ossidoreduttasi | Itriosisonoossidati(attraverso il prelievo di unidrogeno) e addizionati di unfosfatoinorganico. L'idrogeno viene utilizzato perridurredue molecole diNAD+,che diventano NADH + H+.[58][59][60] |
| 7 | 1,3-bisfosfoglicerato | 1,3BPG | Fosfoglicerato chinasi | PGK | Transferasi | La reazione media la conversione diADPadATP,attraverso il trasferimento enzimatico di un gruppo fosfato presente sul glucide. È un esempio difosforilazione a livello del substrato.[61][62][63] |
| 8 | 3-fosfoglicerato | 3PG | Fosfoglicerato mutasi | PGAM | Isomerasi | La reazione media lo spostamento del gruppo fosfato dalla posizione 3 alla posizione 2 per disporre lo stesso in posizione più favorevole.[64][65][66] |
| 9 | 2-fosfoglicerato | 2PG | Enolasi | ENO | Liasi | Una molecola di H2O viene rimossa dalla posizione 2 per concentrare ulteriore energia chimica in prossimità del gruppo fosfato.[67][68] |
| 10 | Fosfoenolpiruvato | PEP | Piruvato chinasi | PK | Transferasi | Si tratta di un altro esempio di fosforilazione a livello del substrato, che converte una molecola diADPin una diATP,formandopiruvato(Pyr).[69][70][71] |
Risultato netto della glicolisi
[modifica|modifica wikitesto]La produzione finale del piruvato è necessaria per ilciclo di Krebs(detto anche ciclo degli acidi tricarbossilici o dell'Acido Citrico), dove vengono prodotti i coenzimi ridotti (NADridotto eFADridotto) che, riossidandosi nella catena respiratoria, produrranno molecole diATP.
Il guadagno complessivo della glicolisi risulta essere, pertanto, di due molecole diATPe due di NADH, come indica la già citata reazione complessiva:[47]
- Glucosio + 2 NAD++ 2 ADP + 2 Pi→ 2 NADH + 2 piruvato + 2 ATP + 2 H2O + 2 H+
tale via metabolica si verifica incessantemente nel citosol, pertanto si richiede nel citosol continua disponibilità di glucosio, ADP, Pi e NAD; di glucosio c'è continua disponibilità (via GLUT o dalla glicogenolisi o dalla gluconeogenesi) così pure di ADP e Pi (da varie vie anaboliche) non c'è invece disponibilità di NAD che deve perciò essere rigenerato dall'ossidazione del NADH, che può avvenire grazie al metabolismo mitocondriale, GLICOLISI AEROBICA, o tramite la riduzione del piruvato a lattato, GLICOLISI ANAEROBICA.
Tappe della glicolisi
[modifica|modifica wikitesto]Prima parte (Fase di investimento)
[modifica|modifica wikitesto]La prima parte della glicolisi consiste anzitutto nella conversione delglucosioin glucosio-6-fosfato, tramite l'aggiunta di un gruppo fosfato al carbonio 6, per impedire alla molecola di uscire dalla cellula. A questo punto il Glucosio-6-fosfato viene trasformato infruttosio 1,6-bisfosfato:tale conversione genera di fatto unintrappolamentodella molecolaglucidicanellacellula(ilfosfatocarica infatti la molecola, impedendole di attraversare lamembrana cellulare).[47]Il fruttosio 1,6-bisfosfato, oltre ad essere una molecola carica, è anche facilmente scindibile in due molecole più piccole da tre atomi dicarbonio:queste due molecole saranno isubstratidella seconda fase della via metabolica. I passaggi enzimatici della prima fase sono di seguito riportati.
Reazione 1: esochinasi
[modifica|modifica wikitesto]
Il glucosio intracellulare viene fosforilato per azione dell'enzima esochinasi e trasformato in glucosio-6-fosfato con consumo di una molecola diATP.[51]Questo passaggio è uno dei tre passaggi chiave dell'interopathway,dal momento che la molecola di glucosio fosforilato, oltre a non poter più uscire dalla membrana cellulare, si destabilizza, diventando più prona a proseguire la viacatabolica.
La esochinasi è un enzima la cui attività dipende dalla presenza diionimagnesio(cofattoremetallico). Uno ione magnesio bivalente è presente nelsito attivodell'enzima ed agisce formando un complesso ternarioesochinasi-ATP-Mg2+.Ma a differenza di altri enzimi specifici questo ha un'affinità anche per altri zuccheri, come ilmannosio(la suaKMè di circa 10−6).[72]
Il glucosio-6-fosfato intracellulare può avere differenti destini. Infatti, nel fegato e nei muscoli può prendere la via dellaglicogenosintesiper sintetizzareglicogeno,rispettivamente epatico e muscolare. Inoltre circa il 3% del glucosio intracellulare viene ossidato nellavia dei pentoso-fosfatiche è principalmente preposta alla sintesi delNADPH(NAD-fosfato-ridotto) ed alla sintesi del ribosio-5-fosfato. IlNADPHviene utilizzato dalla cellula per i propri processi biosintetici; il ribosio-5-fosfato viene utilizzato per la sintesi di tutti i nucleotidi.
Reazione 2: fosfoglucosio isomerasi
[modifica|modifica wikitesto]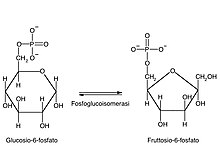
Il passaggio successivo della glicolisi consiste nella isomerizzazione del glucosio-6-fosfato afruttosio-6-fosfato.L'enzimafosfoglucosio isomerasi(ofosfoglucoisomerasi), anch'esso Mg-dipendente, catalizza questa reazione di conversione di un glucidealdosoin unchetoso.[51]
Tale reazione, in realtà, richiede più passaggi intermedi di quanti si possano immaginare: l'enzima è infatti in grado diaprirela struttura ciclica del glucosio (anello a sei atomi di carbonio), isomerizzare la molecola e richiuderla nella struttura ciclica del fruttosio (anello a cinque termini).
Reazione 3: fosfofruttochinasi
[modifica|modifica wikitesto]
In seguito all'isomerizzazione, il fruttosio 6-fosfato viene sottoposto ad un'altra fosforilazione. L'enzimafosfofruttochinasi1catalizza tale reazione fino alla produzione difruttosio-1,6-bisfosfato[73],trasferendo un fosfato dall'ATPalla posizione 1 della molecola di fruttosio.[74]
Anche questa reazione, a causa dell'idrolisi diATP,non è reversibile. La fosfofruttochinasi è un enzimaallosterico,Mg2+dipendente.[72]Esso può essere inibito dall'ATP,[75]dalcitrato[75]e dal suo prodotto, il fruttosio-1,6-bisfosfato. Viene invece attivato dall'ADP,[75]dall'AMP[75]e dal fruttosio-2,6-bisfosfato.[76]Quest'ultima molecola viene ottenuta per fosforilazione del fruttosio-6-fosfato ad opera di un'altra fosfofruttochinasi, lafosfofruttochinasi 2.
Proprio a causa di questa finissima regolazione, anche la terza fase della glicolisi è uno dei tre passaggi chiave dell'intera via metabolica.
Reazione 4: aldolasi
[modifica|modifica wikitesto]
Il fruttosio-1,6-bisfosfato prodotto dal precedente passaggio è, di fatto, la versioneattivatavera e propria del glucosio, quindi la glicolisi può avviare la degradazione vera e propria, producendo due triosi aventi un fosfato ciascuno.
La quarta reazione della glicolisi, catalizzata dall'enzima, Mg2+dipendente,[72]aldolasi,consiste dunque nella scissione delfruttosio-1,6-bisfosfatoindiidrossiacetone fosfatoegliceraldeide-3-fosfato.
Reazione 5: trioso fosfato isomerasi
[modifica|modifica wikitesto]
L'aldolasi ha scisso l'esoso in due triosi diversi: dal momento che seguire due vie metaboliche differenti per entrambe le molecole ottenute sarebbe energeticamente molto dispendioso, l'evoluzione delpathwayglicolitico ha selezionato un enzima in grado di rendere uniforme la successiva degradazione dei due triosi. Latrioso fosfato isomerasiè infatti l'enzima deputato a convertire ildiidrossiacetone fosfatoingliceraldeide-3-fosfato,il substrato unico del successivo passaggio.[74]
L'enzima è infatti in grado diprelevareun H+da un atomo di carbonio, spostandolo su un altro vicino: in questo modo il trioso passa dalla formachetonicaa quellaaldeidica.
Il ΔG° di reazione, in realtà, è spostato verso la formazione di diidrossiacetone fosfato ma, per la legge di azione di massa, l'equilibrio della reazione è spostato verso destra, dal momento che la concentrazione cellulare di gliceraldeide-3-fosfato è molto bassa (le percentuali risultanti sono 96% di DHAP, 4% di G3P). La gliceraldeide-3-fosfato, infatti, viene velocemente metabolizzata dal passaggio successivo della via metabolica.
Seconda parte (Fase di rendimento)
[modifica|modifica wikitesto]Le fasi precedenti della glicolisi hanno prodotto due molecole digliceraldeide-3-fosfato,ma non hanno ancora ricavato alcun tipo di energia dal processo. Al contrario, fino ad ora sono statespesedue molecole diATP.Le reazioni della seconda fase permettono alla cellula di ricavare energia dalla degradazione della gliceraldeide-3-fosfato.
Reazione 6: gliceraldeide-3-fosfato deidrogenasi
[modifica|modifica wikitesto]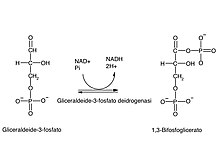
Lagliceraldeide-3-fosfatoviene convertita in1,3-bisfosfogliceratodallagliceraldeide-3-fosfato deidrogenasi.
Tale reazione consiste nella somma di due processi: l'ossidazione dell'aldeideadacido carbossilicomediata dal coenzimaNAD+(che si riduce a NADH) e la fosforilazione, (cioè l'attacco di ungruppo fosfato) al gruppo carbossilico. La prima reazione è abbastanza favorita dal punto di vista termodinamico (ΔG° di circa -43 kJ/mole),[77]mentre la seconda è sfavorita, essendo il suo ΔG° di segno opposto.[77]Se queste due reazioni avvenissero in semplice sequenza, la seconda avrebbe unaenergia di attivazionetalmente alta da renderla di fatto impossibile. Queste due reazioni, in realtà, vengono accoppiate attraverso l'enzima gliceraldeide-3-fosfato deidrogenasi, che rende dunque la fosforilazione effettivamente possibile.
Il potenziale di ossidazione viene conservato sotto forma di potenziale riducente presente sul NADH, il quale cederà i suoi elettroni alla catena respiratoria per la produzione di molecole diATP.L'1,3-bifosfoglicerato è un composto ad altissima energia con un ΔG° di idrolisi di circa -49,3 kJ/mole.[78]
Reazione 7: fosfoglicerato chinasi
[modifica|modifica wikitesto]
La settima tappa della glicolisi consiste nell'inizio della vera e propria fase di recupero, che consiste nella produzione diATP.Attraverso l'enzima, Mg2+dipendente,[72]fosfoglicerato chinasi,infatti, l'1,3-bisfosfogliceratocede un gruppo fosfato ad unADP,che così viene ricaricato adATP.Questo genere di produzione diATPè definitafosforilazione a livello del substrato,dal momento che la molecola donatrice, l'1,3-bisfosfoglicerato, è un substrato ad alto potenziale di trasferimento di un gruppo fosfato.
Come avviene per laesochinasi,anche la fosforilazione diADPdeve avvenire lontano dall'ambiente acquoso. Per questo motivo la fosfoglicerato chinasi è dotata di unatascain grado di riparare i substrati dall'ambiente esterno.
Reazione 8: fosfoglicerato mutasi
[modifica|modifica wikitesto]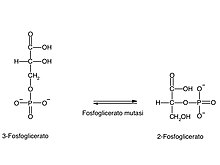
Le ultime tre reazioni della glicolisi consistono nella conversione del3-fosfogliceratoinpiruvato,attraverso una concomitante conversione di un'altra molecola diADPinATP.
La prima reazione è unriarrangiamento.La posizione del gruppo fosfato viene cambiata dalcarbonioin posizione 3 a quello in posizione 2, attraverso la catalisi dellafosfoglicerato mutasi[79](come le altre mutasi, si tratta di un enzima coinvolto nel riarrangiamento interno delle molecole). La reazione, tuttavia, non consiste in un semplice spostamento.
L'enzima, infatti, lavora innanzitutto come unafosfatasi,rimuovendo il fosfato in posizione 3 da una molecola di2,3-bisfosfogliceratoe generando il prodotto2-fosfoglicerato.Tale fosfato rimane legato ad un residuo diistidinadell'enzima e viene successivamente attaccato alla molecola di3-fosfoglicerato(il substrato della reazione), che così rigenera il 2,3-bisfosfoglicerato.[79]L'enzima, dunque, necessita di una quantità di 2,3-bisfosfoglicerato perché il residuo di istidina, indispensabile per la reazione, sia sempre fosforilato.[79]
L'enzima coinvolto è anch'esso magnesio-dipendente.[79]
Reazione 9: enolasi
[modifica|modifica wikitesto]
La penultima reazione è essenzialmente una disidratazione del2-fosfogliceratoche porta alla formazione difosfoenolpiruvato,un composto ad alta energia, edacqua.Questa disidratazione, catalizzata dall'enzimaenolasi,[80]innalza notevolmente il potenziale di trasferimento del gruppo fosfato. Se il ΔG°´ di idrolisi di un fosfato legato ad unalcolè infatti di circa - 13 kJ mol−1,quello del fosfoenolpiruvato raggiunge i - 62 kJ mol−1.[81]Tale valore è dovuto alla forte instabilità della forma enolica della molecola, che cessa solo quando essa raggiunge una più stabile forma chetonica (ovvero ilpiruvato).
L'enolasi è unaliasi[82]la cui attività è stimolata dapotassioe/o damagnesio[83][84]
Reazione 10: piruvato chinasi
[modifica|modifica wikitesto]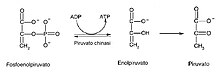
Nell'ultima tappa ilfosfoenolpiruvato,ad opera dellapiruvato chinasi,Mg2+dipendente,[72]viene anzitutto idrolizzato in enolpiruvato. Il gruppo fosfato viene ceduto ad unADPper formareATP.L'energia necessaria alla produzione di ATP proviene dalla conversione dell'enolpiruvato in piruvato, reazione fortemente esoergonica. La forma enolica del piruvato possiede infatti un potenziale energetico alto ma è molto instabile, quindi tramite unatautomeria cheto-enolica,con la dislocazione degli elettroni dall'atomo di ossigeno all'atomo di carbonio, viene trasformato in piruvato.
La piruvato chinasi è un enzima fortemente regolato: esso viene infatti inibito da acidi grassi, citrato eATP,ovvero i suoi prodotti (feedback).[85]Un tale controlloa vallegarantisce che l'ATP venga prodotto solo in caso di effettivo bisogno. Esiste anche una regolazionea monteattuata dal fruttosio 1-6 bisfosfato, il quale annulla l'inibizione (regolazione feed-forward).[85]
Il piruvato è il prodotto finale della glicolisi e, a seconda degli organismi e delle condizioni fisiologiche, può andare incontro a diversi destini, tra cui la sua trasformazione inacetil-CoAtramite ladecarbossilazione ossidativa.
Ingresso nelpathwaydi esosi alternativi al glucosio
[modifica|modifica wikitesto]Sebbene il glucosio sia ilmonosaccaridepiù utilizzato dalla glicolisi, anche altrizuccheripossono essere utilizzati dalla via metabolica. Si considerino, ad esempio, gli ingressi nella via glicolitica di altri dueglucidimolto abbondanti negli alimenti: ilfruttosioed ilgalattosio.
Ingresso del fruttosio
[modifica|modifica wikitesto]La maggior parte del fruttosio ingerito con la dieta[86]è metabolizzato a livelloepatico,attraverso il cosiddettopathway del fruttosio-1-fosfato.L'enzimafruttochinasi,infatti,fosforilail fruttosio, producendo una molecola difruttosio-1-fosfato.[87]Tale molecola è successivamente convertita in una didiidrossiacetone fosfato,un intermedio della glicolisi, ed una digliceraldeide,attraverso una specificaaldolasi(lafruttosio-1-fosfato aldolasi). La gliceraldeide viene ulteriormente fosforilata da unachinasi(latrioso chinasi) a diventaregliceraldeide-3-fosfato[87],che può entrare nelpathwayglicolitico assieme al diidrossiacetone fosfato.
Un'altra via per l'ingresso del fruttosio può essere la suafosforilazioneafruttosio-6-fosfatoattraverso l'enzimaesochinasi.[87]In ogni caso, l'affinità del glucosio per l'enzima è 20 volte maggiore del fruttosio. Nel fegato viene prodotta una ridottissima quantità di fruttosio-6-fosfato,[87]perché il glucosio che vi si trova è molto più abbondante del fruttosio. Allo stesso modo, il glucosio viene immediatamenteintrappolatoanche nei muscoli, sempre attraverso laesochinasi.Per questi motivi, tessuti meno metabolicamente attivi come iltessuto adipososi trovano a metabolizzare maggiormente ilfruttosio,l'esosoa cui sono maggiormente esposti. La formazione di fruttosio-6-fosfato, non più inibito competitivamente dal glucosio, è così maggiormente favorita in questi tessuti.[87]
Ingresso del galattosio
[modifica|modifica wikitesto]Non esistonopathwayin grado di metabolizzare ilgalattosio,così la strategia cellulare per la sua degradazione consiste nella sua conversione a glucosio. La molecola viene più precisamente convertita inglucosio-6-fosfato,attraverso i quattro passaggi del cosiddettopathway di interconversione glucosio-galattosio.
- Nella prima reazione il galattosio viene convertito dall'enzimagalattochinasiin galattosio-1-fosfato.[88]
- Il galattosio-1-fosfato viene legato ad una molecola diuridina,a partire da una molecola diUDP-glucosio (UDP-glucose), un intermedio della sintesi delglicogeno.I prodotti di questa reazione sono il glucosio-1-fosfato ed una molecola di UDP-galattosio. Tale reazione è catalizzata dalla galattosio-1-fosfato uridil transferasi.[88]
- Lo scheletro dell'UDP-galattosio è dunqueepimerizzatoa UDP-glucosio. La configurazione dell'ossidrilein posizione 4 viene invertita dall'enzima UDP-galattosio 4-epimerasi[88](noto anche come galattowaldenasi o semplicemente waldenasi, dal nome del chimico Paul Walden).
- Infine, il glucosio-1-fosfato prodotto dal galattosio è isomerizzato a glucosio-6-fosfato dalla fosfoglucomutasi, altro enzima utilizzato nella sintesi del glicogeno.
Occorre notare che non viene consumata alcuna molecola di UDP-glucosio nella conversione del galattosio a glucosio: essa viene semplicemente rigenerata a partire dall'UDP-galattosio attraverso la epimerasi.
Controllo della velocità di flusso
[modifica|modifica wikitesto]La velocità di flusso nelpathwayglicolitico è in grado di adattarsi molto bene in risposta a stimoli provenienti dall'interno e dall'esterno della cellula. Essa è regolata per massimizzare la presenza di due metaboliti principali: l'ATPed i mattoni fondamentali per le reazioni di biosintesi, come gliamminoacidi.Nella glicolisi, solo le reazioni catalizzate daesochinasi,fosfofruttochinasiepiruvato chinasisono effettivamente irreversibili. Nelle comuni vie metaboliche, enzimi di questo tipo sono solitamente potenziali siti di controllo: in effetti, nella glicolisi il controllo del flusso è del tutto legato alla regolazione dell'attività di questi tre enzimi.
Esistono diversi modi per regolare l'attività di un enzima. Un meccanismo immediato di controllo è quello che avviene attraversoregolazione allostericao attraverso modificazionicovalenti(come unafosforilazione). Una forma più lenta di controllo coinvolge invece direttamente l'espressione genicadei singoli enzimi delpathway.
Controllo dell'esochinasi
[modifica|modifica wikitesto]Laesochinasiè inibita da elevate concentrazioni diglucosio-6-fosfato,il prodotto da essa generato in seguito allafosforilazionedelglucosio.Tale inibizione è necessaria per prevenire l'accumulo di questo metabolita nella cellula nei casi in cui la velocità di flusso complessiva delpathwayè bassa. Il glucosio entrato nella cellula, infatti, fintantoché non viene processato dalla esochinasi, è libero di diffondere nuovamente verso il circolo sanguigno (rendendosi disponibile eventualmente ad altri distretti dell'organismo), a differenza di quanto avviene per il glucosio-6-fosfato, carico e dunque impossibilitato a passare la membrana. Un suo eccessivo accumulo, inoltre, causerebbe un elevato rigonfiamento della cellula perosmosi.
Nelle cellule epatiche, il glucosio-6-fosfato in eccesso viene accumulato comeglicogeno.In queste cellule, come già detto, non è presente la comune esochinasi, ma laglucochinasi.[89]Essa non viene inibita dal G6P, dunque può continuare a produrlo liberamente, dal momento che l'eccesso viene indirizzato a diventare glicogeno. Questo meccanismo è fondamentale nei casi in cui laglicemiaè alta[90](ad esempio al termine di un pasto), ma anche quando la glicemia è molto bassa (a digiuno), dal momento che il glicogeno può essere nuovamente convertito a glucosio-6-fosfato entrando nella via glicolitica oppure tornando a glucosio (attraverso l'enzima glucosio-6-fosfatasi), che viene re-immesso nel circolo sanguigno.
Controllo della fosfofruttochinasi
[modifica|modifica wikitesto]Lafosfofruttochinasi[91]è probabilmente il più importante sito di controllo delpathway,dal momento che si trova immediatamente a valle del punto di ingresso nella via metabolica degliesosialternativi al glucosio (comefruttosioegalattosio).[92][93]
Alti livelli diATP[75]inibiscono la fosfofruttochinasi, riducendone l'affinità per ilfruttosio-6-fosfato.Questo effetto viene raggiunto attraverso il legame dell'ATPa specifiche regioni diregolazione allosterica(distinte dai siti catalitici). L'AMPha invece l'effetto opposto, attivando l'enzima.[75]Per questo motivo, l'attività della fosfofruttochinasi è saldamente legata al bilancio cellulare diATP/AMP,[76]che può essere a buon ragione inteso come lariserva corrente di energia cellulare,a cui le vie energetiche come la glicolisi sono tenute ad adattarsi.
Dal momento che la glicolisi è anche una fonte di scheletri carboniosi per la biosintesi, un controllo afeedback negativodella glicolisi viene anche da molecole come ilcitrato:questa molecola, infatti, è in grado di aumentare l'effetto inibitorio esercitato dall'ATPsull'enzima.[75]Il citrato, infatti, è un intermedio precoce delciclo di Krebs:un alto livello di citrato, dunque, implica un'alta quantità cellulare di precursori biosintetici.
Anche i bassi livelli dipHinibiscono l'attività della fosfofruttochinasi, prevenendo così una eccessiva produzione diacido lattico,in grado di generare un crollo ulteriore del pH, condizione molto grave per l'organismo.
Il fruttosio 2,6-bisfosfato è infine un potente attivatore della fosfofruttochinasi (in particolare della fosfofruttochinasi-1).[76]Tale molecola viene prodotta dallafosforilazionedelfruttosio-6-fosfatoda parte della fosfofruttochinasi-2. Questo secondo enzima è inattivo qualora i livelli dicAMPsiano alti, correlando così la via glicolitica al sistemaormonale.[76]Sia ilglucagoneche l'adrenalina,infatti, generano alti livelli di cAMP e bassi di fruttosio 2,6-bisfosfato: ciò conduce nel fegato ad una elevatagluconeogenesi,in grado di rendere disponibile per l'organismo grandi quantità di glucosio.[94]
Controllo della piruvato chinasi
[modifica|modifica wikitesto]Lapiruvato chinasiè l'enzima che catalizza la terza reazione irreversibile della via metabolica, che produceATPepiruvato,l'intermedio metabolico centrale per una successiva ossidazione o per numerosipathwayanabolici.Esistono tre isoforme dell'enzima neimammiferi:iltipo Lè predominante nelfegato,iltipo Mnelmuscoloe nelcervelloe iltipo Anegli altri tessuti.[48]
Tutte le forme appena descritte, legano ilfosfoenolpiruvatocooperativamente.Ilfruttosio-1,6-bisfosfato,il prodotto della precedente reazione irreversibile, è in grado di attivare questi isoenzimi. L'ATPinvece, come avviene anche per lafosfofruttochinasi,inibisceallostericamenteentrambe le isoforme, riducendo la velocità della glicolisi.[95]Anche l'alanina,prodotta in un solo passaggio a partire dal piruvato, inibisce allostericamente entrambe le isoforme (segnalando in questo caso l'abbondanza di amminoacidi per lasintesi proteica).
La regolazione delle due isoforme differisce invece a livello della loro suscettibilità alle modificazionicovalenti.[96]Le proprietà catalitiche deltipo Lpossono essere modulate anche da unafosforilazionereversibile. Se c'è una bassaglicemia,infatti, ilglucagone,iglucocorticoidie lecatecolaminesono in grado di innalzare i livelli cellulari dicAMP,inducendo la fosforilazione della piruvato chinasi.[97]Questa fosforilazione, così come il controllo della fosfofruttochinasi legato al fruttosio-2,6-bisfosfato impedisce al fegato di consumare inutilmente glucosio, soprattutto se è necessario nei muscoli o nel cervello (nei quali infatti non si verifica alcuna inibizione della piruvato chinasi in caso di bassa glicemia).[98]
Aumento della glicolisi nei tumori
[modifica|modifica wikitesto]In condizionianaerobiche,la glicolisi è l'unico meccanismo in grado di fornire rapidamenteATP(attraverso lefermentazionitipiche dei batteri e dei lieviti anaerobici). In ogni caso, nell'uomo la glicolisi è accoppiata alla respirazione aerobica. In presenza di ossigeno, ilmitocondriointernalizza ilpiruvato,ossidandolo ulteriormente ad ottenere CO2eacqua.Per questo motivo, l'attività glicolitica neimammiferiè minore di quella dei microrganismi anaerobici: il numero di molecole diATPche possono essere ottenute dalla ossidazione completa del piruvato, infatti, è 18-19 volte maggiore di quello proveniente dalla sola glicolisi.[48]
Le celluletumoralipossono presentare livelli di attività glicolitica[99]fino a 200 volte superiori a quelli dei tessuti sani, anche in presenza di grandi concentrazioni di ossigeno. Ciò può essere spiegato attraverso un elevato consumo locale di ossigeno, che ne genera concretamente una carenza nelle cellule tumorali,[100]con conseguente innalzamento dei livelli di glicolisi. Questo fenomeno è stato descritto per la prima volta nel1930daOtto Warburg[101]ed è quindi per questo motivo che è chiamatoeffetto Warburg.L'interruttore glicolitico dell'effetto Warburg osservato nei tessuti maligni è attivato dal danno ossidativo mitocondriale e/o dall'attivazione di fattori di trascrizione redox-sensibili, che si traduce in un aumento della resistenza delle cellule agli ossidanti.[102]
In ogni caso, ciò è stato spiegato anche dalla presenza in quantità maggiori di una particolare forma diesochinasilegata ai mitocondri, che genera un aumento dell'attività glicolitica senza che l'ossigeno sia necessariamente consumato[103];l'esochinasi e più in generale l'effetto Warburg potrebbe diventare un target per un'efficace terapia dei tumori.[104][105][106][107][108]
Recentemente è stato visto che nei soggetti diabetici v'è un aumento dell'incidenza dei tumori per un incremento della produzione di chetoni, che insieme al lattato si comportano da combustibile per le cellule tumorali e le metastasi per uneffetto Warbur inverso.[109]
Il vantaggio biologico che le cellule tumorali acquisiscono con questo tipo di metabolismo non è del tutto chiaro, ma sembra che l'effetto Warburgserva in realtà tutte le cellule proliferanti come adattamento per agevolare la diffusione e l'incorporazione di sostanze nutritive nella biomassa (ad esempio, i nucleotidi, aminoacidi elipidi) necessari per produrre una nuova cellula.[110]
Questo effetto ha delle conseguenze molto rilevanti in alcune applicazioni biomediche. L'elevata glicolisi delle cellule tumorali, infatti, può essere utilizzato come fattore diagnostico di un tumore, come fattore per la valutazione di efficacia del trattamento, nonché per una esatta localizzazione della massa tumorale attraverso tecniche diimaging[111]mediate da un radiotracciante perPET[112][113]come ilfluorodesossiglucosio[114](un substrato modificato dellaesochinasi).
Malattie metaboliche
[modifica|modifica wikitesto]Nell'aciduria combinata malonica e metilmalonica(CMAMMA) dovuta alla carenza diACSF3,la glicolisi è ridotta del -50%, che ha la sua causa nella ridottalipolilazionedegli enzimi mitocondriali, tra cui ilcomplesso della piruvato deidrogenasie ilcomplesso della alfa-chetoglutarato deidrogenasi.[115]
Note
[modifica|modifica wikitesto]- ^DiPI Online - Dizionario di Pronuncia Italiana,suwww.dipionline.it.URL consultato il 28 dicembre 2022.
- ^Nelson e Cox,p. 531.
- ^(EN) F. Marini, S. Radin; P. Tenchini,[The story of oxygen (2)],inChir Ital,vol. 37, n. 2, aprile 1985, pp. 129-38,PMID4017137.
- ^(EN) JF. Kasting, DH. Eggler; SP. Raeburn; JF. Kasting,Mantle redox evolution and the oxidation state of the Archean atmosphere.,inJ Geol,vol. 101, n. 2, marzo 1993, pp. 245-57,PMID11537741.
- ^(EN) RS. Ronimus, HW. Morgan,Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism.,inArchaea,vol. 1, n. 3, ottobre 2003, pp. 199-221,PMID15803666.
- ^Romano AH, Conway T. (1996) Evolution of carbohydrate metabolic pathways.Res Microbiol.147(6-7):448-55PMID 9084754
- ^(EN) LA. Fothergill-Gilmore, PA. Michels,Evolution of glycolysis.,inProg Biophys Mol Biol,vol. 59, n. 2, 1993, pp. 105-235,PMID8426905.
- ^W. de Souza,Special organelles of some pathogenic protozoa.,inParasitol Res,vol. 88, n. 12, dicembre 2002, pp. 1013-25,DOI:10.1007/s00436-002-0696-2,PMID12444449.
- ^JR. Haanstra, A. van Tuijl; P. Kessler; W. Reijnders; PA. Michels; HV. Westerhoff; M. Parsons; BM. Bakker,Compartmentation prevents a lethal turbo-explosion of glycolysis in trypanosomes.,inProc Natl Acad Sci U S A,vol. 105, n. 46, novembre 2008, pp. 17718-23,DOI:10.1073/pnas.0806664105,PMID19008351.
- ^M. Parsons,Glycosomes: parasites and the divergence of peroxisomal purpose.,inMol Microbiol,vol. 53, n. 3, agosto 2004, pp. 717-24,DOI:10.1111/j.1365-2958.2004.04203.x,PMID15255886.
- ^JM. Silverman, SK. Chan; DP. Robinson; DM. Dwyer; D. Nandan; LJ. Foster; NE. Reiner,Proteomic analysis of the secretome of Leishmania donovani.,inGenome Biol,vol. 9, n. 2, 2008, pp. R35,DOI:10.1186/gb-2008-9-2-r35,PMID18282296.
- ^M. Parsons, T. Furuya; S. Pal; P. Kessler,Biogenesis and function of peroxisomes and glycosomes.,inMol Biochem Parasitol,vol. 115, n. 1, giugno 2001, pp. 19-28,PMID11377736.
- ^FR. Opperdoes,Compartmentation of carbohydrate metabolism in trypanosomes.,inAnnu Rev Microbiol,vol. 41, 1987, pp. 127-51,DOI:10.1146/annurev.mi.41.100187.001015,PMID3120638.
- ^F. Lipmann, G. Embden,Reminiscences of Embden's formulation of the Embden-Meyerhof cycle.,inMol Cell Biochem,vol. 6, n. 3, marzo 1975, pp. 171-5,PMID165399.
- ^N. Kresge, RD. Simoni; RL. Hill; OF. Meyerhof,Otto Fritz Meyerhof and the elucidation of the glycolytic pathway.,inJ Biol Chem,vol. 280, n. 4, gennaio 2005, pp. e3,PMID15665335.
- ^HG. Schweiger, O. Meyerhof,Otto Meyerhof 1884-1951.,inEur J Cell Biol,vol. 35, n. 2, novembre 1984, pp. 147-8,PMID6394328.
- ^MA. Shampo, RA. Kyle; OF. Meyerhof,Otto Meyerhof--Nobel Prize for studies of muscle metabolism.,inMayo Clin Proc,vol. 74, n. 1, gennaio 1999, p. 67,PMID9987536.
- ^AP. BADAWCZE, JK. PARNAS,[Works of Jakub Karol Parnas presented during 1907-1939.],inActa Biochim Pol,vol. 3, n. 1, 1956, pp. 3-39,PMID13338986.
- ^WS. Ostrowski, JK. Parnas,[Jakub Karol Parnas: his life and work],inPostepy Biochem,vol. 32, n. 3, 1986, pp. 247-60,PMID3554189.
- ^Z. Zielińska, JK. Parnas,Jakub Karol Parnas, 1884-1949.,inActa Physiol Pol,vol. 38, n. 2, pp. 91-9,PMID3314349.
- ^NG. Coley,Medical chemists and the origins of clinical chemistry in Britain (circa 1750-1850).,inClin Chem,vol. 50, n. 5, maggio 2004, pp. 961-72,DOI:10.1373/clinchem.2003.029645,PMID15105362.
- ^N. Mani,The historical background of clinical chemistry.,inJ Clin Chem Clin Biochem,vol. 19, n. 6, giugno 1981, pp. 311-22,PMID7024459.
- ^J. Büttner,From chemistry of life to chemistry of disease: the rise of clinical biochemistry.,inClin Biochem,vol. 13, n. 5, ottobre 1980, pp. 232-5,PMID6780238.
- ^:: Pasteur Foundation - The U.S. nonprofit affiliate of the Institut Pasteur::,supasteurfoundation.org.URL consultato l'11 ottobre 2010(archiviato dall'url originaleil 14 ottobre 2010).
- ^LF. Haas, L. Pasteur,Louis Pasteur (1822-95).,inJ Neurol Neurosurg Psychiatry,vol. 64, n. 3, marzo 1998, p. 330,PMID9527143.
- ^J. Joaquín Izquierdo,[A flash of genius and the work of Louis Pasteur (1822-1895)],inGac Med Mex,vol. 100, n. 1, luglio 1973, pp. 79-80,PMID4583346.
- ^A. Martínez-Palomo, L. Pasteur,The science of Louis Pasteur: a reconsideration.,inQ Rev Biol,vol. 76, n. 1, marzo 2001, pp. 37-45,PMID11291570.
- ^abOeuvres de Pasteur. Tome 2 / réunies par Pasteur Vallery-Ra... - Gallica,sugallica.bnf.fr.URL consultato l'11 ottobre 2010(archiviatoil 4 maggio 2012).
- ^L. Jaenicke, E. Buchner,Centenary of the award of a Nobel prize to Eduard Buchner, the father of biochemistry in a test tube and thus of experimental molecular bioscience.,inAngew Chem Int Ed Engl,vol. 46, n. 36, 2007, pp. 6776-82,DOI:10.1002/anie.200700390,PMID17600804.
- ^F. Kohl, E. Buchner,[A milestone of biochemistry and enzyme research. 100 years ago the German physiologist and chemist Eduard Buchner demonstrated "cell-free fermentation" in yeast extracts],inDtsch Med Wochenschr,vol. 123, n. 25-26, giugno 1998, pp. 814-7,DOI:10.1055/s-0029-1233241,PMID9672490.
- ^RA. Kyle, MA. Shampo; E. Buchner,Eduard Buchner.,inJAMA,vol. 245, n. 20, p. 2096,PMID7014942.
- ^Perestratto cellularesi intende la raccolta delcitoplasmae di tutto il contenuto di unacellulain seguito alla sua lisi.
- ^RE. Kohler, A. Harden A,The background to Arthur Harden's discovery of cozymase.,inBull Hist Med,vol. 48, n. 1, 1974, pp. 22-40,PMID4370723.
- ^KL. Manchester, A. Harden,Arthur Harden: an unwitting pioneer of metabolic control analysis.,inTrends Biochem Sci,vol. 25, n. 2, febbraio 2000, pp. 89-92,PMID10664590.
- ^KL. Manchester, E. Buchner; AC. Hill; A. Harden,Biochemistry comes of age: a century of endeavour.,inEndeavour,vol. 24, n. 1, 2000, pp. 22-7,PMID10824440.
- ^Young, William John (1878 - 1942) Biographical Entry - Australian Dictionary of Biography Online,suadbonline.anu.edu.au.URL consultato l'11 ottobre 2010(archiviatoil 23 giugno 2010).
- ^Young, William John - Biographical entry - Encyclopedia of Australian Science,sueoas.info.URL consultato l'11 ottobre 2010(archiviatoil 10 agosto 2011).
- ^FF. NORD, C. NEUBERG,Carl Neuberg; 1877-1956.,inAdv Carbohydr Chem,vol. 13, 1958, pp. 1-7,PMID13605967.
- ^A. GOTTSCHALK, C. NEUBERG,Prof. Carl Neuberg.,inNature,vol. 178, n. 4536, ottobre 1956, pp. 722-3,PMID13369516.
- ^AL. GRAUER, C. NEUBERG,[Carl Neuberg, 1877-1956.],inEnzymologia,vol. 18, n. 1, gennaio 1957, pp. 1-2,PMID13414707.
- ^OH. Warburg,The classic: The chemical constitution of respiration ferment.,inClin Orthop Relat Res,vol. 468, n. 11, novembre 2010, pp. 2833-9,DOI:10.1007/s11999-010-1534-y,PMID20809165.
- ^O. Warburg, O. Warburg,[Otto Warburg: a biographical essay (author's transl)],inSeikagaku,vol. 51, n. 3, marzo 1979, pp. 139-60,PMID381542.
- ^RA. Brand,Biographical sketch: Otto Heinrich Warburg, PhD, MD.,inClin Orthop Relat Res,vol. 468, n. 11, novembre 2010, pp. 2831-2,DOI:10.1007/s11999-010-1533-z,PMID20737302.
- ^FG. YOUNG, G. CORI,Gerty T. Cori.,inBr Med J,vol. 2, n. 5054, novembre 1957, pp. 1183-4,PMID13472084.
- ^BA. HOUSSAY, CF. CORI,Carl F. and Gerty T. Cori.,inBiochim Biophys Acta,vol. 20, n. 1, aprile 1956, pp. 11-6,PMID13315342.
- ^RD. Simoni, RL. Hill; M. Vaughan; CF. Cori; GT. Cori,Carbohydrate Metabolism: Glycogen Phosphorylase and the Work of Carl F. and Gerty T.Cori. 1928-1943.,inJ Biol Chem,vol. 277, n. 29, luglio 2002, pp. 18e,PMID12118037.
- ^abcdNelson e Cox,p. 534.
- ^abcdSiliprandi e Tettamanti,p. 298.
- ^Nelson e Cox,p. 533.
- ^Nelson e Cox,p. 612.
- ^abcNelson e Cox,p. 535.
- ^Iynedjian PB,Molecular physiology of mammalian glucokinase,inCell. Mol. Life Sci.,vol. 66, n. 1, gennaio 2009, pp. 27–42,DOI:10.1007/s00018-008-8322-9,PMC2780631,PMID18726182.
- ^Yanagawa T, Funasaka T, Tsutsumi S, Hu H, Watanabe H, Raz A,Regulation of phosphoglucose isomerase/autocrine motility factor activities by the poly(ADP-ribose) polymerase family-14,inCancer Res.,vol. 67, n. 18, settembre 2007, pp. 8682–9,DOI:10.1158/0008-5472.CAN-07-1586,PMID17875708.
- ^Rider MH, Bertrand L, Vertommen D, Michels PA, Rousseau GG, Hue L,6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis,inBiochem. J.,vol. 381, Pt 3, agosto 2004, pp. 561–79,DOI:10.1042/BJ20040752,PMC1133864,PMID15170386.
- ^Kochman M, Dobryszycki P,Topography and conformational changes of fructose-1,6-bisphosphate aldolase,inActa Biochim. Pol.,vol. 38, n. 4, 1991, pp. 407–21,PMID1814134.
- ^Lee JC,Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates,inActa Biochim. Biophys. Sin. (Shanghai),vol. 40, n. 7, luglio 2008, pp. 663–9,PMC2562701,PMID18604458.
- ^Nelson e Cox,p. 537.
- ^MK. Kalyananda, R. Engel; BE. Tropp,Metabolism of L-glyceraldehyde 3-phosphate in Escherichia coli.,inJ Bacteriol,vol. 169, n. 6, giugno 1987, pp. 2488-93,PMID3294792.
- ^J. Jeffery,Kinetic aspects of soluble dehydrogenases requiring nicotinamide coenzymes.,inExperientia Suppl,vol. 36, 1980, pp. 1-39,PMID6987074.
- ^FL. Crane, H. Goldenberg; DJ. Morré; H. Löw,Dehydrogenases of the plasma membrane.,inSubcell Biochem,vol. 6, 1979, pp. 345-99,PMID377585.
- ^E. Beutler,PGK deficiency.,inBr J Haematol,vol. 136, n. 1, gennaio 2007, pp. 3-11,DOI:10.1111/j.1365-2141.2006.06351.x,PMID17222195.
- ^L. Busque, DG. Gilliland,The PGK-PCR clonality assay (PPCA).,inMethods Mol Biol,vol. 31, 1994, pp. 237-46,DOI:10.1385/0-89603-258-2:237,PMID7921021.
- ^HC. João, RJ. Williams,The anatomy of a kinase and the control of phosphate transfer.,inEur J Biochem,vol. 216, n. 1, agosto 1993, pp. 1-18,PMID8365395.
- ^J. Puttick, EN. Baker; LT. Delbaere,Histidine phosphorylation in biological systems.,inBiochim Biophys Acta,vol. 1784, n. 1, gennaio 2008, pp. 100-5,DOI:10.1016/j.bbapap.2007.07.008,PMID17728195.
- ^MJ. Jedrzejas, P. Setlow,Comparison of the binuclear metalloenzymes diphosphoglycerate-independent phosphoglycerate mutase and alkaline phosphatase: their mechanism of catalysis via a phosphoserine intermediate.,inChem Rev,vol. 101, n. 3, marzo 2001, pp. 607-18,PMID11712498.
- ^MJ. Jedrzejas,Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase.,inProg Biophys Mol Biol,vol. 73, n. 2-4, 2000, pp. 263-87,PMID10958932.
- ^JA. Gerlt, PC. Babbitt; I. Rayment,Divergent evolution in the enolase superfamily: the interplay of mechanism and specificity.,inArch Biochem Biophys,vol. 433, n. 1, gennaio 2005, pp. 59-70,DOI:10.1016/j.abb.2004.07.034,PMID15581566.
- ^JM. Brewer,Yeast enolase: mechanism of activation by metal ions.,inCRC Crit Rev Biochem,vol. 11, n. 3, 1981, pp. 209-54,PMID7030619.
- ^JC. Lee,Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates.,inActa Biochim Biophys Sin (Shanghai),vol. 40, n. 7, luglio 2008, pp. 663-9,PMID18604458.
- ^TE. Roche, Y. Hiromasa,Pyruvate dehydrogenase kinase regulatory mechanisms and inhibition in treating diabetes, heart ischemia, and cancer.,inCell Mol Life Sci,vol. 64, n. 7-8, aprile 2007, pp. 830-49,DOI:10.1007/s00018-007-6380-z,PMID17310282.
- ^MC. Sugden, MJ. Holness,Mechanisms underlying regulation of the expression and activities of the mammalian pyruvate dehydrogenase kinases.,inArch Physiol Biochem,vol. 112, n. 3, luglio 2006, pp. 139-49,DOI:10.1080/13813450600935263,PMID17132539.
- ^abcdeL. Garfinkel, D. Garfinkel,Magnesium regulation of the glycolytic pathway and the enzymes involved.,inMagnesium,vol. 4, n. 2-3, 1985, pp. 60-72,PMID2931560.
- ^Il prefisso bis- si riferisce alla presenza di due gruppi fosfato in posizioni diverse; il prefisso di- (usato ad esempio per la molecola diADP) è invece da evitare in questo caso, perché si riferisce alla presenza di due fosfati nella stessa posizione della molecola.
- ^abNelson e Cox,p. 536.
- ^abcdefgSiliprandi e Tettamanti,p. 288.
- ^abcdSiliprandi e Tettamanti,p. 289.
- ^abcCampbell e Farrell,p. 505.
- ^Nelson e Cox,p. 538.
- ^abcdNelson e Cox,p. 541.
- ^A. HOLT e F. WOLD,The isolation and characterization of rabbit muscle enolase.,inJ Biol Chem,vol. 236, dicembre 1961, pp. 3227-31,PMID13908561.
- ^Nelson e Cox,p. 542.
- ^F. Sanguinetti, M. Dompé e S. Mantovani,[Circadian rhythms in urinary coproporphyrin and delta-aminolevulinic acid],inAnn Ist Super Sanita,vol. 14, n. 3, 1978, pp. 601-5,PMID755411.
- ^DP. Hanlon e EW. Westhead,Kinetic studies on the activation of yeast enolase by divalent cations.,inBiochemistry,vol. 8, n. 11, novembre 1969, pp. 4255-60,PMID5353098.
- ^IR. Hamilton,Effects of fluoride on enzymatic regulation of bacterial carbohydrate metabolism.,inCaries Res,11 Suppl 1, 1977, pp. 262-91,PMID318573.
- ^abSiliprandi e Tettamanti,p. 294.
- ^RH. Lustig,Fructose: metabolic, hedonic, and societal parallels with ethanol.,inJ Am Diet Assoc,vol. 110, n. 9, settembre 2010, pp. 1307-21,DOI:10.1016/j.jada.2010.06.008,PMID20800122.
- ^abcdeSiliprandi e Tettamanti,p. 344.
- ^abcNelson e Cox,p. 547.
- ^PB. Iynedjian,Molecular physiology of mammalian glucokinase.,inCell Mol Life Sci,vol. 66, n. 1, gennaio 2009, pp. 27-42,DOI:10.1007/s00018-008-8322-9,PMID18726182.
- ^M. Pal,Recent advances in glucokinase activators for the treatment of type 2 diabetes.,inDrug Discov Today,vol. 14, n. 15-16, agosto 2009, pp. 784-92,DOI:10.1016/j.drudis.2009.05.013,PMID19520181.
- ^JP. Bolaños, A. Almeida; S. Moncada,Glycolysis: a bioenergetic or a survival pathway?,inTrends Biochem Sci,vol. 35, n. 3, marzo 2010, pp. 145-9,DOI:10.1016/j.tibs.2009.10.006,PMID20006513.
- ^PA. Michels, DJ. Rigden,Evolutionary analysis of fructose 2,6-bisphosphate metabolism.,inIUBMB Life,vol. 58, n. 3, marzo 2006, pp. 133-41,DOI:10.1080/15216540600688280,PMID16766380.
- ^G. Wegener, U. Krause,Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle.,inBiochem Soc Trans,vol. 30, n. 2, aprile 2002, pp. 264-70,DOI:10.1042/bst0300264,PMID12023862.
- ^Siliprandi e Tettamanti,p. 290.
- ^MS. Patel, LG. Korotchkina,Regulation of the pyruvate dehydrogenase complex.,inBiochem Soc Trans,vol. 34, Pt 2, aprile 2006, pp. 217-22,DOI:10.1042/BST20060217,PMID16545080.
- ^MC. Sugden, MJ. Holness,Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs.,inAm J Physiol Endocrinol Metab,vol. 284, n. 5, maggio 2003, pp. E855-62,DOI:10.1152/ajpendo.00526.2002,PMID12676647.
- ^(EN) S. Jitrapakdee, JC. Wallace,Structure, function and regulation of pyruvate carboxylase.,inBiochem J,340 ( Pt 1), maggio 1999, pp. 1-16,PMID10229653.
- ^(EN) T. Noguchi,[Regulation of pyruvate kinase gene expression and its clinical application],inRinsho Byori,vol. 38, n. 8, agosto 1990, pp. 868-75,PMID2232246.
- ^CX. Bittner, A. Loaiza; I. Ruminot; V. Larenas; T. Sotelo-Hitschfeld; R. Gutiérrez; A. Córdova; R. Valdebenito; WB. Frommer; LF. Barros,High resolution measurement of the glycolytic rate.,inFront Neuroenergetics,vol. 2, 2010,DOI:10.3389/fnene.2010.00026,PMID20890447.
- ^R. Diaz-Ruiz, M. Rigoulet; A. Devin,The Warburg and Crabtree effects: On the origin of cancer cell energy metabolism and of yeast glucose repression.,inBiochim Biophys Acta,settembre 2010,DOI:10.1016/j.bbabio.2010.08.010,PMID20804724.
- ^O. Warburg, F. Wind; E. Negelein,THE METABOLISM OF TUMORS IN THE BODY.,inJ Gen Physiol,vol. 8, n. 6, marzo 1927, pp. 519-30,PMID19872213.
- ^G. Pani, T. Galeotti; P. Chiarugi,Metastasis: cancer cell's escape from oxidative stress.,inCancer Metastasis Rev,vol. 29, n. 2, giugno 2010, pp. 351-78,DOI:10.1007/s10555-010-9225-4,PMID20386957.
- ^Bustamante and Pedersen, High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase, PNAS, 2005, 74 (9): 3735,supnas.org.URL consultato il 3 settembre 2006(archiviatoil 4 maggio 2008).
- ^SP. Mathupala, YH. Ko; PL. Pedersen,Hexokinase-2 bound to mitochondria: cancer's stygian link to the "Warburg Effect" and a pivotal target for effective therapy.,inSemin Cancer Biol,vol. 19, n. 1, febbraio 2009, pp. 17-24,DOI:10.1016/j.semcancer.2008.11.006,PMID19101634.
- ^Z. Chen, W. Lu; C. Garcia-Prieto; P. Huang,The Warburg effect and its cancer therapeutic implications.,inJ Bioenerg Biomembr,vol. 39, n. 3, giugno 2007, pp. 267-74,DOI:10.1007/s10863-007-9086-x,PMID17551814.
- ^H. Pelicano, DS. Martin; RH. Xu; P. Huang,Glycolysis inhibition for anticancer treatment.,inOncogene,vol. 25, n. 34, agosto 2006, pp. 4633-46,DOI:10.1038/sj.onc.1209597,PMID16892078.
- ^N. Serkova, LG. Boros,Detection of resistance to imatinib by metabolic profiling: clinical and drug development implications.,inAm J Pharmacogenomics,vol. 5, n. 5, 2005, pp. 293-302,PMID16196499.
- ^RH. Xu, H. Pelicano; Y. Zhou; JS. Carew; L. Feng; KN. Bhalla; MJ. Keating; P. Huang,Inhibition of glycolysis in cancer cells: a novel strategy to overcome drug resistance associated with mitochondrial respiratory defect and hypoxia.,inCancer Res,vol. 65, n. 2, gennaio 2005, pp. 613-21,PMID15695406.
- ^G. Bonuccelli, A. Tsirigos; D. Whitaker-Menezes; S. Pavlides; RG. Pestell; B. Chiavarina; PG. Frank; N. Flomenberg; A. Howell; UE. Martinez-Outschoorn; F. Sotgia,Ketones and lactate "fuel" tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism.,inCell Cycle,vol. 9, n. 17, settembre 2010, pp. 3506-14,PMID20818174.
- ^MG. Vander Heiden, LC. Cantley; CB. Thompson,Understanding the Warburg effect: the metabolic requirements of cell proliferation.,inScience,vol. 324, n. 5930, maggio 2009, pp. 1029-33,DOI:10.1126/science.1160809,PMID19460998.
- ^64Cu-1,4,7,10-Tetraazacyclododecane-1,4,7-Tris-acetic acid-10-maleimidoethylacetamide-ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGTG -- Molecular Imaging and Contrast Agent Database (MICAD) -- NCBI Bookshelf,suncbi.nlm.nih.gov.URL consultato il 12 ottobre 2010(archiviatoil 27 settembre 2009).
- ^IF. Robey, RM. Stephen; KS. Brown; BK. Baggett; RA. Gatenby; RJ. Gillies,Regulation of the Warburg effect in early-passage breast cancer cells.,inNeoplasia,vol. 10, n. 8, agosto 2008, pp. 745-56,PMID18670636.
- ^GJ. Kelloff, JM. Hoffman; B. Johnson; HI. Scher; BA. Siegel; EY. Cheng; BD. Cheson; J. O'shaughnessy; KZ. Guyton; DA. Mankoff; L. Shankar,Progress and promise of FDG-PET imaging for cancer patient management and oncologic drug development.,inClin Cancer Res,vol. 11, n. 8, aprile 2005, pp. 2785-808,DOI:10.1158/1078-0432.CCR-04-2626,PMID15837727.
- ^E. Bustamante, PL. Pedersen,High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase.,inProc Natl Acad Sci U S A,vol. 74, n. 9, settembre 1977, pp. 3735-9,PMID198801.
- ^Zeinab Wehbe, Sidney Behringer e Khaled Alatibi,The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism,inBiochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids,vol. 1864, n. 11, 1º novembre 2019, pp. 1629–1643,DOI:10.1016/j.bbalip.2019.07.012.
Bibliografia
[modifica|modifica wikitesto]- J. W. Baynes e M. H. Dominiczak,Biochimica per le discipline biomediche,Casa Editrice Ambrosiana, 2006ISBN 88-408-1353-5.
- Jeremy M. Berg, John L. Tymoczko e Lubert StryerBiochimica,Bologna, Zanichelli, 2003ISBN 88-08-07893-0.
- (EN) Mary K. Campbell e Shawn O. Farrell,Biochemistry,Cengage Learning, 2007,ISBN978-0-495-39041-1.
- V. Donald, Voet Judith G. e Pratt Charlotte W.,Fondamenti di biochimica,Bologna, Zanichelli, 2001ISBN 88-08-09151-1.
- R. H. Garret, C. M. GrishamPrincipi di biochimicaPadova, Piccin, 2004ISBN 88-299-1693-5.
- David L. Nelson e Michael M. Cox,Principi di biochimica,Bologna, Zanichelli, 2002,ISBN88-08-09035-3.
- Noris Siliprandi e Guido Tettamanti,Biochimica medica,Piccin, 2005,ISBN978-88-299-1750-1.
Voci correlate
[modifica|modifica wikitesto]- Decarbossilazione ossidativa del piruvato
- Ciclo di Krebs
- Gluconeogenesi
- Glicogenosintesi
- Glicogenolisi
- Via dei pentoso fosfati
Altri progetti
[modifica|modifica wikitesto] Wikizionariocontiene il lemma di dizionario «glicolisi»
Wikizionariocontiene il lemma di dizionario «glicolisi» Wikiversitàcontiene risorse sullaglicolisi
Wikiversitàcontiene risorse sullaglicolisi Wikimedia Commonscontiene immagini o altri file sullaglicolisi
Wikimedia Commonscontiene immagini o altri file sullaglicolisi
Collegamenti esterni
[modifica|modifica wikitesto]- glicolisi,suTreccani.it – Enciclopedie on line,Istituto dell'Enciclopedia Italiana.
- (EN)glycolysis,suEnciclopedia Britannica,Encyclopædia Britannica, Inc.
- Glicolisi,sumuscolab.net.URL consultato l'11 settembre 2007(archiviato dall'url originaleil 29 agosto 2007).
- Glicolisi e ciclo di Krebs (con animazioni),sumy-personaltrainer.it.
- Gli enzimi della glicolisi,supianetachimica.it.
- (EN)Berg Jeremy M., Tymoczko John L. and Stryer LubertBiochemistry - Fifth Edition- W. H. Freeman and Company,suwhfreeman.com.URL consultato il 29 luglio 2006(archiviato dall'url originaleil 29 ottobre 2006).
- (EN)Le tappe della via metabolica,suncbi.nlm.nih.gov.
- (EN)Il controllo della glicolisi,suncbi.nlm.nih.gov.
| Controllo di autorità | Thesaurus BNCF33873·LCCN(EN)sh85055402·GND(DE)4157742-5·J9U(EN,HE)987007531216105171 |
|---|