Pressione osmotica
Lapressione osmoticaè unaproprietà colligativaassociata allesoluzioni.
Quando due soluzioni con lo stessosolvente,ma aconcentrazionidiverse disoluto,sono separate da unamembrana semipermeabile(cioè che lascia passare le molecole di solvente ma non quelle di soluto), lemolecoledi solvente si spostano dalla soluzione con minore concentrazione di soluto (quindi maggiore concentrazione di solvente) alla soluzione con maggiore concentrazione di soluto (quindi minore concentrazione di solvente), in modo da uguagliare (o meglio, rendere vicine) le concentrazioni delle due soluzioni; la pressione applicata dalle particelle di solvente, che passano dalla soluzione a concentrazione minore a quella a concentrazione maggiore, è detta "pressione osmotica".
La pressione osmotica deiliquidi cellularieintercellularisvolge un ruolo molto importante per gliesseri viventi,e il suo valore, come quello di altre costanti chimico-fisiche relative all'ambiente interno degliorganismi,non può variare oltre certi limiti senza compromettere la funzionalità e la sopravvivenza stessa dellecellule(vediomeostasi): la pressione osmotica determina ad esempio la concentrazione delleproteineplasmatiche.
Interpretazione fisica
[modifica|modifica wikitesto]
Il meccanismo con il quale si manifesta la pressione osmotica può essere interpretato considerando anzitutto che le particelle di unsolutotendono a disperdersi uniformemente nelsolvente,anche contro lagravità,così come quelle di ungastendono a occupare tutto lo spazio a loro disposizione: le particelle di soluto esercitano perciò una pressione analoga allapressionegassosa.
Se poi si considera un sistema costituito da unasoluzionee dal relativo solvente puro separati da una membrana semipermeabile, il numero delle molecole di solvente che nell'unità di tempo attraversano la membrana verso la soluzione è superiore al numero di molecole di solvente che la attraversano in senso opposto, perché nel primo caso le molecole che vengono a contatto con la membrana sono tutte di solvente, nel secondo caso invece si ha una certa percentuale di particelle di soluto[senza fonte],che non passano ma che esercitano comunque con i loro urti sulla membrana una pressione, appunto la pressione osmotica. Il meccanismo responsabile del passaggio del solvente verso la soluzione a maggior concentrazione è attualmente ritenuto legato alle interazioni delle molecole del soluto con la membrana[1]e successivo trasferimento alle molecole del solvente di momento di allontanamento dalla membrana.
La pressione generata dagli urti delle molecole di soluto non è direttamente misurabile, mentre è misurabile lapressione idrostaticache si determina nella soluzione a causa del maggior numero di molecole di solvente che vi penetrano rispetto a quelle che ne escono.
Wilhelm Friedrich Philipp PfeffereJacobus Henricus van 't Hoffhanno verificato leggi, parallele a quelle dei gas, che esprimono l'andamento della pressione osmotica in funzione dellaconcentrazionee dellatemperatura;queste leggi, nel caso di soluzioni di non-elettroliti, si compendiano in una relazione del tutto simile all'equazione di statodeigas perfetti:
Nel caso dielettroliti,è necessario moltiplicare il secondo membro per ilcoefficiente di van 't Hoffi,ottenendo l'equazione di van 't Hoff:
- Dove per entrambi i casi si ha che:
- è la pressione osmotica;
- è il volume della soluzione;
- è latemperatura assoluta(espressa inkelvin);
- sono lemolidi soluto;
- è lacostante universale dei gas(pari a 8,314472 J/mol·K);
- è lamolaritàdel soluto in soluzione.
Derivazione termodinamica
[modifica|modifica wikitesto]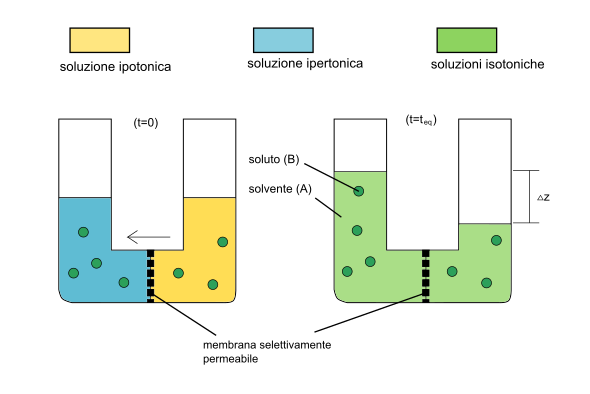
Per ottenere l'espressione sopra citata relativa alla pressione osmotica, dobbiamo considerare il sistema costituito da due soluzioni (α e β) all'equilibrio, con concentrazioni diverse dei componenti A (solvente) e B (soluto). Supponiamo più precisamente che la soluzione α sia costituita da solvente puro (A). Le due soluzioni sono separate da una membrana permeabile al solo componente A.
Essendo le due soluzioni a contatto tramite la membrana, all'equilibrio chimico[non chiaro]avremo l'uguaglianza deipotenziali chimicidel componente A nelle due soluzioni, ovvero:
da cui:
in cuiè lafrazione molaredel solvente nella soluzione β,è lacostante universale dei gas,eè latemperatura.
esi riferiscono a due pressioni differenti, quindi hanno valori diversi. In particolare, chiamiamo rispettivamentela pressione che insiste sulla membrana dal lato della soluzioneαela pressione che insiste sulla membrana dal lato della soluzioneβ.[3]
essendo la variazione del potenziale chimico di un componentein condizioni isoterme pari al volume parziale molare, cioè,sostituendo otteniamo:
la differenza tra le pressionieè lapressione osmoticaπ, quindi:
per soluzioni diluite, le seguenti approssimazioni sono valide:
in cuieindicano le moli di A e B nella soluzione β, eè la frazione molare di B nella soluzione β.
Effettuando le opportune sostituzioni, otteniamo:
ma essendo,con V pari al volume di β, ricaviamo infine:
conpari alla concentrazione molare di B in β.
Va sottolineato che, nonostante l'espressione della pressione osmotica e l'equazione di statodei gas ideali siano formalmente simili, la loro derivazione termodinamica, e quindi il loro significato fisico è assai differente.
Soluzioni ipotoniche, isotoniche e ipertoniche
[modifica|modifica wikitesto]Inchimicaè possibile indicare la pressione osmotica di una datasoluzionein termini quantitativi, conoscendone lamolaritàe latemperatura,oppure in relazione alla pressione osmotica di un'altra soluzione, presa come riferimento. In quest'ultimo caso la soluzione può avere una pressione osmotica inferiore, uguale o maggiore a quella con cui la si paragona. Si dice allora che la soluzione è, rispettivamente, ipotonica, isotonica o ipertonica rispetto a quella a cui la si paragona,[4]a seconda del grado ditonicitàtra le due soluzioni.
In particolare, indipendentemente dalla natura del soluto, soluzioni aventi la stessaconcentrazionehanno medesima pressione osmotica e si diconoisotoniche;le soluzioniipertonichesi presentano invece quando la pressione interna è maggiore di quella esterna mentre le soluzioniipotonicheviceversa.
Questo tipo di dizione, anche se puramente indicativa, è utile quando le due soluzioni sono separate da unamembrana semipermeabile,perché permette di dedurre un eventuale fenomeno diosmosi,ed è ricorrente inbiologiadove fenomeni di osmosi fra membrane hanno conseguenze rilevanti per lafisiologiadelle cellule.
Osmosi inversa
[modifica|modifica wikitesto]L'osmosi inversa è un'importante applicazione moderna dei principi dell'osmosi nei processi di purificazione odissalazionedelle acque, o per la concentrazione a freddo di soluzioni acquose.
Il meccanismo dell'osmosi inversa è presente anche in natura, per esempio nellapompa sodio-potassio,che regola la concentrazione degli ionisodioepotassioall'interno delle cellule.
Calcolo dei pesi molecolari tramite il processo di osmosi
[modifica|modifica wikitesto]Si prenda un tubo di vetro con una parte chiusa da una membrana semipermeabile, in questo caso permeabile all'acquae non allozucchero,e lo si riempia con una soluzione di acqua e zucchero. Si prenda un altro recipiente e lo si riempia di acqua. Se il tubo di vetro viene immerso nel recipiente d'acqua con la membrana semipermeabile verso il basso, i livelli di acqua pura e di soluzione acqua-zucchero saranno differenti per un'altezza.Questo significa che la pressione dell'acqua e quella della soluzione sono diverse di una quantità
dove:
- ρè ladensitàdello zucchero in soluzione;
- gè l'accelerazione di gravità.
Questa differenza è dovuta alla presenza dello zucchero ed è la pressione osmotica dello zucchero in soluzione.
Inoltre ponendoe sostituendo a nsoluto/V l'espressione c(g/litro)/PM, dovecè la concentrazione della soluzione ePMilpeso molecolaredi un soluto, otteniamo l'espressione:
conPMincognita.PMpuò essere ad esempio il peso molecolare di unaproteinaincognita presente in una soluzione, a concentrazione nota, di cui si vuole conoscere l'entità.
Note
[modifica|modifica wikitesto]- ^Philip Nelson,Biological Physics,W.H. Freeman, 16 dicembre 2013,ISBN978-0-7167-9897-2.
- ^conlnsi indica illogaritmo naturaleo in base,doveè ilnumero di Nepero.
- ^Più precisamente bisogna considerare la pressione transmembrana.
- ^Silvestroni,p. 278.
Bibliografia
[modifica|modifica wikitesto]- Paolo Silvestroni,Fondamenti di chimica,10ª ed., CEA, 1996,ISBN88-408-0998-8.
Voci correlate
[modifica|modifica wikitesto]Altri progetti
[modifica|modifica wikitesto] Wikimedia Commonscontiene immagini o altri file sullapressione osmotica
Wikimedia Commonscontiene immagini o altri file sullapressione osmotica
Collegamenti esterni
[modifica|modifica wikitesto]- (EN) Fatima Foflonker,osmotic pressure,suEnciclopedia Britannica,Encyclopædia Britannica, Inc.
- (EN)IUPAC Gold Book, "osmotic pressure",sugoldbook.iupac.org.
| Controllo di autorità | Thesaurus BNCF38945·GND(DE)4172912-2 |
|---|

































