Alcheni
Gli alcheni sono idrocarburi (cioè composti organici costituiti solamente da atomi di carbonio e idrogeno) aciclici contenenti esattamente un doppio legame C=C.[1] Gli alcheni fanno parte della classe delle olefine, alla quale appartengono anche i cicloalcheni e i polieni.[2]
Hanno formula bruta CnH2n.[1]
Il più semplice alchene esistente è l'etilene (o etene), avente formula CH2=CH2, dal quale si ottiene il polietilene attraverso polimerizzazione per addizione.
| Nome | Formula molecolare | Numero di atomi di carbonio | Massa molare | Numero CAS | Formula di struttura |
|---|---|---|---|---|---|
| Etilene (o etene) |
C2H4 | 2 | 28,054 g/mol | 74-85-1 | 
|
| Propilene (o propene) |
C3H6 | 3 | 42,08 g/mol | 115-07-1 | 
|
| 1-Butilene (o 1-butene) |
C4H8 | 4 | 56,11 g/mol | 106-98-9 | 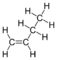
|
| 1-Pentene | C5H10 | 5 | 70,13 g/mol | 109-67-1 | 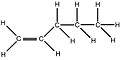
|
Come nel caso degli alcani, gli atomi di carbonio sono uniti tra loro attraverso legami covalenti a formare una catena aperta, lineare o ramificata; una coppia di atomi di carbonio adiacenti è però unita da un legame covalente doppio.
I due atomi di carbonio coinvolti nel doppio legame presentano orbitali ibridi di tipo sp2; questo fa sì che i tre atomi legati ad ognuno di essi si trovino ai tre vertici di un triangolo grosso modo equilatero. I due triangoli sono inoltre allineati lungo l'asse del legame e tra loro complanari.
Un legame C-C è di tipo σ, formato dalla sovrapposizione di due orbitali ibridi sp2 lungo l'asse del legame; il secondo legame è di tipo π, formato dalla sovrapposizione in direzione perpendicolare all'asse del legame dei due orbitali p non coinvolti nell'ibridazione.
A differenza di quanto accade negli alcani, la rotazione attorno al doppio legame è impedita. Questo, quando ognuno dei carboni coinvolti nel doppio legame reca sostituenti diversi, crea coppie di isomeri geometrici, che vengono distinti l'uno dall'altro tramite i prefissi "cis-" e "trans-" (si veda la voce formula chimica).
La presenza del doppio legame carbonio-carbonio conferisce agli alcheni una reattività superiore a quella dei corrispondenti alcani. Tale reattività si esplica principalmente in reazioni di addizione, che prevedono l'apertura del doppio legame e la sua conversione in due legami semplici. L'addizione di una molecola di alchene ad un'altra identica, ripetuta virtualmente all'infinito produce un esempio di polimero.
Nomenclatura IUPAC
[modifica | modifica wikitesto]La nomenclatura IUPAC degli alcheni segue regole simili a quella degli alcani, tuttavia occorre evidenziare alcune differenze:
- quando si individua la catena principale della molecola, questa deve includere i due atomi di carbonio coinvolti nel doppio legame.
- il nome che viene dato alla catena principale è simile a quanto previsto per gli alcani, ma il suffisso -ano viene sostituito dal suffisso -ene (etene, propene, butene, pentene, esene, eptene, ottene, etc...)
- nel numerare la catena principale, il numero più basso possibile dovrà essere assegnato ai due atomi di carbonio coinvolti nel doppio legame.
- quando ognuno dei due atomi coinvolti nel doppio legame ha legati a sé due sostituenti diversi, l'alchene presenta isomeria geometrica. Per distinguere i due isomeri si fa ricorso ai prefissi cis-, quando i due sostituenti più ingombranti di ogni atomo si trovano sul medesimo lato del doppio legame, e trans-, quando i due sostituenti più ingombranti di ogni atomo si trovano sui lati opposti del doppio legame. (Esempi alle pagine isomeria e formula chimica).
Fonti industriali
[modifica | modifica wikitesto]I due principali processi industriali di produzione degli alcheni sono il cracking catalitico a letto fluido (FCC, Fluid Catalytic Cracking) e lo steam cracking. Il primo è un processo proprio alle raffinerie, il secondo è un processo petrolchimico e produce essenzialmente etilene e propilene. La preparazione di 1-alcheni lineari con un numero pari di atomi di carbonio (1-dodecene, 1-tetradecene, 1-esadecene, etc.), impiegati nell'industria dei detergenti, viene condotta per polimerizzazione controllata dell'etene con i catalizzatori di Ziegler-Natta.
Test per gli alcheni
[modifica | modifica wikitesto]Come riconoscere gli alcheni
Reazione riconoscimento con Br2
Gli alcheni sono facilmente trasformabili dal cloro o dal bromo (lo iodio generalmente non reagisce) in dialogenuri, composti saturi che contengono 2 atomi di alogeno legati a due atomi di carbonio adiacenti. La reazione di addizione elettrofila avviene miscelando i due reagenti in presenza di un solvente inerte e procede velocemente a temperatura ambiente o anche più bassa. Si devono, anzi, evitare temperature più alte, un eccesso di alogeno e l’esposizione alla luce UV, poiché in queste condizioni la sostituzione potrebbe diventare una reazione secondaria importante. Il saggio è positivo (conferma della presenza di un doppio legame) se scompare la colorazione rossa dell’acqua di bromo (sia il dialogenuro che si forma, sia l’alchene sono incolori).
Alcuni agenti ossidanti trasformano gli alcheni in “glicoli”, composti organici che contengono due gruppi “– OH”, caratteristici degli alcoli. La reazione, nota come ossidrilazione, corrisponde all’addizione di due gruppi ossidrilici al doppio legame. Per il riconoscimento del doppio legame si utilizza, come agente ossidante, una soluzione diluita neutra o leggermente basica di permanganato di potassio. La reazione viene condotta a temperatura ambiente. Si devono evitare sia le alte temperature, sia l’aggiunta di acidi perché in queste condizioni può avvenire la scissione del doppio legame. Il saggio è positivo se scompare la soluzione violetta del KMnO4 sostituita da un precipitato bruno di biossido di manganese.
Preparazioni per sintesi
[modifica | modifica wikitesto]In laboratorio gli alcheni possono essere preparati per
- disidratazione degli alcoli
R-CH2-CH2OH → R-CH=CH2
- la reazione è catalizzata con agenti disidratanti quali l'allumina, l'anidride fosforica o l'acido solforico; in quest'ultimo caso, la formazione dell'etere è concorrenziale a quella dell'alchene; con alcuni alcoli è possibile indirizzare l'esito finale agendo sulle condizioni di reazione
- deidroalogenazione degli alogenuri alchilici (β-eliminazione)
R-CH2-CH2X + base → R-CH=CH2 (X = Cl, Br, I)
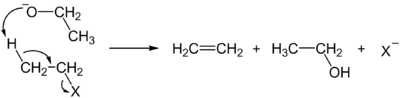
- la base generalmente usata in questi casi è l'idrossido di potassio in soluzione di etanolo; l'uso di basi in soluzione acquosa è meno efficace, dato che l'alogenuro alchilico è poco solubile in acqua.
- Gli alogenuri alchilici terziari sono i più reattivi, seguono i secondari e quindi i primari. Tra gli alogenuri, a parità di gruppo alchilico, gli ioduri sono i più reattivi, seguiti dai bromuri e quindi dai cloruri.
- Sia in questo caso, come nella disidratazione degli alcoli, verrà perso preferenzialmente l'idrogeno che porta alla formazione dell'alchene più stabile, cioè quello più sostituito - vale a dire quello che reca più gruppi alchilici possibile sui carboni impegnati nel doppio legame.
- dealogenazione dei dialogenuri vicinali
R-CH-CH2 | | + Zn → R-CH=CH2 (X = Cl, Br, I) X X
- reazione di Wittig (da Georg Wittig, che l'ha messa a punto nel 1954), cioè l'accoppiamento tra un'aldeide o un chetone ed un'ilide del fosforo, quest'ultima preparata in situ per reazione tra una fosfina (di solito la trifenilfosfina) ed un alogenuro alchilico, seguita dal trattamento con una base molto forte (un alchillitio nell'esempio)
Ph Ph
| |
1. Ph-P + R-CH2-X → Ph-P+-CH2 X-
| | |
Ph Ph R
Ph Ph
| |
2. Ph-P+-CH2 X- + R-Li → Ph-P+-CH- ilide di fosforo
| | | |
Ph R Ph R
Ph Ph
| |
3. Ph-P+-CH- + R'-C=O → R'-C=C-H + Ph-P=O
| | | | | |
Ph R R' R'R Ph
- Ph rappresenta convenzionalmente il gruppo fenile, cioè un benzene privo di un atomo di idrogeno, C6H5-
- La scelta dell'alogenuro alchilico e del chetone permette la sintesi dell'alchene desiderato.
È una reazione tra un diene ed un alchene sostituito con gruppi elettron-attrattori (detto dienofilo); produce un alchene ciclico.
ROOC COOR
\ /
CH2=CH ROOC COOR CH-CH
\ + \ / → / \
CH=CH2 CH=CH CH2 CH2
\ /
CH=CH
- rientra nel novero delle cosiddette reazioni elettrocicliche.
- reazione di Cope o eliminazione di Cope
È una reazione di eliminazione con cui, tramite riscaldamento, si trasforma un ossido di un'ammina terziaria in un alchene e una N,N-dialchilidrossilammina.

Reazioni tipiche
[modifica | modifica wikitesto]La maggior parte della reattività degli alcheni si esplica attraverso reazioni di addizione al doppio legame. Tale addizione può avvenire con meccanismo ionico (addizione elettrofila) o radicalico.
- addizione di idrogeno (formazione di alcani)
RR'C=CHR" + H2 → RR'CH-CH2R"
- avviene a temperature e pressioni non elevate in presenza di catalizzatori metallici quali il platino, il palladio o il nichel, producendo l'alcano corrispondente.
- L'efficienza del catalizzatore è direttamente legata alla sua dispersione ed alla sua capacità di adsorbire l'alchene; è probabile che l'adsorbimento trasferisca al metallo parte della densità elettronica del doppio legame, che risulta così indebolito e maggiormente attaccabile dall'idrogeno.
- addizione di alogeno
RR'C=CHR" + X2 → RR'CX-CXHR" X = Cl, Br
- È una reazione immediata e completa a temperatura ambiente, al punto che una soluzione di bromo in tetracloruro di carbonio è usata come reagente per caratterizzare gli alcheni, dato che in loro presenza subisce un immediato viraggio da arancione intenso ad incolore.
- L'addizione di alogeno ad un doppio legame procede con il meccanismo qui indicato, in cui si ha dapprima formazione di uno ione bromonio ciclico che viene successivamente aperto da un anione bromuro che lo approccia dal lato opposto inserendosi su uno o l'altro dei due atomi di carbonio in funzione dell'ingombro sterico.

- il meccanismo proposto spiega perché l'addizione di un alogeno ad un cicloalchene produce solo l'isomero trans-1,2 dialogenato e non il cis. Un'addizione di questo genere è detta anti (in opposto alla sin, in cui l'addizione avviene sullo stesso lato del doppio legame).
- formazione di aloidrine
RR'C=CHR" + X2 + H2O → RR'C-CHR"
| | X = Cl, Br
X OH
- È un'ulteriore conferma della formazione dello ione ciclico intermedio illustrato nel meccanismo precedente.
- Quando l'alogeno è addizionato all'alchene in presenza di acqua, insieme al prodotto di alogenazione si ottiene anche il corrispondente alcol 2-alogenato (noto anche come cloridrina o bromidrina, a seconda dell'alogeno impiegato), per apertura dello ione ciclico intermedio ad opera di uno ione OH-.
- addizione di acidi alogenidrici (formazione di alogenuri alchilici)
RR'C=CHR" + H-X → RR'CX-CH2R" (X = Cl, Br, I)
- È una reazione che avviene facendo gorgogliare l'acido alogenidrico secco nell'alchene o in una soluzione dell'alchene in un solvente organico polare; si evita l'acqua perché potrebbe competere nell'addizione con l'acido e quindi convertire l'alchene nell'alcol corrispondente.
- Quando l'alchene non è simmetrico, l'addizione di una molecola di acido alogenidrico può portare a due diversi prodotti; secondo la regola di Markovnikov, enunciata nel 1869 in seguito allo studio sistematico di diverse reazioni di addizione, si osserva che l'idrogeno dell'acido si lega preferenzialmente all'atomo di carbonio che già ha più idrogeni legati a sé, ad esempio
CH3-CH=CH2 + HCl → CH3-CH-CH3 e non CH3-CH2-CH2
| |
Cl Cl
- Questo orientamento si spiega ipotizzando che la reazione di addizione si svolga secondo un meccanismo in due passaggi. Nel primo, l'alchene somma a sé lo ione H+ dell'acido formando un carbocatione (non ciclico, come nel caso dell'addizione di alogeni, perché l'idrogeno non ha elettroni esterni per formare legami supplementari), il quale va successivamente a legarsi all'anione. L'addizione di H+ secondo la regola di Markovnikov produce preferenzialmente il carbocatione più stabile:
CH3-CH=CH2 + H+ → CH3-CH-CH3 carbocatione secondario: più stabile
+
CH3-CH2-CH2+ carbocatione primario: meno stabile
- il carbocatione meno stabile inoltre subisce trasposizione modificandosi in un isomero più stabile.
- In presenza di perossidi il meccanismo della reazione di addizione non è più ionico, bensì radicalico, l'effetto è quello di rovesciare l'orientamento dell'addizione e dare quindi un prodotto opposto a quello previsto dalla regola di Markovnikov. Questo perché la particella che si somma all'alchene non è più lo ione H+, bensì il radicale X.
CH3-CH=CH2 + X. → CH3-CH-CH2 radicale secondario: più stabile
. |
X
CH3-CH-CH2. radicale primario: meno stabile
|
X
- il radicale formatosi si unisce poi ad un radicale H. completando l'addizione.
- addizione di acqua (idratazione, formazione di alcoli)
RR'C=CHR" + H-X → RR'CX-CH2R" (X = Cl, Br, I)
- con un meccanismo simile a quanto visto per l'addizione di acidi alogenidrici, gli alcheni, in presenza di un acido catalizzatore che normalmente è l'acido solforico sommano una molecola di acqua dando l'alcol corrispondente.
- L'orientamento dell'addizione segue la regola di Markovnikov, quindi tenderanno a formarsi preferenzialmente alcoli secondari e terziari, ad esempio
CH3-CH=CH2 + H2O → CH3-CH-CH3 e non CH3-CH2-CH2
| |
OH OH
- la sintesi di alcoli con un orientamento anti-Markovnikov dagli alcheni è un processo più complesso, che richiede due passaggi e prende il nome di idroborazione-ossidazione. Consiste nell'addizionare all'alchene un borano ed ossidarlo successivamente con perossido di idrogeno in ambiente alcalino
1. CH3-CH=CH2 + (BH3)2 → CH3-CH2-CH2
|
BH2
2. CH3-CH2-CH2 + H2O2 → CH3-CH2-CH2
| |
BH2 OH
- addizione di alchili (alchilazione, dimerizzazione, polimerizzazione)
- Il carbocatione che si forma per addizione di uno ione H+ ad un alchene può, in funzione delle condizioni di reazione e della sua struttura, addizionarsi ad un'altra molecola di alchene, formando un carbocatione più grosso il quale può o perdere uno ione H+ e trasformarsi in un alchene o, sua volta, proseguire l'addizione e portare ad un polimero. La reazione viene condotta trattando l'alchene con acido solforico concentrato o acido fosforico concentrato.
- Un esempio è la dimerizzazione del 2-metil-2-propene (più noto come isobutene)
+
1. CH3-C=CH2 + H+ → CH3-C-CH3
| |
CH3 CH3
CH3
+ | +
2. CH3-C-CH3 + CH3-C=CH2 → CH3-C-CH2-C-CH3
| | | |
CH3 CH3 CH3 CH3
CH3 CH3
| + |
3. CH3-C-CH2-C-CH3 → CH3-C-CH=C-CH3 + H+
| | | |
CH3 CH3 CH3 CH3
- Similmente, se il carbocatione viene formato in presenza di un alcano, il carbocatione può strappare uno ione idruro (H-) all'alcano per neutralizzare la propria carica e trasformarsi in un alcano a sua volta, ad esempio
CH3 CH3 CH3 CH3
| + | | |
3a. CH3-C-CH2-C-CH3 + CH3-CH → CH3-C-CH2-CH-CH3 + CH3-C+
| | | | | |
CH3 CH3 CH3 CH3 CH3 CH3
- L'addizione di un radicale ad un alchene dà il via ad una reazione di addizione a catena che porta al polimero corrispondente. Come iniziatore, cioè come composto capace di generare radicali che diano inizio alla reazione, viene generalmente impiegato un perossido.
1. R-O-O-R → R-O.
2. R-O. + CH2=CH2 → R-O-CH2-CH2.
3. R-O-CH2-CH2. + CH2=CH2 → R-O-CH2-CH2-CH2-CH2.
n. ...-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-...
- formazione di dioli
R-CH=CH-R' + KMnO4 → R-CH-CH-R'
| |
OH OH
- il doppio legame tende anche ad aprirsi per ossidazione; il trattamento con agenti ossidanti molto blandi, ad esempio il potassio permanganato in soluzione fortemente alcalina permette di fermare l'ossidazione ad uno stadio iniziale, convertendo l'alchene nel corrispondente diolo.
- addizione di carbene (ciclizzazione)
R-CH=CH-R' + CH2N2 → R-CH---CH-R'
\ /
CH2
- il carbene è una particella poco stabile che può esistere in due forme, una di queste è il biradicale .CH2. che, con i suoi due elettroni spaiati è in grado di inserirsi nel doppio legame di un alchene convertendolo in un ciclopropano.
- Il carbene viene solitamente generato in situ dalla decomposizione del diazometano, CH2N2, attivata dalla luce.
- Similmente, il trattamento di un alchene con cloroformio e idrossido di sodio porta alla conversione dell'alchene nel corrispondente 1,1-diclorociclopropano a seguito dell'inserimento sul doppio legame del diclorocarbene :CCl2 generato dall'azione dell'idrossido di sodio sul cloroformio.
- formazione di epossidi
R-CH=CH-R' + RCO-O-OH (peracido) → R-CH—CH-R'
\ /
O
- similmente al carbene, anche un atomo di ossigeno, con i suoi due elettroni spaiati, è in grado di inserirsi in un doppio legame trasformando l'alchene nel corrispondente epossido. Fonte usuale di ossigeno atomico a questo scopo sono i peracidi, cioè acidi carbossilici che contengono un atomo di ossigeno aggiuntivo, con una struttura analoga a quella dell'acqua ossigenata.
- sostituzione radicalica
- Anche gli alcheni, come gli alcani possono subire reazioni di sostituzione ad opera di radicali; la stabilità creata dalla risonanza favorisce la sostituzione in posizione allilica, cioè sui carboni adiacenti a quelli impegnati nel doppio legame
. . R-CH2-CH=CH2 → R-CH-CH=CH2 ↔ R-CH=CH-CH2
- demolizione ossidativa (ozonolisi)
- Il trattamento con ossidanti forti, quali l'ozono o il potassio permanganato in soluzione acida, porta ad una rottura del doppio legame in prossimità del quale l'alchene si spezza in due frammenti che possono essere chetoni, acidi carbossilici e anidride carbonica, in funzione della forza dell'agente ossidante e della struttura dell'alchene
R R' R R' \ / \ \ C=C + O3 → C=O + C=O / \ / / R H R OH
R H R \ / \ C=C + O3 → C=O + CO2 / \ / R H R
- l'identificazione dei frammenti è un modo per determinare la struttura dell'alchene di partenza.
Alcheni lineari a n atomi di carbonio
[modifica | modifica wikitesto]- 2 atomi di C: etene (o etilene)
- 3 atomi di C: propene (o propilene)
- 4 atomi di C: butene (o butilene)
- 5 atomi di C: pentene
- 6 atomi di C: esene
- 7 atomi di C: eptene
- 8 atomi di C: ottene
Note
[modifica | modifica wikitesto]- ^ a b (EN) IUPAC Gold Book, "alkenes"
- ^ (EN) IUPAC Gold Book, "olefins"
Bibliografia
[modifica | modifica wikitesto]- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 47-50, 197-229, ISBN 88-08-09414-6.
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 59-90, ISBN 3-527-30578-5.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «alcheni»
Wikizionario contiene il lemma di dizionario «alcheni» Wikimedia Commons contiene immagini o altri file su alcheni
Wikimedia Commons contiene immagini o altri file su alcheni
Collegamenti esterni
[modifica | modifica wikitesto]- Esercizi sulla Nomenclatura degli alcheni, su mnemochimica.it.
- Esperienze in laboratorio - Gli alcheni, su itchiavari.org.
| Controllo di autorità | Thesaurus BNCF 21153 · LCCN (EN) sh85094589 · GND (DE) 4001207-4 · BNF (FR) cb11948674t (data) · J9U (EN, HE) 987007546028505171 · NDL (EN, JA) 00562061 |
|---|
