Acido fosforoso
| Acido fosforoso | |
|---|---|
 | |
 | |
| NomeIUPAC | |
| acido fosfonico acido fosforoso (vedi testo) | |
| Nomi alternativi | |
| acido triossofosforico(III) (nome sistematico) acido fosforoso (nome comune) | |
| Caratteristiche generali | |
| Formula brutaomolecolare | H3PO3 |
| Massa molecolare(u) | 81,99 |
| Aspetto | cristalli deliquescenti incolori |
| Numero CAS | |
| Numero EINECS | 237-066-7 |
| PubChem | 407 |
| SMILES | OP(O)=O |
| Proprietà chimico-fisiche | |
| Densità(g/cm3,inc.s.) | 1,651 (21 °C) |
| Costante di dissociazione acidaa 298 K | Ka1:5,5×10−2 Ka2:2,60×10−7 |
| Solubilitàinacqua | 310 g/100 mL |
| Temperatura di fusione | 70,1 °C (343,35 K) |
| Temperatura di ebollizione | ~200 °C, con decomposizione |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302-314 |
| Consigli P | 280-305+351+338-310[1] |
L'acido fosforosoè il nome tradizionale con cui è conosciuto uno degliossiacididelfosforoaventeformula molecolareH3PO3.Esso è intermedio, per contenuto di ossigeno, tra l'acido fosforicoH3PO4e l'acido ipofosforosoH3PO2(acido fosfinico).
A questa formula H3PO3corrispondono 2isomeri strutturalicoesistenti in equilibrio: uno largamente maggioritario, il cui nome IUPAC èacido fosfonico,e un altro molto minoritario, il cui nome IUPAC èacido fosforoso(vide infra).[2]
Nonostante la chiara distinzione, in ambito principalmente commerciale emerceologico,si è affermata la pratica comune di usare il nome generico di"acido fosforoso"per tale miscela, vista la non separabilità dei due tautomeri e visto anche che il suffisso "-oso" della nomenclatura tradizionale ben si adatta a un acido con un ossigeno in meno rispetto al fosforico.[3]
A temperatura ambiente si presenta come un solido cristallino incolore che fonde appena sopra ai 70 °C (altri riportano 73,8 °C)[4]dando un liquido incolore. Èdeliquescentee solubilissimo in acqua ed anche molto solubile inalcool.[5][6]La sua composizione elementare fu determinata per la prima volta daJöns Jacob Berzelius.[7]
Struttura, tautomeria e proprietà
[modifica|modifica wikitesto]Si credette che questo acido, per analogia con l'acido fosforico H3PO4e gli ossiacidi di altri elementi avesse dovuto essere rappresentato dalla formula P(OH)3[8]ed essere perciò un acido triprotico. In realtà, si è trovato che esso consiste in unamisceladiequilibriodi duetautomeri:
O=P(H)(OH)2,acido fosfonico (nome IUPAC[2][9])[10]
P(OH)3,acido fosforoso (nome IUPAC[2]);

Tautomeria di H3PO3:acido fosfonico HP(O)(OH)2(a sinistra) eacido fosforoso P(OH)3(a destra). L'equilibrio in realtà è fortemente spostato a sinistra, Keq≈ 10−10,3.[11]
Come si vede dal valore dellacostante di equilibrio,l'acido fosforoso P(OH)3è presente in tale miscela in proporzione poco più che trascurabile; di conseguenza, questo acido è rappresentato essenzialmente dall'isomero acido fosfonico, che è diprotico,[12]perché il legame H-P è troppo poco polare per far sì che H possa essere ceduto come H+in una soluzione acquosa.[13]
Da notare che nell'acido fosfonico il fosforo èpentavalentee allostato di ossidazione+5[14][11](essendo H leggermente piùelettronegativodi P[15]), mentre nel fosforoso P è trivalente e allo stato di ossidazione +3.
Il motivo della netta prevalenza di questo isomero è nella presenza del gruppofosforile[16](≡P=O↔≡P+−O−), residuo trivalente dell'acido fosforico, molto stabile (e polare).[17]Questodoppio legameè piuttosto forte,D0= ~544 kJ/mol, mentre l'analogo con l'arsenicolo è parecchio meno (~389 kJ/mol).[18]Nel caso del fosforo la spintatermodinamicache favorisce questo tautomero viene attribuita alla formazione di questo doppio legame P=O, analogamente al motivo di quanto avviene nellareazione di Michaelis-Arbuzov,[19]mentre nel caso dell'arsenico questa manca. Andamenti analoghi si verificano per le coppie di elementi che seguono P e As: S/Se e Cl/Br. Questo fenomeno è noto come 'riluttanza dei non metalli delquarto periodoad assumere la valenza massima'.[20][21]Nel caso dell'arsenico, il tautomero quasi esclusivo dell'acido corrispondente è As(OH)3,cioè l'acido arsenioso,mentre l'acido arsonico HAs(=O)(OH)2è presente in quantità irrilevante.[21]
Struttura cristallina e molecolare
[modifica|modifica wikitesto]Su unmonocristallodi acido fosfonico sono state condotte due indagini cristallografiche congiunte a bassissima temperatura: unadiffrazione neutronica(15 K) e unadiffrazione dei raggi X(173 K). I risultati delle analisi dei dati ricavati dalle due tecniche parzialmente complementari differiscono tra loro solo in maniera trascurabile. La diffrazione neutronica ha permesso la localizzazione accurata degli atomi di idrogeno.
Questo acido cristallizza nel sistemaPna21,con parametri di cellaa= 716,6(3) pm,b= 1201,3(5) pm,c= 674,3(3) pm, e 8 molecole nellacella elementare.La molecola nel reticolo cristallino ètetraedricadistorta. Il legame H–P misura 139pm,quello P=O 150 pm e i due P–OH 155 pm.
Ciascuna molecola forma quattrolegami idrogenoasimmetrici con le molecole vicine, con lunghezze O...H nell'intervallo 155÷160 pm: due vengono donati dagli idrogeni degli ossidrili e due ne riceve sull'O fosforilico.[5][22]
Proprietà acido-base
[modifica|modifica wikitesto]L'acido fosfonico (a differenza dell'acido fosforico) è dunque unacido diprotico,poiché l'idrogeno direttamente legato all'atomo di fosforo non è facilmente ionizzabile. La sua prima costante di dissociazione (pKa1= 1,26)[5]lo rende, tra gliacidi deboli,piuttosto forte, simile all'ipofosforoso (pKa1= 1,2), ma un po' più forte del fosforico (pKa1= 2,14):
La seconda dissociazione acida (pKa2= 6,7) vede la deprotonazione dello ione idrogenofosfonato HP(O)2(OH)−a dare ione fosfonato HPO32−:
Anche in seconda dissociazione è un leggermente più forte dell'acido fosforico (pKa2= 7,20).[5]
Sali, esteri e derivati organofosforo
[modifica|modifica wikitesto]Dell'acido fosforoso P(OH)3non si conoscono isali(i fosfiti metallici), ma sono ben noti i suoiesteri,il più semplice dei quali è iltrimetilfosfitoP(OMe)3.[23]
Dall'acido fosfonico si ottengono due serie di sali:
- fosfonati [es.: il fosfonato di sodio (Na+)2HP(=O)(O−)2,spesso scritto semplicemente Na2HPO3][24]
- idrogenofosfonati [es.: idrogenofosfonato di potassio (K+)HP(=O)(OH)(O−), spesso scritto semplicemente KH2PO3][25]
In ambito dichimica inorganicala distinzione tra i due tipi di acido non è in discussione; altrettanto per i derivati organofosforo inchimica organica,i quali si ottengono da HP(=O)(OH)2per sostituzione dell'atomo di idrogeno unito al fosforo con unalchileo unarile,insieme ai rispettiviesteri;dall'acido fosforoso P(OH)3,si ottengono gli esteri. Così, ad esempio, si hanno tre tipi di derivati:
- R-P(=O)(OH)2è un acido alchilfosfonico o, arilfosfonico se R =Ar(anche negli esempi seguenti) [es. CH3-P(=O)(OH)2è l'acido metilfosfonico, C6H5-P(=O)(OH)2è l'acido fentilfosfonico]
- R-P(=O)(OR')2è un alchilfosfonato di dialchile [es. CH3-P(=O)(OCH3)2è il metilfosfonato di dimetile o dimetil metilfosfonato; C6H5-P(=O)(OC2H5)2è il fenilfosfonato di dietile o dietil fenilfosfonato; occorre fare attenzione alla diversa funzione dei sostituenti organici, quelli con C unito a P e quelli esterei, C unito a O]
- P(OR')3è un fosfito di trialchile [ es. P(OCH3)3,il trimetil fosfito]
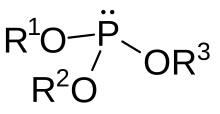
Questi ultimi, i fosfiti organici, sono importanti anche inchimica organometallica:sonoligandiadatti a centrimetalliciin bassostato di ossidazionee in questo ruolo possono sostituire un ligandofosfinicoo uncarbonile.Proprio in questo ambito è stato possibile ritrovare l'acido fosforoso propriamente detto, P(OH)3,così elusivo in ambito puramente inorganico, comeligandopresente in complessi organometallici con il metallo inconfigurazione elettronicad6,quali il complesso neutro Mo(CO)5(P(OH)3,[26]in cui figura Mo(0), e lo ione [Ru(NH3)4(H2O)(P(OH)3)]2+,in cui è presente Ru(II).[27]
Sintesi
[modifica|modifica wikitesto]L'acido fosfonico è prodotto medianteidrolisia freddo dell'anidride fosforosaP4O6(a caldo la reazione diviene molto complessa):[6]
Il metodo di preparazione più comune dell'acido fosfonico consiste nell'idrolisi,con acqua o vapore, deltricloruro di fosforo,ma la reazione è violenta,[6]più adatta a livello industriale, che da farsi in laboratorio:
La stessa si può anche ripetere con iltribromuro di fosforo,PBr3.Una reazione molto più tranquilla e che fornisce l'acido essenzialmente puro e privo di ogni altro prodotto è quella del PCl3con l'acido ossalicoanidro:[6]
PCl3+ 3 (COOH)2→ H3PO3+ 3CO↑+ 3CO2↑+ 3HCl↑
Reattività
[modifica|modifica wikitesto]L'acido fosfonico, riscaldato a 100 °C sotto vuoto (o in atmosfera inerte) si converte in acido difosfonico eliminando acqua:
2 H3PO3→ H4P2O5+ H2O
portando la temperatura a 200 °C, si decompone, dando acido fosforico efosfina:[28]
- 4 H3PO3→ 3 H3PO4+ PH3
e questo è anche un metodo di sintesi della fosfina stessa.[29]
L'acido libero (o in soluzione acquosa), esposto all'aria si ossida lentamente ad acido fosforico;[30]esso e le sue specie deprotonate sono infatti discreti agenti riducenti:E°(H3PO4/ H3PO3) = -0,276 V, anche se non necessariamente rapidi; tuttavia, l'acido ipofosforoso è un riducente assai migliore [E°(H3PO3/ H3PO2) = -0,499 V].[31]
Note
[modifica|modifica wikitesto]- ^Sigma Aldrich; rev. del 24.07.2012
- ^abcNomenclature of inorganic chemistry: IUPAC recommendations 2005(PDF), Royal society of chemistry, 2005, p. 128,ISBN978-0-85404-438-2.URL consultato il 21 maggio 2024.
- ^Phosphorous acid 13598-36-2 98% - ChemicalBook India,suchemicalbook.in.URL consultato il 22 maggio 2024.
- ^(DE) Arnold F. Holleman, E. Wiberg e N. Wiberg,Anorganische Chemie,103ª ed., DE GRUYTER, 2017, p. 907,ISBN978-3-11-026932-1.
- ^abcdN. N. Greenwood e A. Earnshaw,Phosphorus,inChemistry of the Elements,2ª ed., Butterworth-Heinemann, 1997, p. 514,ISBN0-7506-3365-4.
- ^abcdPradyot Patnaik,Handbook of InorganicChemicals,McGraw-Hill, 2003, pp.706-707,ISBN0-07-049439-8.
- ^Icilio Guareschi,Jöns Jacob Berzelius e la sua opera scientifica: Brevi cenni sulla Chimica nella prima metà del secolo XIX,Torino: Unione Tipografico-Editrice, 1915
- ^In un ossiacido gli atomi di idrogeno erano sempre uniti a quelli di ossigeno.
- ^(EN) PubChem,Phosphorous acid,supubchem.ncbi.nlm.nih.gov.URL consultato il 21 maggio 2024.
- ^Nome mutuato dalla chimica organica (in analogia a solfonico)
- ^ab(EN) J. Peter Guthrie,Tautomerization equilibria for phosphorous acid and its ethyl esters, free energies of formation of phosphorous and phosphonic acids and their ethyl esters, and p K a values for ionization of the P—H bond in phosphonic acid and phosphonic esters,inCanadian Journal of Chemistry,vol. 57, n. 2, 15 gennaio 1979, pp. 236–239,DOI:10.1139/v79-039.URL consultato il 12 maggio 2024.
- ^F. Albert Cotton e Geoffrey Wilkinson,ADVANCED INORGANIC CHEMISTR Y,3ª ed., INTERSCIENCE PUBLISHERS A DIVISION OF JOHN WILEY & SONS, 1972, pp.394-395,ISBN0-471-17560-9.
- ^Erwin Riedel e Christoph Janiak,Anorganische Chemie,collanaDe Gruyter Studium,10. Auflage, De Gruyter, 2022, p. 534,ISBN978-3-11-069604-2.
- ^(DE) Arnold F. Holleman, E. Wiberg e N. Wiberg,Anorganische Chemie,103ª ed., DE GRUYTER, 2017, p. 901,ISBN978-3-11-026932-1.
- ^Gary Wulfsberg,Inorganic chemistry,University Science Books, 2000,ISBN978-1-891389-01-6.
- ^fosforile in Vocabolario - Treccani,sutreccani.it.URL consultato il 2 settembre 2021.
- ^J. E. Huheey, E. A. Keiter e R. L. Keiter,Chimica Inorganica, Principi, Strutture, Reattività,2ª ed., Piccin, 1999, pp. 901-907,ISBN88-299-1470-3.
- ^J. E. Huheey, E. A. Keiter e R. L. Keiter,Chimica Inorganica,Principi, Strutture, Reattività,2ª ed., Piccin, 1999, p. A-31,ISBN88-299-1470-3.
- ^J.B. Hendrickson, D.J. Cram e G.S. Hammond,CHIMICA ORGANICA,traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 76-78.
- ^J. E. Huheey, E. A. Keiter e R. L. Keiter,Chimica Inorganica,Principi, Strutture, Reattività,2ª ed., Piccin, 1999, pp. 912-913,ISBN88-299-1470-3.
- ^ab(DE) Arnold F. Holleman, E. Wiberg e N. Wiberg,IX. Hauptgruppenelemente,inAnorganische Chemie,103ª ed., DE GRUYTER, 2017, pp. 332-333,ISBN978-3-11-026932-1.
- ^(DE) G. Becker, H.-D. Hausen e O. Mundt,Wasserstoffbrücken. I. Molekül- und KristallStruktur der Phosphonsäure H3PO3 - Röntgen- und Neutronenbeugungsuntersuchungen an der Hydrogen- und der Deuterium-Verbindung,inZeitschrift für anorganische und allgemeine Chemie,vol. 591, n. 1, 1990-12, pp. 17–31,DOI:10.1002/zaac.19905910103.URL consultato il 1º settembre 2021.
- ^(EN) PubChem,Trimethyl phosphite,supubchem.ncbi.nlm.nih.gov.URL consultato il 12 maggio 2024.
- ^(DE) D. Brodalla, C. Goeters e R. Kniép,Zur Kenntnis der Hydrate des Na2PHO3, Phasenbeziehungen und kristallographische Untersuchungen,inZeitschrift für anorganische und allgemeine Chemie,vol. 439, n. 1, 1978-04, pp. 265–274,DOI:10.1002/zaac.19784390132.URL consultato il 2 settembre 2021.
- ^J. Loub,Crystal chemistry of inorganic phosphites,inActa Crystallographica Section B Structural Science,vol. 47, n. 4, 1º agosto 1991, pp. 468–473,DOI:10.1107/S0108768191002380.URL consultato il 2 settembre 2021.
- ^Chanjuan Xi, Yuzhou Liu, Chunbo Lai e Lishan Zhou,Synthesis of molybdenum complex with novel P(OH)3ligand based on the one-pot reaction of Mo(CO)6with HP(O)(OEt)2and water,inInorganic Chemistry Communications,vol. 7, n. 11, 2004, pp. 1202,DOI:10.1016/j.inoche.2004.09.012.
- ^Sernaglia, R. L.; Franco, D. W.,The ruthenium(II) center and the phosphite-phosphonate tautomeric equilibrium,inInorg. Chem.,vol. 28, n. 18, 2005, pp. 3485–3489,DOI:10.1021/ic00317a018.
- ^Sudarshan D. Gokhale, William L. Jolly e Sherman Thomas,Phosphine,John Wiley & Sons, Inc., 5 gennaio 2007, pp. 56–58,DOI:10.1002/9780470132401.ch17,ISBN978-0-470-13240-1.URL consultato il 2 settembre 2021.
- ^(EN) G. T. Shechkov, I. A. Pevneva e O. A. Meshkova,Thermal Disproportionation of Hypophosphorous Acid,inRussian Journal of Applied Chemistry,vol. 76, n. 8, 1º agosto 2003, pp. 1354–1355,DOI:10.1023/B:RJAC.0000008318.22178.07.URL consultato il 12 maggio 2024.
- ^(EN) Gerhard Bettermann, Werner Krause e Gerhard Riess,Phosphorus Compounds, Inorganic,Wiley-VCH Verlag GmbH & Co. KGaA, 15 giugno 2000, pp. a19_527,DOI:10.1002/14356007.a19_527,ISBN978-3-527-30673-2.URL consultato il 2 settembre 2021.
- ^William M. Haynes, David R. Lide e Thomas J. Bruno,CRC handbook of chemistry and physics: a ready reference book of chemical and physical data,93ª ed., CRC, 2012,ISBN978-1-4398-8049-4.
Voci correlate
[modifica|modifica wikitesto]Altri progetti
[modifica|modifica wikitesto] Wikimedia Commonscontiene immagini o altri file suacido fosfonico
Wikimedia Commonscontiene immagini o altri file suacido fosfonico
| Controllo di autorità | LCCN(EN)sh85101110·GND(DE)4519764-7·J9U(EN,HE)987007543644605171 |
|---|



