Atomo
| Atomo | |
|---|---|
 | |
| Composizione | Elettronie unnucleocomposto daprotonieneutroni |
| Interazioni | Gravitazionale,elettromagnetica,debole,forte |
| Antiparticella | antiparticella |
| Proprietà fisiche | |
| Massa | da 1,67 × 10−27a 4,52 × 10−25kg |
| Carica elettrica | zero (neutro), o la carica delloione |
L'atomo(dalgrecoἄτομοςátomos:indivisibile) è la struttura nella quale lamateriaè organizzata in unità fondamentali che costituiscono glielementi chimici.Gli atomi si aggregano frequentemente in unità stabili dettemolecoleche caratterizzano moltesostanze.
Concepito come l'unità più piccola e indivisibile della materia secondo la dottrina atomistica deifilosofi greciLeucippo,DemocritoedEpicuro,e teorizzato su base scientifica all'inizio delXIX secolo,verso la fine dell'Ottocento,con la scoperta dell'elettrone,fu dimostrato che l'atomo è composto daparticelle subatomiche(oltre all'elettrone, ilprotonee ilneutrone).
Se nel mondo fisico abituale la materia, nei suoistatisolido,liquidoegassoso,è costituita dalle unità elementari degli atomi, a valori dipressioneetemperaturasufficientemente elevati la loro esistenza non è possibile, determinandosi lo stato diplasma.
Storia
[modifica|modifica wikitesto]Il modello atomico oggi riconosciuto è l'ultima tappa di una serie di ipotesi che sono state avanzate nel tempo. Inetà anticaalcuni filosofi greci, quali Leucippo (V secolo a.C.), Democrito (V-IV secolo a.C.) ed Epicuro (IV-III secolo a.C.), eromani,qualiTito Lucrezio Caro(I secolo a.C.), ipotizzarono che la materia non fosse continua, ma costituita da particelle minuscole e indivisibili, fondando così la "teoria atomica". Questa corrente filosofica, fondata da Leucippo, venne chiamata "atomismo".Si supponeva che i diversi" atomi "fossero differenti per forma e dimensioni.
Democrito propose la "teoria atomica", secondo cui la materia è costituita da minuscole particelle, diverse tra loro, chiamate atomi, la cui unione dà origine a tutte lesostanzeconosciute. Queste particelle erano la più piccola entità esistente e non potevano essere ulteriormente divise: per questo erano chiamate atomi.
In contrasto con questa teoriaAristotele(IV secolo a.C.), nella teoria della continuità dellamateria,sostenne che unasostanzapuò essere suddivisa all'infinito inparticellesempre più piccole e uguali tra loro. Queste ipotesi rimasero tali in quanto non verificate con metodologie basate sull'osservazione e sull'esperimento.
Ilcorpuscolarismoè il postulato del XIII secolo dell'alchimistaGeber,secondo il quale tutti i corpi fisici posseggono uno strato interno e uno esterno di particelle minuscole. La differenza con l'atomismo è che i corpuscoli possono essere divisi, veniva per questo teorizzato che ilmercuriopotesse penetrare nei metalli modificandone la struttura interna. Il corpuscolarismo rimase la teoria dominante per i secoli successivi. Tale teoria servì come base aIsaac Newtonper sviluppare lateoria corpuscolare della luce.

Tra gli atomisti dell'età modernaci fuPierre Gassendi,per via del suo recupero dell'epicureismo.
Origine del modello scientifico
[modifica|modifica wikitesto]Solo all'inizio delXIX secoloJohn Daltonrielaborò e ripropose la teoria di Democrito fondando la teoria atomica moderna, con la quale diede una spiegazione ai fenomeni chimici. Propose una legge secondo la quale le diverse quantità in peso di un elemento che si combinano con la stessa quantità di un altro elemento per formare composti diversi stanno tra loro in rapporti esprimibili mediante numeri interi piccoli (legge delle proporzioni multiple), ipotizzando quindi che la materia fosse costituita da atomi. Nel corso dei suoi studi Dalton si avvalse delle conoscenze chimiche e fisiche del tempo (lalegge della conservazione della massa,formulata daAntoine Lavoisier,e lalegge delle proporzioni definite,formulata daJoseph Louis Proust) ed espose la sua teoria nel libroA New System of Chemical Philosophy,pubblicato nel 1808. La teoria atomica di Dalton si fondava su cinque punti:
- lamateriaè formata da piccolissimeparticelle elementarichiamate atomi, che sono indivisibili e indistruttibili;
- gli atomi di uno stessoelementosono tutti uguali tra loro;
- gli atomi di elementi diversi si combinano tra loro (attraversoreazioni chimiche) in rapporti di numeri interi e generalmente piccoli, dando così origine acomposti;
- gli atomi non possono essere né creati né distrutti;
- gli atomi di un elemento non possono essere convertiti in atomi di altri elementi.
In definitiva questa è la definizione di atomo per Dalton: "Un atomo è la più piccola parte di un elemento che mantiene le caratteristiche chimiche di quell'elemento".
Questa viene considerata la prima teoria atomica della materia perché per primo Dalton ricavò le sue ipotesi per via empirica.
I modelli atomici
[modifica|modifica wikitesto]
Con la scoperta dellaradioattivitànaturale si intuì successivamente che gli atomi non erano particelle indivisibili, bensì erano oggetti composti da parti più piccole. Nel 1902Joseph John Thomsonpropose il primo modello fisico dell'atomo[1],successivamente alle sue ricerche sul rapporto tra la massa e la carica dell'elettrone.[2]Egli immaginò che un atomo fosse costituito da una sfera fluida di materia caricata positivamente (protoni e neutroni non erano stati ancora scoperti) in cui gli elettroni (negativi) erano immersi (modello a panettone,in ingleseplum pudding model[2]omodello ad atomo pieno), rendendo neutro l'atomo nel suo complesso.[2]
Questo modello fu superato quandoErnest Rutherfordscoprì la presenza di unnucleo atomicocaricato positivamente. Nel 1910, due allievi di Rutherford (GeigereMarsden) svolsero unesperimento cruciale,con lo scopo di convalidare il modello di Thomson.[3]Essi bombardarono un sottilissimo foglio dioro,posto fra una sorgente diparticelle alfae uno schermo.[3]Le particelle, attraversando la lamina, lasciarono una traccia del loro passaggio sullo schermo. L'esperimento portò alla constatazione che i raggi alfa non venivano quasi mai deviati; solo l'1% dei raggi incidenti era deviato considerevolmente dal foglio di oro (alcuni venivano completamente respinti).
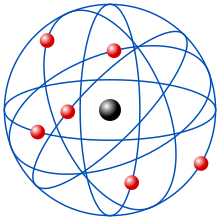
Attraverso questo esperimento Rutherford propose un modello di atomo in cui quasi tutta la massa dell'atomo fosse concentrata in una porzione molto piccola, il nucleo (caricato positivamente) e gli elettroni gli ruotassero attorno così come ipianetiruotano attorno alSole(modello planetario).[4]L'atomo era comunque largamente composto da spazio vuoto, e questo spiegava il perché del passaggio della maggior parte delle particelle alfa attraverso la lamina. Il nucleo è così concentrato che gli elettroni gli ruotano attorno a distanze relativamente enormi, con orbite aventi un diametro da 10.000 a 100.000 volte maggiore di quello del nucleo.Rutherfordintuì che iprotoni(particelle cariche nel nucleo) da soli non bastavano a giustificare tutta la massa del nucleo e formulò l'ipotesi dell'esistenza di altre particelle, che contribuissero a formare l'intera massa del nucleo.
Dopo l'esperimento di Rutherfordera abbastanza evidente che gli elettroni non potessero trovarsi all'interno del nucleo. Si può, però, pensare a una dimostrazione per assurdo: si supponga, per un momento, l'esistenza degli elettroni nel nucleo. Il suo raggio può essere stimato nell'ordine dei cinquefm.
L'impulsodell'elettrone, nell'atomo, allora sarà:
dovecè lavelocità della luceeλlalunghezza d'onda di de Brogliedell'elettrone.
A questo punto si fissa unalunghezza d'ondamassima in 10 fm e si può così calcolare il valore minimo per l'impulso, che alla fine risulta essere di circa 124MeV/c.Ora, poiché lamassadell'elettrone è pari a 0,5 MeV/c2,da un semplice contorelativisticorisulta evidente che l'energiatotale dell'elettrone è pari a:
- E2=p2c2+m2c4= 125 MeV
Quindi, se ci fossero elettroni nel nucleo, la loro energia sarebbe 250 volte maggiore rispetto alla loro intera massa: elettroni così energetici, però, non sono mai stati emessi da alcun nucleo. L'unico indiziato, l'elettrone emesso neldecadimento betadei nuclei, ha un intervallo di energia che va da pochi MeV a un massimo di 20 MeV.
Il modello di Rutherford aveva incontrato una palese contraddizione con le leggi dellafisica classica:secondo la teoriaelettromagnetica,una carica che subisce unaaccelerazioneemetteenergiasotto forma diradiazione elettromagnetica.Per questo motivo gli elettroni dell'atomo di Rutherford, che si muovono dimoto circolareintorno al nucleo, avrebbero dovuto emettere onde elettromagnetiche e quindi, perdendo energia, cadere nel nucleo stesso (teoria del collasso), cosa che evidentemente non accade.[5]Inoltre un elettrone, nel perdere energia, potrebbe emettere onde elettromagnetiche di qualsiasilunghezza d'onda,operazione preclusa nella teoria e nella pratica dagli studi sulcorpo nerodiMax Planck(e successivamente diAlbert Einstein).Solo la presenza di livelli di energia quantizzati per quanto riguarda gli stati degli elettroni poteva spiegare i risultati sperimentali: la stabilità degli atomi rientra nelle proprietà spiegabili mediante lameccanica quantistica,crescenti con il numero atomico degli elementi secondo incrementi dei tempi di stabilità via via decrescenti (regola dell'ottettoeregola dei 18 elettroni).[non chiaro]
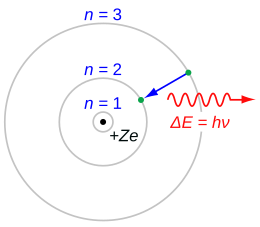
Nel 1913Niels Bohrpropose una modifica concettuale al modello di Rutherford. Pur accettandone l'idea dimodello planetariopostulò che gli elettroni avessero a disposizione orbite fisse, dette anche "orbite quantizzate", queste orbite possedevano un'energia quantizzata (ossia un'energia già prestabilita identificata da un numero detto numero quantico principale N) nelle quali gli elettroni non emettevano né assorbivano energia (questa infatti rimaneva costante): in particolare, un elettrone emetteva o assorbiva energia sotto forma dionde elettromagnetichesolo se effettuava una transizione da un'orbita all'altra, e quindi passava a uno stato a energia minore o maggiore. In seguito,Sommerfeldpropose una correzione al modello di Bohr, secondo cui si aveva una buona corrispondenza fra la teoria e le osservazioni deglispettridella radiazione emessa o assorbita degli atomi.
Molti elementi del modello non erano compatibili con le leggi della fisica classica diNewton,poiché era fondato sulle idee dell'allora nascentemeccanica quantistica.Ciò nonostante, il modello di Bohr-Sommerfeld si basava ancora su postulati e soprattutto funzionava molto bene per l'atomo diidrogeno,ma non con quelli più complessi.
La meccanica ondulatoria e il modello atomico contemporaneo
[modifica|modifica wikitesto]I punti deboli del modello di Bohr-Sommerfeld vennero riesaminati alla luce anche delprincipio di indeterminazioneintrodotto daWerner Karl Heisenbergnel 1927, il quale convinse la comunità scientifica che fosse impossibile descrivere esattamente il moto degli elettroni attorno al nucleo, motivo per cui ai modellideterministicifino ad allora proposti si preferì ricercare un modelloprobabilistico,che fosse in grado di descrivere qualsiasi atomo con una buona approssimazione. Ciò fu reso possibile grazie ai successivi risultati dellameccanica ondulatoria.
Fu abbandonato il concetto di orbita e fu introdotto il concetto diorbitale.Secondo la meccanica quantistica non ha più senso infatti parlare ditraiettoriadi una particella: da ciò discende che non si può neanche definire con certezza dove un elettrone si trova in un dato momento. Ciò che è possibile conoscere è laprobabilitàdi trovare l'elettrone in un certo punto dellospazioin un dato istante ditempo.Un orbitale quindi non è una traiettoria su cui un elettrone (secondo le idee della fisica classica) può muoversi, bensì una porzione di spazio intorno al nucleo definita da unasuperficie di equiprobabilità,ossia entro la quale c'è il 95% della probabilità che un elettrone vi si trovi.
In termini più rigorosi un orbitale è definito da una particolarefunzione d'onda,soluzione dell'equazione di Schrödinger,caratterizzata da trenumeri quanticiassociati rispettivamente all'energia, alla forma e all'orientamento nello spazio dell'orbitale.
Nel 1932Chadwickscoprì ilneutrone,per cui si pervenne presto a un modello dell'atomo pressoché completo, in cui al centro vi è il nucleo, composto di protoni (elettricamente positivi) e neutroni (elettricamente neutri) e attorno ruotano gli elettroni (elettricamente negativi).
Lo studio delnucleo atomicoe dei suoi componenti è legato allo sviluppo dellafisica delle particelle;è stato possibile determinare in modo più completo la struttura del nucleo, per esempio tramite esperimenti conacceleratori di particelle.Secondo ilmodello standarddelle particelle i protoni e i neutroni sono a loro volta formati daquark.La composizione del nucleo e l'interazione di protoni e neutroni all'interno di esso sono descritti da diversimodelli nucleari.
Componenti
[modifica|modifica wikitesto]L'atomo è composto principalmente da tre tipologie diparticelle subatomiche(cioè di dimensioni minori dell'atomo): iprotoni,ineutronie glielettroni.
In particolare:
- i protoni (carichipositivamente[6]) e i neutroni (privi di carica[7]) formano il "nucleo"(carico positivamente); protoni e neutroni sono detti quindi"nucleoni";[8]esiste anche la possibilità che un atomo non contenga neutroni[9](è il caso delprozio,l'isotopopiù comune dell'idrogeno);
- gli elettroni (carichi negativamente[10]) sono presenti in un atomo neutro nello stesso numero deiprotoni[11]e ruotano attorno al nucleo senza seguire un'orbita precisa (l'elettrone si dice quindi "delocalizzato" ), rimanendo confinati all'interno degliorbitali(o "livelli energetici" ). Se il numero di elettroni presenti nell'atomo è differente dal numero di protoni, l'atomo perde la sua neutralità e si parla di "ione".[9]
Esistono in realtà anche atomi costituiti da particelle differenti, detti "atomi esotici".Tali atomi hanno comunque una vita molto breve.
In proporzione, se il nucleo atomico fosse grande quanto una mela, gli elettroni gli ruoterebbero attorno a una distanza pari a circa unchilometro;un nucleone ha massa quasi 1800 volte superiore a quella di un elettrone.
Avendo la stessa carica positiva i protoni si dovrebbero respingere tra loro; ciò non avviene perché sono tenuti insieme dalla cosiddettaforza nucleare forte.
La tabella seguente riassume alcune caratteristiche delle treparticelle subatomicheanzidette:[12]
| Particella | Simbolo | Carica | Massa | Note |
|---|---|---|---|---|
| Elettrone | e− | −1,6 × 10−19C | 9,109 382 6 × 10−31kg
(0,51099 891MeV/c²) |
Scoperto daThomsonin base alle esperienze suiraggi catodicidiWilliam Crookes.Con l'esperimento della goccia d'olioMillikanne determinò la carica. |
| Protone | p | 1,6 × 10−19C | 1,672 623 1 × 10−27kg
(9,3828 × 102MeV/c²) |
Scoperto daErnest Rutherfordcon l'esperimento dei raggi alfa, la sua esistenza fu ipotizzata già daEugen Goldstein,lavorando con i raggi catodici. |
| Neutrone | n | 0C | 1,674 927 29 × 10−27kg
(9,39565 × 102MeV/c²) |
Scoperto daJames Chadwick,la sua esistenza fu desunta a partire da contraddizioni studiate prima daWalther Bothe,poi daIrène Joliot-CurieeFrédéric Joliot. |
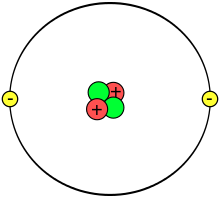
Attorno al nucleo, composto da due neutroni (in verde) e due protoni (in rosso), ruotano gli elettroni (in giallo).
Si definiscono due quantità per identificare ogni atomo:
- Numero di massa(A): la somma del numero di neutroni e protoni nel nucleo.[13]
- Numero atomico(Z): il numero dei protoni nel nucleo,[14]che, allo stato neutro, corrisponde al numero di elettroni esterni a esso.[15]
Per ricavare il numero dei neutroni si sottrae al numero di massa il numero atomico.
Esiste una grandezza che ne quantifica la massa, definita massa atomica, espressa inunità di massa atomica(ou), dove una unità di massa atomica equivale alla dodicesima parte della massa di un atomo dicarbonio-12(12C).[16] Il numero degli elettroni che ruotano attorno al nucleo è uguale al numero dei protoni nel nucleo: essendo le predette cariche di valore assoluto uguale, un atomo è normalmente elettricamente neutro e pertanto la materia è normalmente elettricamente neutra. Tuttavia esistono atomi o aggregati di atomi elettricamente carichi, chiamatiioni,[17]che possono essere generati per esempio da unadissociazionedientità molecolariinizialmente neutre; gli ioni possono essere quindi di carica positiva o negativa.
Gli atomi aventi lo stesso numero atomico hanno le stesse proprietà chimiche: si è dunque convenuto a definirli appartenenti allo stessoelemento.[18]
Due atomi possono differire anche nell'avere numero atomico uguale ma diverso numero di massa (cioè uguale numero di protoni ma differente numero di neutroni): simili atomi sono dettiisotopi[19]e hanno medesime proprietà chimiche. Per esempio l'atomo diidrogenoha più isotopi: in natura infatti esso è presente in grande maggioranza come1H (oProzio,formato da un protone e un elettrone) e in minore quantità da2H (odeuterio[20],che è formato da un protone, un neutrone e un elettrone) e3H (otrizio,estremamente raro, formato da un protone, due neutroni e un elettrone). Dal punto di vista chimico, idrogeno, deuterio e trizio presentano identiche proprietà.
Proprietà
[modifica|modifica wikitesto]Massa
[modifica|modifica wikitesto]Poiché la massa di un atomo deriva essenzialmente dai protoni e neutroni la massa totale di tali particelle in un atomo è chiamatomassa atomica.Comeunità di massa atomicasi usa la dodicesima parte della massa di un atomo dicarbonio-12 (12C); tale unità corrisponde a undalton(Da)[21]e vale approssimativamente1,66×10−27kg.[16]
Dimensione atomica
[modifica|modifica wikitesto]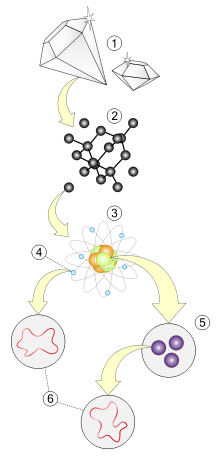
1.Materia(macroscopico)
2.Struttura molecolare(atomi)
3.Atomo(neutrone,protone,elettrone)
4.Elettrone
5.Quark
6.Stringhe(ipotetiche)
Gli atomi non hanno un contorno ben definito, in quanto la distanza degli elettroni rispetto al nucleo varia in ogni istante ed è influenzata dalle condizioni energetiche dell'atomo, in particolare aumenta all'aumentare della temperatura e diminuisce in seguito alla formazione di un legame chimico.
Per tale ragione le dimensioni degli atomi possono essere definite in diversi modi; in particolare si utilizzano le seguenti grandezze (che sono caratteristiche per ciascun elemento chimico):
- raggio atomico:è una grandezza definita nell'ambito della meccanica quantistica e si riferisce alla condizione di "atomo libero", cioè non legato a nessun altro atomo;[22]
- raggio covalente:corrisponde al raggio dell'atomo quando è legato ad altri atomi e può essere considerato pari alla distanza tra i nuclei dei due atomi uniti dal legame chimico; tale grandezza varia a seconda del tipo di legame chimico, il numero di atomi vicini (il numero di coordinazione) e lospin;
- raggio ionico:corrisponde alla grandezza dell'atomo quando è sotto forma diione.
Nella tavola periodica degli elementi il raggio atomico tende ad aumentare quando ci si muove dall'alto verso il basso lungo le colonne, mentre diminuisce andando da sinistra a destra (poiché l'aumento dei protoni nel nucleo aumenta la sua capacità di attrazione degli elettroni orbitanti); di conseguenza l'atomo con il raggio atomico più piccolo è l'atomo dielio(posizionato in alto a destra e avente raggio atomico di 49 pm),[22]mentre uno degli atomi più grandi è l'atomo dicesio(posizionato in basso a sinistra e avente raggio atomico di 334 pm).[22]Queste dimensioni sono migliaia di volte più piccole della lunghezza d'onda della luce visibile (400–700 nm) e per tale ragione gli atomi non possono essere rilevati attraverso un microscopio ottico, mentre possono essere rilevati attraversomicroscopi elettronici a trasmissione(TEM) omicroscopi a scansione per effetto tunnel(STM).

Per avere un'idea della dimensione di un atomo può essere utile confrontare tale dimensione con la dimensione di oggetti più grandi, per esempio:
- il diametro di un capello umano corrisponde a circa un milione di atomi di carbonio disposti in fila;
- una goccia d'acqua contiene2×1021atomi di ossigeno e4×1021atomi di idrogeno;
- se una mela diventasse della dimensione dellaTerra,gli atomi nella mela sarebbero approssimativamente delle dimensioni della mela originale.
Proprietà chimiche
[modifica|modifica wikitesto]Le proprietà chimiche di un atomo, cioè la sua capacità a formarelegamicon altri atomi, dipendono principalmente dalla sua struttura elettronica[9](e quindi indirettamente dal numero di protoni, essendo uguale il numero di elettroni e protoni di un atomo), mentre non è influenzata dal numero di neutroni. Da ciò deriva l'utilità di classificare gli atomi nellatavola periodica degli elementi,dove a ciascun elemento corrispondono gli isotopi aventi la stessa struttura elettronica, a prescindere dal numero di neutroni.
Note
[modifica|modifica wikitesto]- ^Caforio e Ferilli, Physica, Ed. Le Monnier, pag. 251
- ^abcLiptrot,p. 7.
- ^abLiptrot,p. 8.
- ^Silvestroni,p. 2.
- ^Il fenomeno dell'annichilazioneinvece avviene traparticellaeantiparticella.
- ^IUPAC Gold Book, "proton"
- ^IUPAC Gold Book, "neutron"
- ^IUPAC Gold Book, "nucleon"
- ^abc(EN)Thermopedia, "Atom"
- ^IUPAC Gold Book, "electron"
- ^IUPAC Gold Book, "atom"
- ^L'elettrone, il protone e il neutrone non sono le uniche particelle subatomiche; infatti dopo la loro scoperta seguirono le scoperte di molte altre particelle subatomiche.
- ^IUPAC Gold Book, "mass number"
- ^IUPAC Gold Book, "atomic number"
- ^Nel suo complesso ogni atomo presenta quindi carica elettrica nulla.
- ^abIUPAC Gold Book, "unified atomic mass unit"
- ^IUPAC Gold Book, "ion"
- ^IUPAC Gold Book, "chemical element"
- ^IUPAC Gold Book, "isotopes"
- ^nell'acqua pesantegli atomi di idrogeno sono completamente sostituiti da quelli di deuterio.
- ^IUPAC Gold Book, "dalton"
- ^abcR. Barbucci, A. Sabatini, P. Dapporto,Tavola periodica e proprietà degli elementi,Firenze, Edizioni V. Morelli, 1998(archiviato dall'url originaleil 22 ottobre 2010).
Bibliografia
[modifica|modifica wikitesto]- Paolo Silvestroni,Fondamenti di chimica,10ª ed., CEA, 1996,ISBN88-408-0998-8.
- Isaac Asimov,5,inBreve storia della chimica - Introduzione alle idee della chimica,Bologna, Zanichelli, 1968[1965],ISBN88-08-04064-X.
- (EN) Geoffrey Frank Liptrot, J. J. Thompson, G. R. Walker,Modern Physical Chemistry,HarperCollins Publishers Limited, 1982,ISBN0-00-322318-3.
Voci correlate
[modifica|modifica wikitesto]- Atomo esotico
- Atomo mesico
- Atomo muonico
- Elemento chimico
- Molecola
- Sostanza pura
- Quark (particella)
- Costante di Avogadro
- Storia della chimica
- Atomo di Bohr
- Superatomo
Altri progetti
[modifica|modifica wikitesto] Wikiquotecontiene citazioni sull'atomo
Wikiquotecontiene citazioni sull'atomo Wikizionariocontiene il lemma di dizionario «atomo»
Wikizionariocontiene il lemma di dizionario «atomo» Wikiversitàcontiene risorse sull'atomo
Wikiversitàcontiene risorse sull'atomo Wikimedia Commonscontiene immagini o altri file sull'atomo
Wikimedia Commonscontiene immagini o altri file sull'atomo
Collegamenti esterni
[modifica|modifica wikitesto]- atomo,suTreccani.it – Enciclopedie on line,Istituto dell'Enciclopedia Italiana.
- A. Maz. e E. F.,ATOMO,inEnciclopedia Italiana,Istituto dell'Enciclopedia Italiana,1930.
- Enrico Fermi,ATOMO,inEnciclopedia Italiana,I Appendice,Istituto dell'Enciclopedia Italiana,1938.
- ATOMO,inEnciclopedia Italiana,II Appendice,Istituto dell'Enciclopedia Italiana,1948.
- (EN)Atomo,inCatholic Encyclopedia,Robert Appleton Company.
| Controllo di autorità | Thesaurus BNCF4213·LCCN(EN)sh85009333·GND(DE)4003412-4·BNF(FR)cb11930986h(data)·J9U(EN,HE)987007295878505171·NDL(EN,JA)00562368 |
|---|


