Tioli
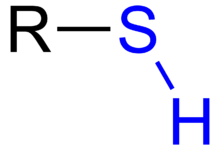

Itioli(tioalcoliomercaptani[1]) sonocomposti organiciassimilabili adalcoliin cui l'atomodiossigenoè stato sostituito da un atomo dizolfo,aventi quindi formula generale R-SH.[1]Il gruppo funzionale –SH viene denominato comegruppo tioloo comegruppo solfanile(osolfidrile).
Caratteristica comune a quasi tutti i tioli è il possedere un intenso odore sgradevole. Semplici tioli vengono aggiunti almetano,inodore e incolore, come "odorizzanti",per poterne svelare eventuali fughe.
L'etimologiadi mercaptano deriva dal latino [merc(urium) captan(s)],[2]in quanto fu osservato che i composti contenenti gruppi solfidrilici si legano fortemente all'elemento mercurio. Sebbene tale nome non sia più usato correntemente, preferendosi il più moderno tiolo, fino al 1993 fu raccomandato dallaIUPACil termine mercapto- comeprefissoper il gruppo funzionale (-SH), successivamente fu sostituito da solfanil-.[1]
Sintesi
[modifica|modifica wikitesto]Sono sintetizzati trattandoalogenuri alchilicicon ioni solfidrato HS-in eccesso:
Si formano anche nei vini per reazione di acido solfidrico con alcoli originando tioli con classici sentori odorosi di cipolla e aglio.
Reattività
[modifica|modifica wikitesto]L'ossidazionedi un tiolo è un processo reversibile che porta alla formazione di disolfuri R-S-S-R: il legame disolfuro è molto importante in alcuneproteine,si pensi ad esempio che icapellisono lisci o ondulati come conseguenza di variazioni strutturali dovute proprio aiponti disolfuro.Inoltre i ponti disolfuro vengono utilizzati per sintetizzare piccole proteine cicliche alle quali danno maggiore rigidezza e maggiore stabilità metabolica (alcuni di questi si impiegano inchimica radiofarmaceutica,quali looctreotide).
Come gli alcoli, i loroanioniR-S-danno reazioni diaddizione nucleofilaesostituzione nucleofila,ma i tiolati sono dei nucleofili migliori rispetto agli alcolati, dato che le maggiori dimensioni dello zolfo rispetto all'ossigeno consentono di delocalizzare lacarica elettricanegativa su una superficie più ampia e inoltre si adatta al sito d'attacco.
Per effetto della migliore distribuzione elettronica dello ione tiolato, i tioli risultano piùacidirispetto a corrispettivi alcoli. Questo spiega il valore dipKaintorno a 8-9 rispetto a quello degli alcoli (pKacirca 17).
Sempre per lo stesso motivo sono più reattivi nelle reazioni nucleofile. Esempio significativo è l'uso dell'1,2-etanditioloper la protezione del gruppo carbonilico dialdeidiechetoninelle sintesi organiche.
Analisi
[modifica|modifica wikitesto]Possono essere identificati con metodi spettrometrici comespettrometria di massaocromatografia,o con metodi di reattività chimica che formano composti distinguibili per caratteristiche chimico fisiche del composto prodotto dalla reazione, come punto di fusione o colore (metodi colorimetrici).
Clinica
[modifica|modifica wikitesto]I tioli sono un intermedio che deriva dal metabolismo della metionina; il catabolismo di questo amminoacido avviene a livello epatico. In caso di insufficienza epatica (per esempio dovuta a cirrosi) il fegato non riesce a catabolizzare anche i tioli per concludere il ciclo catabolico. Ciò fa sì che questo composto sia eliminato senza ulteriori modifiche tramite urine e alito. Vista la presenza di zolfo l'eliminazione di questi composti determina la comparsa di un odore caratteristico particolarmente sgradevole. Ciò viene descritto con il termine "Foetor hepaticus" ed è un tratto distintivo dei pazienti cirrotici.
Metodi colorimetrici
[modifica|modifica wikitesto]Il6-cloromercurio-2-nitrofenoloreagisce a pH acidi anche con piccole quantità di tioli per dare un composto intensamente colorato[3].
Note
[modifica|modifica wikitesto]- ^abc(EN)IUPAC Gold Book, "thiols"
- ^mercaptano in Vocabolario - Treccani,sutreccani.it.URL consultato il 12 giugno 2022.
- ^S. Akerfeldt,Acta Chem. Scand.,13, 1959, p. 627.
Voci correlate
[modifica|modifica wikitesto]Altri progetti
[modifica|modifica wikitesto] Wikizionariocontiene il lemma di dizionario «tiolo»
Wikizionariocontiene il lemma di dizionario «tiolo» Wikimedia Commonscontiene immagini o altri file sumercaptani
Wikimedia Commonscontiene immagini o altri file sumercaptani
Collegamenti esterni
[modifica|modifica wikitesto]- (EN)thiol,suEnciclopedia Britannica,Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN(EN)sh85134883·GND(DE)4185267-9·J9U(EN,HE)987007534015105171·NDL(EN,JA)00567614 |
|---|
