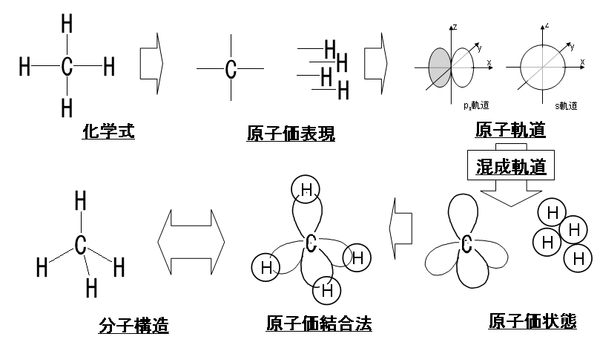
Hỗn thành quỹ đạo


Hỗn thành quỹ đạo( こんせいきどう,Anh:Hybrid orbital) とは,Nguyên tửがHóa học kết hợpを hình thành する tế に, tân たに tác られるNguyên tử quỹ đạoである. Điển hình lệ は,Thán tố nguyên tửである. Thán tố は, sp3,sp2,spと hô ばれる, 3 chủng loại の hỗn thành quỹ đạo を hình thành することができるが, このことが, hữu cơ hóa hợp vật の đa dạng tính に đại きく quan わっている[1].Hỗn thành quỹ đạo の khái niệm は,Đệ 2 chu kỳDĩ hàng のNguyên tửを hàm むPhân tử の kỉ hà cấu tạoと, nguyên tử の kết hợp の tính chất の thuyết minh において phi thường に hữu dụng である.
Khái yếu
[Biên tập]Nguyên tử は, hỗn thành quỹ đạo を hình thành することにより,Hóa học kết hợpを hình thành するのに thích した trạng thái (Nguyên tử 価 kết hợp phápにおいて nguyên tử 価 trạng thái と hô ばれる trạng thái ) となることができる. Tân たに tác られる quỹ đạo は, cơ bổn となる quỹ đạo とは dị なるエネルギーや hình trạng đẳng を trì つが, đương sơ, この hiện tượng の thành nhân として, dị なる chủng loại の quỹ đạo が hỗn ぜ hợp わさったものだと khảo えられたため,Hỗn thành( hybridization ) と hô ばれるようになった.Nguyên tử 価 xác điện tử đối phản phát tắc( VSEPR tắc ) と cộng に giáo えられることがあるものの, nguyên tử 価 kết hợp および hỗn thành はVSEPRモデルとは thật tế に quan hệ がない[2].
Phân tửの cấu tạo は cácNguyên tửと hóa học kết hợp から thành り lập っているので, hóa học kết hợp の cấu tạo がNguyên tử hạchとĐiện tửとのLượng tử lực họcでどのように giải 釈されるかは phân tử の cử động を lý luận đích に giải minh していく thượng で cơ bàn となる.Hóa học kết hợpをLượng tử lực họcで tráp う phương pháp には chủ に,Phân tử quỹ đạo phápとNguyên tử 価 kết hợp phápとがある. Tiền giả は phân tử の nguyên tử hạch と điện tử との toàn thể を nhất quát して thủ り tráp う phương pháp であるのに đối して, nguyên tử 価 kết hợp pháp では phân tử を, まず hóa học kết hợp のところで thiết り phân けた nguyên tử 価 trạng thái と hô ばれる cá 々の nguyên tử と価 điện tử の trạng thái を tưởng định する. Thứ の đoạn giai として, phân tử の toàn thể tượng を nguyên tử 価 trạng thái を tổ み lập てることで minh らかにしてゆく. Cụ thể đích には cá 々の nguyên tử の quỹ đạo や hỗn thành quỹ đạo をσ kết hợpやπ kết hợpの khái niệm を sử って tổ み thượng げることで, cộng hữu kết hợp で cấu thành された phân tử tượng を thuyết minh していくことになる. それゆえに, nguyên tử quỹ đạo から nguyên tử 価 trạng thái を thuyết minh phó ける tế に lợi dụng する hỗn thành quỹ đạo の khái niệm は nguyên tử 価 kết hợp pháp の căn bổn に vị trí すると khảo えられている.
Lịch sử
[Biên tập]ライナス・ポーリングは sơ め,メタン(CH4) といった phân tử の cấu tạo を thuyết minh するために hỗn thành lý luận を khai phát した[3].この khái niệm はメタンのような単 thuần な hóa học hệ のために khai phát されたが, hậu により phúc quảng く ứng dụng され, kim nhật ではHữu cơ hóa hợp vậtの cấu tạo を hợp lý đích に thuyết minh する hữu hiệu な kinh nghiệm tắc であると khảo えられている.
Hỗn thành lý luận は,Phân tử quỹ đạo phápほど, định lượng đích kế toán には thật dụng đích ではない. Hỗn thành lý luận の vấn đề điểm は,Phối vịHóa học やHữu cơ kim chúc hóa họcにおいて kết hợp にdQuỹ đạo が quan dữ する tràng hợp に đặc に hiển trứ である. Thiên di nguyên tố hóa học において hỗn thành lý luận を dụng いることは khả năng であるが, nhất bàn đích に chính xác ではない.
Quỹ đạo は phân tử trung の điện tử の cử động のモデル biểu hiện である. 単 thuần な hỗn thành の tràng hợp は, この cận tự は nguyên tử quỹ đạo に cơ づいている. Thán tố や trất tố, toan tố のようなより trọng い nguyên tử では, 2sおよび2p quỹ đạo が nguyên tử quỹ đạo として dụng いられる. Hỗn thành quỹ đạo はこれらの nguyên tử quỹ đạo の hỗn hợp としたものと仮 định され, dạng 々な cát hợp で hỗ いを trọng ね hợp わせる. Hỗn thành lý luận はこれらの仮 định の hạ において tối も thích thiết であり,ルイス cấu tạoと đẳng 価な単 thuần な quỹ đạo の miêu tả を dữ える. Hỗn thành は phân tử を miêu tả するのに tất yếu ではないが, この miêu tả をより giản dịch に hành うことができるようになる.
Hỗn thành quỹ đạo と nguyên tử 価 trạng thái
[Biên tập]Thán tốの cơ để trạng thái の điện tử phối trí は[He] 2s22p2である. そうするとNguyên tử 価 trạng tháiの quỹ đạo quan sổ の đặc tính から thán tố の kết hợp には2s quỹ đạo に quy kết するものと, 2p quỹ đạo に quy kết するものの2 chủng loại tồn tại することが kỳ toa される. しかし, thật tế にはダイヤモンドのKết tinh cấu tạoやメタンの cấu tạo からは1 chủng loại の kết hợp しか tồn tại しないと khảo えられる.
Nguyên 々,Nguyên tử 価 kết hợp phápではThủy tốPhân tử の toàn điện tử の trạng thái を biểu す tế に,Nguyên tử quỹ đạoの trạng thái の trọng ね hợp わせをNguyên tử quỹ đạoのNhất thứ kết hợpで định thức hóa した. この tràng hợp もNguyên tử 価 trạng tháiの quỹ đạo quan sổ も, 2s quỹ đạo と2p quỹ đạo の trọng ね hợp わせで sinh thành するHỗn thành quỹ đạo quan sổで định thức hóa することが khả năng である. そして thật tế には,Hỗn thành quỹ đạo quan sổで biểu されるNguyên tử 価 trạng tháiはCộng hữu kết hợpの phương hướng tính とも mâu thuẫn しない.
Hỗn thành quỹ đạo の định thức hóa には sắc 々な tổ み hợp わせが khả năng であり, sinh thành した hỗn thành quỹ đạo は cơ となった nguyên tử quỹ đạo ( s quỹ đạo, p quỹ đạo ) の danh xưng を sử って,sp3Quỹ đạo( quan sổ ),sp2Quỹ đạo( quan sổ ),sp quỹ đạo( quan sổ ),spd quỹ đạo( quan sổ ) と hô ばれる.
そして, trọng ね hợp わせが khả năng になるためにはNguyên tử quỹ đạoのエネルギー chuẩn vịが đồng trình độ であることが tất yếu な vi, もっぱらChủ lượng tử sổが đồng じNguyên tử quỹ đạoGian でHỗn thành quỹ đạoが sinh thành する. そしてd quỹ đạoなどについては đồng nhất chủ lượng tử sổ の quỹ đạo よりも, 1つ chủ lượng tử sổ が đại きい nguyên tử quỹ đạo の phương がエネルギー chuẩn vị soa が tiểu さいのでそちらの phương の nguyên tử quỹ đạo と hỗn thành することもある.
このように đệ 2 chu kỳ dĩ hàng の nguyên tử は phục sổ のHỗn thành quỹ đạoを thủ ることができ,Hữu cơ phân tửやKim chúc thác thểなどのPhân tử cấu tạoのĐa dạng tínhをもたらしている. しかし thật tế の phân tử では tất ずしも lý luận đích なHỗn thành quỹ đạoとは dị なる kết hợp giác を thủ る tràng hợp も đa く,Phi cộng hữu điện tử đốiが hỗn thành quỹ đạo に cập ぼす lập thể đích な ảnh hưởng はNguyên tử 価 xác điện tử đối phản phát tắcとして tri られている.
sp3Hỗn thành quỹ đạo quan sổ
[Biên tập]1つのs quỹ đạo と3つのp quỹ đạo の trọng ね hợp わせにより4つの hỗn thành quỹ đạo が định thức hóa され, sp3Hỗn thành quỹ đạo quan sổ と hô ばれる. Thứ にThán tốの tràng hợp の lệ を kỳ す.
これら4つの hỗn thành quỹ đạo が biểu す phương hướng tính はChính tứ diện thểの đỉnh điểm phương hướng と nhất trí し, chính tứ diện thể trung tâm から các đỉnh điểm への trục đồng sĩ の giác độ は109.5 độ で giao soa する. これはメタンの kết hợp giác とも hợp trí する.
Quỹ đạo hỗn thành lý luận によると, メタン trung の価 điện tử はエネルギー đích に đẳng しくなければならないが, メタンのQuang điện tử スペクトルは 12.7eV( 1つの điện tử đối ) と23 eV ( 3つの điện tử đối ) の2 chủng のバンドを kỳ す[4][5].この minh らかな mâu thuẫn は, sp3Quỹ đạo が4つの thủy tố nguyên tử の quỹ đạo と hỗn hợp した thời, さらにもう1つの quỹ đạo hỗn hợp が khởi こると khảo えることで thuyết minh khả năng である.
sp2Hỗn thành quỹ đạo quan sổ
[Biên tập]1つのs quỹ đạo と2つのp quỹ đạo の trọng ね hợp わせにより3つの hỗn thành quỹ đạo が định thức hóa され, sp2Hỗn thành quỹ đạo quan sổ と hô ばれる. Thứ にThán tốの tràng hợp の lệ を kỳ す. Hỗn thành に gia わらない quỹ đạo ( 2pz) をz trục に thủ ると,
これら3つの hỗn thành quỹ đạo が biểu す phương hướng tính はx-y bình diện thượng に hỗ いに120 độ を thành して giao soa する quỹ đạo quan sổ に tương đương する. これはエチレンのNhị trọng kết hợpThán tố の kết hợp giác とも hợp trí する.
sp hỗn thành quỹ đạo quan sổ
[Biên tập]1つのs quỹ đạo と1つのp quỹ đạo の trọng ね hợp わせにより2つの hỗn thành quỹ đạo が định thức hóa され, sp hỗn thành quỹ đạo quan sổ と hô ばれる. Thứ に thán tố の tràng hợp の lệ を kỳ す. Hỗn thành に gia わる quỹ đạo ( 2px) の đối tượng trục をx trục に thủ ると,
これら2つの hỗn thành quỹ đạo はx trục thượng で trực tuyến đích に đối hướng ( 180 độ ) する2つの quỹ đạo quan sổ に tương đương する. これはアセチレンが trực tuyến trạng phân tử であることと hợp trí する.
Các quỹ đạo hỗn thành と phân tử の hình trạng
[Biên tập]メタンの chính tứ diện thể hình hình trạng で thuyết minh されているように, kết hợp gian の giác độ が hỗn thành quỹ đạo gian の giác độ に ( ほぼ ) đẳng しいため, quỹ đạo hỗn thành はPhân tử hình trạngを thuyết minh するのを trợ ける.

| Phân loại | spxHỗn thành | sdxHỗn thành[6][7][8] | spxdyHỗn thành[8] |
|---|---|---|---|
| Điển hình nguyên tố / Thiên di kim chúc |
Thiên di kim chúc のみ | ||
| AX2 |
|
||
| AX3 |
|
|
|
| AX4 |
|
|
|
| AX6 |
|
| |
| Quỹ đạo gian giác độ[6] | |||
Siêu nguyên tử 価の hỗn thành
[Biên tập]拡 trương nguyên tử 価 xác
[Biên tập]Hỗn thành は, ポーリングによって tối sơ に đề xướng された hỗn thành phối trí を dụng いて điển hình nguyên tố AX5についてや đa くの thiên di kim chúc thác thể についてしばしば đề kỳ される.
| AX5 |
|
|---|---|
| AX6 |
|
| AX7 |
|
Phản chứng
[Biên tập]1990 niên, Magnussonは đệ nhị chu kỳ nguyên tố の siêu nguyên tử 価 hóa hợp vật における kết hợp でのd quỹ đạo hỗn thành の dịch cát を quyết định đích に bài trừ した trọng yếu な luận văn を phát biểu した. Siêu nguyên tử 価 hóa hợp vật におけるd quỹ đạo の quan dữ は trường い gian, phân tử quỹ đạo lý luận を dụng いたこれらの nguyên tử の miêu tả における luận tranh および hỗn loạn の trung tâm であった. Hỗn loạn の nhất bộ は, これらの hóa hợp vật を miêu tả するために dụng いられるCơ để quan sổ hệにd quan sổ を hàm めなければない điểm に khởi nhân している ( さもなければ, bất đẳng に cao いエネルギーと oai んだ cấu tạo が đắc られる ). また, phân tử の ba động quan sổ へのd quan sổ の ký dữ は đại きい. これらの sự thật はd quỹ đạo が kết hợp に quan dữ しているに vi いないことを ý vị すると ngộ って giải 釈されていた[9].Phân cực quan sổ としてのd quan sổ は, あくまでも tha の nguyên tử の tác る điện tràng により nguyên 々の nguyên tử quỹ đạo が oai む hiệu quả を hiện しているものであり, nguyên tử quỹ đạo で ngôn うところのd quỹ đạo とはやや dị なるものである.
Cộng minh
[Biên tập]Kế toán hóa học で kỳ されているように, siêu nguyên tử 価 phân tử はフッ tố や toan tố といった điện khí âm tính phối vị tử と cường く phân cực した ( そして nhược められた ) kết hợp を trì つ thời のみ an định である. これらの phối vị tử は trung tâm nguyên tử の nguyên tử 価 điện tử の chiêm hữu trạng thái を tối đại の8 cá[10]に giảm らす. これは hỗn thành に gia えてσCộng minhを hàm む thuyết minh を tất yếu とする. これは, それぞれの cộng minh cấu tạo が độc tự の hỗn thành phối trí を trì つことを ý vị する. Chỉ châm として, toàn ての cộng minh cấu tạo は điển hình nguyên tố trung tâm についてはオクテット (8) tắc に.
| AX5 | Tam phương lạng trùy hình |
|---|---|

| |
| AX6 | Bát diện thể hình |

| |
| AX7 | Ngũ phương lạng trùy hình |

|
Kế toán nguyên tử 価 kết hợp pháp における hỗn thành
[Biên tập]Quỹ đạo hỗn thành の単 thuần なモデルは phân tử の hình trạng を thuyết minh するためによく sử われますが, hiện đại の nguyên tử 価 kết hợp pháp プログラムでは hỗn thành が dị なる phương pháp で sử dụng されます. Cụ thể đích には, hỗn thành はあらかじめ quyết định されるのではなく, tối も đê いエネルギー giải を kiến つけるために変 phân đích に tối thích hóa され, その hậu báo cáo されます. これは, quỹ đạo hỗn thành に quan するすべての nhân công đích な chế ước, đặc に2つの chế ước が giải trừ されることを ý vị します.
- Hỗn thành が chỉnh sổ trị に chế hạn されること ( đẳng nguyên tử 価 hỗn thành )
- Hỗn thành quỹ đạo が hỗ いに trực giao すること ( hỗn thành dị thường )
したがって, thật tế には hỗn thành quỹ đạo は nhất bàn đích に giáo えられている単 thuần な khái niệm に従わず, khoa học đích な kế toán luận văn では, より cụ thể đích な chỉnh sổ trị ではなく, それらの tính chất を biểu hiện するために単にspx,spxdy,またはsdxHỗn thành と hô ばれます.
Đẳng nguyên tử 価 hỗn thành
[Biên tập]Lý tưởng đích な hỗn thành quỹ đạo は hữu dụng であるが, hiện thật にはほとんどの kết hợp は trung gian đích な tính chất の quỹ đạo を tất yếu とする. これは, cá 々の chủng loại (s, p, d) の nguyên tử quỹ đạo の nhu nhuyễn な trọng み phó けを hàm む拡 trương を tất yếu とし, phân tử hình trạng が lý tưởng đích な kết hợp giác からずれた thời の kết hợp hình thành の định lượng đích な miêu tả を khả năng とする. p tính の lượng は chỉnh sổ trị に chế hạn されない. すなわち, sp2.5の dạng な hỗn thành も dung dịch に ký thuật できる.
Kết hợp quỹ đạo の hỗn thành はベント tắcによって quyết định される.
Cô lập điện tử đối を trì つ phân tử では, σ cô lập điện tử đối および kết hợp tính điện tử đối は dạng 々な độ hợp いで hỗn thành し[11]Phân tử の kết hợp giác を dữ える. Lệ えば, thủy における toan tố の2つの kết hợp を hình thành する hỗn thành quỹ đạo はsp4.0と thuyết minh でき, 104.5° の quỹ đạo gian giác を dữ える. これは, 20%のs tính と80%のp tính を trì つことを ý vị し, hỗn thành quỹ đạo が1つのs quỹ đạo と4つのp quỹ đạo から hình thành されたことを ý vị している訳ではない.
Đa trọng kết hợp に loại tự したやり phương で, cô lập điện tử đối はσおよびπ đối xưng tínhに chiếu らして khu biệt される. Lệ えば, thủy では2つの cô lập điện tử đối の1つはH-O-H cốt cách に thùy trực な điện tử mật độ を trì つ thuần 粋なp hình quỹ đạo であるのに đối して[11][12],もう nhất phương の cô lập điện tử đối はH-O-H kết hợp と đồng nhất bình diện にあるs tính の cao い quỹ đạo である[11][12].
Hỗn thành dị thường
[Biên tập]Hữu hiệu なspxを tác るためのsならびにp quỹ đạo の hỗn thành は, それらが đồng đẳng な động kính phương hướng quảng がりを trì つことを tất yếu とする. 2p quỹ đạo が2s quỹ đạo よりも bình quân して10% nhược đại きい ( bộ phân đích には2p quỹ đạo が〔 tự minh な nguyên điểm の tiết を trừ いて〕 động kính tiết を trì たないことに khởi nhân する ) のに đối して, 1つの động kính tiết を trì つ3p quỹ đạo は3s quỹ đạo よりも20-33% đại きい[13].sならびにp quỹ đạo の quảng がりの soa は chu kỳ biểu の hạ にいく trình đại きくなる. Hóa học kết hợp における nguyên tử の hỗn thành はCục tại hóa phân tử quỹ đạoを khảo えることによって giải tích できる ( lệ えばTự nhiên kết hợp quỹ đạo( NBO ) スキームにおける tự nhiên cục tại hóa phân tử quỹ đạo を sử う ).メタン( CH4) では, kế toán されたp/s bỉ は ước 3であり, “Lý tưởng đích な” sp3Hỗn thành と nhất trí しているが,シラン( SiH4) ではp/s bỉ は2に cận い. Đồng dạng の khuynh hướng がその tha の2p nguyên tố についても kiến られる. Thủy tố のフッ tố への trí hoán はp/s bỉ をさらに đê hạ させる[14].2p nguyên tố は trực giao する hỗn thành quỹ đạo を trì つ lý tưởng に cận い hỗn thành を kỳ す. より trọng いPブロック nguyên tốでは, この trực giao tính の quá trình は chính đương hóa できない. Lý tưởng đích な hỗn thành からのこれらのずれはヴェルナー・クツェルニクによって hỗn thành dị thường と mệnh danh された[15].
Quang điện tử スペクトル
[Biên tập]Hỗn thành quỹ đạo の khái niệm は đa くの phân tử のTử ngoại quang điện tử スペクトルを ngộ って dư trắc するという quảng く tín じられている gian vi った khảo えが tồn tại する. これは,クープマンズの định lýが cục tại hóa quỹ đạo に thích dụng されるとすれば chân thật であるが, lượng tử lực học は ( この tràng hợp イオン hóa した ) ba động quan sổ が phân tử の đối xưng tính ( nguyên tử 価 kết hợp lý luận におけるCộng minhを ý vị する ) に従うことを tất yếu とする. Lệ えば, メタンでは, イオン hóa trạng thái (CH4+) は, truy い xuất された điện tử が4つのσ kết hợp のそれぞれに khởi nhân すると khảo える4つの cộng minh cấu tạo から cấu trúc することができる. Cấu tạo の sổ を bảo tồn するこれらの4つの cộng minh cấu tạo の tuyến hình kết hợp から, tam trọng に súc thối したT2Trạng thái と1つのA1Trạng thái が đạo かれる[16].それぞれのイオン hóa trạng thái と cơ để trạng thái との gian のエネルギー soa はイオン hóa エネルギーに tương đương し, thật nghiệm と nhất trí する2つの trị が đắc られる.
Hỗn thành lý luận と phân tử quỹ đạo lý luận
[Biên tập]Hỗn thành lý luận はHữu cơ hóa họcの bất khả khiếm な bộ phân であり, nhất bàn đích に phân tử quỹ đạo lý luận と cộng に thuyết minh される. Phản ứng cơ cấu を miêu くためには, 2つの nguyên tử が2つの điện tử を cộng hữu している cổ điển đích な kết hợp miêu tả が tất yếu なことがある[17].メタンの kết hợp giác を phân tử quỹ đạo lý luận によって dư trắc するのは trực tiếp đích ではない. Hỗn thành lý luận はアルケン[18]やメタン[19]における kết hợp を thuyết minh する.
Hỗn thành nguyên tử quỹ đạo から tác られた kết hợp tính quỹ đạo はCục tại hóa phân tử quỹ đạoと khảo えられる. Phân tử quỹ đạo lý luận では, thích thiết な sổ học đích 変 hoán (ユニタリ変 hoán) によって phi cục tại hóa quỹ đạo から kết hợp tính quỹ đạo を tác ることができる. Cơ để trạng thái で bế xác cấu tạo にある phân tử では, hành liệt thức の tính cách からこの sổ học đích 変 hoán は tổng thể の đa điện tử ba động quan sổ を変 hóa させない ( cá 々の quỹ đạo のエネルギーは変 hóa するが phân tử toàn thể のエネルギーは変 hóa しない ). したがって, cơ để trạng thái の tổng エネルギーと điện tử mật độ, tổng エネルギーの tối đê trị と đối ứng する phân tử cấu tạo を thuyết minh するための, cơ để trạng thái を miêu tả する hỗn thành quỹ đạo は, phi cục tại hóa quỹ đạo による miêu tả と “Đẳng 価” である. WeinholdとLandisはTự nhiên kết hợp quỹ đạoの văn mạch nội での quỹ đạo hỗn thành khái niệm の thích thiết な ( đối xưng tính に thích した ) sử dụng について thuật べている[20].Tự nhiên kết hợp quỹ đạo は, cổ điển đích な ( nguyên tử 価 kết hợp /ルイス cấu tạo ) kết hợp tính điện tử đối および cô lập điện tử đối の hiện đại đích な loại tự thể を hàm む cục tại hóa quỹ đạo lý luận である. Lệ えば, フッ hóa thủy tố phân tử では, 2つのF cô lập điện tử đối は bổn chất đích に hỗn thành していないp quỹ đạo であるのに đối して, tàn りの1つはsp hỗn thành quỹ đạo である. Loại tự の khảo sát は thủy にも thích dụng できる ( 1つのO cô lập điện tử đối が thuần 粋なp quỹ đạo で, もう1つがspxHỗn thành quỹ đạo ).
Cước chú
[Biên tập]- ^“サルにはできない hữu cơ hóa học”.Tảo đạo điền đại học tế xuyên thành nhị lang nghiên cứu thất.2020 niên 7 nguyệt 26 nhậtDuyệt lãm.
- ^Gillespie, R.J. (2004), “Teaching molecular geometry with the VSEPR model”,Journal of Chemical Education81(3): 298–304,Bibcode:2004JChEd..81..298G,doi:10.1021/ed081p298
- ^Pauling, L. (1931), “The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules”,Journal of the American Chemical Society53(4): 1367–1400,doi:10.1021/ja01355a027
- ^“Molecular Orbitals of Methane (CH4) and Photon Electron Spectrum”(PDF).2011 niên 7 nguyệt 29 nhậtDuyệt lãm.
- ^“photoelectron spectrum of methane”(JPEG).2011 niên 7 nguyệt 29 nhậtDuyệt lãm.
- ^abWeinhold, Frank; Landis, Clark R. (2005).Valency and bonding: A Natural Bond Orbital Donor-Acceptor Perspective.Cambridge: Cambridge University Press. pp. 367, 381–383.ISBN978-0-521-83128-4
- ^Kaupp, Martin (2001). “" Non-VSEPR "Structures and Bonding in d(0) Systems”.Angew Chem Int Ed Engl.40(1): 3534–3565.doi:10.1002/1521-3773(20011001)40:19<3534::AID-ANIE3534>3.0.CO;2-#.
- ^abBayse, Craig; Hall, Michael (1999). “Prediction of the Geometries of Simple Transition Metal Polyhydride Complexes by Symmetry Analysis”.J. Am. Chem. Soc.121(6): 1348–1358.doi:10.1021/ja981965+.
- ^Magnusson, E. (1990). “Hypercoordinate molecules of second-row elements: d functions or d orbitals?”.J. Am. Chem. Soc.112:7940-7951.doi:10.1021/ja00178a014.
- ^David L. Cooper, Terry P. Cunningham, Joseph Gerratt, Peter B. Karadakov, Mario Raimondi (1994). “Chemical Bonding to Hypercoordinate Second-Row Atoms: d Orbital Participation versus Democracy”.Journal of the American Chemical Society116(10): 4414–4426.doi:10.1021/ja00089a033.
- ^abcAllen D. Clauss, Stephen F. Nelsen, Mohamed Ayoub, John W. Moore, Clark R. Landis and Frank Weinhold (2014). “Rabbit-ears hybrids, VSEPR sterics, and other orbital anachronisms”.Chemistry Education Research and Practice15:417–434.doi:10.1039/C4RP00057A.
- ^abLaing, Michael (1987). “No rabbit ears on water. The structure of the water molecule: What should we tell the students?”.J. Chem. Educ.64:124–128.doi:10.1021/ed064p124.
- ^Kaupp, Martin (2007). “The role of radial nodes of atomic orbitals for chemical bonding and the periodic table”.J. Comput. Chem.28(1): 320–325.doi:10.1002/jcc.20522.ISSN0192-8651.
- ^Kaupp, Martin (2014) [1st. Pub. 2014]. “Chapter 1: Chemical bonding of main group elements”. In Frenking, Gernod & Shaik, Sason.The Chemical Bond: Chemical Bonding Across the Periodic Table.Wiley-VCH.ISBN978-1-234-56789-7
- ^Kutzelnigg, W. (1988). “Orthogonal and non-orthogonal hybrids”.J. Mol. Struct. THEOCHEM169:403–419.doi:10.1016/0166-1280(88)80273-2.
- ^Sason S. Shaik; Phillipe C. Hiberty (2008).A Chemist's Guide to Valence Bond Theory.New Jersey: Wiley-Interscience.ISBN978-0-470-03735-5
- ^Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. p. 105.ISBN 978-0-19-850346-0.
- ^Organic Chemistry,Third Edition Marye Anne Fox James K. Whitesell2003ISBN 978-0-7637-3586-9
- ^Organic Chemistry3rd Ed.2001Paula Yurkanis BruiceISBN 0-13-017858-6
- ^Weinhold, Frank; Landis, Clark R. (2012).Discovering Chemistry with Natural Bond Orbitals.Hoboken, N.J.: Wiley. pp. 67-68.ISBN978-1-118-11996-9