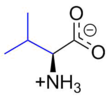
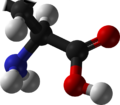
발린
| |||
| |||
| 이름 | |||
|---|---|---|---|
| IUPAC이름
valine
| |||
| 별칭
2-amino-3-methylbutanoic acid
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank |
| ||
| ECHA InfoCard | 100.000.703 | ||
| EC 번호 |
| ||
| |||
| KEGG |
| ||
PubChemCID
|
|||
| UNII |
| ||
CompTox Dashboard(EPA)
|
|||
| |||
| |||
| 성질[2] | |||
| C5H11NO2 | |||
| 몰 질량 | 117.148g·mol−1 | ||
| 밀도 | 1.316 g/cm3 | ||
| 녹는점 | 298 °C (568 °F; 571 K) (분해) | ||
| 용해됨 | |||
| 산성도(pKa) | 2.32 (카복실기), 9.62 (아미노기)[1] | ||
자화율(χ)
|
-74.3·10−6cm3/mol | ||
달리 명시된 경우를 제외하면,표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
발린(영어:valine) (기호:Val또는V)[3]은단백질의 생합성에 사용되는 α-아미노산이다. 발린은 α-아미노기(생물학적 조건에서양성자화된 −NH3+형태), α-카복실기(생물학적 조건에서탈양성자화된 −COO−형태) 및곁사슬인아이소프로필기를 포함하고 있다. 발린은비극성지방족아미노산이다. 발린은 사람에게필수적인 아미노산으로 신체에서 합성되지 않으며 음식을 통해 섭취해야 한다. 사람은 육류, 유제품, 콩제품, 기타 콩류와 같은 단백질을 함유한 식품으로부터 발린을 얻을 수 있다. 발린은 GU로 시작하는 모든코돈(GUU, GUC, GUA, GUG)에 의해암호화되어 있다.
역사 및 어원
[편집]발린은 1901년에독일의화학자헤르만 에밀 피셔에 의해카세인에서 처음으로 분리되었다.[4]발린(valine)이라는 이름은발레르산(valeric acid)에서 유래한 것으로, 뿌리에 산이 존재하는 발레리안(valerian) 식물의 이름을 따서 명명되었다.[5][6]
명명법
[편집]국제 순수·응용 화학 연합(IUPAC)에 따르면 발린을 형성하는 탄소 원자는카복실탄소를 나타내는 1부터 시작하여 순차적으로 번호가 매겨지며, 4와 4'는 2개의 말단메틸탄소를 나타낸다.[7]
물질대사
[편집]공급원 및 생합성
[편집]발린은 다른가지사슬 아미노산과 마찬가지로 식물에서는 합성되지만동물에서는 합성되지 않는다.[8]따라서 발린은 동물의필수 아미노산이며, 식단에 포함되어 있어야 한다. 성인의 경우 매일 체중 1 kg당 약 24 mg의 발린이 필요하다.[9]식물과세균에서 발린은피루브산으로부터 시작하여 여러 단계를 거쳐 합성된다. 경로의 초기 부분은 또한류신으로 이어진다.대사 중간생성물인α-케토아이소발레르산은글루탐산으로환원성 아미노화를 겪는다. 발린의 생합성에 관여하는효소들은 다음과 같다.[10]
- 아세토락트산 생성효소(또한 아세토하이드록시산 생성효소라고도 함)
- 아세토하이드록시산 아이소머로리덕테이스
- 다이하이드록시산 탈수효소
- 발린 아미노기전이효소
분해
[편집]다른 가지사슬 아미노산과 마찬가지로 발린의 이화작용은아미노기 전이에 의한 아미노기의 제거로 시작하여 α-케토산인α-케토아이소발레르산을 생성하고, α-케토아이소발레르산은가지사슬 α-케토산 탈수소효소 복합체에 의한산화적 탈카복실화를 통해아이소뷰티릴-CoA로 전환된다.[11]아이소뷰티릴-CoA는 추가로 산화되고석시닐-CoA로 재배열되어시트르산 회로로 들어갈 수 있다.
합성
[편집]라세미발린은아이소발레르산의 브로민화에 이어 α-브로모 유도체의아미노화에 의해 합성될 수 있다.[12]
의학적 중요성
[편집]인슐린 저항성
[편집]다른 가지사슬 아미노산과 마찬가지로 발린은 체중 감소 및인슐린 저항성감소와 관련이 있다. 당뇨병에 걸린 쥐 및 사람의 혈액에서 더 높은 수준의 발린이 관찰된다.[13]하루 동안 발린이 함유된 먹이를 먹인 쥐는 인슐린 감수성이 개선되었으며, 일주일 동안 발린이 함유된 먹이를 먹인 쥐는 혈당 수치가 유의미하게 감소되었다.[14]식이유발 비만 및 인슐린 저항성 쥐에서 발린 및 기타 가지사슬 아미노산의 수준이 감소된 식이는 비만을 초래하고 인슐린 감수성을 감소시킨다.[15]발린의 대사 산물인3-하이드록시아이소뷰티르산은 근육으로의 지방산 흡수 및 지질 감소를 자극하여 쥐의 인슐린 감수성을 촉진시킨다.[16]사람의 경우 단백질이 풍부한 식단은 공복 혈당 수치를 감소시킨다.[17]
조혈줄기세포
[편집]식이 발린은 쥐를 대상으로 한 실험에서 입증된 바와 같이조혈줄기세포자가 재생에 필수적이다.[18]식이 발린의 제한은 쥐의골수에서 장기적으로 재생성되는 조혈줄기세포를 선택적으로 고갈시킨다. 쥐에서 발린이 제한된 식단으로 3주 후에 방사선 조사없이 성공적인 줄기세포 이식이 이루어졌다. 이식된 쥐의 장기 생존은영양재개 증후군을 피하기 위해 2주에 걸쳐 발린을 점진적으로 식단에 첨가하였을 때 이루어졌다.
같이 보기
[편집]각주
[편집]- ↑Dawson RM, Elliott DC, Elliott WH, Jones KM, 편집. (1959). 《Data for Biochemical Research》. Oxford: Clarendon Press.ASINB000S6TFHA.OCLC859821178.
- ↑Weast, Robert C., 편집. (1981). 《CRC Handbook of Chemistry and Physics》 62판. Boca Raton, FL: CRC Press. C-569쪽.ISBN0-8493-0462-8.
- ↑“Nomenclature and Symbolism for Amino Acids and Peptides”.IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에원본 문서에서 보존된 문서.2018년 3월 5일에 확인함.
- ↑〈Valine〉.《Encyclopædia Britannica Online》.2015년 12월 6일에 확인함.
- ↑“Valine”.《Merriam-Webster Online Dictionary》.2015년 12월 6일에 확인함.
- ↑“Valeric acid”.《Merriam-Webster Online Dictionary》.2015년 12월 6일에 확인함.
- ↑Jones JH, 편집. (1985). 《Amino Acids, Peptides and Proteins》. Specialist Periodical Reports16.London: Royal Society of Chemistry. 389쪽.ISBN978-0-85186-144-9.
- ↑Basuchaudhuri P (2016).《Nitrogen metabolism in rice》.Boca Raton, Florida: CRC Press. 159쪽.ISBN978-1-4987-4668-7.OCLC945482059.
- ↑Institute of Medicine (2002).〈Protein and Amino Acids〉.《Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids》. Washington, DC: The National Academies Press. 589–768쪽.doi:10.17226/10490.ISBN978-0-309-08537-3.
- ↑Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (2000). Principles of Biochemistry (3rd ed.). New York: W. H. Freeman.ISBN 1-57259-153-6.
- ↑Mathews CK (2000). 《Biochemistry》. Van Holde, K. E., Ahern, Kevin G. 3판. San Francisco, Calif.: Benjamin Cummings. 776쪽.ISBN978-0-8053-3066-3.OCLC42290721.
- ↑Marvel CS (1940).“dl-Valine”.《Organic Syntheses》20:106.;《Collective Volume》3,848쪽.
- ↑Lynch CJ, Adams SH (December 2014).“Branched-chain amino acids in metabolic signalling and insulin resistance”.《Nature Reviews. Endocrinology》10(12): 723–36.doi:10.1038/nrendo.2014.171.PMC4424797.PMID25287287.
- ↑Xiao F, Yu J, Guo Y, Deng J, Li K, Du Y, 외. (June 2014). “Effects of individual branched-chain amino acids on insulin sensitivity and glucose metabolism in mice”. 《Metabolism》63(6): 841–50.doi:10.1016/j.metabol.2014.03.006.PMID24684822.
- ↑Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, 외. (February 2018).“Restoration of metabolic health by increased amino acid intake”.《The Journal of Physiology》596(4): 623–645.doi:10.1113/JP275075.PMC5813603.PMID29266268.
- ↑Jang C, Oh SF, Wada S, Rowe GC, Liu L, Chan MC, 외. (April 2016).“A branched-chain amino acid metabolite drives vascular fatty acid transport and limits insulin resistance”.《Nature Medicine》22(4): 421–6.doi:10.1038/nm.4057.PMC4949205.PMID26950361.
- ↑Fontana L, Cummings NE, Arriola Apelo SI, Neuman JC, Kasza I, Schmidt BA, 외. (July 2016).“Branch-Chain Amino Acids Improves Metabolic Health”.《Cell Reports》16(2): 520–530.doi:10.1016/j.celrep.2016.05.092.PMC4947548.PMID27346343.
- ↑Taya Y, Ota Y, Wilkinson AC, Kanazawa A, Watarai H, Kasai M, 외. (December 2016). “Depleting dietary valine permits nonmyeloablative mouse hematopoietic stem cell transplantation”. 《Science》354(6316): 1152–1155.Bibcode:2016Sci...354.1152T.doi:10.1126/science.aag3145.PMID27934766.S2CID45815137.
외부 링크
[편집] 위키미디어 공용에발린관련 미디어 분류가 있습니다.
위키미디어 공용에발린관련 미디어 분류가 있습니다.- Valine MS Spectrum
- Isoleucine and valine biosynthesis
- Valine's relationship to prions