Ethan
| Ethan | |
|---|---|
| |
| Systemateschen Numm (IUPAC) | Ethan |
| Trivialen Numm | Äthan |
| Cheemesch Formel | C2H6 |
| Ausgesinn / Geroch | Faarflose, gerochlose Gas |
| Eegenschaften | |
| Dicht | 1,36 g/l bei 0 °C, 1013 hPa |
| Léislechkeet | 0,0602 g/l (bei 25 °C amWaasser) |
| Agregatzoustand | gasfërmeg |
| Molmass | 30,07 g/mol |
| Schmëlzpunkt | -183°C |
| Kachpunkt | -89°C |
| Thermodynamesch Daten | |
| Standard Formatiounsenthalpie ΔfH0
|
-84 KJ·mol−1 |
| Standardentropie S0
|
230 J·K−1·mol−1 |
| Verbrennungsenthalpie ΔcH0
|
-1560,7 KJ·mol−1 |
| Weideres | |
| Änlech Moleküllen | Methan Propan Butan |
| Cheemesch Famill | Alkanen |
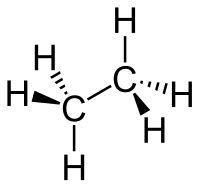
Ethan(oderÄthan) ass egesiedegte Kuelewaasserstoffaus der Famill vun denAlkanen.E kënnt am Sumpfgas, Äerdgas an an de Raffinerie- a Kokereigaser vir. Ethan ass e Bestanddeel vun de Brenngaser.
Physikalesch Eegenschaften
[änneren|Quelltext änneren]Ethan ass bei 25 °C an 1013 hPa am gasfërmegen Zoustand an en huet kee Geroch a keng Faarf. En ass méi schwéier wéiLoft,sengDichtläit bei 1,36 g/l. Ethan léist sech schlecht amWaasser,dofir awer ass en amBenzolgutt léislech. Wéi deMethan,ass och den Ethan schwéier ze verflëssegen, wéinst sengem nidderege Kachpunkt.
Cheemesch Eegenschaften
[änneren|Quelltext änneren]Ethan ass liicht brennbar a kann, mat Sauerstoff gemëscht, explodéieren. E brennt mat enger schwacher Flam. Bei der Verbrennung vum Ethan entsteet, wéi bei allAlkan,WaasseraKuelendioxid[1].
Ethan bilt matChlora mat Brom duerchSubstitutiounnei Produkter. Déi wichtegst sinn déi chloréiert Substitutiounsprodukter wéi de Monochlorethan, den Dichlorethan, den Trichlorethan, den Tetrachlorethan, de Pentachlorethan a den Hexachlorethan.
Produktioun vum Ethan
[änneren|Quelltext änneren]Am Laboratoire:
Ethan kann een duerchElektrolysvun enger konzentréierterNatriumacetat-Léisung hierstellen. Dobäi entsteet un derKathodWaasserstoff an un derAnodEthan aKuelendioxid.
Eng aner Méiglechkeet ass d'Wurtz-Reaktioun.MatMonochloromethanaNatriumléisst sech Ethan gutt hierstellen[1].
Eng drëtt Method besteet doran,NatriumpropanoatmatNatriumhydroxidze hëtzen.
An der Industrie: AusÄerdgaskann een Ethan industriell hierstellen. Aner Methode sinn d'Pëtrolhydréierung an d'Kuelenhydréierung.
Uwendung
[änneren|Quelltext änneren]An der cheemescher Industrie gëtt Ethan bei derEthenproduktiounbenotzt. Eng Method dofir ass deCracking.Bei 500 °C bis 1000 °C gëtt den Ethan an Ethen an aWaasserstoffëmgewandelt.
Literatur
[änneren|Quelltext änneren]- Éditions A. De Boeck, Bruxelles, 1979, Chimie organique, A. Dessart - J. Jodogne - J. Paul
Um Spaweck
[änneren|Quelltext änneren]| Commons: Ethane– Biller, Videoen oder Audiodateien |
- http://www.seilnacht.com/Chemie/ch_ethan.htm
- http://webbook.nist.gov/cgi/cbook.cgi?Name=ethane&Units=SI[28.02.2012]



