Amonija jons
| Amonija jons | |
|---|---|
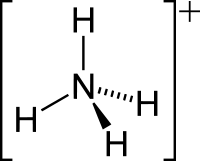 Amonija jona struktūrformula   Amonija jona modeļi | |
| Citi nosaukumi | amonijs |
| CAS numurs | 14798-03-9 |
| Ķīmiskā formula | NH4+ |
| Molmasa | 18,04 g/mol |
Amonija jonsjeb vienkāršiamonijsir pozitīvi lādēts vairākatomujonsar formulu NH4+.Ja amonija joniem pievienojas anjoni (negatīvi lādēti joni), veidojasamonija sāļi,kas pieder pie tā dēvētajiem "onija" sāļiem.
Amonija jonam irtetraedriskaforma, kur centrā irslāpekļaatoms, kam apkārt izvietojušiesūdeņražaatomi. Jona izmērs ir 1,43Å.[1]

Amonija joni viegli veidojas,amonjakamreaģējot arskābēm:
- NH3+ HCl →NH4Cl
Ūdens šķīdumos amonija sāļi disociē:
- NH4Cl ⇄ NH4++ Cl−
Ūdeņraža atomi amonija jonā var tikt aizvietoti ar citiem atomiem, piemēram,fluoraatomiem (tetrafluoramonija katjons [NF4]+). Tie var aizvietoties arī ar organiskām grupām. Ja visi ūdeņraža atomi amonija jonā tiek aizvietoti armetilgrupām,rodas tetrametilamonija jons. Atšķirībā noamonija hidroksīda,kas pastāv (nosacīti) tikai ūdens šķīdumos,tetrametilamonija hidroksīdsir samērā stabila viela.
Atsauces
[labot šo sadaļu|labot pirmkodu]| Vikikrātuvēpar šo tēmu ir pieejami multivides faili. Skatīt:amonija jons |
- ↑Nails Ahmetovs.Neorganiskā ķīmija.Rīga: Zvaigzne, 1978, 371. lpp.
| Šis arķīmijusaistītais raksts irnepilnīgs.Jūs varatdot savu ieguldījumuVikipēdijā,papildinot to. |
