Ovalbumin
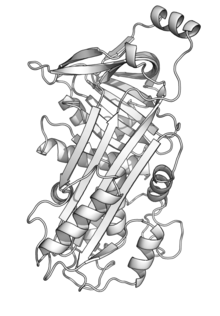
Ovalbumin(singkatanOVA[1]) ialahproteinutama yang ditemui dalamtelur putih,kira-kira 55% dari jumlah protein.[2]Ovalbumin memaparkan urutan dan tiga-dimensi keluarga besarhomologikeserpin,tapi tidak seperti kebanyakan serpin ia bukan perencatserina protease.[3]Fungsi ovalbumin adalah tidak diketahui, walaupun ia dianggap sebagaipenyimpanan protein.[4]
Penyelidikan
[sunting|sunting sumber]Ovalbumin adalah protein penting di beberapa kawasan yang berbeza penyelidikan, termasuk:
- kajian umum struktur dan sifat protein (kerana ia boleh didapati dalam kuantiti yang besar).
- kajian struktur dan fungsi serpin (hakikat bahawa ovalbumin tidak menghalang protease bermakna dengan membandingkan struktur yang melarang serpin, ciri-ciri struktur yang diperlukan untuk menghalang boleh ditentukan).
- proteomik(telur ayam ovalbumin adalah yang biasa digunakan sebagai penanda molekul berat untuk menentu ukur gel Elektroforesis).
- imunologi(biasa digunakan untuk merangsangtindakbalas alahanpada ujian subjek, contohnya model alergen untuksaluran udara hiper-responsif,AHR).
(Untuk kajianin vivodanin vitroberdasarkan ovalbumin, ia adalah penting bahawa kandungan endotoksin adalah kurang dari 1 EU/mg.)[perlu rujukan]
Struktur
[sunting|sunting sumber]Protein ovalbumin ayam terdiri 385asid amino,relatif jisim molekulnya adalah 45kDa,[5]dan ia menggunakan struktur sepertiserpin.[6]Ovalbumin juga mempunyai beberapa modifikasi, termasuk pengasetilan terminal N (G1), fosforilasi (S68, S344), dan pengglikosilan (N292). Ia dikeluarkan dari sel, ditargetkan oleh dalamanurutan isyarat(sisa-sisa 21-47), berbanding terminal N urutan isyarat biasa ditemui bersembunyi di protein lain. Urutan isyarat ovalbumin tidak berpecah, tapi masih sebagai sebahagian daripada protein matang.[7]
Perubahan atas pemanasan
[sunting|sunting sumber]Apabila dipanaskan, ovalbumin mengalamiperubahan konformasidari larutannya, struktur serpin kepada struktur semua lembaran β tidak larut dengan kawasanhidrofobiaterdedah. Ini menyebabkan protein terkumpul dan menyebabkan pemejalan dikaitkan dengan telur putih masak.[8]
Ciri-ciri perubatan
[sunting|sunting sumber]Dalam kes di mana disyaki keracunan oleh akibat berat (seperti besi), ovalbumin boleh diberikan.[9]Ovalbumin kelat untuk logam berat dan memerangkap logam ion di dalam kumpulan ikatan sulfhidril protein.Pengkelatanmenghalang penyerapan logam ke saluran pencernaan dan mencegah keracunan.
Lihat juga
[sunting|sunting sumber]Rujukan
[sunting|sunting sumber]- ^Sano Kunio; Kanna Haneda; Gen Tamura; Kunio Shirato (1999)."Ovalbumin (OVA) and Mycobacterium tuberculosis Bacilli Cooperatively Polarize Anti-OVA T-helper (Th) Cells toward a Th1-Dominant Phenotype and Ameliorate Murine Tracheal Eosinophilia".Am. J. Respir. Cell Mol. Biol.20(6): 1260–1267.doi:10.1165/ajrcmb.20.6.3546.Dicapai pada28 December2011.
- ^Takehiko Yamamoto, Mujo Kim,Hen eggs
- ^Hu H.Y., Du H.N. (2000). "Alpha to Beta Structural Transformation of Ovalbumin: Heat and pH Effects".Journal of Protein Chemistry.19(3): 177–183.doi:10.1023/A:1007099502179.PMID10981809.
- ^Gettins, PGW (2002). "Serpin structure, mechanism, and function".Chemical Reviews.102(12): 4751–4804.doi:10.1021/cr010170+.
- ^Nisbet, AD; Saundry, RH; Moir, AJG; Fothergill, LA; Fothergill, JE (1981). "The complete amino-acid sequence of hen ovalbumin".European Journal of Biochemistry.115(2): 335.doi:10.1111/j.1432-1033.1981.tb05243.x.
- ^Stein, Penelope E.; Leslie, Andrew G. W.; Finch, John T.; Carrell, Robin W. (1991-10-05)."Crystal structure of uncleaved ovalbumin at 1·95 Å resolution".Journal of Molecular Biology.221(3): 941–959.doi:10.1016/0022-2836(91)80185-W.
- ^Robinson, A; Meredith, C; Austen, BM (1986). "Isolation and properties of the signal region from ovalbumin".FEBS Letters.203(2): 243–246.doi:10.1016/0014-5793(86)80751-7.
- ^Hu, H. Y.; Du, H. N. (2000-04-01)."α-to-β Structural Transformation of Ovalbumin: Heat and pH Effects".Journal of Protein Chemistry(dalam bahasa Inggeris).19(3): 177–183.doi:10.1023/A:1007099502179.ISSN0277-8033.PMID10981809.
- ^Dominiczak M, Baynes J,Medical Biochemistry,2d edition (2004), p59.
Pautan luar
[sunting|sunting sumber]- OvalbumindalamTajuk Subjek Perubatan(MeSH) di Perpustakaan Perubatan Negara AS
