Elektron
Hetelektron(Oudgrieks:ἤλεκτρον,betekenis:barnsteendat doorwrijvingelektrisch geladenwerd) is een negatief geladenelementair deeltje,dat gebonden kan zijn, bijvoorbeeld in eenatoom,of zich vrij in de ruimte kan bevinden. De ontdekking van het elektron in 1897 wordt toegeschreven aanJoseph John Thomson.
| Elektron | ||
|---|---|---|
| ||
| Samenstelling | Elementair deeltje | |
| Generatie | Eerste | |
| Interactiekrachten | zwakke,elektromagnetische kracht,gravitatiekracht | |
| Symbool | e− | |
| Ontdekt | Joseph John Thomson(1897) | |
| Massa | 9,109 383 56(11) × 10−31kg = 0,510 998 950MeV/c² | |
| Vervalt naar | stabiel | |
| Elektrische lading | −1e(= −1,6022 × 10−19C) | |
| Spin | 1/2 | |
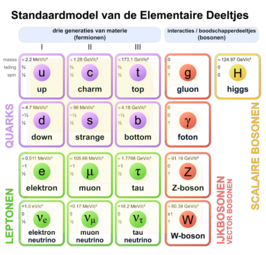
Het elektron behoort tot de klasse derleptonenen daarmee tot de eerstegeneratie materie.Deze deeltjes zijn stabiel. Als een elektron zich in eenelektrisch veldbevindt ondervindt het, net als eenion,daarvan invloed. Als het zich in eenmagnetisch veldvoortbeweegt, ondervindt het delorentzkracht.Dehypothese van De Broglie,dat alle materie het karakter van eengolfheeft waarvan degolflengteafhangt van demassaen de snelheid van het deeltje, geldt ook voor het elektron.
Structuur van het atoom
bewerkenAtomenbestaan volgens hetatoommodel van Rutherforduit een positief geladenatoomkern,waar evenveel negatief geladen elektronen omheen draaien als er positief geladenprotonenzijn in de kern.Rutherfordpubliceerde zijn model in 1911. De protonen enneutronenin de kern van het atoom bevatten vrijwel de gehele massa van het atoom. Ze zijn ruim 1800 maal zo zwaar als een elektron, of specifieker: de protonmassa is 1836,15 maal de elektronmassa en de neutronmassa is 1838,68 maal de elektronmassa.[1]Bohrpaste in 1913 het atoommodel van Rutherford aan door kwantiseringen in te invoeren, die op de theorie van Planck over de kwantisering van straling zijn gebaseerd. Dat gaf hetatoommodel van Bohr.Het verschil is dat de elektronen volgens het atoommodel van Bohr inschillenliggen en daarbinnen op verschillende energieniveaus.
Kenmerken van het elektron
bewerkenHet elektron is eenelementair deeltjemetspin1/2, dus eenfermion,zoals het proton, het neutron en hetpositron.Hetantideeltjevan het elektron heet positron. Voor zover men weet heeft het elektron geen verdere inwendige structuur. Volgens desnaartheorieis het elektron, evenals andere elementaire deeltjes, een bepaald trillingspatroon in een eendimensionale snaar. Over deze theorie is echter nog veel discussie.
Het elektron heeft een negatieve lading gelijk aan hetelementaire ladingskwantume (1,6022 × 10−19coulomb), voor het eerst gemeten doorRobert Millikanmet zijnoliedruppelexperiment.
Volgens hetstandaardmodel van de deeltjesfysicakunnen elektrische ladingen alleen voorkomen in veelvouden van 1 e.
Derustmassavan het elektron bedraagt 9,10938356(11) × 10−31kg[2],wat 1/1836e is van de massa van een proton en overeenkomt met een rustenergie van 511 keV. Het elektron heeft overigens net als eenfotonook golfeigenschappen en is onderhevig aan dedualiteit van golven en deeltjesvolgens dehypothese van De Broglie.Deze golfeigenschap van elektronen wordt toegepast binnen deelektronenmicroscoop.
Deelektronenconfiguratiebepaalt in hoge mate het chemisch gedrag van het atoom.
Elektronen in een atoom
bewerkenDe elektronen kunnen in een atoom alleen welbepaalde energieënhebben (discreteenergieniveaus) die door eenkwantumgetalzijn gegeven.
Voor waterstof (metatoomnummer1) en helium (atoomnummer 2) komtovereen met de grondtoestand enmetaangeslagen toestanden.De elektronen zijn verdeeld over enkeleschillen. Bij de elementen met atoomnummers 3 tot en met 10 (lithium tot en met neon) bevinden zich twee elektronen in de binnenste schil (in het kwantummechanische model van het atoom, de-schil in het Bohr-model) en één tot en met acht elektronen in de daaropvolgende schil (,de-schil) die voor deze elementen de buitenste elektronenschil is. De grondtoestanden komen voor deze elementen overeen met hoofdkwantumgetal,de aangeslagen toestanden met.
Binnen moleculen of vaste stoffen kunnen de energieniveaus zeer dicht tegen elkaar liggen en ze vormen dan gezamenlijk eenenergieband.Het hoogste bezette energieniveau behorende bij een vaste stof heet devalentieband,het laagste niet bezette energieniveau de geleidingsband en de ruimte tussen de geleidingsband en de valentieband is een verboden zone, deband gap.Bijhalfgeleidersis de grootte van de verboden zone van dezelfde orde als de thermische energie. Hierdoor is het voor elektronen soms mogelijk om over te springen van de valentieband naar de geleidingsband, waardoor deze materialen in zuivere vorm een zeer kleine geleiding vertonen.
Spectraallijnen
bewerkenOmdat een elektron in het atoom alleen bepaalde discrete energieniveaus kan hebben, zal bij overgang tussen deze energieniveaus emissie of absorptie van fotonen plaatsvinden, waarbij de energie recht evenredig is met de frequentie. De evenredigheidsconstante energie/frequentie heet deconstante van Planck.Er wordt van dit effect bijvoorbeeld gebruik gemaakt door aan de hand van despectraallijnenin het atoomspectrum van een ster te bepalen welkeelementener in die ster voorkomen.
Elektrische geleiding
bewerkenIngeleiderszorgen de zich vrij bewegende elektronen voor deelektrische geleiding.Wanneer de elektronen in de geleider, bijvoorbeeld een koperen draad, gemiddeld gezien een bepaalde richting opgaan, spreekt men van elektrische stroom in die geleider.
Geleider enisolatorzijn elkaars tegenovergestelde. Een isolator is een stof waarin geen elektrische stroom kan lopen, er zijn in een isolator geen vrije elektronen. De bewegingen van de elektronen zijn beperkt in hun atoom. Er zijn evenveel elektronen als energieniveaus. De elektronen kunnen alleen maar van plaats verwisselen, maar daarbij verandert er niets aan de energieniveaus. In een elektrisch veld verschuiven de positief geladen atoomkern en de banen van de negatief geladen elektronen zich ten opzichte van elkaar, dat effect heetpolarisatie.
Statische elektriciteitontstaat wanneer een voorwerp meer of minder elektronen bevat dan nodig zijn om de positieve lading van de protonen in de kern op te heffen.
Techniek
bewerkenDe eersteelektronenbuizen,de eersteelektronischeschakelingen werden aan het einde van de19een het begin van de20e eeuwgebouwd.
Elektronen spelen een belangrijke rol in de verschillende mogelijkekernreacties.Zij komen bijbètavervalen bijelektronenvangstals bestanddeel in de reactie voor.
- voetnoten
- ↑(en)David Griffiths.(1987). GEEN TITEL OPGEGEVEN Introduction to Elementary Particles. – Harper and Row Publishers
- ↑CODATA Value: electron mass.National Institute of Standards and Technology.Gearchiveerdop7 augustus 2019.Geraadpleegd op23 maart 2019.
- websites
- C Beenakker voor deUniversiteit Leiden.De ontdekking van het elektron,december 1998.