Eiwitten
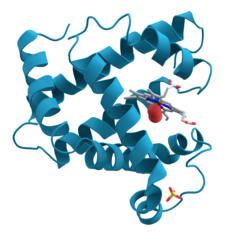
Eiwittenofproteïnenvormen een grote klasse vanbiologische moleculen,die bestaan uitpolymere ketensvanaminozuren.De aminozuren in deze ketens zijn verbonden doorpeptidebindingen.Polypeptidenbestaan uit een lange keten van aminozuren die met elkaar verbonden zijn. Pas wanneer polypeptiden nog eensruimtelijk opgevouwenworden door interacties tussen de atomen van de aminozuren spreekt men van een proteïne.Synthese(aanmaak) van eiwit-polymeren uitmonomereaminozuren vindt binnen iederecelvan alle soortenorganismenplaats.
Eiwitten hebben verschillende functies. Ze vormen de celstructuren van deribosomenen hetcytoskelet,ze komen voor alsenzymen,die alle soortenchemische reactiesin de cellenmogelijk maken,als transporteiwitten in de vorm vanhemoglobinein het bloed enmembraaneiwittenin de celmembranen, en alsafweerstoffen.Voorheterotrofeorganismen zijn eiwitten in hunvoedselessentieel om te overleven. Heterotrofenbrekende uit voedsel verkregen eiwitten af tot aminozuren, waaruit ze vervolgens lichaamseigen eiwitten aanmaken.Autotrofe(zelfvoedende) organismen als planten en algen maken hun eigen aminozuren (en daaruit vervolgens eiwitten) aan. Eiwitten zitten in hogere concentraties onder andere inpeulvruchten,vlees,gevogelte,eieren,vis,zuivelproductenennoten.
Functies van eiwitten
[bewerken|brontekst bewerken]Eiwitten hebben een grote diversiteit aan functies, met name op cellulair niveau. Een aantal belangrijke functies zijn:
- Chemische omzettingen – veel eiwittenkatalyserenbiochemischereacties.Zulke eiwitten wordenenzymengenoemd. Enzymen zijn verantwoordelijk voor destofwisseling,waarbijvoedingsstoffenworden omgezet in bouwstoffen enenergie.
- Structuur – een groot aantal eiwitten zorgt voor het in stand houden van dynamische structuren. Een belangrijk voorbeeld is hetcytoskelet.Het cytoskelet geeft cellenstructuuren vorm. Het cytoskelet is ookdynamisch,het kan ervoor zorgen dat de cel van vorm verandert, maakt deceldelingmogelijk en draagt ertoe bij dat sommige cellen zich kunnen verplaatsen.
- Celtransport – verschillende eiwitten zijn betrokken bij het transport van stoffen in, uit en binnen decel.Transport binnen de cel vindt onder andere plaats via het cytoskelet.Membraaneiwitten,zogehetenionkanalenenionenpompen,bijvoorbeeld denatrium-kaliumpomp,zorgen voor het transport vanionenin en uit de cel.
- Communicatie – sommige eiwitten zijnhormonenen zorgen, via het bloed, voor de communicatie tussen cellen op afstand.Receptorenzorgen voor de communicatie tussen cellen en hunomgeving.Signaaleiwittenzorgen voor de communicatie binnen cellen.
- Regulatie – cellen bevatten veel regelsystemen. Eiwitten spelen hier een belangrijke rol in, bijvoorbeeld door de structuur van andere eiwitten te veranderen, bijvoorbeeld doorfosforylering.
Veel eiwitten hebben geen functie op zichzelf, maar maken deel uit vaneiwitcomplexen.
Eiwitten chemisch bekeken
[bewerken|brontekst bewerken]
Eiwitten zijn, samen met depolysacharidenen denucleinezurenDNAenRNA,de belangrijkstebiopolymerenin destofwisselingvan organismen.
Natuurlijke eiwitten bestaan uitin serie geschakeldeaminozuren. Er zijn 20 soorten zogehetenfundamentele aminozurenwaaruit alle op aarde bekendenatuurlijkeeiwitten worden gevormd. Niet alleen de per soort eiwit gebruikte aminozuren, maar ook hun onderlinge opeenvolging ofsequentiebepaalt het karakter van het te vormen eiwit. De sequentiecodes voor deze 20 aminozuren liggen, voor iedere soort te vormen eiwit, vast op een specifiekgenin hetDNA.
In de cellen vaneukaryotenbevindt het DNA zich in decelkern,de aminozuren, die chemisch aaneengeregen moeten worden tot een eiwit, bevinden zich in het cytoplasma. Bij de aanmaak van een eiwit wordt de sequentiecode vanuit het DNA (het gen), in de celkern eerst overgeschreven naar RNA. Het RNA met de kopie, inmiddelsmRNAgeheten, verplaatst zich vervolgens vanuit de celkern, viaactief transport,door dekernporiënnaar deribosomenin hetcytoplasma.De ribosomen gebruiken de door het mRNA overgebrachtesequentie-code als een mal (matrix) om, met de in het cytoplasma aanwezige aminozuren, (meestal meerdere exemplaren van) het te vormen eiwit aan te maken.
Typische eiwitten zijn enige tientallen tot vele honderden aminozuren lang. De aminozuren zijn onderling verbonden dooramidebindingen,in eiwittenpeptidebindingengeheten. Kleine eiwitten worden ook wel polypeptidengenoemd; de grens tussen een eiwit en een polypeptide is arbitrair. Door de vele mogelijke sequenties van de twintig fundamentele aminozuren is de variatie in soorten eiwitten schier eindeloos. Dit verklaart mede de grote variatie in de levende natuur.
Structuur
[bewerken|brontekst bewerken]Eiwittenvouwenzich in een specifieke driedimensionale vorm. Deze vorm wordt bepaald door de onderlinge aantrekking en afstoting van de verschillende aminozuren, en door de biochemische omgeving (bijvoorbeeld depH) waarin het eiwit zich bevindt. De vorm van een eiwit is bepalend voor de interacties die een eiwit aan kan gaan met andere moleculen. Hierbij is het van belang dat het eiwit zich goed opvouwt. Wanneer dit niet gebeurt verliest het eiwit zijn functie, en kan het soms zelfs schadelijke effecten veroorzaken, zoals bij deziekte van Creutzfeldt-Jakob.
De vorm waarin een proteïne zich normaal vouwt noemt men zijnnatieve conformatie.De biochemie onderscheidt de volgende aspecten van de structuur van een eiwitmolecuul:
- Primaire structuur:de volgorde van de aminozuren. De keten van aminozuren wordt bij elkaar gehouden doorcovalente bindingentussen de opeenvolgende aminozuren, depeptidebinding.Er zijn twintig verschillende, natuurlijk voorkomende aminozuren, en een eiwit kan gemakkelijk uit enkele duizenden aminozuren bestaan.

- Secundaire structuur:de lokale vouwing in driedimensionale structuurelementen, zoals deα-helixen deβ-sheet.Deze structuurelementen worden vooral gestabiliseerd door middel vanwaterstofbruggenbinnen de ruggengraat van de proteïne.
- Tertiaire structuur:de vouwing van het eiwit als geheel. Stabilisatie treedt op door aantrekkingskrachten tussen verschillende delen van de eiwitketen, zoalshydrofobeinteracties, ion-interacties enzwavelbruggen.
- Quaternaire structuur:de vorm die voortkomt uit de associatie van meerdere eiwitketens, ook heteiwitcomplexgenoemd. Een voorbeeld hiervan ishemoglobine,dat uit meerdere eiwitketens bestaat, en dat bovendien in het midden eenheembevat.
Wanneer men refereert aan de uiteinden van een eiwitketen, spreekt men respectievelijk van de stikstof- of N-terminus, voor het begin van de eiwitketen, en van de koolstof- of C-terminus voor het einde van de keten, genoemd naar defunctionele groepdie zich ieder aan een uiteinde bevindt.
Denaturatie
[bewerken|brontekst bewerken]Elk enzym heeft voor elke parameter een bepaalde optimale waarde. Bij ditoptimumvertoont het enzym de grootste activiteit, terwijl als de omstandigheden iets veranderen de activiteit (licht) daalt. Wanneer de omstandigheden waarin het enzym zich bevindt, te ver van het optimum afwijken, kan de enzymstructuur abrupt veranderen: het enzym ondergaatdenaturatie,waardoor het zijn functie -biologische activiteit- verliest. Suboptimale omstandigheden die denaturatie veroorzaken zijn:
- afwijkendepH:met het veranderen van de zuurgraad verandert deionisatievan de aminozuren. Doordat andereladingenenladingsverdelingenontstaan kan de structuur abrupt veranderen.
- afwijkendetemperatuur:bij te hoge temperatuur worden dedisulfidebruggenverbroken.
Regulatie van activiteit
[bewerken|brontekst bewerken]Dikwijls kunnen andere moleculen binden op specifieke plaatsen op het eiwit. Deze bindingsplaatsen hebben een bepaalde specifiekeaffiniteitvoor dergelijke moleculen ofliganden.Zonder deze liganden zijn dergelijke eiwitten biologisch niet actief. Bijgevolg hangt de activiteit van het eiwit af van deconcentratievan het ligand in hetcytosol.
Omdat eiwitten betrokken zijn bij vrijwel elk proces in een cel, zijn de mechanismen die deze processen controleren dezelfde als die de activiteit van de betrokken eiwitten regelen. Het regelen van de eiwitactiviteit kan plaatsvinden door het regelen van zowel de eiwitstructuur als de eiwitconcentratie.
Concentratie
[bewerken|brontekst bewerken]Als een grote biochemische activiteit vereist is, wordt het DNA veelvuldig overgeschreven op RNA, waarbij elke RNA-streng verschillende keren gebruikt kan worden voor het maken van meerdere exemplaren van hetzelfde eiwit. Wanneer verschillende nauw verwante enzymen tegelijk in grote hoeveelheden nodig zijn, worden deze vaak na elkaar tegelijk overgeschreven op RNA, zodanig dat de verschillende benodigde enzymen tegelijk beschikbaar komen.
Eiwitstructuur
[bewerken|brontekst bewerken]De volgende processen kunnen de activiteit van het eiwit veranderen door het wijzigen van de structuur:
- Allosterische modulatie:wanneer de binding van een ligand de binding van andere liganden beïnvloedt. Zo kan bijvoorbeeld het ligand dat nodig is voor de goede werking van het enzym niet meer binden.
- Covalente modulatie:wanneer eencovalentewijziging de binding van een ligand of de eiwitstructuur beïnvloedt.
Splitsing
[bewerken|brontekst bewerken]Het splitsen van eiwitten vindt plaats middelshydrolyse,eenontledingsreactieonder opname van een watermolecuul,gekatalyseerddoor de enzymenendopeptidaseenexopeptidase.Endopeptidasen knippen eiwitten ergens in het midden door, terwijl exopeptidasen steeds een aminozuur vrijmaken aan het uiteinde van een polypeptideketen. Hydrolyse specifiek van eiwitten wordtproteolysegenoemd.
Het tegenovergestelde van hydrolyse ispolycondensatie,waarbij bij iedere'aankoppeling'van een aminozuur aan de eiwitketen, een watermolecuul wordt afgesplitst.
Proteïnen en voeding
[bewerken|brontekst bewerken]Voor alleheterotrofen,waaronder alleherbivore,carnivoreenomnivorediersoorten, vormen proteïnen een belangrijk deel van hetdieet.In de dierlijkespijsverteringworden eiwittenafgebrokentot aminozuren, die vervolgens gebruikt worden als bouwstenen voor deaanmaakvan lichaamseigen eiwitten, en als brandstof voor decelademhaling.
Ook hetmenselijk lichaamgebruikt alle aminozuren die uit voedsel gehaald kunnen worden voor de aanmaak van lichaamseigen eiwitten en als energiebron. Bij een tekort aan bepaalde aminozuren, worden deze door het lichaam zelf in delever,uit voorhanden zijnde aminozuren, viatransamineringgesynthetiseerd. Dit geldt echter niet voorthreonine,valine,tryptofaan,isoleucine,leucine,lysine,fenylalanineenmethionine.Dit zijnessentiële aminozuren,aminozuren die uit voedsel gehaald moeten worden. Hoewel alle voedingsmiddelen deze aminozuren bevatten, bevatten ze elk andere hoeveelheden. Daarom kan het gedurende langere tijd eten van één enkel voedingsmiddel, rijk aan één bepaalde proteïne, leiden tot een tekort aan bepaalde essentiële aminozuren.
Eentekortaan ingenomen eiwitten leidt tot symptomen als vermoeidheid,haaruitval,verlies vanpigmenten(normaal zwart haar kleurt rood), verlies vanspiermassa,lagelichaamstemperatuuren verstoring van dehormoonspiegel.Ernstige proteïnedeficiëntie, enkel voorkomend bij uitgehongerde mensen, is dodelijk. Eenplantaardig dieetlevert voor een mens genoeg essentiële en niet-essentiële aminozuren, zolang de voeding gevarieerd is en de calorie-inname hoog genoeg is om aan de energiebehoefte te voldoen.
Een teveel aan opgenomen proteïnen wordt in het lichaam als energiebron gebruikt. Eiwitten worden danafgebrokenwaarbijureumwordt gevormd. Een echte overdaad aan proteïnen zorgt, net als proteïnedeficiëntie, voor problemen: overreactie van hetimmuunsysteem,overbelasting van de nieren met mogelijknierfalentot gevolg, een ontregelde lever dietoxischeresiduen produceert, en verlies vanbeenmassadoor een verhoogdezuurgraad van het bloed.Verder is een te hoge eiwitinname gelinkt aanobesitas.
Een manier om de 'nutritionele kwaliteit' van een proteïne uit te drukken is debiologische waarde.Een correcter criterium is de PDCAAS (Protein Digestibilty Corrected Amino Acid Score). Dit geeft de mate aan waarin een voedingseiwit werkelijk in de behoefte aan essentiële aminozuren kan voorzien, rekeninghoudend met deverteerbaarheidvan het eiwit.
Proteïnen kunnen aanleiding geven totallergische reactiesen allergieën. Dit komt doordat de structuur van elke proteïne (licht) verschillend is, zodat sommige proteïnen een allergische reactie kunnen uitlokken, terwijl andere volledig veilig zijn. Zo zijn sommige mensen allergisch voorcaseïne(een melkproteïne), gluten (eiwitten in graangewassen), bepaalde proteïnen die gevonden worden inpindanotenofweekdieren.Allergieën voor meerdere proteïnen bij dezelfde persoon zijn zeer zeldzaam.
De eiwitbehoefte verschilt tussen iemand die wel sport en iemand die niet sport. Volwassenen die niet sporten hebben 0,8 gram per kilogram lichaamsgewicht nodig. Sporters die twee keer of vaker aan cardio doen komen op 1,4 gram per kilogram lichaamsgewicht en krachtsporters komen op 1,8–2,0 gram per kilogram lichaamsgewicht uit.[1]
Geschiedenis
[bewerken|brontekst bewerken]De eerste keer dat de termproteïne,wat 'van eerste orde' betekent, werd gebruikt, was in een brief vanJöns Jacob BerzeliusaanGerardus Johannes Mulderop 10 juli 1838:
Le nom protéine que je vous propose pour l'oxyde organique de la fibrine et de l'albumine, je voulais le dériver de πρώτειος, parce qu'il paraît être la substance primitive ou principale de la nutrition animale.
Vrij vertaald betekent dit:
De naam 'proteïne' die ik voorstel voor hetorganischoxidevanfibrineenalbumine,leid ik af van hetGriekse woordπρώτειος, omdat het de primitieve substantie of het hoofdbestanddeel van dierlijke voeding lijkt te zijn.
Onderzoek naar eiwitten en hun eigenschappen begon omstreeks 1800 toen wetenschappers de eerste sporen ontdekten van een op dat moment onbekende klasse organische verbindingen. Sindsdien is de kennis er enorm op vooruitgegaan en is het besef gegroeid dat deze verbindingen onmisbaar zijn voor nagenoeg alle levensprocessen.
Myoglobine was het eerste eiwit waarvan de structuur doorröntgendiffractiewerd opgehelderd doorMax PerutzenSir John Cowdery Kendrewin 1958. Voor deze prestatie kregen ze deNobelprijs voor de Scheikunde.
Wetenschappelijk onderzoek naar eiwitten
[bewerken|brontekst bewerken]Röntgendiffractiewordt gebruikt om dedriedimensionale structuurvan eiwitten op te helderen. Deze techniek kan enkel worden toegepast op gekristalliseerde eiwitten. Sommige eiwitten vormen moeilijk of geenkristallen.Bovendien komt de structuur (vaste vorm) van de eiwitten in deze kristallen per definitie niet volledig overeen met de biologisch actieve vorm (waterige oplossing). Toch levert röntgendiffractie zeer nuttige structurele informatie. Voor het toepassen van deze techniek zijn grote hoeveelhedenzuivere proteïnenodig.
Door de vooruitgang in andere experimentele technieken gaat het huidige onderzoek naar eiwitten veel sneller. Tegenwoordig worden ook de volgende experimentele technieken gebruikt:
- Metmassaspectrometriekan de primaire structuur van eiwitten worden bepaald.
- Ramanspectroscopieeninfraroodspectroscopie:verschuivingen in de frequenties van de banden van de peptidebindingen geven informatie over de aanwezigheid van de verschillende structurele elementen zoalsα-helixenβ-plaat.Met behulp van 2D-IR- of Ramancorrelatiespectroscopie kan men zelfs nauwkeurig de opeenvolgende stappen vandenaturatiesvolgen.
- NMR-spectroscopie:een algemene techniek voor onderzoek naar de structuur vanorganische verbindingen,die ook de bepaling van eiwitstructuren mogelijk maakt
Door gebruik te maken van een combinatie van deze technieken kan men de structuur of hoeveelheid van specifieke eiwitten achterhalen.
Externe links voor eiwitspecifieke vrije software
[bewerken|brontekst bewerken]Voor eiwitten is heel wat specifiekefreewareofvrije softwarebeschikbaar. Deze is vooral gericht op het bestuderen van de molecuulstructuur (met de interacties en aanwezigheid van de verschillendeeiwitdomeinen). Verder zet men eiwitspecifieke software in voor het berekenen en voorspellen van de eiwitstructuur uitgaande van desequentievan het eiwit:
- bestuderen van de eiwitstructuur
- structuurberekening met behulp van krachtvelden enmoleculaire dynamica:
- Gromacs
- Tinker
- via distributed computing projecten:
- Folding@home,een initiatief van deStanford-universiteitom de manier waarop eiwitten vouwen te ontrafelen. Door ongebruikte rekentijd op pc's van vrijwilligers te benutten kan men zo bepaalde ziekten bestuderen of naar nieuwe medicijnen zoeken.
- Rosetta@home
- meer algemene software: voor beide doelen
Zie ook
[bewerken|brontekst bewerken]Externe links
[bewerken|brontekst bewerken]- RCSB Protein Data Bank(wereldwijde databank voor de verwerking en verspreiding van 3D structuurgegevens van biomoleculen)
- ↑Campbell, Bill,Kreider, Richard B, Ziegenfuss, Tim, La Bounty, Paul, Roberts, Mike(26 september 2007).International Society of Sports Nutrition position stand: protein and exercise.Journal of the International Society of Sports Nutrition4: 8.ISSN:1550-2783.PMID:17908291.PMC:2117006.DOI:10.1186/1550-2783-4-8.
