Immunoglobuline
Immunoglobulinen,ookantistoffenofantilichamengenoemd, behoren tot deglobulinefractievan hetbloeden vormen een belangrijk onderdeel van hetimmuunsysteem.
Immunoglobulinen (afgekort Ig) zijn Y-vormigeeiwitmoleculendie door hetafweersysteemvan de mens en anderegewerveldedieren worden geproduceerd als reactie op binnengedrongenantigenen.Antigenen zijn lichaamsvreemde stoffen; doorgaans zijn dit (één of meer) moleculen die zich bevinden aan de buitenkant van eenpathogeen:een schadelijk virus of bacterie. De twee poten van de "Y" van het antilichaam bevatten eenparatoop,dat middels eencovalente bindingpast op eenepitoop,een deel van het antigeen-molecuul. Door de binding wordt depathogeengeneutraliseerd, of "gemarkeerd" voor opruiming elders in het afweersysteem. Sommige antilichamen komen als losse moleculen voor in het bloed en in anderlichaamsvocht.Andere antilichamen zitten vast aanwitte bloedcellenen fungeren als een 'zintuig' van de witte bloedcel, bijvoorbeeld eenB-cel. Wanneer antigenen zich binden aan de antilichamen op de buitenkant van een B-cel, wordt de B-cel gestimuleerd om zich tedifferentiërenin ofwelB-plasmacellen,ofwelB-geheugencellen.Plasmacellenproduceren vervolgens grote hoeveelheden antilichamen, die via hetbloeden delymfenaar de verschillendeweefselsworden getransporteerd, waar ze tegen antigenen actief kunnen zijn.Geheugencellenblijven jaren in het lichaam aanwezig, zij vormen de afweer (hetadaptieveimmuunsysteem) tegen bijvoorbeeld een nieuwe infectie door een specifieke pathogeen. Door dit geheugenmechanisme kan het lichaam zich vlot tegen een herhaalde infectie weren, zonder dat alle soorten antilichamen continu geproduceerd moeten worden. Zie ookvaccin.
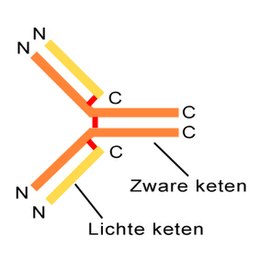
Algemene bouw van immunoglobulinen
[bewerken|brontekst bewerken]Een molecuul van een antistof bestaat uit twee identieke zware, en twee identieke lichteaminozuur-ketens,die onderling samengehouden worden doorcovalente(zwavelbruggen) en niet-covalente bindingen (waterstofbruggen,ionaire bindingen,vanderwaalskrachtenenhydrofobepakking). Bij elk van deze ketens is er een onveranderlijk (constant) deel, en een veranderlijk (variabel) deel. Het constante deel staat in voor de stabiliteit en de interactie met lichaamseigenreceptorenop (immuun)cellen. Het variabele deel (CDR 1+2+3) bindt hetantigeen.
Door middel vanenzymenkan hetmolecuul(een antistof) in drie delen worden gesplitst: twee Fab fragmenten (dit zijn deantigen-bindende delen) en een Fc-deel. De Fab fragmenten bestaan uit de lichte, en een deel van de zware keten. Het Fc-deel bestaat uit een deel van beide zware ketens.
Basis voor variatie
[bewerken|brontekst bewerken]Degenendie coderen voor immunoglobulinen worden onderverdeeld in V-, D- en J-segmenten. Van elk van deze segmenten is een aantal verschillende exemplaren aanwezig in hetgenoom.Zo zijn er in hetmenselijk lichaamvoor wat betreft de zware keten al ruim 50 V-segmenten, 25 D-segmenten en 6 J-segmenten bekend. Van elke soort wordt per B-cel (en dus per immunoglobuline) één gen uitgekozen door enzymen (RAG-1 en RAG-2) om een zware keten mee te vormen. Samen met de gecombineerde genen voor de lichte keten (uit verschillende V- en J-segmenten) vormt dit de basis voor de grote variatie aan immunoglobulinen. Dit wordtrecombinatiegenoemd en zorgt voor ongeveer 2,5 105mogelijkheden voor het vormen van een immunoglobulinemolecuul. Verdere variatie wordt verkregen door onder andereinsertieendeletievannucleotiden.Daardoor ontstaan er uiteindelijk zo'n 1011mogelijkheden voor een uniek immunoglobuline. Immunoglobulinen maken zichzelf bovendien na interactie met hun antigeen nog beter passend.
Een bepaalde B-cel maakt dus maar één soort immunoglobuline, die steeds hetzelfde opgebouwd is. Omdat er twee chromosomen zijn, wordt er daarvan per B-cel eentje uitgezet, om te voorkomen dat één B-cel twee verschillende soorten immunoglobulinen maakt. Dit wordtallelische exclusiegenoemd.
Typen immunoglobuline
[bewerken|brontekst bewerken]
Er bestaan in hetmenselijke lichaamvijf verschillende vormen immunoglobuline: IgA, IgD, IgE, IgG en IgM. Bijvoorbeeld IgA is de afkorting van immunoglobuline A. Ze worden allemaal doorB-lymfocytengemaakt, maar onder verschillende omstandigheden. Een jongeB-celproduceert in principe IgM en IgD. De B-cel gaat nadat die door eenT-helpercelis geactiveerd een proces datclass switchingwordt genoemd en produceert IgA, IgG of IgE. Bij het class switching verandert het constante gedeelte van de keten van de immunoglobuline, en niet het variabele gedeelte waaraan het antigeen bindt. Class switching zorgt er dus niet voor dat de B-cel ineens antistof tegen een anderantigeengaat produceren. Bij class switching vindtdeletievan genetisch materiaal plaats, dit is dus onomkeerbaar.
IgA zit vooral in delichaamssecreten. De aminozuurresiduen zijn onderverdeeld in vier domeinen. Een kenmerk dat IgA hetzelfde als IgM heeft is dat het een additioneelpeptidevan 18 residuen heeft. Hiermee kan een extra ketencovalent worden gebonden,zodat eendimeerontstaat. IgA bevindt zich vooral in hetmaag-darmstelsel,speekselen melk.
Minder dan 1% van het totale immunoglobuline inserumis IgD. Heteiwitis gevoeliger voorproteolysedan IgG1, IgG2, IgA en IgM en heeft de neiging tot spontane proteolyse.
IgE zit op deslijmvliezenen zit meestal met zijn Fc-gedeelte vast op de Fc-receptor vanbasofiele granulocyten,diehistaminevrijlaten wanneer ze zich aan een antigeen binden. Dit is ook de oorzaak vanallergischereacties, die worden gekenmerkt door bijvoorbeeld rode ogen en een rode neus vanwege devasodilatieve,vaatverwijdende werking van histamines. Er zijngeneesmiddelentegen een dergelijke allergische reactie, zogenaamdeantihistaminica.Die gaan de overdreven werking van histamine tegen.

IgG is een immunoglobuline, dus een antistof, dat wordt aangemaakt bij grotere hoeveelheden of bij een herhaald contact met het antigeen. Het is het belangrijkste van de vijf immunoglobinen in hetmenselijke lichaam.Het IgG-molecuul zorgt binnen hetimmuunsysteemvan de mens vooral voor de afweer tegenvirussenenbacteriënen is de antistof, die het meeste in debloedbaanvoorkomt. IgG is eenmonomeeren ieder IgG bestaat uit vierpeptiden.

Menselijk IgM is normaal gesproken eenpentameervan de vier-keten-basiseenheid. De μ-ketens van IgM verschillen van de γ-ketens in de aminozuursequentie en hebben een extra constant domein in plaats van het IgG-scharnier. De subeenheden van het pentameer zijn verbonden door disulfidebruggen. Het complete molecuul bestaat uit een dicht opeen gepakt centraal gebied met uitstekende armen. Dat kan met eenelektronenmicroscoopworden gezien. IgM is bij een infectie vaak de eerst geproduceerde antistof, die later door IgG wordt 'afgelost' en is met zijn bindingsplaatsen een uitstekende immunoglobuline voor het wegvangen van antigenen.
Werking
[bewerken|brontekst bewerken]Immunoglobulinen binden aan eenepitoopvan het antigeen. Dit kan verschillende effecten hebben:
- Neutralisatie.Dit betekent dat de antistoffen aan bepaalde gedeeltes van het antigeen binden, waardoor het antigeen geen interacties metcellenof moleculen meer aan kan gaan. Het antigeen verliest hierdoor zijn werking. Dit gebeurt onder meer bij gifstoffen (bijvoorbeeld geproduceerd door bacteriën, zogenaamdeexotoxines) ofvirussen.
- Opsonisatie.Door omringen van antigeen met antistoffen wordtfagocytose(het als het ware opeten van cellen) vergemakkelijkt. Dit komt doordat fagocyterende cellenreceptorenbezitten voor het constante deel van immunoglobuline (Fc-receptoren).
- Hetcomplementsysteemwordt geactiveerd door het Fc-gedeelte. Dit leidt tot verbetering van de opsonisatie, omdat fagocyterende cellen ook complementreceptoren bezitten. Hierdoor wordt fagocytose nog verder vergemakkelijkt. Ook kan het binden van complement leiden tot directe vernietiging van het antigeen.
- Celgemedieerde cytotoxiciteit die afhankelijk is van antistoffen. Dit is ook wel bekend onder de Engelse afkortingADCC,die staat voorantibody dependent cell-mediated cytotoxicity.Dit is vernietiging van het antigeen doorNK-cellen.Deze cellen bezitten ook Fc-receptoren en door binding aan antistoffen geven zij bepaalde stoffen af die het antigeen doden.
Immunoglobulinen komen zowel vrij in het cytoplasma voor als gebonden aan hun B-cel als B-celreceptor (waarmee ze tegelijkertijd voorantigeen-presenterende celspelen).
Immunoglobulinen bepalen in een geneeskundig laboratorium
[bewerken|brontekst bewerken]In een geneeskundig laboratorium kan de hoeveelheid van de verschillende immunoglobulinen bepaald worden.
IgG is de grootste fractie van de immunoglobulinen in het menselijk lichaam. Er zijn 4 sub klassen, IgG1,IgG2, IgG3 en IgG4. Deze subklassen hebben verschillende biologische eigenschappen. Zo verschillen de subklassen in hun capaciteit het complement systeem te activeren. IgG1 en IgG3 kunnen dit wel goed, IgG2 en IgG4 in mindere mate of niet, respectievelijk. Verhoogde gehaltes van subklassen kunnen voorkomen bij chronische ontstekingen, auto-immuunziekten en infecties, of bij multiple myeloom of B-cellymfoom. Een voorbeeld hiervan isIgG4-gerelateerde ziekte.
Een verhoging van IgM komt voor bij infecties, leveraandoeningen,ziekte van Waldenström,of bij een IgMplasmacytoom.Matige verhogingen kunnen ook voorkomen bij lymfoproliferatieve ziekten,auto-immuunziektenencarcinomen.
De belangrijkste functie van IgA is het beschermen van het lichaam tegen binnendringen van allerlei ziekteverwekkers door de aanwezigheid intraanvocht,colostrum,galen van de klieren van lucht- en urinewegen enmaag-darmstelsel.In het geneeskundig laboratorium kan de hoeveelheid IgA bepaald worden om een eventuele IgA deficiëntie aan te tonen. Dit is van interesse omdat deze mensen een grotere kans hebben op reumatische en infectieuze aandoeningen, of een vergrote kans op anti-IgA dat problemen kan geven bijtransfusievan bloedproducten. In bloed kunnen verhogingen van IgA gevonden worden na infecties, verhogingen van IgA bij mensen met acute of chronische leukemieën, solidetumorenenauto-immuunziektenof bij eenmonoklonale gammopathie,non-hodgkinlymfomen en bepaalde vormen van amyloïdose.
Toepassing in de biologie
[bewerken|brontekst bewerken]De hoge specificiteit waarmee antilichamen hun antigeen herkennen wordt in de biologie gebruikt om het antigeen, in de meeste gevallen een eiwit, zichtbaar te maken. De antilichamen zijn ofwel direct gekoppeld aan een enzym (chemiluminescentie), met fluorescerende kleurstoffen of met radioactieve isotopen of worden gedetecteerd met een secundair antilichaam dat zich aan het eerste (primair antilichaam) bindt en dienovereenkomstig geëtiketteerd wordt.
Zie ook
[bewerken|brontekst bewerken]Externe links
[bewerken|brontekst bewerken]- Mike's Immunoglobuline structuur en functie pagina van de Universiteit van Cambridge.
- Immunoglobuline Database
- Antibody,Encylopaedia Britannica
