Methaan
| Methaan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformulevan methaan
| ||||
| Algemeen | ||||
| Molecuulformule | CH4 | |||
| IUPAC-naam | methaan | |||
| Andere namen | moerasgas,grauwvuurgas, mijngas | |||
| Molmassa | 16,04g/mol | |||
| SMILES | C
| |||
| CAS-nummer | 74-82-8 | |||
| Wikidata | Q37129 | |||
| Beschrijving | Brandbaar gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220-H280[1] | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210-P410+P403[1] | |||
| Omgang | Verwijderd houden van hitte, vonken en open vuur | |||
| Opslag | Brandveilig en koel bewaren. Verluchting langs de vloer en het plafond. | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | (gas, 25 °C, 1 atm) 0,656 × 10−3g/cm³ (gas, 0 °C, 1 atm) 0,716 × 10−3g/cm³ | |||
| Smeltpunt | −182,48 °C | |||
| Kookpunt | −164 °C | |||
| Vlampunt | −188 °C | |||
| Zelfontbrandings- temperatuur | 537 °C | |||
| Oplosbaarheidinwater | (bij 20°C) 0,0227 g/L | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−74,81kJ/mol | |||
| S |
83,7J/mol·K | |||
| Tenzij anders vermeld zijnstandaardomstandighedengebruikt (298,15Kof 25°C,1bar). | ||||
| ||||
Methaan(CH4) is de eenvoudigstekoolwaterstofen behoort tot de groep deralkanen.Het bezit eentetraëdrische moleculaire geometrie.Het centralesp3-gehybridiseerdekoolstofatoomis volledig verzadigd. Methaan is bijkamertemperatuuren bij atmosferische druk eengas.Het werd in1778ontdekt doorAlessandro Volta.
Methaan, ook bekend onder de naammoerasgas,is het voornaamste bestanddeel vanaardgas.Aardgas wordt in de natuur aangetroffen in samenhang metaardolieen anderefossiele brandstoffen,en heeft een vergelijkbare geologische oorsprong, ontstaan uit vergane resten organisch materiaal.
Ontstaan en bronnen
[bewerken|brontekst bewerken]Methaan kan ontstaan uit verschillende natuurlijke processen (aardkorst,zeebodem, draslanden en venen) of uit antropogene bronnen (fossiele industrie, bio-industrie, vuilnisbelten). Hoewel vrij nauwkeurig gemeten kan worden hoeveel methaan jaarlijks wordt uitgestoten, is het veel moeilijker precies na te gaan welke de bronnen zijn.[2]
Geologische bronnen
[bewerken|brontekst bewerken]De twee belangrijkste routes voor geologische methaanproductie zijn:
- organisch (thermisch gegenereerd, of thermogeen). Thermogeen methaan komt voor door het uiteenvallen van organische materie bij hoge temperaturen en hoge druk in diepe sedimentaire lagen. Het meeste methaan in sedimentatiebekkens is thermogeen; daarom is thermogeen methaan de belangrijkste bron van aardgas.
- anorganisch ofabiotisch,dit betekent dat methaan wordt gevormd uit anorganische verbindingen, zonder biologische activiteit, hetzij door magmatische processen of via water-rots-reacties die optreden bij lage temperaturen en drukken, zoals bij de vorming vanserpentiniet.
Biologische bronnen
[bewerken|brontekst bewerken]Methaan ontstaat onder andere bij afbraak van organische stoffen door bacteriën onderanaerobe(zuurstofloze) omstandigheden. Anaerobe omstandigheden komen veelal in moerasbodems voor. Ook in zuurstofarme grond wordt onder andere door de afbraak van dode plantenwortels methaan gevormd. Ook bij bosbranden kan methaan ontstaan door verhitting vanorganische stof.
Veeteelt
[bewerken|brontekst bewerken]Herkauwers,maar vooralrunderen,leveren met hunboerenenwindeneen grote bijdrage aan de wereldwijde uitstoot van methaangassen. Juist een hoog aandeel ruwvoer zorgt voor deze methaanproductie in de pens door middel van fermentatie door debacteriën.De veeteelt zou zelfs bijna 40% van de menselijke uitstoot van methaan vertegenwoordigen.[3]Door aanpassingen van de samenstelling van krachtvoer zijn er mogelijkheden om dit te verminderen, alsmede met uitgekiend graslandbeheer.[4][5]Ook het gericht kruisen van rassen zou helpen.[3]In de omgeving vanrundveehouderijenis dan ook een verhoogde concentratie van methaan aanwezig. Er zijn gevallen bekend waarinstallenin brand vlogen door een verhoogde concentratie methaan.[6]
Zeebodem
[bewerken|brontekst bewerken]Het grootste deel van de diepere zeebodem isanoxischomdat zuurstof wordt onttrokken dooraërobemicro-organismenin de bovenste paar centimeters van het sediment. In de zeebodem produceren methanogenen methaan dat door andere organismen wordt gebruikt, of in gashydraten wordt opgesloten. Deze andere organismen die methaan voor energie gebruiken, staan bekend als methanotrofen (methaaneters), en zijn de belangrijkste reden waarom weinig methaan uit de zeebodem het zeeoppervlak bereikt.
Industriële bronnen
[bewerken|brontekst bewerken]Methaanproductie
[bewerken|brontekst bewerken]Methaan wordt geproduceerd doorhydrogeneringvan kooldioxide in eenSabatierreactie.Methaan is ook eenbijproductvan de hydrogenering van koolmonoxide in hetFischer-Tropsch proces.Voor praktische toepassingen wordt methaangas verkocht in stalen cilinders.
Uitanaerobevergisting van biologische afvalstoffen wordt methaan gewonnen voor productie van groene stroom of warmtekrachtkoppeling.
Fossiele energiebedrijven
[bewerken|brontekst bewerken]Bij de productie, verwerking en transport van fossiele energiebronnen (olie, aardgas, steenkool) komt methaangas vrij. En bij defrackingvanschaliegasenschalieoliezou de uitstoot nog groter zijn.[7]Het aandeel van de fossiele industrie in de methaanuitstoot zou volgens onderzoek uit 2020 in het verleden sterk onderschat zijn geweest.[8]Met behulp vaninfraroodcamera's vonden Amerikaanse milieu-onderzoekers methaanlekken in de meeste van de 150 bezochte olie- en gasinstallaties in zeven Europese landen. Het rapport, uit 2021, concludeert dat het niet om toevallige lekken gaat, wellicht te wijten aan het ontbreken van controles en meldplicht.[9][10]
Chemie
[bewerken|brontekst bewerken]Moleculaire structuur
[bewerken|brontekst bewerken]Een methaanmolecule bestaat uit een centraal koolstofatoom met daarom vier waterstofatomen, gerangschikt volgens een symmetrischetetraëder.Dezesymmetriebepaalt in belangrijke mate de eigenschappen van methaan. Zo leidt de symmetrie ertoe dat methaan striktapolairis, waardoor het gasvormig en weinig reactief is onder standaard omstandigheden.
Deze symmetrie kan theoretisch worden voorspeld metMO-theorie,en is ook experimenteel aangetoond met onder andereröntgendiffractieenUV/VIS-spectroscopie.Deze ontdekkingen hebben geleid tot de vorming van hethybridisatiemodel.Het koolstofatoom in methaan is sp3-gehybridiseerd. Dientengevolge zijn dekoolstof-waterstofbindingenin methaan zeer sterk en verloopt bijvoorbeeld de deprotonering bijzonder moeizaam (depKavan methaan ligt namelijk boven de 50).
Reacties
[bewerken|brontekst bewerken]Methaan is net als alle alkanen weinig reactief. Eigenlijk reageert het alleen met sterke oxidatoren zoals zuurstof(verbranding) of de halogenen. Een andere belangrijke reactie isstoomreforming.
Verbrandingsreacties
[bewerken|brontekst bewerken]De verbranding is als volgt:[11](vormingsenthalpieΔfHo= −891 kJ · mol−1)
Als er niet genoeg zuurstof is, zal de verbranding onvolledig zijn en ontstaat ookkoolstofmonoxide(CO):
Of ookcokes:
Chloormethaanproductie
[bewerken|brontekst bewerken]Chloormethanen worden gemaakt doorradicalaire reactiemet chloorgas:[12]
Stoomreforming
[bewerken|brontekst bewerken]Methaan bevat de hoogste H/C verhouding van alle koolwaterstoffen, en daarom wordt methaan vaak gebruikt om waterstof te produceren. Hierbij worden methaan (doorgaans aardgas) en stoom onder verhoogde druk en temperatuur over een metalen katalysator geleid:
Deze reactie wordt vooral toegepast in hetHaber-Boschproces,waarbij grote hoeveelheden waterstof nodig zijn voor de productie vanammoniak,en bij vergassing van biomassa omsynthesegaste produceren.
Synthese
[bewerken|brontekst bewerken]Methaan kan worden gevormd uit gemakkelijk afbreekbare organische stoffen, zoalsazijnzuur:
Natriumacetaatkan ook samen metnatriumhydroxidemethaan vormen:
Methaan kan ook uitkoolstofdioxideenwaterstofgasgevormd worden volgens de langzaam verlopendesabatierreactie:
Methaanhydraat
[bewerken|brontekst bewerken]Sedimenten op de oceaanbodems en inpermafrostgebiedenaan de onderzijde van de bevroren bodemlaag bevatten heel grote methaanvoorraden: methaan dat onder hoge druk eenclatraatof insluitverbinding vormt met water (ijs),methaanhydraatof methaanijs, waarin methaan alsgashydraatinvaste vormaanwezig is. Soms ontsnapt een deel van dit methaan in gasvorm naar de oppervlakte. De methaanclatraten zouden, vanwege de grote omvang van de voorraden, potentieel een belangrijke energiebron kunnen vormen, maar de winning ervan op de bodem van de oceaan is met de huidige stand der techniek nog zeer moeilijk.
Klimaat
[bewerken|brontekst bewerken]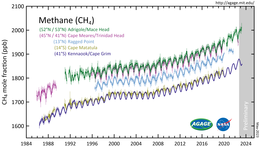
Atmosferisch methaanis schadelijk voor het klimaat, omdat het bijdraagt aan het versterktebroeikaseffect.Het is als broeikasgas ongeveer 25 keer zo sterk alskoolstofdioxide.[13]Sinds 1750 is de hoeveelheid methaan in de lucht meer dan verdubbeld, waarbij sedert 2010 waarden van meer dan 1.800 ppb (1,85ppm) worden gemeten. De stijging is voornamelijk te wijten aan de landbouw en het gebruik van fossiele brandstoffen.[14]Methaan heeft 0,5°C bijgedragen aan de netto opwarming van de aarde van 1,1°C sinds het pre-industriële tijdperk.[15]De levensduur van methaan in de atmosfeer is om en nabij de tien jaar. Hierdoor heeft vermindering van uitstoot al relatief snel effect.
Er wordt gevreesd dat stijging van de temperatuur op aarde zal leiden tot het ontdooien van depermafrost.Dit zou kunnen leiden tot het vrijkomen van grote hoeveelheden methaan en een verdere toename van het broeikaseffect. Amerikaanse onderzoekers vanNOAAstelden tot hun verrassing een sterke toename vast van doorbeversgemaakte poelen in de periode 2000-2020 in detoendravanAlaska.Kennelijk was de beverpopulatie door deopwarming van de Aardein noordelijke richting opgeschoven. De ophoping van water in de vele poelen heeft er echter sterk bijgedragen tot de dooi van de permafrost.[16]Russische onderzoekers waren in 2021 bijzonder verontrust door zeer omvangrijke “gasbellen” van methaan inSiberië,ongetwijfeld het gevolg van de dooi van de permafrost:[17]
- in deOost-Siberische Zeevond eenonderzoeksschipeen zestal “kraters” met een atmosferische methaanconcentratie van 16-32 ppm, dat is tot 15 maal het planetaire gemiddelde van 1,85 ppm
- in hetBaikalmeerwalmde methaan uit meer dan 20 onderwaterputten
- op de schiereilandenJamalenGydawerden reusachtige permafrostkraters ontdekt, naast een groot aantal kleinere methaanputten
- deBatagaika-kraterwordt nog wijder, met instorting van permafrost aan de randen.
Tijdens de klimaatconferentie in Glasgow in 2021 hebben meer dan 100 landen niet-bindende afspraken gemaakt, in de zogenoemde Global Methane Pledge, om de mondiale uitstoot van methaan terug te dringen met 30 procent in 2030 ten opzichte van 2020.[18]
Volgens de Global Methane Tracker, een rapport dat hetInternationaal Energieagentschapuitbrengt over de industriële uitstoot van methaan, was de energiesector in 2022 verantwoordelijk voor 135 miljoen ton aan methaanemissies in de atmosfeer, slechts een beetje minder dan de recorduitstoot van 2019[19].De energiesector neemt ongeveer 40 % van de methaanuitstoot voor zijn rekening en bekleedt daarmee, wat de menselijke activiteit op aarde betreft, de tweede plaats na de landbouw. De ontginning en verwerking van steenkool, olie en aardgas zorgt telkens voor ongeveer 40 miljoen ton uitstoot terwijl bijna 5 miljoen ton afkomstig is van lekkende infrastructuur. Ongeveer 10 miljoen ton uitstoot wordt veroorzaakt door de onvolledige verbranding van biomassa, gebruikt voor verwarming en koken.
Toch zijn er volgens het Energieagentschap enorme, onbenutte, kansen om deze uitstoot te reduceren. Zowat 70 % van de industriële emissies zou kunnen worden teruggedrongen met bestaande technologieën. In de olie- en gassector kunnen de emissies met 70 % omlaag als vertrouwde en welbekende maatregelen zoals lekopsporing en reparaties worden toegepast en lekkende apparatuur wordt geüpgraded. Ook in de steenkoolsector kan meer dan de helft van de uitstoot worden opgevangen, eventueel ook door affakkeling ofoxidatiewanneer recuperatie van energie niet mogelijk is. Ook door te zorgen voor wereldwijde toegang tot propere kookapparaten en moderne verwarming kunnen emissies ten gevolge van onvolledige verbranding worden aangepakt, hetgeen gunstige effecten zou hebben op de menselijke gezondheid.
Zie ook
[bewerken|brontekst bewerken]Externe links
[bewerken|brontekst bewerken] methaan-International Chemical Safety Card
methaan-International Chemical Safety Card- (en)Gegevens vanmethaanin de GESTIS-stoffendatabank van het IFA
- (en)MSDS vanmethaan
- Methaangas op Mars(Kennislink-artikel)
- (en)Bonding in methane
- ↑abcProductinformatie in de Online catalogus van Sigma Aldrich,geraadpleegd op 5 juli 2011.
- ↑(en)Methane emitted by humans vastly underestimated, researchers find.phys.org (19 februari 2020).Gearchiveerdop16 juni 2020.Geraadpleegd op21 februari 2020.
- ↑abSlim kruisen verlaagt methaanuitstoot koeien.MO*(10 juli 2019).Gearchiveerdop21 februari 2020.Geraadpleegd op21 februari 2020.
- ↑Veevoedermaatregelen ter vermindering van methaanproductie door herkauwers,WUR, dr. W.A.G Veen, 2001. Geraadpleegd 14 april 2019.
- ↑Een antwoord op het milieuleed van de koeienscheet,BNR, Didi Levison, 9 mei 2016, 21:00. Geraadpleegd 17 juni 2018.
- ↑Koeien doen eigen stal ontploffen,deredactie.be,27 januari 2014
- ↑Waar komt al dat methaan ineens vandaan?.de Volkskrant(28 juni 2019).Gearchiveerdop23 mei 2020.Geraadpleegd op21 februari 2020.
- ↑(en)Oil and gas firms 'have had far worse climate impact than thought'.The Guardian(19 februari 2020).Gearchiveerdop28 augustus 2020.Geraadpleegd op21 februari 2020.
- ↑(en)Massive Quantity of Methane Emissions Documented Across Europe at Oil & Gas Facilities(24 juni 2021).Gearchiveerdop11 oktober 2021.
- ↑(en)Infrared images show under-regulated ‘methane crisis’ across Europe(24 juni 2021).Gearchiveerdop14 augustus 2021.
- ↑Standardreaktionsenthalpie für die Verbrennung von Methan und diversen Erdölprodukten vgl. S. 3 ff. in:Herbert Mayr:Vorlesung 9: Erdölverarbeitung,LMU München: Physikalisch-organische Chemie, 2006 (PDF-Datei; ca. 190 kB)
- ↑The reaction between methane and chlorine
- ↑Dit getal wordt ook wel hetaardopwarmingsvermogengenoemd, en wordt berekend over een periode van 100 jaar, zodat rekening gehouden wordt met de verschillende retentietijden van broeikasgassen.
- ↑(en)Climate Change Indicators: Atmospheric Concentrations of Greenhouse Gases.EPA.Gearchiveerdop31 oktober 2021.Geraadpleegd op3 november 2021.
- ↑Grillig gas uit koe, sloot en vuilnisbeltNRC,20 november 2021
- ↑(en)K.D. Tape et al.,Arctic Report Card 2021. Beaver Engineering: Tracking a New Disturbance in the Arctic.NOAA.Gearchiveerdop6 januari 2022.
- ↑(en)Siberia's stark warning to Scotland for Cop26: climate change in the planet's last great wilderness.The Siberian Times(31 oktober 2021).Gearchiveerdop1 november 2021.Geraadpleegd op2 november 2021.
- ↑Ruim honderd landen willen minder Methaan uitstotenNOS,2 november 2021
- ↑Global Methane Tracker 2023.Geraadpleegd op23 februari 2023.










![{\displaystyle {\ce {CH4{}+2H2O->[{\text{katalysator}}]CO2{}+4H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4e289283232fa93071ff45fde8e1f7f179d4432)


