Ribosoom
| Celbiologie |
|---|
| De dierlijke cel |

|
| Componenten van een dierlijke cel: |
| Portaal |
Hetribosoomis een moleculair complex vaneiwittenenribosomaal RNA(rRNA) dat de centrale plaats vormt vaneiwitsynthese.Ribosomen komen in grote aantallen voor in het cytoplasma van alle levendecellen.In ribosomen wordenaminozurenin een keten aan elkaar verbonden in een volgorde die wordt bepaald door hetmessenger-RNA(mRNA), een proces genaamdtranslatie.Ribosomen bestaan uit twee componenten: een klein ribosoomdeel dat het mRNA afleest, en een groot ribosoomdeel waarin deaminozuurketenwordt gevormd. Ribosomen kunnen vrij voorkomen in het cytoplasma of gebonden zijn aan hetendoplasmatisch reticulumof hetkernmembraan.
Cellen besteden veel energie aan de vorming van ribosomen. EenE. coli-bacterie bevat ongeveer 15.000 ribosomen, elk met een molecuulgewicht van ongeveer drie miljoendalton.Ribosomen vertegenwoordigen circa 25% van de totale massa van deze bacteriën. Ook in planten en dieren is ribosomaal RNA het meest voorkomende type RNA dat in de cel voorkomt.[1]
Algemeen
[bewerken|brontekst bewerken]
Genetische informatie die in hetDNAvastligt, wordt tijdens detranscriptieovergeschreven naar een mRNA-molecuul. Dit molecuul bevat informatie voor de synthese vaneiwitten.Tijdens detranslatiewordt de nucleotidevolgorde van het mRNA vertaald naar een aminozuurvolgorde in eenpolypeptideketen.Hieruit zal een eiwit ontstaan. De translatie speelt zich geheel af in het ribosoom.
Ribosomen herkennen het5'-eind van de mRNA-keten.Het kleine ribosoomdeel bindt zich aan dit 5'-eind en leest de mRNA-keten af richting het 3'-eind, totdat er een startcodon wordt herkend. Daaraan wordt een methioninecomplex vastgehecht (het eerste aminozuur) en vervolgens bindt ook het grote ribosoomdeel zich. De translatie kan nu beginnen.Transfer-RNA-moleculen binden aminozuren uit het cytoplasma en vervoeren ze naar het ribosoom. Het meegevoerde aminozuur wordt via eenpeptidebindingverbonden aan een al ingebouwd aminozuur. Vervolgens schuift het ribosoom één codon verder langs de mRNA-streng, en kan een nieuw aminozuur worden ingebouwd.
Ribosomen vanbacteriën,archaeaeneukaryotenverschillen in structuur, maar functioneel zijn de ribosomen vrijwel identiek. Dit is een aanwijzing dat ribosomen ontstaan zijn uit een gemeenschappelijke oorsprong. In eukaryotische cellen bevattenmitochondriëneen eigen type ribosoom. Deze ribosomen hebben functionele kenmerken die erg lijken op de kenmerken van ribosomen in bacteriën, wat de vermoedelijke evolutionaire oorsprong van mitochondriën aanwijst.[2][3]
Dankzijkristallografisch onderzoekis dekristalstructuur,waarin de honderdduizenden atomen van het ribosoom zijn gerangschikt, inmiddels bekend. In 2011 was de volledige atomaire structuur van een 80S-ribosoom vastgesteld. Dit was afkomstig uit de gistSaccharomyces cerevisiae.[4]Daarmee is het ribosoom het grootste niet-viraleeiwitcomplexwaarvan de structuur is bepaald; ribosomen blijken de molecuulcomplexen te zijn met de meeste asymmetriegerelateerdeatomen.
Ontdekking
[bewerken|brontekst bewerken]Ribosomen zijn voor het eerst waargenomen door de Roemeens-Amerikaanse celbioloogGeorge Emil Palade,in 1955. Hij zag ribosomen met behulp van eenelektronenmicroscoopals geclusterde deeltjes of korrels in het cytoplasma.[5]De term 'ribosoom' werd voorgesteld door wetenschapper Richard B. Roberts aan het eind van de jaren vijftig.
Albert Claude, Christian de Duve en George Emil Palade kregen in 1974 gezamenlijk deNobelprijs voor Fysiologie of Geneeskundevoor de ontdekking van het ribosoom.[6]De Nobelprijs voor de Scheikunde 2009 werd uitgereikt aanVenkatraman Ramakrishnan,Thomas SteitzenAda Yonathvoor het gedetailleerd vaststellen van de structuur en werking van het ribosoom.[7]
Structuur
[bewerken|brontekst bewerken]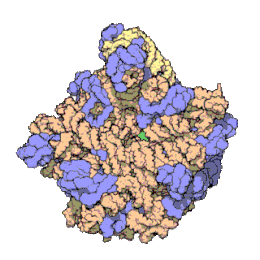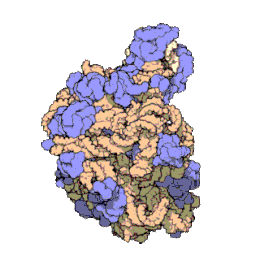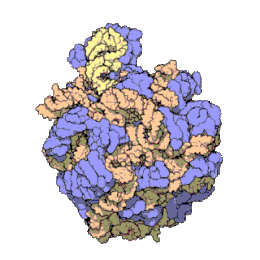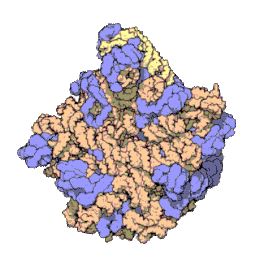
Het ribosoom is een zeer complex moleculair systeem. In vergelijking met andereorganellenin de cel zijn ribosomen zeer kleine structuren. Een ribosoom bestaat grotendeels uit een gespecialiseerd typeRNAgenaamdribosomaal RNA(rRNA) en een groot aantal verschillenderibosomale eiwitten.De ribosomale eiwitten (r-eiwitten) en rRNA's vouwen zich om elkaar heen en vormen dan twee afzonderlijke ribosomale delen: een groot en een kleinribosoomdeel.De twee delen passen in elkaar en werken samen als één om polypeptiden te synthetiseren. Omdat ribosomen uit twee subunits bestaan van ongelijke grootte, zijn ze iets langer in de hoogte dan in breedte.
Prokaryotischeribosomen hebben een diameter van ongeveer 20nm(200Å) en zijn opgebouwd uit 65% rRNA- en 35% ribosomale eiwitten.[9]Eukaryotischeribosomen hebben een diameter tussen 25 en 30 nm (250-300 Å) en bestaan ongeveer voor de helft uit rRNA en voor de andere helft uit ribosomale eiwitten.[10]De eiwitcomponenten hebben geen rol in het katalyseren van de vorming van peptidebindingen, maar zorgen voor stabilisering van de correcte structuur. De eiwitten, die voornamelijk aan de buitenkant voorkomen, ondersteunen ook de vormveranderingen van de rRNA-ketens die optreden tijdens translatie.
De eenheid die wordt gebruikt om het ribosoom en de rRNA-ketens te beschrijven, is deSvedberg-eenheid(S). Het is een eenheid voor desedimentatiesnelheidvan moleculen en wordt bepaald door de grootte, massa en vorm van een molecuul. De sedimentatiesnelheden van de twee aparte ribosoomdelen kunnen opgeteld groter zijn dan die van het gehele ribosoom: prokaryotische 70S-ribosomen zijn bijvoorbeeld gemaakt van 50S- en 30S-ribosoomdelen.
Prokaryoten
[bewerken|brontekst bewerken]Ribosomen worden gevormd wanneer rRNA-genen wordenafgeschrevenen de ontstane rRNA-ketens zich met r-eiwitten in een juiste ruimtelijke structuur organiseren. Prokaryoten hebben 70S-ribosomen, elk bestaande uit een klein (30S) en een groot (50S) ribosoomdeel. Het kleine ribosoomdeel bevat een 16S rRNA-keten (bestaande uit 1540 nucleotiden) en bestaat uit 21 eiwitten. Het grote ribosoomdeel bestaat uit een 5S-RNA-keten (120 nucleotiden), een 23S-RNA-keten (2900 nucleotiden) en 31 eiwitten. Zie onderstaand schema.
prokaryotisch ribosoom (E. coli)[11] ribosoom ribosoomdeel rRNA-ketens r-eiwitten 70S 50S 23S (2904nt) 31 5S (120 nt) 30S 16S (1542 nt) 21
Eukaryoten
[bewerken|brontekst bewerken]In eukaryoten worden de ribosoomdelen gevormd in denucleolus.Viakernporiënworden ze naar het cytoplasma vervoerd. Eukaryotische cellen hebben 80S-ribosomen, wederom bestaande uit een klein (40S) en groot (60S) ribosoomdeel. Het 40S-deel bevat een 18S rRNA-keten (1900 nucleotiden) en 33 eiwitten. Het grote ribosoomdeel bestaat uit een 5S-RNA (120 nucleotiden), 28S-RNA (4700 nucleotiden), 5,8S-RNA (160 nucleotiden) en 46 eiwitten. Zie onderstaand schema.
eukaryotisch vrij ribosoom (R. norvegicus)[11] ribosoom ribosoomdeel rRNA-ketens r-eiwitten 80S 60S 28S (4718 nt) 49 5,8S (160 nt) 5S (120 nt) 40S 18S (1874 nt) 33
De ribosomen uitchloroplastenenmitochondriënbestaan ook uit grote en kleine ribosoomdelen die samen met eiwitten zijn verbonden tot een 70S-complex. Volgens deendosymbiosetheoriezouden deze ribosomen ontstaan zijn uit bacteriën. Mitochondriale ribosomen zijn dan ook zeer vergelijkbaar met die van bacteriën.
Het feit dat bacteriële en eukaryotische ribosomen in enige mate verschillen is medisch van belang. Hetantibioticumchlooramfenicolwerkt, door de verschillen in structuur, wel in op bacteriële, maar niet op eukaryotische ribosomen. Een bacteriële infectie kan worden bestreden doordat de eiwitsynthese van de ziekteverwekkende bacterie wordt geïnhibeerd, terwijl de menselijke cellen onaangetast blijven. Ooktetracyclineenstreptomycineworden gebruikt om op deze manier een bacteriële infectie tegen te gaan. Hoewel mitochondriën ribosomen hebben die lijken op de bacteriële ribosomen, treedt in mitochondriën geen inhibitie op door deze antibiotica omdat ze zijn omgeven door een dubbel membraan waar antibiotica moeilijk door kunnen passeren.[12]
Actieve centrum
[bewerken|brontekst bewerken]Hetactieve centrumvan ribosomen wordt, in tegenstelling tot dat vanenzymen,volledig gevormd door de rRNA-ketens.[13]In het actieve centrum vindt de katalyse van peptidebindingen plaats tussen de aminozuren. Deze plek wordt daarom ook wel hetpeptidyltransferasecentrumgenoemd. Ribosomen werken alskatalysatorenvoor peptidyltransferase (vorming van een peptidebinding tussen aminozuren) en peptidylhydrolyse (het loskoppelen van aminozuurketen en het tRNA). Het peptidyltransferasecentrum is verantwoordelijk voor het produceren vanpolypeptidentijdens deeiwitelongatie.Ribosomen kunnen door hun katalytische capaciteit beschouwd worden als groteribozymen.
Functie
[bewerken|brontekst bewerken]
Ribosomen zijn betrokken bij het synthetiseren van alle eiwitten. Ze hebben de taak om de tRNA-moleculen op de juiste manier te binden aan de codons in het mRNA, zodat een aminozuur op de goede plaats in de keten wordt ingebouwd. Eiwitten regelen destofwisseling,hettransporten decommunicatievan cellen in alle levensvormen. Direct en indirect zijn ze betrokken bij alle levensprocessen.
De structuur van ribosomen weerspiegelt hun functie om mRNA en tRNA-dragende aminozuren bij elkaar te brengen. Wanneer het mRNA wordt afgelezen, passeert elk codon achtereenvolgens de A-plaats, de P-plaats en de E-plaats in het ribosoom. Op de A-plaats (aminoacyl-binding-site) bindt het tRNA zich tijdelijk aan de mRNA-streng doordat het anticodon en het codon waterstofbruggen vormen. Op de P-plaats (peptidyl-binding-site) wordt de aminozuurketen gevormd doordat er een peptidebinding ontstaat tussen het aminozuur in de P-plaats en de A-plaats. Deze plaats is het actieve centrum (het peptidyltransferasecentrum), en is vrijwel volledig opgebouwd uit RNA. Op de E-plaats (exit-site) verlaat tRNA zonder aminozuur het ribosoom.
Eiwitsynthese begint bij eenstartcodonAUG nabij het 5'-eind van het mRNA. Het ribosoom weet waar het zich aan de mRNA-keten moet binden doordat het een specifieke nucleotidevolgorde herkent: deShine-Dalgarnosequentiein prokaryoten en deKozak-sequentiein eukaryoten. Aan het eind van de mRNA-keten zit eenstopcodon,waaraan tRNA zich niet kan hechten. Doordat er geen aminozuur wordt ingebouwd, stopt de eiwitsynthese. De aminozuurketen laat los en het kleine en grote ribosoomdeel gaan uit elkaar.
Er kunnen meerdere ribosomen tegelijkertijd gebonden zijn aan één mRNA-molecuul. Zo kan er in de cel veel van hetzelfde eiwit worden geproduceerd. Met eenelektronenmicroscoopzijn clusters van ribosomen (polyribosomen) in de cel zichtbaar.
Binding aan ER
[bewerken|brontekst bewerken]Ribosomen komen vrij voor in het cytoplasma of gebonden aan hetendoplasmatisch reticulum(ER) ofkernmembraan.De eiwitten die worden gemaakt in vrije ribosomen, functioneren meestal binnen het cytosol, bijvoorbeeld een enzym dat een stap in deglycolysekatalyseert. Ribosomen aan het endoplasmatisch reticulum zijn betrokken bij de synthese vanmembraaneiwitten,eiwitten die verpakt moeten worden (zoalslysozymen) en bij eiwitten die aan het externe milieu van de cel worden afgegeven (exocytose). Cellen die zich specialiseren in eiwitsecretie, zoalsalvleeskliercellendie spijsverteringsenzymen afscheiden, hebben vaak zeer veel gebonden ribosomen. Er is geen verschil in structuur tussen gebonden en vrije ribosomen; of het ribosoom zich al of niet aan het ER bindt, hangt af van welk eiwit het op dat moment synthetiseert.
De ribosoomdelen, afkomstig uit denucleolus,omsluiten een mRNA-keten altijd in het cytosol. Als het om de synthese van een secretie-eiwit gaat, moet het ribosoom zich hechten aan het ER-membraan. Aan het uiteinde van de groeiende peptideketen bij secretie-eiwitten komt een specifieke sequentie voor die door zogenaamdeSRP-eiwittenwordt herkend.[14]Het SRP-eiwit bindt zich in dat geval aan de polypeptideketen (en daarbij ook aan het ribosoom) en de translatie wordt kort onderbroken: tRNA-moleculen komen niet meer naar binnen. Het SRP-gebonden ribosoom kan zich nu op een specifieke plaats aan het ER-membraan hechten, namelijk op een SRP-receptorplaats die naast eentranslocon(kanaaltje voor peptiden) is gelegen.[15]Het ribosoom wordt zo gebonden aan het translocon, waardoorheen het polypeptide gesynthetiseerd kan worden. Het SRP-eiwit laat los en de translatie wordt voortgezet.
Oorsprong
[bewerken|brontekst bewerken]Ribosomen zijn waarschijnlijk verschenen in deRNA-wereldalszelfreplicerendestructuurtjes.[16]Aannemelijk is dat deze vroege ribosomen nog uitsluitend uit rRNA waren opgebouwd. Later, toen interacties met individuele aminozuren waren ontstaan, ontwikkelden ribosomen geleidelijk het vermogen om peptidebindingen te katalyseren.[17][18]Onderzoek wijst uit dat in de eerste rRNA-moleculen van ribosomen ook coderende stukken aanwezig waren. De rRNA-ketens codeerden voor tRNA-moleculen die het ribosoom gebruikte voor zelfreplicatie.[19]
Naarmate aminozuren in de RNA-wereld verschenen, konden ze door hun interacties met RNA de efficiëntie vergroten van de functie van katalytische RNA-moleculen. De drijvende kracht achter de evolutie van het ribosoom, van een primitieve zelfreplicerende structuur naar zijn huidige vorm, kan deselectiedrukzijn geweest om eiwitten in het ribosoom op te nemen, om zo zijn eigen zelfreplicatie te garanderen.[19]
Zie ook
[bewerken|brontekst bewerken]Referenties
- ↑(en)Campbell N. Urry L. Cain M. Wasserman S.Biology, A Global Approach,eleventh edition (2018)ISBN 1-292-17043-3
- ↑(en)Benne R, Sloof P(1987).Evolution of the mitochondrial protein synthetic machinery.BioSystems21(1): 51–68.PMID2446672.DOI:10.1016/0303-2647(87)90006-2.
- ↑Ribosomes.Gearchiveerd op20 maart 2009.Geraadpleegd op28 april 2011.
- ↑(en)Ben-Shem A, Garreau de Loubresse N, Melnikov S, Jenner L, Yusupova G, Yusupov M(2011).The structure of the eukaryotic ribosome at 3.0 Å resolution.Science334(6062): 1524–1529.PMID22096102.DOI:10.1126/science.1212642.
- ↑(en)Palade G.E.(January 1955).A small particulate component of the cytoplasm.J Biophys Biochem Cytol1(1): 59–68.PMID14381428.PMC2223592.DOI:10.1083/jcb.1.1.59.
- ↑(en)The Nobel Prize in Physiology or Medicine 1974.Nobelprize.org.The Nobel Foundation.Gearchiveerdop 26 January 2013. Geraadpleegd op10 december 2012.
- ↑(en)2009 Nobel Prize in Chemistry.The Nobel Foundation.Gearchiveerdop8 april 2012.Geraadpleegd op10 december 2012.
- ↑(en)Ban N. Nissen P. Hansen J. Moore P. Steitz T.(2000).The complete atomic structure of the large ribosomal subunit at 2.4 Å resolution.Science289(5481): 905–20.PMID10937989.DOI:10.1126/science.289.5481.905.
- ↑(en)Kurland C.G.(1960).Molecular characterization of ribonucleic acid from Escherichia coli ribosomes.Journal of Molecular Biology2(2): 83–91.DOI:10.1016/s0022-2836(60)80029-0.
- ↑(en)Wilson, Daniel N.,Doudna Cate, Jamie H.(May 2012).The Structure and Function of the Eukaryotic Ribosome.Cold Spring Harbor Perspectives in Biology4(5).ISSN:1943-0264.PMID22550233.PMC3331703.DOI:10.1101/cshperspect.a011536.
- ↑ab(en)Reginald Garrett, Charles M. Grisham.Biochemistry.(International Student Edition). Cengage Learning Services; 4th edition 2009;ISBN 978-0-495-11464-2;p. 962.
- ↑(en)O'Brien T.W.(1971).The General Occurrence of 55S Ribosomes in Mammalian Liver Mitochondria.J. Biol. Chem.245.
- ↑(en)Nissen P. Hansen J. Ban N. Moore P.B. Steitz T.A.(2000).The structural basis of ribosome activity in peptide bond synthesis.Science289(5481).PMID10937990.DOI:10.1126/science.289.5481.920.
- ↑(en)Walter P, Ibrahimi I, Blobel G(1981).Translocation of proteins across the endoplasmic reticulum. I. Signal recognition protein (SRP) binds to in-vitro-assembled polysomes synthesizing secretory protein.The Journal of Cell Biology91(2 Pt 1): 545–50.PMID7309795.PMC2111968.DOI:10.1083/jcb.91.2.545.
- ↑(en)Gilmore R, Blobel G, Walter P(1982).Protein translocation across the endoplasmic reticulum. I. Detection in the microsomal membrane of a receptor for the signal recognition particle.The Journal of Cell Biology95(2 Pt 1): 463–9.PMID6292235.PMC2112970.DOI:10.1083/jcb.95.2.463.
- ↑(en)Noller H. F.(2012).Evolution of protein synthesis from an RNA world.Cold Spring Harbor Perspectives in Biology4:1–U20.PMID20610545.PMC3312679.DOI:10.1101/cshperspect.a003681.
- ↑(en)Dabbs, E.R.(1986).Mutant studies on the prokaryotic ribosome.Springer-Verlag, N.Y.
- ↑(en)Noller H. F. Hoffarth V. Zimniak L.(5 juni 1992).Unusual resistance of peptidyl transferase to protein extraction procedures.Science256:1416–1419.PMID1604315.DOI:10.1126/science.1604315.
- ↑ab(en)Root-Bernstein M. Root-Bernstein R.(2015).The ribosome as a missing link in the evolution of life.Journal of Theoretical Biology367:130–158.PMID25500179.DOI:10.1016/j.jtbi.2014.11.025.
Literatuur
- (en)Campbell N. Urry L. Cain M. Wasserman S. Minorsky P. Reece J.Biology, A Global Approach,eleventh edition (2018)ISBN 1-292-17043-3p. 393–406.
- (en)Alberts, B. Johnson, AD.et al.(2015).Molecular Biology of The Cell, 6th edition.Garland Science, New York, "Chapter 6: From DNA to Protein".ISBN 1317563751.
