Difosforpentoxide
| Difosforpentoxide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformulevan fosforpentoxide
| ||||
| ||||
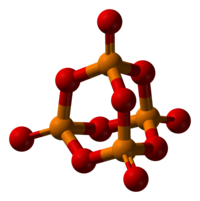
Molecuulmodelvan fosforpentoxide
| ||||
| Algemeen | ||||
| Molecuulformule | P4O10 | |||
| IUPAC-naam | difosforpentoxide | |||
| Andere namen | fosfor(V)oxide, tetrafosfordeca-oxide | |||
| Molmassa | 283,889g/mol | |||
| CAS-nummer | 16752-60-6 | |||
| Wikidata | Q369309 | |||
| Beschrijving | Witte vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280-P305+P351+P338-P310 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Dichtheid | 2,39 g/cm³ | |||
| Smeltpunt | 340 °C | |||
| Sublimatiepunt | 360 °C | |||
| Tenzij anders vermeld zijnstandaardomstandighedengebruikt (298,15Kof 25°C,1bar). | ||||
| ||||
Fosforpentoxideis eenanorganische verbindingmet alsbrutoformuleP4O10.De wittekristallijnevaste stofis hetanhydridevanfosforzuur.Het is een krachtigdroogmiddelen reageertexothermmetwater,onder vorming van fosforzuur.
Synthese
[bewerken|brontekst bewerken]Difosforpentoxide wordt bereid door elementairfosformet voldoendezuurstofte verbranden:
Tijdens het grootste deel van de 20e eeuw werd difosforpentoxide gebruikt als uitgangsmateriaal voor de bereiding van geconcentreerdfosforzuur.In het thermische proces wordt het difosforpentoxide dat tijdens de verbranding van witte fosfor ontstaat opgelost in verdundfosforzuurwaarbij geconcentreerd fosforzuur ontstaat.[1]Verbeteringen in de filtratietechniek leiden er momenteel toe dat het "natte-fosforzuurproces" steeds belangrijker wordt. Het grootste voordeel daarbij is dat niet eerst witte fosfor gemaakt hoeft te worden.[2]De dehydratatie van fosforzuur om difosforpentoxide te maken is niet praktisch: bij verwarming ontleedt fosforzuur voor het water verliest.
Structuur
[bewerken|brontekst bewerken]Van P4O10zijn ten minste vierverschillende kristalvormenbekend. De meest voorkomende, zoals in de afbeelding, bestaat uit moleculen met de formule P4O10.Zwakkevanderwaalskrachtenhouden deze moleculen in een hexagonale kristalstructuur bijeen, al is dit niet de meest compacte manier om deze moleculen in een kristal te plaatsen[3].De structuur van het P4O10lijkt erg op die vanadamantaanmet een Tdsymmetrie.[4]Hierin lijkt het erg op het overeenkomstige anhydride vanfosforigzuur,P4O6.In de laatste ontbreken de uit het molecule stekende zuurstofatomen. P4O10heeft een dichtheid van 2,30 g/cm³. Onder atmosferische druk kookt het bij 423 °C, maar bij snel verwarmen kan het ooksublimeren.
De andere modificaties zijn polymere vormen van P4O10,maar in alle gevallen is elk fosforatoom gebonden aan eentetraëdervan vier zuurstofatomen, waarvan een voorkomt als terminale P=O binding. De O-vorm (dichtheid 3,05 g/cm³, smeltpunt 580 °C) vormt een gelaagde structuur bestaande uit onderling verbonden P6O6ringen. Hiermee lijkt deze stof op bepaalde polysilicaten.Een vorm met een lagere dichtheid, de O'-vorm, bestaande uit een driedimensionaal netwerk is ook bekend (dichtheid 2,72 g/cm³).[5]De laatste polymorf is eenglasof amorfe vorm; het ontstaat bij smelten van elke van de andere vormen.
 |
 |
Toepassingen
[bewerken|brontekst bewerken]P4O10is een krachtigdroogmiddelzoals ook blijkt uit het exotherme karakter van de hydrolyse-reactie (ΔH= −177 kJ/mol):
De toepasbaarheid van de stof als droogmiddel is echter minder dan verwacht zou worden door de vorming van een beschermende, viskeuze laag over de stof die dieper gelegen, nog droge stof, afschermt voor vochtopname. Een granulaire vorm wordt van P4O10wordt indesiccatorenendroogpistolengebruikt.
In lijn met zijn wateronttrekkende eigenschappen wordt P4O10ook in deorganische synthesegebruikt. De bekendste toepassing op dit gebied is de omzetting vanamideninnitrilen:[6]
De hier gegeven formule P4O9(OH)2is een geïdealiseerde formule voor de niet nader gedefinieerde stoffen die ontstaan bij de hydratatie van P4O10.
Het Onodera-reagens, een oplossing van difosforpentoxide inDMSO,wordt toegepast in de oxidatie vanalcoholen.[7]Deze reactie lijkt erg op deSwern-oxidatie.
Het Eatons-reagens (7,7 gew% fosforpentoxide-oplossing inmethaansulfonzuur) wordt gebruikt als alternatief voor polyfosforzuur inchemische syntheseomacyleringsreactieste versnellen.
Het wateronttrekkende effect van P4O10is groot genoeg om een groot aantal minerale zuren om te zetten in hun anhydriden. Bijvoorbeeld:HNO3wordt omgezet inN2O5;H2SO4inSO3;HClO4wordt omgezet inCl2O7.
Andere fosforoxiden
[bewerken|brontekst bewerken]Naast de twee bekendste fosforoxiden,difosfortrioxideen difosforpentoxide, zijn andere oxiden bekend:P4O7,P4O8enP4O9.[8]
Toxicologie en veiligheid
[bewerken|brontekst bewerken]Algemeen
[bewerken|brontekst bewerken]De stof is niet brandbaar, maar reageert heftig met water en stoffen waar water in zit, zoals hout of katoen. Bij deze reacties komt veel warmte vrij, waarbij zelfs brand kan ontstaan. De stof is corrosief ten opzichte van metalen. Difosforpentoxide kan ernstige brandwonden veroorzaken in de ogen en op de huid,slijmvliezen,en deluchtwegen.Dit is zelfs nog het geval bij concentraties ter grootte van 1 mg/cm³.
Brand
[bewerken|brontekst bewerken]Tijdens brandbestrijding dient een volledig beschermend pak gedragen te worden, water mag niet direct in de brandhaard gespoten worden. De brand dient geblust te worden met eenpoederblusser,koolstofdioxide,of alcohol-bestendig schuim.
EHBO
[bewerken|brontekst bewerken]- Inademing: Breng onmiddellijk in frisse lucht, waarschuw een arts.
- Ogen: Spoel overvloedig met water, waarschuw een arts.
- Huid: Spoel overvloedig met water, waarschuw een arts.
Externe links
[bewerken|brontekst bewerken] difosforpentoxide-International Chemical Safety Card
difosforpentoxide-International Chemical Safety Card- (en)Website of the Technische Universität Darmstadt and the CEEP about Phosphorus Recovery
- ↑Threlfall, Richard E., (1951).The story of 100 years of Phosphorus Making: 1851 - 1951.Oldbury: Albright & Wilson Ltd
- ↑Podger, Hugh (2002).Albright & Wilson: The Last 50 Years.Studley: Brewin Books.ISBN 1-85858-223-7
- ↑Cruickshank, D.W.J.Refinements of Structures Containing Bonds between Si, P, S or Cl and O or N: V. P4O10Acta Cryst. 1964, volume 17, pages 677-9.
- ↑D. E. C. CorbridgePhosphorus: An Outline of its Chemistry, Biochemistry, and Technology5th Edition Elsevier: Amsterdam.ISBN 0-444-89307-5.
- ↑D. Stachel, I. Svoboda and H. Fuess(June 1995).Phosphorus Pentoxide at 233 K.Acta Cryst.C51(6): 1049-1050.DOI:10.1107/S0108270194012126.
- ↑Meier, M. S.Phosphorus(V) Oxidein Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑Tidwell, T. T.Dimethyl Sulfoxide–Phosphorus Pentoxidein Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑Luer, B.; Jansen, M.Crystal Structure Refinement of Tetraphosphorus Nonaoxide, P4O9Zeitschrift fur Kristallographie 1991, volume 197, pages 247-8.





