Metaal
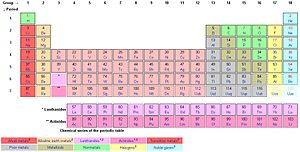

In de scheikunde is eenmetaaleen van de 62scheikundig elementenuit een van de volgendereeksenin hetperiodiek systeemder elementen:
- zesalkalimetalen(groep 1)
- zesaardalkalimetalen(groep 2)
- 38overgangsmetalen(groep 3 t/m 12)
- twaalfhoofdgroepmetalen(gedeeltelijk groep 13 t/m 16)
In hetperiodiek systeembevinden al deze elementen zich links van de semi-metalen, ofmetalloïden.De metalloïden liggen op een diagonale lijn, vanboor(B) totastaat(At).
In demateriaalkundeworden daarnaast ook metaalmengsels, met nameintermetallische verbindingenenlegeringen,als metaal aangeduid. Metalen zijn dan allematerialenmet, in vaste of vloeibare vorm, de volgende vier karakteristiekemateriaaleigenschappen:
- hogeelektrische geleiding,die afneemt met toenemende temperatuur;
- hogewarmtegeleiding;
- ductiliteit(vervormbaarheid);
- metaalglans.
Bekende metaalsoorten zijn:ijzer,aluminium,koper,chroom,nikkel,lood,zink,tin,goud,zilverenplatina.Bekendelegeringen:staal(bijvoorbeeldinox),brons,messing,elektrumensoldeersel.
Eigenschappen van metalen[bewerken|brontekst bewerken]
Chemische eigenschappen[bewerken|brontekst bewerken]
De belangrijkste metaaleigenschap is de lageelektronegativiteit.Door deze lage elektronegativiteitbindende in eenkristalroostergerangschikte metaalatomen hunelektronen niet sterk aan deatoomkern.Hetkristalroostervan metalen bestaat daardoor uit positief geladenionenmet geleidingselektronen,devalentie-elektronen,die er los tussen bewegen. Dit verklaart deelektrische geleidbaarheidvan metalen. Doordat ze gemakkelijk elektronen afstaan zijn metalen sterkereductoren:inredoxreactiesstaan metaalatomen hun vrije elektronen af aanoxidatoren,waarbij eenzoutgevormd wordt.
Alleen edelmetalen als goud en zilver komen door hun lagechemische reactiviteitin zuiveregedegenvorm in de natuur voor. De meeste andere metalen moeten uit hunmineraalgewonnen worden, bijvoorbeeld ijzer uitijzerhoudende mineralenen koper uitkoperhoudende mineralen;het werk van demetallurgie.Metalen uit de reeksen van de alkalimetalen (zoalsnatrium) en aardalkalimetalen (magnesium) zijn zeer reactief. Deze metalen vormen 1+ en 2+ positief geladenionendie de elektronen uit huns-schillenkwijt zijn. Zouten van deze metalen zijn over het algemeen goedoplosbaarin water, vooral de zouten van alkalimetalen. De ionen vancesium-137en-135en vanstrontium-90,die als bijproduct gevormd worden bij hetradioactief vervaltijdens de opwekking vankernenergie,verspreiden zich daarom gemakkelijk in het milieu als ze vrijkomen.
Metalen die niet reageren met zuurstof en water geencorrosievertonen, noemt demetaalkundeedel.Onedelemetalen vertonen corrosie.Zeer onedelemetalen als natrium enkaliumreageren zelfs heftig met water. In de materiaalkunde (metaalkunde) spelen ze dan ook geen rol.
Deovergangsmetalenuit deplatinagroepenkopergroepzijn relatief inert. Deedelmetalenuitperiode-5en6van deze groepen, zoalsgoud,zilverenplatina,zijn chemisch vrijwel vollediginert.Ze reageren net als deedelgassenmet vrijwel geen enkele stof.
Een verschijnsel dat bij metalen op kan treden:metaalhaartjes,dit zijn zeer kleine haarvormige uitgroeiingen,monokristallenvan bepaalde metalen, zoalstin,zinkencadmium.
Fysische en mechanische eigenschappen[bewerken|brontekst bewerken]

Metalen hebben een aantal kenmerkendefysischeenmechanischeeigenschappen:
- meestal een glimmend oppervlak
- een hogetaaiheidenvervormbaarheid
- meestal een hoogsmeltpunt;met uitzondering vankwikengalliumzijn alle metalen invastetoestand bijkamertemperatuur
- ze zijn goede geleiders vanwarmteenelektriciteit
Deze eigenschappen zijn hoofdzakelijk het gevolg van het feit dat deelektronenop de buitensteelektronenschilzeer los gebonden zijn. In een metaalkristal worden dezevalentie-elektronendan ook gedeeld over de atomen in het volledigekristalrooster,zodat sprake is van een gemeenschappelijkeelektronenwolk(valentieband).
IJzer, nikkel, kobalt en enkele metaallegeringen kunnen wordengemagnetiseerd.
Legeringen[bewerken|brontekst bewerken]
Eenlegeringis een mengsel van metalen. Een legering kan ook wel niet-metalen bevatten. Legeringen worden geproduceerd om aan metalen de gewenste eigenschappen, zoalshardheidensmeedbaarheidte verschaffen. In debronstijd(± 2000 - 1000 voor Chr.) wist men reeds hoe men van koper een legering kon maken die gemakkelijker te bewerken was door ertinaan toe te voegen. Deze legering heetbrons.
Productie van metaal[bewerken|brontekst bewerken]
Met uitzondering van edelmetalen worden metalen in de natuur zelden in zuivere vorm gevonden. Zuiver aangetroffen metaal wordt ook welgedegenmetaal genoemd. Metalen worden meestalgedolvenin de vorm vanertsen,die in demetallurgieworden omgezet in de zuivere metaalvorm. Voorbeelden hiervan zijn de winning van gietijzer uit ijzererts door middel vanhoogovensof de elektrochemische omzetting vanbauxietinaluminium.
Ferro- en non-ferrometalen[bewerken|brontekst bewerken]
In de metaalhandel wordt onderscheid gemaakt tussen de ferrometalen en non-ferrometalen. IJzer en alle legeringen op basis van ijzer, waarvanstaalde bekendste is, worden ferrometalen genoemd, de overige metalen, zoals aluminium, goud en koper, zijn de non-ferrometalen.
Ferromagnetisme[bewerken|brontekst bewerken]
Hoewel veel metalen magnetisch gedrag vertonen, worden er maar een paar soorten direct aangetrokken door een magneet. Dit verschijnsel heetferromagnetisme( "ferro" van ijzer). Het bekendste ferromagnetische metaal isijzer,maar ook metalen alskobaltennikkelvertonen deze eigenschap.
Toepassingen[bewerken|brontekst bewerken]

Metalen hebben zeer veel toepassingen. Onderstaande lijst dient enkel om een indruk te geven van de veelzijdigheid van metalen. Zo worden zij toegepast in:
- constructies,machinesenvervoermiddelen(staal,aluminium,zink,magnesium)
- verpakkingsmateriaal zoalsblikvoorconserven,drankenverf(tin,aluminium)
- elektrische verbindingen (koper,goud,zilver)
- kwikbarometersen thermometers (kwik)
- magneten(ijzer,nikkel,neodymium,kobalt)
- pigmenten(lood,kwik,cadmium)
- ballastin dekielvan schepen, of alscontragewicht(lood,wolfraam,uranium)
- projectielenen slagwapens (koper, lood, wolfraam, uranium)
- chemischekatalysatoren(rodium,ruthenium,palladium)
- kunstvoorwerpen (goud, zilver, koper, tin)
- belegging (edelmetalen) en betaalmiddel (goud, zilver,nikkel,koper)
- geneesmiddel(lithium,technetium,platina)
- vergif(arseen,thallium)
Edele en onedele metalen[bewerken|brontekst bewerken]
De metalen die vooraan in groep 1 van hetperiodiek systeemstaan zijn zeer onedel: ze reageren zeer gemakkelijk, worden vlotgeoxideerden komen daardoor ook alleen maar alschemische verbindingin de natuur voor. Natrium en kalium reageren zeer heftig met water onder vorming vanwaterstofgasenwarmte(vaak metbrandtot gevolg), en moeten in hunelementairetoestand bewaard worden onderpetroleumofminerale olie.De metalen uit groep 1 worden dealkalimetalengenoemd.
De metalen uit groep 2 van het periodiek systeem zijn minderreactief:ze reageren veel minder uitgesproken met water, maar komen ook niet in elementaire vorm voor in de natuur. Voorbeelden zijn:magnesium,calcium,bariumenstrontium,waarvan calcium het minst edel uit die reeks is. Deze groep metalen worden aangeduid als deaardalkalimetalen.Ook aluminium is onedel en reageert gemakkelijk met zowel sterke als zwakkezurenenbasen.IJzer is relatief onedel: inzuurstof-enwaterrijkeomgevingen wordt ijzer geoxideerd tot overeenkomstigeijzeroxide.Dit verschijnsel staat bekend alsroest.
Metalen kunnen ook halfedel zijn, ze komen soms in de vrije natuur als element voor, maar kunnen ook nog redelijk makkelijk in ionaire toestand over gaan. Enkele voorbeelden van halfedele metalen zijn:koper,lood,nikkel,cadmium,kobaltenzink.Om deze metalen te doen overgaan in oplossing is een sterke (zure) oxidator (zoalszwavelzuur) nodig.
Zeer edele metalen komen meestal in de natuur alselementvoor, ze zijn relatief zeldzaam en vormen minder snel een zout. Om edele metalen te doen overgaan in een zout is een zeer sterkeoxidatornodig, zoalsnitrosylchlorideinkoningswater.Voorbeelden zijn:zilver,goudenplatina.In deze reeks is zilver het minst en goud het meest edel.
Het edele dan wel onedele karakter van een metaal kan opelektrochemischewijze in verband worden gebracht met diensstandaardelektrodepotentiaal:metalen met een sterk negatieve standaardelektrodepotentiaal, zoals lithium en kalium, worden zeer vlot geoxideerd, terwijl metalen met een positieve standaardelektrodepotentiaal, zoals goud en zilver, veel moeizamer geoxideerd worden.
