Karbon
| Karbon | |||
|---|---|---|---|
 | |||
| Basisdata | |||
| Navn | Karbon | ||
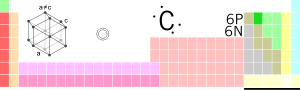
| Symbol | C | ||
| Atomnummer | 6 | ||
| Utseende | svart (grafitt) fargeløs (diamant) | ||
| Plass iperiodesystemet | |||
| Gruppe | 14 | ||
| Periode | 2 | ||
| Blokk | p | ||
| Kjemisk serie | ikke-metaller | ||
| Atomegenskaper | |||
| Atomvekt | 12,0107u | ||
| Empiriskatomradius | 70pm | ||
| Kalkulertatomradius | 67 pm | ||
| Kovalent atomradius | 77 pm | ||
| Elektronkonfigurasjon | [He] 2s22p2 | ||
| Elektronerper energinivå | 2, 4 | ||
| Oksidasjonstilstander | 4,2 | ||
| Krystallstruktur | heksagonal | ||
| Fysiske egenskaper | |||
| Stofftilstand | fast stoff | ||
| Smeltepunkt | 3 500°C | ||
| Kokepunkt | 4 827 °C | ||
| Molart volum | 5,29 · 10-6m³/mol | ||
| Tetthet | 2 267kg/m³(grafitt) 3 513 kg/m³ (diamant) | ||
| Hardhet | 0,5 (grafitt) 10 (diamant) (Mohs skala) | ||
| Fordampningsvarme | 355,8 kJ/mol | ||
| Smeltevarme | 100 kJ/mol (grafitt) 120 kJ/mol (diamant) | ||
| Damptrykk | 0Pa | ||
| Lydfart | 18 350m/s(diamant) | ||
| Diverse | |||
| Elektronegativitetetter Pauling-skalaen | 2,55 | ||
| Spesifikk varmekapasitet | 710J/(kg•K) | ||
| Elektrisk ledningsevne | Grafitt: 3 · 106S/m Diamant: 1 · 10-4S/m | ||
| Termisk konduktivitet | Grafitt: 119–165W/(m · K) Diamant: 900–1300 W/(m · K) | ||
Karbonellerkullstoffer etikke-metalliskgrunnstoffmedkjemisk symbolCogatomnummer6. Fra naturens side er det tre ulike isotoper, hvor12Cog13Cer stabile, mens14Cerradioaktivt,med enhalveringstidpå omtrent 5730 år.[1]Karbon er et av fågrunnstoffer som har vært kjent siden oldtiden.[2]
Karbon forekommer i flere ulike allotropiske tilstander, hvor de best kjente ergrafitt,diamantogamorft karbon.Defysiske egenskapenefor karbonet i dets ulike allotropiske tilstander er meget ulike: for eksempel er diamant i høy gradtransparent,mens grafitt har høyopasitet,og er sort; diamant er et av de hardeste materialene man kjenner, grafitt er bløtt nok til å danne streker på papir (derav dets navn, som er avledet fra detgreskeordet for «å skrive»); diamant har lavelektrisk ledningsevne,grafitt er en utmerketelektrisk leder.Under normale forhold har diamant den høyestevarmeledningsevnenav alle kjente materialer.
Karbon er det 15. mest vanlige grunnstoffet i jordskorpen, og det fjerde mest vanlige grunnstoffet i universet målt i masse, etterhydrogen,heliumogoksygen.Karbon eksisterer i alle kjente livsformer, og er det grunnstoffet man finner nest mest av i menneskekroppen målt i masse (omtrent 18,5 %), etter oksygen.[3]
Historie
[rediger|rediger kilde]Karbon (fralatincarbonumsom betyrkull) har vært kjent siden de tidligste sivilisasjoner i form av sot og kull.Diamantervar trolig kjent iKina2 500 år før Kristi fødsel, mens trekull ble fremstilt i romertiden med samme metoder som brukes i dag.
I 1722 viste René A. F. de Réaumur atjernkunne styrkes og bli tilstålved absorpsjon av et stoff, nå kjent som karbon. I 1772 kunne Antoine Lavoisier demonstrere at diamanter er en form for karbon da han brente prøver av diamant og kull, og viste at ingen av dem avga vann, og begge frigjorde samme mengde karbondioksid (CO2) pr.gram.Carl Wilhelm Scheeleoppdaget atgrafitt,som inntil da hadde vært ansett for å være en form forbly,i virkeligheten var en form for karbon. De franske forskerne Claude Louis Berthollet, Gaspard Monge og C. A. Vandermonde viste i 1786 at grafitt var rent karbon, og i sin rapport foreslo de navnet«carbone»(fra latincarbonum) på grunnstoffet.
En nyallotropiskform av karbon ble oppdaget i 1985, og ga oppdagernenobelprisen i kjemii 1996.

Egenskaper
[rediger|rediger kilde]Karbon er plassert ip-blokkenidet periodiske system.Karbon har bemerkelsesverdige egenskaper, noen er etparadoks.De forskjellige allotropiske formene (se under) inkluderer det hardeste naturlige materialet (diamant) men også et av de mykeste (grafitt).
Karbon har lett for å binde seg med andre småatomer,inkludert andre karbon-atomer, og kan danne stabilekovalente bindingermed disse atomene. På grunn av disse egenskapene er karbon til stede i nesten ti millioner[4]forskjellige stoffer, størstedelen av de kjente kjemiske forbindelsene.
Karbon er grunnleggende i altorganisk materiale.Læren om karbonets kjemi har derfor fått navnetorganisk kjemi.«Hvis det ikke var for karbon, ville livet slik vi kjenner det, ikke vært mulig», skriverPaul Davies.Det er det femtende mest vanlige grunnstoffet, men karbonatomene utgjør ingen stor del av oss. Av 200 atomer i en menneskekropp, vil 126 værehydrogen,51 vil væreoksygenog bare 19 karbon.[5]
Allotroper
[rediger|rediger kilde]Karbon har flereallotroper,det vil si varianter eller grunnstrukturer:

- Diamant(karbon 13-diamantene) er det hardeste naturlige stoffet. Struktur: Hvertatomertetraedriskbundet til fire andre karbonatomer, og danner en tredimensjonal kovalent nettverkstruktur. Diamant er en elektriskisolator,men har svært god evne til å ledevarme.Årsaken er at molekylet holdes sammen at et nettverk avkovalente bindingersom tillater lite bevegelse til individuelle karbonatomer. Derfor vil all tilført varme overføres som molekylær bevegelse gjennom diamanten.
- Grafitter en myk forbindelse. Struktur: Hvert atom ertrigonalt,planart bundet til tre andre karbonatomer slik at det dannes lag av karbonatomer ordnet ibikubemønster.Bindingsavstanden mellom karbonatomene i lagene er 141 pm. Avstanden mellom lagene er 335 pm, noe som gir svake krefter mellom lagene.
- Fullerenerhar følgende struktur: Store molekyler bestående av karbonatomer som er trigonalt, men ikke-planart bundet slik at de danner sfæriske molekyler.
- Lonsdaleitter et mineral[6]som kan bli dannet når grafittholdigemeteorittertreffer bakken. Struktur: Som diamant, men danner heksagonaltkrystallgitter.[7]
- Karbonnanorører små rør bestående av karbon. Struktur: Hvert karbonatom er trigonalt bundet i et kurvet ark som danner en hulsylinder.
Mer enn 95 prosent av alle kjente stoffer inneholder karbon, dette kommer av at karbon lett inngårkjemiske forbindelsermed andregrunnstoffer.
Isotoper
[rediger|rediger kilde]Naturlig forekommende karbon består av 2 stabileisotoper:12C(98,93 %) og13C(1,07 %). I tillegg finnes det små mengder av den ustabile, og dermedradioaktive14C(0,0000000001 %).14Cblir dannet høyt oppe iatmosfæren.Dette skjer ved atkosmisk strålingdannernøytronersom igjen reagerer mednitrogenatomerslik at man får14C.Reaksjonen ser slik ut.
- 1n +14N →14C +1H
Det finnes også 12 kunstig fremstilte isotoper. Den mest stabile er11Cmed halveringstid 20,39 minutter. Alle de resterende isotopene har halveringstider kortere enn 20 sekunder, og de fleste kortere enn 1 sekund.[8]
CAS-nummer: 7440-44-0
Forekomst
[rediger|rediger kilde]Karbon er det fjerde mest utbredte grunnstoffet i universet målt i masse, etterhydrogen,heliumogoksygen.Man finner karbon isolen,stjerner,kometer,samt i de flesteplanetersatmosfærer.Enkelte meteoritter inneholder mikroskopiskediamanter,dannet dasolsystemetenda var enprotoplanetarisk skive.Mikroskopiske diamanter kan også dannes under intenst trykk og ved høye temperaturer på nedslagssteder etter meteorittnedslag.[9]
I kombinasjon med oksygen, i den kjemiske forbindelsenkarbondioksid,finner man karbon i jordens atmosfære (anslagsvis 810gigatonnmed karbon) og oppløst i vann i alle typer vannlegemer, som i hav, innsjøer og elver (anslagsvis 36 000gigatonnmed karbon, omtrent 1900 gigatonn karbon befinner seg ibiosfæren.Hydrokarboner,somkull,oljeognaturgass,inneholder også karbon.
Karbon forekommer naturlig i ren form (diamant og grafitt), og finnes i mangemineralerog i utallige kjemiske forbindelser.
Anvendelse
[rediger|rediger kilde]
- Naturlige diamanter brukes somsmykkesteinpå grunn av sitt vakre fargespill. Til en viss grad brukes også kunstige diamanter, men disse er ikke så høyt ansett og er vesentlig billigere.
- Kunstige diamanter samt små, naturlige diamanter og diamantstøv brukes i bore-, slipe- og skjæreverktøy på grunn av sinhardhet.
- Grafittkombinert medleirebrukes somskriveredskapiblyanter.
- Kull blir brukt ismedkunsten,som varmekilde.
- Grafitt brukes somnøytronmoderatorikjernereaktorer.
- Denradioaktiveisotopenkarbon-14brukes i datering av dødt organisk materiale (dyr,planter,trevirkeosv.)
- Diamantstøv brukes i datamaskiner, som kjølesystem, på grunn av sin unike evne til å lede varme.
Se også
[rediger|rediger kilde]Referanser
[rediger|rediger kilde]- ^«Carbon – Naturally occurring isotopes».WebElements Periodic Table.Besøkt 9. oktober 2008.(en)
- ^«Periodic Table: Date of Discovery».Chemical Elements.com.Besøkt 13. mars 2007.(en)
- ^«Biological Abundance of Elements».The Internet Encyclopedia of Science.Besøkt 9. oktober 2008.(en)
- ^Los Alamos National LabsArkivert13. september 2008 hosWayback Machine.
- ^Bill Bryson:En kort historie om nesten alt,forlaget Gyldendal, Oslo 2005,ISBN 82-05-33391-2
- ^Mindat.org – Lonsdaleite
- ^«Technion – Israel Institute of Technology – Lonsdaleite».Arkivert fraoriginalen17. oktober 2013.Besøkt 29. september 2008.
- ^Lawrence Berkeley National Laboratory – Isotoptabell for karbonArkivert1. juni 2008 hosWayback Machine.
- ^Mark, Kathleen (1987).Meteorite Craters.University of Arizona Press.ISBN0-8165-0902-6.(en)
Eksterne lenker
[rediger|rediger kilde]- Superstoffet karbon- Interaktiv multimedia fra forskning.no 31.3.05
