Fèrre
Lofèrre(var.fer,fèr,ferri,hèr[2]) es l'element quimicde simbòl Fe e denumèro atomic26. Es lo metau pus frequent dins la vida vidanta car intra dins la fabricacion d'aliatgescoma lafondae l'acier.
Lo fèrre es unelementprobablament conegut dempuei laPreïstòriacar lofèrre meteoritices un materiau que se trabalha aisament. Sametallurgiaapareguèt durant l'Edat dau Bronzee venguèt preponderanta a partir de1 200 avC.Sa difusion dins lo monde marca l'intrada dins l'Edat dau Fèrrequ'es una etapa importanta de l'istòria umana. Conoguèt de melhoraments nombrós coma l'invencionde l'aut-fornèu.Pasmens, lei progrès s'accelerèron amb laRevolucion Industriala,çò que permetèt d'aumentacions considerables de la produccion.
Au nivèu fisicoquimic, lo fèrre es unmetaudetransicionque tèn de proprietatsferromagneticasimportantas. A l'estat pur, es ductil e fòrça sensible a lacorrosion.Pasmens, leis aliatges a basa de fèrre e decarbòni,coma l'aciere lafonda,son fòrça resistents. Lasiderurgiaes lo domeniindustriauque s'ocupa de la produccion d'aqueleis aliatges. Ocupa una plaça importanta dins l'economiamodèrna car, en2023,la produccion cumulada d'acier e de fonda èra de 2,3 miliards de tonas.
Istòria[modificar|Modificar lo còdi]
L'Edat dau Fèrre[modificar|Modificar lo còdi]
Segon leiconoissençasactualas, lofèrre meteoriticfoguèt trabalhat per lo premier còp en3500 avCenEgipte[3].Pasmens, d'utilizacions pus ancianas son sospichadas car aqueu fèrre es ductil e relativament deformable[4].L'aparicion de lametallurgiadau fèrre es pas clara. Quauqueis objèctes mòstran una aparicion durant l'Edat dau BronzeenAnatoliaò enSiria,probablament entre3000e2700 avC[5].Durant la segonda mitat dau millenari II avC, leisItitasintroduguèron l'usatge d'armasde fèrre sus loprat batalhier,mai leis armas de bronze contunièron de largament dominar[6].De mai, lei descubèrtasarqueologicspermèton pas de ben comprendre lo nivèu de mestritge dei metallurgistas ititas. Ansin, lo començament de l'Edat dau Fèrrees donc encara fixat enAnatoliavèrs1200 avC.
De l'Antiquitat a la Revolucion Industriala[modificar|Modificar lo còdi]
La metallurgia dau fèrre se difusèt, ò foguèt descubèrta d'un biais independent, dins mai d'una region d'Euròpa,d'Asiae d'Africa.Leisaciersefondasproduchas èran dequalitatsrelativament mediòcras segon lei critèris actuaus, mai la preséncia d'impuretats nombrosas permetiá sovent de protegir leis objèctes metallics còntra lorovilh.Ansin, dins lei tèxtes dePlini lo Vièlh,lo fèrre es descrich coma un element comun au sen de lasocietat romana[7].
Ausègle I apC,l'aut-fornèuapareguèt enChina.EnEuròpa,aqueu sistèma apareguèt enEscandinàviadurant losègle XII.Son usatge se generalizèt sus lo continent a partir dausègle XIV.Divèrsei metòdes, coma lometòde valon,permetèron de produrre d'aciers naturaus d'una qualitat sufisenta per fabricar decanons.D'efiech, lei besonhs de l'artilhariáfoguèron un vector important dau progrès de la metallurgia europèa durant aqueu periòde. Aquò necessitèt d'organizar de bacins protoindustriaus per gerir la produccion e l'extraccion dei matèrias premieras. En particular, de mesuras de proteccion deiseuvasfoguèron presas car l'activitat èra a l'origina d'importants movements de deforestacion.
La produccion defondae d'acierfoguèt un dei premiers sectors tocats per laRevolucion Industriala.En1783,Henry Cort(1740-1800) descurbiguèt lopuddlage,una tecnica que permet de braçar la fonda per i favorizar la circulacion d'aire.Aquò permet de redurre son taus decarbònie de facilitar l'afinatge. Regularament melhorat, aqueu procès marca la fondacion de lasiderurgiamodèrna en aumentant considerablament lei quantitats d'acier e de fonda disponiblas[8].
Dempuei la Revolucion Industriala[modificar|Modificar lo còdi]
Durant laRevolucion Industriala,lasiderurgiavenguèt un sector estrategic que son importància s'observèt durant lei dos conflictes mondiaus. La produccion conoguèt d'aumentacions sensa precedents dins l'istòria umana e l'acier venguèt un element de basa de latecnologiadei país desvolopats. Per sostenir aquela evolucion, fòrça trabalhs de recèrca aguèron luòc. Permetèron de concebre de procès capables d'esplechar de fònts novèlas deminerause d'aliatgesadaptats a de besonhs novèus. Lo reciclatge venguèt tanben un element important de la siderurgia car leiferralhasson desenant de materiaus comuns. Dempuei la fin dau sègle XX, aquela activitat s'intègra egalament dins lei preocupacionsecologicascar la produccion d'acier demòra una activitatpolluenta.
La quimia dau fèrre[modificar|Modificar lo còdi]
Occuréncia, distribucion e reparticion[modificar|Modificar lo còdi]
Lo fèrre es lo seisenelement quimicpus abondós de l'Univèrs[9].Es l'elementfinau dei reaccions defusionque se debanan dins leisestelaspus massisas. Es un compausant major de laTèrraque constituís 5 % de lamassade lacrosta terrèstra[10].I forma aisament deminerausamb l'oxigèn,losofree l'idrogèn.Entre lei pus coneguts, se pòdon citar l'ematita(Fe2O3), lamagnetita(Fe3O4), lalimonita(Fe2O3,n H2O), lapirita(FeS2) e l'olivina((Mg,Fe)2[SiO4])[11].Aqueleiminerausson relativament frequents dins lanatura.
Proprietats fisicas[modificar|Modificar lo còdi]
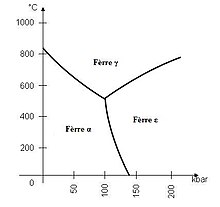
Lo fèrre es unmetauque se presenta sota diferentei formas en foncion de latemperaturae de lapression[12][13][14].Dins leicondicions normalas de temperatura e de pression,es unsubstànciasolidaque tèn una estructura cristallina cubica centrada. Dich fèrre α, a unamassa volumicade 7,874 g.cm-3a 20 °C e unaduretatsituada entre 4 e 5. Es relativament dur, mai es ductil e sa resisténcia mecanica es ben inferiora a l'acier.
Se latemperaturacontunia d'aumentar, d'autrei fasas aparéisson. A partir de 912 °C, l'estructura cristallina vèn cubica fàcias centradas. Aquela fasa es dicha fèrre γ. Es a la basa de l'austenita,una forma d'acier qu'a un ròtle important ensiderurgiadins la fabricacion d'aciers inoxidables.A partir de 1 384 °C, l'estructura vèn tornarmai cubica centrada. Aquela fasa es dicha fèrre δ. Son ponch de fusion, 1 538 °C, es aqueu dau fèrre sota pression atmosferica. Quand latemperaturademòra a 20 °C e que la pression aumenta, una estructura cristallina exagonala compacta se forma a partir de 130 kbar. Es dicha fèrre ε. Loponch tripledau fèrre se situa a 750 K e 10,5 GPa[15].
Lo fèrre es egalament ferromagnetic. Es a dire que lei moments magnetics deis atòms se pòdon alinhar sota l'influéncia d'un camp magnetic exterior e conservar aquela orientacion novèla après la disparicion d'aqueu camp. Aquela proprietat es a l'origina dei fenomèns d'aimantacion.
Proprietats quimicas[modificar|Modificar lo còdi]
Lo fèrre es unmetau de transicionque sei proprietatsquimicaspresentan de similituds amb lorutèni,l'òsmi,locobalte loniquèl.Pòu prendre d'estats d'oxidacionanant de -IV a +VII, mai leis estats 0, +II e +III son lei pus importants per laquimiamodèrna. Lo fèrre es donc unelementque pòu s'engatjar dins mai d'unareaccion.Lo paragraf se limita donc a la presentacion dei proprietats pus frequentament utilizada ò observada.
Corrosion e oxidacion[modificar|Modificar lo còdi]

A l'aireliure, lo fèrre es sensible a lacorrosion.Aquò es lo resultat de la formacion d'oxidse d'idroxidsonte lo fèrre es a l'estat +II ò +III[16][17].Lo tèrmerovilhdesigna la mescla d'aqueleicompausats.Coma es un materiau porós e fragil, l'oxidacion pòu se propagar dins la prefondor d'un materiau ferrós e o degrada pauc a cha pauc. La proteccion còntra lacorrosiones donc un enjòc important per leisindustriaus.Necessita l'utilizacion de produchs especiaus aplicats a la superficia dei materiaus (pintura,vernís,etc.), d'anòde sacrificiau(sovent dezinc) ò d'aliatgesespeciaus (aciers inoxidables,etc.).
Comportament en solucion aquosa[modificar|Modificar lo còdi]

Ensolucionaquosa,lo fèrre forma generalament leisionsferrós(Fe2+) eferric(Fe3+). Lo premier, a l'estat d'oxidacion +II, es estable en solucion per depHinferiors a 6. Segon l'environament quimic, pòu prendre diferenteicolors.Per exemple, la solucion eissida de la dissolucion d'una mòstra desau de Mohres de color verd clar. Per lei pH superiors a 6, l'ion ferrósprecipitaper formar d'idroxid de fèrre (II)(Fe(OH)2) mai, segon leis ions presents, pòu participar a la formacion d'autrei precipitats.
L'ion ferrices estable dins desolucionsacidasdepHinferiors a 2. En delà, precipita per formar d'idroxid de fèrre (III)(Fe(OH)3). Pasmens, coma per l'ion ferrós,pòu integrar d'autrei precipitats segon leis ions presents. Lei solucions contenent d'ions ferrics presentan egalament una granda diversitat de coloracions.
Oxidoreduccion dau fèrre[modificar|Modificar lo còdi]
Lo fèrre tèn dos pareus que sei potenciaus de referéncias son Fe2+/ Fe: E0= -0,44 V e Fe3+/ Fe2+= +0,77 V. Lo fèrre metallic es donc pas estable en solucion aquosa e son oxidacion es d'aitant mai importanta que lo pH es feble. D'autra part, aquelei valors mòstran egalament qu'en preséncia dedioxigènO2,leis ions Fe2+son pas estables ensolucion.
Complexacion[modificar|Modificar lo còdi]
Lo fèrre pòu formar un nombre important de complèxes, especialament en solucion aquosa. Lei pus frequents son leis ions CN-,F-,1,10-fenantrolin(utilizat per la titracion deis ions Fe2+) e tiocianats SCN-(utilizat per detectar la preséncia de fèrre en solucion gràcias a una coloracion caracteristica).
Quimia organometallica[modificar|Modificar lo còdi]
Laquimia organometallicade fèrre apareguèt en1951amb la sintèsi deferrocèn.Dempuei aquela descubèrta, divèrsei compausats son estats trobats, siá a partir de l'estructura dau ferrocèn, siá a partir d'assemblatges diferents.
Isotòpia[modificar|Modificar lo còdi]
En2024,lo fèrre aviá 28isotòpsconeguts que seinombras de massaanavan de 45 a 72. Entre aqueleis isotòps, quatre son estables (54Fe,56Fe,57Fe e58Fe). Lo pus abondós es lo fèrre-56 (91,574 %) seguit per lo fèrre-54 (5,845 %[18]), lo fèrre-57 (2,119 %) e lo fèrre-58 (0,282 %). La crosta oceanica contèn tanben de traças de fèrre-60, un isotòp de periòde radioactiu egau a 2,6 milions d'ans. La massa atomica dau fèrre naturau es ansin de 55,845 u.
La metallurgia dau fèrre[modificar|Modificar lo còdi]

En causa de l'importància dau fèrre dins lasocietatumana,fòrça procès d'extraccion d'aqueumetauexistisson. Lor desvolopament permetèt l'esplecha de mineraus dequalitatvariabla e necessitèt d'adaptacions frequentas per tractar una impuretat donada. Pasmens, quauquei principis generaus dictan lo debanament d'aquelei metòdes. Per començar, lo fèrre es obtengut per unareacciond'oxidoreduccionentre lomonoxid de carbònie leisoxids de fèrrepresents dins lo minerau[19].Dempuei lo sègle XIX, aquela procès a sistematicament luòc dins un aut-fornèu en preséncia desilici.Aquela installacion permet de realizar d'un biais simultanèu la reduccion dau minerau e la recuperacion de lafondaliquida.Losilicipermet la separacion espontanèa de lafondae de la màger part deis impuretats que forman unafasa,dichalachier,que floteja au dessüs dau metau enfusion[20].Lomonoxid de carbòninecessari a la reduccion es eissit de lacombustiondecòc[21].En lei país productors degas naturau,es tanben possible d'utilizar una partida d'aquelei gas.
Puei, per obtenir unmetauutilizable per fabricar de pèças metallicas utilizablas, es necessària de purificar lafonda.Dos ensembles de procès de purificacion son més en òbra. Lei premiers son basats sus l'injeccion d'oxigènper entraïnar de reaccions decombustion.Aquò permet de redurre la preséncia decarbònie de transformar la fonda enacier[22].Leis autrei procès de purificacion son destinats a eliminar d'impuretats non desideradas. Losofrees eliminat per injeccion desoda,decalciò demagnèsi,losiliciper una reaccion de combustion[23]e lofosfòrper injeccion decauç.
Uei, lo reciclatge dei pèças d'acier e de fonda ocupa egalament una plaça importanta dins la produccion. D'efiech, coma la màger part deis aliatges a basa de fèrre sonmagnetics,sa triada es relativament simpla. Deforns electricsson utilizats per fondre la ferralha, sovent en vista de fabricar d'aciers especiaus.
Utilizacions e produccion[modificar|Modificar lo còdi]
Utilizacions[modificar|Modificar lo còdi]

Representant 90 % de la produccion de l'industriametallurgicamondiala, lo fèrre es lometaupus utilizat per la societat modèrna. Pasmens, l'utilizacion dau fèrre pur es relativament rara e limitada a quauquei domenis coma la fabricacion de produchs alimentaris ò de supòrts d'enregistramentmagnetics.Aquò es una consequéncia dei proprietats dau metau pur qu'es sensible a lacorrosione que se deforma quand es somés a defòrçasimportantas. La màger part de la produccion deminerau de fèrrees ansin destinada a la fabricacion d'aliatges.
Leisaliatgesprincipaus a basa de fèrre son d'aliatges fèrre-carbòni:
- leifondascontènon de 2,1 % a 6,67 % decarbòni.An unatemperatura de fusionsituada entre 1 135 e 1 350 °C e una bòna colabilitat. Son devesidas en plusors grops diferents en foncion de sei proprietats mecanicas coma lafonda blancaqu'es resistenta a l'abrasion mai relativament fragila[24].
- leisacierscontènon de 0,025 % a 2,1 % decarbòni.Pòdon subir de tractaments variats (recuech,tremp,revengut,cementacion,nitruracion,carbonitruracion,etc.) que permèton de crear d'aliatges variats capables de resistir a mai d'una constrencha ò a la corrosion. En particular, l'acier permet de fabricar de pèças plegadissas, çò qu'a d'interès major dins la construccion.
- leifèrres industriauscontènon mens de 0,025 %.
Aqueleis aliatges pòdon contenir d'autreiselements quimics,de còps dins de proporicions importantas. Per exemple, l'acier inoxidablees constituït de mens de 1,2 % decarbònie de mai de 10,5 % decròme[25].
Leis aliatges entre lo fèrre e un autreelement(a l'excepcion dau carbòni) son dichsferroaliatges.Lei pus produchs son loferrocròme,loferromanganès,loferroniquèle loferrosilici.Son utilizats ensiderurgiacoma « ingredients » per la fabricacion d'aciers especiaus[26].
Produccion[modificar|Modificar lo còdi]
Coma lo fèrre es pauc utilizat a l'estat pur, sa produccion es pas dirèctament mesurada. En plaça, son puslèu mesuradas lei produccions deminerau de fèrree deis aliatges a basa de fèrre. En2023,la produccion deminerau de fèrreèra estimada a 2,5 miliards detonas.Aqueuminerauconteniá una quantitat de fèrre estimada a 1,5 miliards de tonas. Lei país productors principaus èranAustràlia(960 Mt),Brasil(440 Mt),China(280 Mt),Índia(270 Mt),Russia(88 Mt),Iran(77 Mt),Canadà(70 Mt) eSud-Africa(61 Mt). Lei resèrvas actualament esplechablas èran estimadas a 190 miliards de tonas e se trobavan mai que mai enAustràlia(58 Gt), enBrasil(34 Gt), enRussia(29 Gt), enChina(20 Gt), enUcraïna(6,5 Gt) e enCanadà(6 Gt). La quantitat de fèrre dins aquelei resèrvas seriá de 87 miliards de tonas. Lei resèrvas totalas de minerau, esplechablas e non esplechablas amb lei mejans actuaus, serián d'aperaquí 800 miliards de tonas[27].
La produccion defondabruta èra estimada a 1,3 miliards de tonas en2023.Amb 890 milions de tonas,Chinaèra largament lo premier productor mondiau. Leis autrei productors importants èraÍndia(80 Mt),Japon(63 Mt),Russia(54 Mt), laCorèa dau Sud(44 Mt),Brasil(26 Mt),Alemanha(22 Mt) e leisEstats Units(21 Mt). Per l'acier,lei país productors èran relativament similars.Chinaproduguèt un miliard de tonas en2023,siá 53 % de la produccion mondiala. Leis autrei productors importants èranÍndia(140 Mt),Japon(87 Mt), leisEstats Units(80 Mt),Russia(75 Mt), laCorèa dau Sud(68 Mt),Turquia(42 Mt),Brasil(34 Mt),Alemanha(33 Mt) eIran(30 Mt)[28].
La produccion deferroaliatgeses pus limitada. En2015,èra estimada a 52,8 milions de tonas.China,Sud-Africa,Índia,RussiaeCazacstanèran a l'origina de 84 % de la produccion mondiala[29].
Toxicologia[modificar|Modificar lo còdi]

Lo fèrre es unelementindispensable au còrs uman, especialament per fabricar l'emoglobinaque permet lo transpòrt de l'oxigènper leiglobuls rogese lamioglobinaque permet l'estocatge de l'oxigèndins leimuscles[30].95 % d'aqueu fèrre es reciclat. Lei besonhs nutritius son donc relativament febles e l'èsser umanen bònasantatabsorbís e excreta de quantitats fòrça feblas de fèrre.
Tot desequilibri pòu aver de consequéncias negativas. Lei caréncias pòdon menar a unaanemia.En l'enfant, aquò es egalament susceptible de redurre lei facultats cognitivas (anemia ferripriva). Leis excès de fèrre favorizan l'aparicion de patologias epaticas, pulmonaras e renalas e aurián un ròtle dins lo desvolopament de lamalautiá de Parkinsone de formas raras decancèr.De transfusions sanguinas frequentas, certaneimalautiáse certaneis aliments favorizan l'aumentacion de la concentracion de fèrre dins l'organisme[31].De mai, fau nòtar que la consumacion excessiva d'alimentsanimauscontenent de quantitats importantas de fèrre (carn rojaecarnsalada) aumenta la probabilitat de formacion d'uncancèr dau colon.
Annèxas[modificar|Modificar lo còdi]
Liames intèrnes[modificar|Modificar lo còdi]
Bibliografia[modificar|Modificar lo còdi]
Istòria de la metallurgia e dei tecnicas:
- (fr)Bertrand Gille,Histoire des techniques,Gallimard, coll. « La Pléiade », 1978.
- (en)H. R. Schubert,History of the British Iron and Steel Industry... to 1775 AD,Londres, Routlege, 1957.
- (en)R. F. Tylecote,History of Metallurgy,Londres, Institute of Materials, 1992.
- (en)R. F. Tylecote, « Iron in the Industrial Revolution », dins J. Day e R. F. Tylecote,The Industrial Revolution in Metals,Institute of Materials, 1991, pp. 200–260.
- (en)Mary Elvira Weeks e Henry M. Leichester, « Elements known to the ancients »,Discovery of the elements,Easton, Journal of Chemical Education, 1968.
Procès e metòdes siderurgics:
- (en)G. Reginald Bashforth,The manufature of iron and steel, vol. 2: Steel production,Londres, Chapman & Hall Ltd, 1951.
- (fr)Louis Colombier,Métallurgie du fer,Dunod, 1957.
- (fr)Adolf Ledebur (trad. Barbary de Langlade),Manuel théorique et pratique de la métallurgie du fer,Librairie polytechnique Baudry et Cie éditeur, 1895.
- (fr)Daniel Rivet,L'acier et l'industrie sidérurgique,París, Presses universitaires de France, coll. « Que sais-je? » (n° 561), 1978.
Toxicologia, efiechs biologics e patologias:
- (fr)M. Bourel e M. Simon, « Physiopathologie et classification des hémochromatoses »,La Revue du Praticien,vol. 27, n° 7, febrier de 1977, pp. 339-350.
- (fr)Yves Deugnier, « Surcharges en fer »,La Revue du praticien,vol. 56, n° 19, decembre de 2006, pp. 2109-2110.
- (en)L. F. Grimsley, « Iron and cobalt », dins E. Bingham, B. Cohrssen e C. H. Powell (dir.),Patty's Toxicology,Nòva York, Chichester, Weinheim, Brisbane, Singapore e Toronto, John Wiley & Sons, Inc., 2001, pp. 169-193.
- (en)C. C. Wu e H. M. Liu, « Determinants of metals exposure to metalworking fluid among metalworkers in Taiwan »,Arch Environ Occup Health,vol. 69, n° 3, 2014, pp. 131-138.
Nòtas e referéncias[modificar|Modificar lo còdi]
- ↑1,0et1,1(en)David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 paginas.
- ↑Lo Congrès Permanent de la Lenga Occitana,Dicod'Òc,cèrca « fer », consultat lo 3 de febrier de 2024,[1].
- ↑(en)Mary Elvira Weeks e Henry M. Leichester, « Elements known to the ancients »,Discovery of the elements,Easton,Journal of Chemical Education,1968, pp. 29-40.
- ↑(de)Andrew Ure,Technisches wörterbuch oder Handbuch der Gewerbskunde...: Bearb. nach Dr. Andrew Ure's Dictionary of arts, manufactures and mines,G. Haase, 1843, p. 492.
- ↑(en)Mary Elvira Weeks e Henry M. Leichester, « Elements known to the ancients »,Discovery of the elements,Easton,Journal of Chemical Education,1968, p. 32.
- ↑(fr)Jacques Freu e Michel Mazoyer,L'apogée du nouvel Empire hittite,París, L'Harmattan, 2008.
- ↑(en)Mary Elvira Weeks e Henry M. Leichester, « Elements known to the ancients »,Discovery of the elements,Easton,Journal of Chemical Education,1968, p. 31.
- ↑(fr)Bertrand Gille,Histoire des techniques,Gallimard, coll. « La Pléiade », 1978.
- ↑(en)I. McDonald, G. C. Sloan, A. A. Zijlstra, N. Matsunaga, M. Matsuura, K. E. Kraemer, J. Bernard-Salas e A. J. Markwick, « Rusty Old Stars: A Source of the Missing Interstellar Iron? »,The Astrophysical Journal Letters,vol. 717, n° 2, 2010, L92-L97.
- ↑(en)John W. Morgan e Edward Anders, « Chemical composition of Earth, Venus, and Mercury »,Proceedings of the National Academy of Sciences,vol. 77, n° 12, 1980, pp. 6973-6977.
- ↑(de)Arnold F. Holleman, Egon Wiberg e Nils Wiberg, « Iron »,Lehrbuch der Anorganischen Chemie (91–100 ed.),Walter de Gruyter, 1985, pp. 1125-1146.
- ↑(en)R. L. Clendenen e H. G. Drickamer, « The effect of pressure on the volume and lattice parameters of ruthenium and iron »,Journal of Physics and Chemistry of Solids,vol. 25, n° 8, 1964, pp. 865-868.
- ↑(en)Ho-Kwang Mao, William A. Bassett e Taro Takahashi,« Effect of Pressure on Crystal Structure and Lattice Parameters of Iron up to 300 kbar »,Journal of Applied Physics,vol. 38, n° 1, 1967, pp. 272-276.
- ↑(en)Reinhard Boehler, « High-pressure experiments and the phase diagram of lower mantle and core materials »,Review of Geophysics,vol. 38, n° 2, 2000, pp. 221-245.
- ↑(en)Simone Anzellini e Daniel Errandonea, « Properties of Transition Metals and Their Compounds at Extreme Conditions »,Crystals,vol. 11, n° 10, 2021, p. 1185.
- ↑(fr)G. Bresch, « La formation de la rouille »,Revue de Métallurgie,vol. 7, n° 6, 1910, pp. 433-446.
- ↑Leis estats -II, 0, +I, +IV e +VI pòdon tanben èsser presents, mai son pus rars.
- ↑Aquel isotòp es benlèuradioactiu,mai sonperiòde radioactiuseriá fòrça lòng (mai de 3,1.1022ans).
- ↑Aperavans, de mineraus de fèrresofrats,coma lapirita,èran tanben utilizats ensiderurgia.La premiera etapa dau procès de produccion èra alora una etapa de crematge dau minerau que permetiá de formar d'oxids de fèrre en remplaçant leis atòms desofreper d'atòms d'oxigèn.Aquò èra fòrça polluent en causa de la liberacion de compausats sofrats. Uei, aquelei metòdes demòran utilizats per produrre desofreò d'acid sulfuric.En revènge, son estats abandonats ensiderurgiacar es mens costós d'utilizar dirèctament d'oxids de fèrre.
- ↑(en)Frank K. Krundwell, Michael S. Moats, Venkoba Ramachandran, Timothy G. Robinson e William G. Davenport,Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals,Elsevier, 2011, p. 67.
- ↑(fr)Jean-Marie Duchène, Daniel Isler e Émile Yax,Élaboration du métal primaire, coke métallurgique,Éditions des Techniques de l'ingénieur, 1991.
- ↑Pus rarament, permet de començar la preparacion de fèrre pur.
- ↑Aquela reaccion a luòc gràcias a l'injeccion d'oxigèn. A luòc avans la combustion entre l'oxigèn e lo carbòni, çò que permet d'eliminar lo silici sensa iniciar la demenicion de la concentracion de carbòni.
- ↑(fr)Thibault Fourcade, « Les Fontes »,Techniques de l'Ingénieur - TBA 1064, consultat lo 2 de febrier de 2024,[2].
- ↑(fr)Nòrma NF EN 10020, « Définition et classification des nuances d'acier », setembre de 2000, consultat lo 2 de febrier de 2024.
- ↑(fr)Lisa A. Corathers et al.,Minerals Yearbook 2008 (Report),vol. I, U.S. Geological Survey, 2010, pp. 25.1-25.14.
- ↑(en)US Geological Survey, « Iron Ore Statistics and Information - 2023 », consultat lo 2 de febrier de 2024,[3].
- ↑(en)US Geological Survey, « Iron Ore Statistics and Information - 2023 », consultat lo 2 de febrier de 2024,[4].
- ↑(en)Sheryl A. Singerling, Christopher A. Tuck et al., « Ferroalloys »,Minerals Yearbook 2015 (Report),vol. I, U.S. Geological Survey, 2018, pp. 25.1–25.14.
- ↑Aqueleiproteïnascontènon respectivament 70 % e 20 % de la quantitat de fèrre presenta dins l'organisme.
- ↑(fr)Frédéric Galactéros, « Les surcharges en fer secondaires »,La Revue du Praticien,vol. 50, n° 9, mai de 2000, pp. 983-987.


