Oxigèn
L’oxigènes unelement quimicde simbòl O e denumèro atomic8. Se situa dins la linha II e dins la colona 16 de lataula periodica.A donc unpes atomicrelativament feble (15,999) mai unaelectronegativitatfòrça importanta (la segonda pus auta). Fa partida deinon metause, dins leicondicions normalas de pression e de temperatura,sa forma principala es lodioxigènO2.Gasós, constituís 21% dauvolumtotau de l'atmosfèraterrèstra.
Elementfrequent dins l'Univèrs,l'oxigèn pòu formar de compausats fòrça variats coma d'oxids e divèrsei substànciasorganicas.Tènon un ròtle fòrça important dins lei mecanismes dauvivent,especialament lodioxigèn,l'aigae lodioxid de carbòni.
Istòria[modificar|Modificar lo còdi]
De l'Antiquitat a l'aparicion de la quimia[modificar|Modificar lo còdi]

Se la descubèrta de l'oxigèn es relativament recenta, d'observacions de sa preséncia ò de sei proprietats aguèron luòc tre l'Antiquitat.La pus anciana coneguda a l'ora d'ara es aquela deFilon de Bizanci(vèrs280-220 avC) que s'interes sắc t a lacombustiond'una candèla plaçada dins una campana sotada dins d'aiga.Observèt una montada dau nivèu de l'aigadins la campana mai expliquèt lo fenomèn per una transformacion d'unvolumd'aireenelementfuòc[1].Durant laRenaissença,Leonardo da Vinci(1452-1519) repetiguèt aquela experiéncia per la combustion e capitèt de l'estendre a larespiracion.
A la fin dau sắc gle XVI ò au començament dau sắc gle XVII, l'alquimistapolonésMichael Sendivogius(1566-1636) isolèt una mòstra dedioxigèngasós mai mau capitèt de d'identificar sa natura. En revènge, observèt una partida de sei proprietatsbiologicase li donèt lo nom decibus vitae.Per aquela rason,Sendivogiuses de còps considerat coma lo premier descubraire de l'oxigèn[2].
Dos sắc gles pus tard,Robert Boyle(1627-1691) demostrèt que l'airees necessari a lacombustion.Puei, totjorn au sắc gle XVII, loquimistaanglésJohn Mayow(1641-1679) capitèt d'isolar la partida de l'airenecessària a lacombustione a larespiracion.Estimèt sonvoluma 20% dau volum totau de l'aire e la diguètspiritus nitroaereus.Mayowmesurèt tanben l'aumentacion demassad'una mòstra d'antimòniavans e après sa combustion. Concluguèt que lospiritus nitroaereusdeviá se combinar amb lometau.Puei, generalizèt aqueu resultat a larespiraciondins un obratge paregut en1688.Marcant de progrès importants, sa teoria desvolopèt l'idéa d'una extraccion dauspiritus nitroaereusde l'aireper leipaumons,de son transpòrt per losange de sa consumacion dins leimuscles[3].
Lo periòde de la teoria dau flogistic[modificar|Modificar lo còdi]
Durant lei sắc gles XVII e XVIII, plusors sabents realizèron d'experiéncias entraïnant una produccion importanta dedioxigèn.Entre lei pus famós, se pòdon citarRobert Hooke(1635-1703),Ole Borch(1626-1690),Mikhail Lomonosov(1711-1765) ePierre Bayen(1725-1798)[4].Pasmens, foguèron pas capables d'identificar sa descubèrta probablament en causa de lateoria dau flogisticque dominava laquimiad'aqueu temps. D'efiech, aquela teoria explicava lacombustionper l'existéncia d'una substància, dichaflogistic,qu'èra perduda quand un materiau èra cremat. L'airei aviá ges de rótle.
La descubèrta de l'oxigèn[modificar|Modificar lo còdi]
La descubèrta de l'oxigèn es generalament atribuïda aufarmacianCarl Wilhelm Scheele(1742-1786). Entre1771e1775,isolèt dedioxigèngasós a partir d'oxid de mercurie de nitrats. O diguèt « aire de fuòc ». A respèct de sei predecessors, identifiquèt la natura gasosa dau dioxigèn. Dins aquò, en1774-1775,loBritanicJoseph Priestley(1733-1804) realizèt d'experiéncias similaras d'un biais independent e arribèt a la meteissa conclusion[5].Es ansin de còps creditat de la descubèrta de l'oxigèn car publiquèt sei resultats tre1775(contra1777perScheele).
Pus tard,Antoine Lavoisier(1743-1794) proclamèt aver comprés la natura gasosa daudioxigènavans lei dos òmes mai aquò es pauc probable. En revènge, gràcias d'experiéncias decombustionpus precisas, capitèt d'identificar l'oxigèn comaelement quimicen1777.Revolucion majora dins l'istòria de laquimia,aquò li permetèt tanben de donar son nom definitiu a l'oxigèn a partir deimotsgrècsὀξύς(« acid » enoccitan) e-γενής(« productor »). D'efiech,Lavoisierpensava que l'oxigèn èra lo constituent deisacidsen causa de son ròtle dins lacorrosion[6].Aquela error foguèt compresa en1812mai èra tròp tard per cambiar de nom.
-
Retrach deCarl Wilhelm Scheele
-
Retrach deJoseph Priestley
-
Retrach d'Antoine Lavoisier
Lo desvolopament deis aplicacions industrialas de l'oxigèn[modificar|Modificar lo còdi]

Après sa descubèrta, l'oxigèn demorèt un objècte d'estudi important tant per lo desvolopament de laquimiaque de l'industria.En particular, mai d'un procès foguèt concebut per produrre dedioxigènliquid.Lo premier foguèt inventat per loSoísRaoul Pictet(1846-1929) que mesclètreaccions quimicase operacionsfisicasper obtenir una pichona quantitat de dioxigèn liquid en1877[7].Pasmens, foguèt necessari d'esperar lo trabalh deJames Dewar(1842-1923) per de dispausar d'unvolumsufisent per realizar de mesuras.
Lo premier procès comerciau foguèt l'òbra deCarl von Linde(1842-1934) e deWilliam Hampson(1854-1926). Basat sus la destillacion d'aire liquefiat atemperaturabassa, permetèt la generalizacion d'aplicacions industrialas coma localamèuoxacetilenic.
La descubèrta dei ròtles biologics de l'oxigèn[modificar|Modificar lo còdi]
Coma o mòstra leis experiéncias deLeonardo da VinciòMichael Sendivogius,d'indicis dau ròtle de l'oxigèn foguèron observats tre lo periòde de laRenaissença.De mai, a la fin dau sắc gle XVIII quand l'element oxigèn foguèt descubèrt, la teoria de John Mayow permetiá d'explicar una partida dau foncionament de la respiracion animala.
Aquela dei vegetaus comencèt d'èsser compresa perJoseph Priestleyque placèt alternativament unaratae una planta dins una mòstra dedioxigèn.Observèt que la respiracion de la rata « bleçava » lo gas de la mòstra qu'èra « restaurat » per la planta. Tre1778,Jan Ingenhousz(1730-1799) demostrèt que lalutzsolaraèra necessària au bòn debanament d'aqueu fenomèn. Enfin,Jean Senebier(1742-1809) concluguèt en1796que la respiracion vegetala èra basada sus un procès invèrs a aquela deis animaus. Aquò menèt a la descubèrta de lareacciondefotosintèsi,tèrme formulat au sắc gle XIX, qu'es pas encara totalament compresa a l'ora d'ara.
Proprietats quimicas[modificar|Modificar lo còdi]
Proprietats atomicas[modificar|Modificar lo còdi]
L'atòmd'oxigèn a uechelectronsque son estat fondamentau es 1s22s22p6.A donc sièiselectronsde valéncia e doas proprietats de remarca:
- unaelectronegativitatfòrça importanta (3,44 segon l'escala de Pauling) en causa de la preséncia d'interaccions fòrtas entre lo nuclèu e lei sosjaç 2s e 2p.
- la cèrca d'una configuracion electronica establa similara an aquela deneon.
L'oxigèn a donc una reactivitat que presenta de similituds amb leis autreis elements de la colona 16 de lataula periodicamai pòu pas practicar, au contrari d'aqueleis elements, l'ipervaléncia (es a dire plaçar 18electronsdins sa valéncia per s'estabilizar). En causa d'aqueu limit, sei proprietatsquimicasan donc una certana similitud amb aquelei de l'azòtqu'es son vesin dirècte, especialament sa capacitat de crear deliames quimicsamb unatòmd'idrogèn.De mai, pòu, coma l'azòt,formar deliames idrogèn.
Ocurréncia e isotòpia[modificar|Modificar lo còdi]
Ocurréncia[modificar|Modificar lo còdi]
Segon lei mesurasespectrograficasrealizadas dempuei laTèrra,l'oxigèn es lo tresenelementpus present dins laVia Lactèa.Enmassa,sembla ansin formar 0,9% dauSoleu,23,1% de l'atmosfèrade laTèrra[8],49,2% de sacrostae 88,8% de seisoceans[9].
Aquela abondància relativa s'explica per lei mecanismes defusion nuclearaque se debanan au còr deisestelas.D'efiech, quand an agotat sei re sắc rvas d'idrogèn,leisestelasde tipe solar son capablas d'entraïnar dereaccions de fusionde seisatòmsd'èlique menan a la formacion d'oxigèn.
Isotòpia[modificar|Modificar lo còdi]
En2019,17isotòpsde l'oxigèn èran estats identificats. Tres son estables. SusTèrra,lo pus frequent es l'oxigèn-16(99,76%) qu'es format per la fusion de l'èlicontengut dins lei nuclèus estellars. Pasmens, existís tanben l'oxigèn-17(0,04%) e l'oxigèn-18(0,20%). Lo premier es eissit de cicles de fusion dichscicle CNOque pòdon aver luòc lafusionde l'èli.Lo segond se fòrma a partir de nuclèus d'azòt-14 creats per lei cicles CNO[10].
Leisisotòpsinstables an deperiòdes radioactiusfòrça febles (122,24 s per la pus lònga). An pauc d'aplicacions franc de l'oxigèn-15qu'es utilizat enmedecinaper realizar detomografias per emission de positrons.
| Simbòl de l'isotòp |
Z (p) | N (n) | Massa isotopica (u) | Periòde | Mòde(s) de desintegracion |
Isotòp(s)-fiu[11] | Espin nuclear |
|---|---|---|---|---|---|---|---|
| 12O | 8 | 4 | 12,034405(20) | 580(30)×10−24s [0,40(25) MeV] |
2p (60,0 %) | 10C | 0+ |
| p (40,0 %) | 11N | ||||||
| 13O | 8 | 5 | 13,024812(10) | 8,58(5) ms | β+(89,1 %) | 13N | (3/2-) |
| β+,p (10,9 %) | 12C | ||||||
| 14O | 8 | 6 | 14,00859625(12) | 70,598(18) s | β+ | 14N | 0+ |
| 15O | 8 | 7 | 15,0030656(5) | 122,24(16) s | β+ | 15N | 1/2- |
| 16O | 8 | 8 | 15,99491461956(16) | Estable | 0+ | ||
| 17O | 8 | 9 | 16,99913170(12) | Estable | 5/2+ | ||
| 18O | 8 | 10 | 17,9991610(7) | Estable | 0+ | ||
| 19O | 8 | 11 | 19,003580(3) | 26,464(9) s | β− | 19F | 5/2+ |
| 20O | 8 | 12 | 20,0040767(12) | 13,51(5) s | β− | 20F | 0+ |
| 21O | 8 | 13 | 21,008656(13) | 3,42(10) s | β− | 21F | (1/2,3/2,5/2)+ |
| 22O | 8 | 14 | 22,00997(6) | 2,25(15) s | β−(78,0 %) | 22F | 0+ |
| β−,n (22,0 %) | 21F | ||||||
| 23O | 8 | 15 | 23,01569(13) | 82(37) ms | β−,n (57,99 %) | 22F | 1/2+# |
| β−(42,0 %) | 21F | ||||||
| 24O | 8 | 16 | 24,02047(25) | 65(5) ms | β−,n (57,99 %) | 23F | 0+ |
| β−(42,01 %) | 24F | ||||||
| 25O | 8 | 17 | 25,02946(28)# | 5,2×10−8s | n | 24O | (3/2+)# |
| 26O | 8 | 18 | 26,03834(28)# | 4,0×10−8s | β− | 26F | 0+ |
| n | 25O | ||||||
| 27O | 8 | 19 | 27,04826(54)# | < 260 ns | n | 26O | (3/2+)# |
| 28O | 8 | 20 | 28,05781(64)# | < 260 ns | n | 27O | 0+ |
Quimia e proprietats dei compausats oxigenats[modificar|Modificar lo còdi]
En causa de sa reactivitat, l'oxigèn es susceptible de formar de compausats amb mai d'un autreelement.Sonestat d'oxidacioni es sovent egau a -2 car sonelectronegativitatauta li permet d'atraire fòrtament leiselectronsdeis autreisatòms.Pasmens, se tròba tanben l'estat -1 dins leiperoxidse d'estats fòrça rars son estats identificats en certaneimoleculas(-1/2, -1/3, +1/2, +1 e +2).
Dioxigèn[modificar|Modificar lo còdi]
Dins leicondicions normalas de temperatura e de pression,lodioxigènO2es la forma pus frequenta de l'oxigèn.
Generalitats[modificar|Modificar lo còdi]

Lamoleculadedioxigènes formada de dosatòmsd'oxigèn liats per unliame quimicdoble que sonenergiaes relativament febla (498 kJ/mol) per un liame d'aqueu tipe. Conjugada amb una talha pichona (121 pm de longor), aquò li conferís una reactivitat relativament importanta, especialament amb lei materiauscombustibles,que mena generalament a la formacion d'oxids. De mai, explica lo caractèr exotermic de mai d'una reaccion implicant lo dioxigèn.
Au nivèu fisic, es una substància inodòra, incolòra e sensa gòst. Sonponch d'ebullicionse situa a 90,20K(-182,95°C) e sonponch de fusiona 54,36K(-218,79°C)[12].Sei formasliquidaesolidasonblavas.
Ròtle biologic[modificar|Modificar lo còdi]
Dins labiosfèraterrèstra,lodioxigèntèn dos ròtlesbiologicsfondamentaus dins lo foncionament dei mecanismes dauvivent.D'efiech, es present tant dins l'atmosfèra que dins lei mitans aqüatics gràcias a sei proprietats de solubilitat dins l'aiga(6,04 mL/L a 25 °C[13]). I participa a larespiraciondeivegetause deisanimaus.La premiera es liada a lafotosintèsie vetz la liberacion dedioxigènper una reaccion permetent ai plantas de produrre desucrea partir dedioxid de carbòni,d'aigae delutz:
- 6 CO2+ 6 H2O +fotons→ C6H12O6+ 6 O2
La segonda pertòca la respiracion animala qu'es una reaccion globalament contrària a la fotosintèsi e qu'entraïna la liberacion dedioxid de carbònie d'energiaa partir dedioxigène desucre:
- C6H12O6+ 6 O2→ 6 CO2+ 6 H2O + 2 880 kJ/mol
Ozòn[modificar|Modificar lo còdi]

L'ozòn(òtrioxigèn) es una substància de formula quimica O3qu'es formada de tresatòmsd'oxigèn. Satemperaturadeliquefacciones de 161,3K(−111,9°C) e sa temperatura de solidificacion de 80,7K(−192,5°C).Blauclar a l'estatgasós, esblausorn sota formaliquidaerogeporpresota formasolida.A unaodorsimilara a l'aiga de javèle es ungastoxic(CL50de 8 a 12 mg/m3),corrosiuecomburant[14].
Descubèrt en1789per loquimistaolandésMartin van Marum(1750-1837), es naturalament present dins l'atmosfèra terrèstra.I es generalament produch per l'accion de raionamentsultravioletsò de correntselectricssus demoleculasdedioxigèn.Sa concentracion es maximala entre 20 e 40kmd'altitudonte forma un jaç protector còntra lo raionament solar. Pasmens, existís d'autrei procès de formacion implicant de polluents eissits de la combustion decarburants fossils.Relativament instable, l'ozòna una durada d'existéncia febla e se descompausa per tornar formar dedioxigèn.
Dins l'industria,l'ozòn es utilizat per sei proprietats oxidantas e desinfectantas, especialament per produrre d'aigapotablae per tractar d'aigas corrumpudas. Dins aqueu domeni, son instabilitat es un avantatge important car laissa pas de traças de produchs de tractament dins l'aiga.D'utilizacions segondàrias existisson enmedecina(coma desinfectant), enbugadariá,enpapetariá(coma agent de blanquiment) e enquimia(dins certanei sintèsis).
Tetraoxigèn[modificar|Modificar lo còdi]
Lotetraoxigènes una espècia quimica de formula O4qu'es compausada de quatreatòmsd'oxigèn. Suggerida en1924per explicar certanei proprietats daudioxigènliquid,son existéncia foguèt confiermada per d'observacions realizadas entre1999e2006.Es unamoleculainstabla que sa formacion necessita de pressions d'au mens 20 GPa. Son estructura es encara mau determinada.
Aiga[modificar|Modificar lo còdi]

L'aigaes una substànciaquimicaconstituïda de dosatòmsd'idrogène d'unatòmd'oxigèn. SusTèrra,es presenta sotasei tres formas(solida,liquidaegasosa) car sei ponchs de solidificacion e de vaporizacion son respectivament de 0°Ce de 100°C.Relativament estable, presenta pasmens unareactivitatimportanta e es egalament un bònsolventper lei compausatspolars.Es tanben susceptibla de formar aisament deliames idrogèn[15].
L'aigaes una substància indispensabla a lavidaterrèstra.D'efiech, es lo constituent majoritari de la màger part deisespèciasconegudas amb unpercentatgemassicmejan de 60% en leisanimause de 75% en leivegetaus[16][17].
Leis utilizacions e aplicacions de l'aigason innombrablas en causa de sei proprietatsfisicoquimicasebiologicas.La pus importanta es son utilizacion coma bevenda tant que per leisumansque per leisanimausdomestics.Es tanben força utilizada per leisagricultorsqu'an besonh d'aigatge.Enfin, a mai d'un usatge dins la vida vidanta e dins l'industriaonte pòu servir de reactiu, de solvent, de liquid de refrejament... etc.
Dioxid de carbòni[modificar|Modificar lo còdi]

Lodioxid de carbònies una espècia quimica de formula CO2qu'es compausada d'unatòmdecarbònie de dosatòmsd'oxigèn. Dins lei condicionsatmosfericasterrèstras,a ges de fasaliquida.Satemperatura de sublimaciones de −78,48°C(194,7K). Inodòr e incolòr, a una savor cosenta. Au contrari d'una opinion populara frequenta, satoxicitates nulla mai, coma totei lei gas, pòu causar d'asfixiasen l'abséncia dedioxigèn[18].
Lodioxid de carbònia un ròtlebiologicimportant qu'es consumat per lei plantas per produrre sabiomassaa partir de lafotosintèsie qu'es regitat per leisanimaus.De mai, sa preséncia dins l'atmosfèra congrea un efiech de sắc rra que permet de la rescaufar en aumentant satemperatura.Dins aquò, dempuei lo sắc gle XIX e la consumacion generalizada decombustibles fossils,sa concentracion es venguda tròp importanta entraïnant una aumentacion de latemperaturaglobala (rescaufament climatic).
Dins l'industria,es subretot utilizat per la produccion d'engraise per l'industria petroliera afin de facilitar l'esplecha de jaciments d'idrocarburs.Leis aplicacions segondàrias son fòrça variadas. Sota forma gasosa, lo dioxid de carbòni pòu èsser utilizat enagriculturaper favorizar la creissença dei plantas ò en seguretat coma agent d'extincion deifuòcs.Sa forma liquida pòu èsser utilizada comacaloportairee sa forma solida pòu servir de refrigerant. Enfin, dins son estat supercritic, es utilizat coma agent d'extraccion enquimia(per exemple, per descafeïnar locafè).
Oxids[modificar|Modificar lo còdi]

Unoxides un compausat associant l'oxigèn amb unelementmenselectronegatiu.Lo nombre d'oxidacion de l'oxigèn i es egau a -2. Son de substàncias força frequentas a la superficiaterrèstra.Per exemple, es lo cas d'un nombre important deminerauscoma locorindon(oxid d'aluminiAl2O3) ò loqüars(dioxid de siliciSiO2). L'aigae lodioxid de carbòni,compausats primordiaus dei mecanismes dauvivent,son pereu d'oxids.
Una proprietat de remarca deis oxids es sa capacitat de reagir amb l'aigaper formar d'acids.La quimia deis oxids es pron reducha. D'efiech, sa preparacion es relativament aisada car necessita sovent de grasilhar una substància en preséncia d'aire.De tractaments quimics ulteriors son possibles per eliminar d'impuretats. Pasmens, lo problema per leiquimistases generalament pas de fabricar d'oxidsmai d'asssegurar sa transformacion. En particular, aquela question es centrala dins lei procès demetallurgiadestinats a produrre demetauspurs.
Leis utilizacions deisoxidsson variadas en causa de sa gròssa diversitat. Pasmens, es possible de destriar dos ensems. Dins lo premier, se tròban leisoxidsaguent de proprietats materialas interessentas (materiaus de construccion,semiconductors,catalizairesquimics...). Lo segond gropa leisoxidsservissent dereactius ò d'intermediarisdins de procès quimics (preparacion demetaus,sintèsiorganica...).
Compausats organics[modificar|Modificar lo còdi]
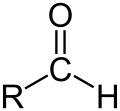
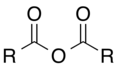
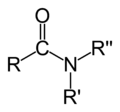
L'oxigèn es unelementforça present dins lei compausatsorganics.Entre lei pus importants, se pòdon citar leisalcòlsR–OH, leisaldeïdsR–CO–H, leicetonasR–CO–R, leisacids carboxilicsR–COOH, leisestèrsR–COO–R, leisanidrids d'acidR–CO–O–CO–R e leisamidsR–C(O)–NR2.Divèrseisolventsorganicscontènon tanben d'oxigèn coma lofenòl,loDMFò loDMSO.
Produccion[modificar|Modificar lo còdi]
La produccion d'oxigèn se fa sota la forma dedioxigèn.Plusors procès existisson segon lei besonhs e lei luòcs. Lei metòdesindustriausprincipaus son:
- ladestillaciond'aireliquefiat que permet d'evaporar dediazòtgasós e de gardar dedioxigènliquid.
- l'adsorpcion per inversion de pressionque permet de separar lodiazòte lodioxigènde l'airegràcias a de modificacion de pression e de cambis amb dezeolits.
L'electroliside l'aigaes pereu un mejan d'obtenir dedioxigèn.Per aquò, es necessari d'utilizar un corrent continú que permet de recuperar de dioxigèn a unelectròdee dediidrogèna l'autre[19].Es possible de melhorar lo procès en realizant l'electrolisi de mesclas d'oxidse d'oxoacids.
Enfin, de dispositius son estats concebuts per produrre dedioxigèndins de situacions d'urgéncia (sosmarinsen dificultat, minaires blocats per un afondrament...). Son basats sus dereaccionsde descomposicion de superoxids coma loclorat de sòdiNaClO3,loperoxid de bariBaO2e loperclorat de potassiKClO4.
Liames intèrnes[modificar|Modificar lo còdi]
Bibliografia[modificar|Modificar lo còdi]
- (en)Gerhard A. Cook e Carol M. Lauer,"Oxygen"dinsThe Encyclopedia of the Chemical Elements,Reinhold Book Corporation,1968,pp. 499-512.
- (en)John Emsley,"Oxygen",Nature's Building Blocks: An A-Z Guide to the Elements,Oxford University Press, 2001, pp. 297–304.
- (en)Peter H. Raven, Ray F. Evert e Susan E. Eichhorn,Biology of Plants (7th ed.),W. H. Freeman and Company Publishers, 2005, pp. 115-127.
Nòtas e referéncias[modificar|Modificar lo còdi]
- ↑(en)Joseph Jastrow,Story of Human Error,Ayer Publishing, 1936, p. 171.
- ↑(fr)Didier Kahn,« Le Tractatus de sulphure de Michaël Sendivogius (1616), une alchimie entre philosophie naturelle et mystique »,dins Claude Thomasset (éd.),L’Écriture du texte scientifique au Moyen Âge,Presses de l’Université de Paris-Sorbonne,2006,pp. 193-221.
- ↑(en)Gale Thomson,World of Chemistry contributors,article"John Mayow",2005.
- ↑(en)John Emsley,"Oxygen",Nature's Building Blocks: An A-Z Guide to the Elements,Oxford University Press, p. 299.
- ↑Diguèt logasnovèu « aire deflogisticat ».
- ↑(fr)Antoine Lavoisier,Traité élémentaire de chimie,edicion de 1864, p. 48.
- ↑(en)Daintith, John,Biographical Encyclopedia of Scientists,CRC Press,1994,p. 707.
- ↑L'abondància de l'oxigèn dins l'atmosfèrade laTèrraes una particularitat liada a la preséncia d'unabiosfèraactiva. Per exemple, l'atmosfèra deMartne'n contèn que 0,1%.
- ↑(en)Gerhard A. Cook, Carol M. Lauer,The Encyclopedia of the Chemical Elements,article"Oxygen",Reinhold Book Corporation,1968,p. 500.
- ↑(en)B. S. Meyer,Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen,dinsWorkgroup on Oxygen in the Earliest Solar System,Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute,Gatlinburg,2005.
- ↑Isotòps estables en gras.
- ↑(en)David R. Lide,"Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements",CRC Handbook of Chemistry and Physics (84th ed.),CRC Press, 2003.
- ↑Aquela valor aumenta quand latemperaturademenís.
- ↑(fr)INRS, Fiche toxicologique n°43 « Ozone », consultada lo 23 de genier de2020,[1]
- ↑(en)W. L. Jorgensen e J. D. Madura,"Temperature and size dependence for Monte Carlo simulations of TIP4P water",Mol. Phys.,1985,56(6): 1381.
- ↑Dins aquò, de formas devidaexistisson onte l'aigaes un constituent minoritari. Per exemple, es lo cas deigranasque ne'n contènon generalament 10%.
- ↑En l'òme,lo taus mejan es de 65% per un individuadult.
- ↑(fr)INRS, Fiche toxicologique n°238 « Dioxyde de carbone », consultada lo 22 de genier de2020,[2]
- ↑Un corrent alternatiu entraïna la formacion d'una mescla forçaexplosivadediidrogène dedioxigèn.