Glicyna
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C2H5NO2 | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
H | ||||||||||||||||||||||||||||||||||
| Masa molowa |
75,07 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały, krystaliczny proszek[1],o słodkawym smaku[2] | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS |
56-40-6 | ||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego(25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
Glicyna(łac.acidum aminoaceticum), skr.Gly,G –organiczny związek chemiczny,najprostszy spośród 20 standardowychaminokwasów białkowych,jedyny niebędącyczynny optycznie[2].Za jej pojawienie się włańcuchu polipeptydowymodpowiada obecnośćkodonówGGU, GGC, GGA lub GGG w łańcuchumRNA.
Można ją otrzymać sztucznie w reakcjikwasu chlorooctowegozamoniakiem[2].
- ClCH2COOH + 2NH3→ H2NCH2COOH + NH4Cl
Struktura i właściwości
[edytuj|edytuj kod]Glicyna posiada najmniejszą resztę aminokwasową, z jednym tylko atomem wodoru włańcuchu bocznym.Ze względu na to, że z atomemwęglaα związane są dwa atomywodoru,glicyna – w przeciwieństwie do innych aminokwasów – nie jestoptycznie czynna.Glicyna zalicza się do grupy aminokwasówniepolarnychalifatycznych.
W trakcieewolucjidywergentnej (rozbieżnej) reszty glicyny zmieniają się znacznie rzadziej niż pozostałych aminokwasów, a gdy już ulegają mutacji w białkach homologicznych, to na takie reszty jakalanina,seryna,kwas asparaginowylubasparagina.Ta konserwatywność w występowaniu glicyny wiąże się z jej niewielkimi rozmiarami – zmiana tego aminokwasu na inny, z większym łańcuchem bocznym, mogłaby zaburzyć strukturę przestrzenną białka i pozbawić to białko jego funkcji biologicznej.
Glicyna stanowi średnio około 7,2% reszt aminokwasowych występujących w białkach[6].Wyjątkiem jestkolagen,w którym glicyna stanowi blisko jedną trzecią wszystkich budujących go aminokwasów.
Glicyna jestaminokwasem endogennym.
Objętość van der Waalsa 48 ų.
Funkcja fizjologiczna
[edytuj|edytuj kod]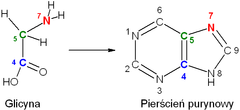
[Na schemacie nie pokazano atomów wodoru znajdujących się przy atomach węgla C2, C6 i C9 w pierścieniu pirymidynowym]
- Glicyna jako samodzielny aminokwas występuje przede wszystkim w roliprzekaźnikawośrodkowym układzie nerwowym(CNS). Działa jako hamujący przekaźnikreceptorów glicynowych,a ponadto jako koagonista kluczowy do aktywacjireceptorów NMDA.Stężenie glicyny w CNS jest wyższe wrdzeniu przedłużonym,mościeorazrdzeniu kręgowym,natomiast niższe wpółkulach mózgowychorazmóżdżku.
- Wperoksysomachhepatocytówglicyna ulega sprzęgnięciu z pierwotnymikwasami żółciowymi,tworząc w ten sposób sole żółciowe.
- Glicyna bierze udział w biosynteziepurynde novo,w trakcie której zostaje wbudowana do pierścienianukleotydowego,będąc źródłem węgli C4 i C5 oraz azotu N7 w tym pierścieniu.
- LD50dla glicyny wynosi 7930 mg/kg (szczury, podawana ustnie), natomiast śmierć następuje zazwyczaj na skutek wzmożonej pobudliwości.
Biosynteza
[edytuj|edytuj kod]
Ludzki organizm potrafi syntetyzować glicynę, dlatego nazywa się ją aminokwasem endogennym. Glicyna może być produkowana: z glioksalanu iglutaminianuprzez aminotransferazę glutaminianową; zalaninyprzez aminotransferazę alaninową. Ważnym sposobem syntezy glicyny u ssaków jest także synteza zcholinyorazseryny.
Degradacja glicyny
[edytuj|edytuj kod]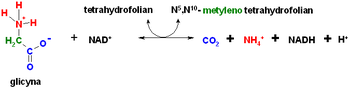
Glicyna ulega degradacji na drodze trzechszlaków metabolicznych.
- Glicyna może ulec przekształceniu w serynę. Reakcję katalizuje hydroksymetylotransferaza serynowa, akoenzymamireakcji sątetrahydrofolianorazfosforan pirydoksalu.
- Degradacja glicyny może zachodzić także wwątrobieza pomocąmitochondrialnegokompleksu syntazy glicynowej,który rozkłada glicynę nadwutlenek węglaijon amonowy,przy okazji tworzącN5,N10-metylenotetrahydrofolian.Kofaktoremtego procesu jestfosforan pirydoksalu.Ta ścieżka metaboliczna ma olbrzymie znaczenie dlassaków,a jej zaburzenia mogą prowadzić do hiperglicynemii.
- Trzecim sposobem degradacji glicyny jestutlenienieprzezoksydazęD-aminokwasów.Glicyna zostaje przekształcona doglioksalanu,który z kolei jest utleniany w NAD+-zależnej reakcji doszczawianu.
Ponadto glicyna ulega licznym przemianom w innemetabolity,co zostało opisane w podrozdziale dotyczącym jej funkcji.
Choroby związane z przemianami glicyny
[edytuj|edytuj kod]Z metabolizmem glicyny związane są następujące schorzenia:
- Glicynuria– wynika z zaburzeń reabsorpcji glicyny wkanalikach nerkowychi polega na wydalaniu większych niż normalnie ilości tego aminokwasu.
- Pierwotna hiperoksaluria– jest to zaburzeniekatabolizmuglioksalanu,który powstaje przez deaminację glicyny. Następujące po tym utlenienie glioksalanu do szczawianu skutkujekamicą moczowąorazwapnicą nerek,a także może prowadzić do przedwczesnych zgonów na skutek niewydolności nerek lubnadciśnienia.
- Nieketonowa hiperglicynemia–choroba genetycznapowodująca nagromadzenie się glicyny wekrwiorazpłynie mózgowo-rdzeniowym.
Zastosowanie w lecznictwie
[edytuj|edytuj kod]Glicyna jest wykorzystywana do zwiększania skutecznościleków przeciwpsychotycznychzawierającychkwas glutaminowy.Choć sama w sobie nie ma działania psychotropowego, to jednak wzmacnia efekty działania glutaminianu w mózgu (zgodnie zhipotezą glutaminową). Przyłącza się doreceptora NMDAwraz z glutaminianem i pokonujebarierę krew-mózg[7].
Występowanie glicyny w przestrzeni międzygwiazdowej
[edytuj|edytuj kod]W roku 1994 grupa badaczy zUniversity of Illinoispod kierownictwem Lewisa Snydera ogłosiła wstępnie odkrycie glicyny wprzestrzeni międzygwiazdowej,jednak późniejsze badania nie potwierdziły ich przypuszczeń[8].
Dziewięć lat później, w 2003 roku, Yi-Jehng Kuan zNational Taiwan Normal Universitywraz ze Steve’em Charlneyem zNASAponowili to doniesienie. Badacze monitorowalifale radiowepod kątem obecnościlinii spektralnychcharakterystycznych dla glicyny, których zarejestrowali w sumie 27. Kuan i Charlney wysunęlihipotezę,że glicyna międzygwiazdowa powstała z prostych cząsteczek organicznych uwięzionych w lodzie na skutek ekspozycji nanadfiolet[9].
W roku 2004 Snyder wraz ze współpracownikami opublikowali pracę, w której próbowali określić obiektywne kryterium, które powinny spełniać rejestrowane linie spektralne, aby można było mówić o potwierdzonym odkryciu glicyny w przestrzeni międzygwiazdowej. Uznali jednocześnie, że żaden z rezultatów uzyskanych przez grupę Kuana nie spełnia tego kryterium[10].
W roku 2009 dzięki misji NASAStardustostatecznie potwierdzono występowanie glicyny w przestrzeni kosmicznej pobierając próbki z kometyWild 2[11].
W 2016 roku ogłoszono, że sondaRosettaodkryła glicynę w komie komety67P/Czuriumow-Gierasimienkopodczas pomiarów za pomocą spektrometru masowego ROSINA w latach 2014–2015.[12]
Tzw. glicyna fotograficzna
[edytuj|edytuj kod]W fotografii terminem „glicyna” określa się typwywoływacza fotograficznegozawierającegopochodnąglicyny,N-(4-hydroksyfenylo)glicynę.
Przypisy
[edytuj|edytuj kod]- ↑abFarmakopea Polska VIII,Polskie Towarzystwo Farmaceutyczne, Warszawa:Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych,2008, s. 3491,ISBN978-83-88157-53-0.
- ↑abcPodręczny słownik chemiczny,RomualdHassa(red.),JanuszMrzigod(red.),JanuszNowakowski(red.), Katowice: Videograf II, 2004, s. 147–148,ISBN83-7183-240-0.
- ↑abcdeGlicyna.[martwy link]The Chemical Database. Wydział ChemiiUniwersytetu w Akronie.[dostęp 2012-09-01].(ang.).[niewiarygodne źródło?]
- ↑abGlycine,[w:] ChemIDplus [online],United States National Library of Medicine[dostęp 2012-09-01](ang.).
- ↑Glycine,[w:]DrugBank[online],University of Alberta,DB00145(ang.).
- ↑Nelson D., Cox M.,Lehninger Principles of Biochemistry,wyd. 4, 2005, W.H. Freeman & Co.
- ↑JamesKalat,Biologiczne podstawy psychologii,2004.
- ↑Rachel Nowak:Amino acid found in deep space.[w:]New Scientist[on-line]. newscientist.com, 2002-07-18. [dostęp 2016-10-16].
- ↑
 Yi-Jehng Kuan and Steven B. Charnley and Hui-Chun Huang and Wei-Ling Tseng and Zbigniew Kisiel.Interstellar Glycine.„The Astrophysical Journal”. 593 (2), s. 848–867, 2003.DOI:10.1086/375637.
Yi-Jehng Kuan and Steven B. Charnley and Hui-Chun Huang and Wei-Ling Tseng and Zbigniew Kisiel.Interstellar Glycine.„The Astrophysical Journal”. 593 (2), s. 848–867, 2003.DOI:10.1086/375637.
- ↑
 L. E. Snyder and F. J. Lovas and J.M. Hollis and D. N. Friedel and P. R. Jewell and A. Remijan and V. V. Ilyushin and E. A.A Rigorous Attempt to Verify Interstellar Glycine.„The Astrophysical Journal”. 619 (2), s. 914–930, 2005.DOI:10.1086/426677.
L. E. Snyder and F. J. Lovas and J.M. Hollis and D. N. Friedel and P. R. Jewell and A. Remijan and V. V. Ilyushin and E. A.A Rigorous Attempt to Verify Interstellar Glycine.„The Astrophysical Journal”. 619 (2), s. 914–930, 2005.DOI:10.1086/426677.
- ↑Maggie McKee:Found: first amino acid on a comet.[w:]New Scientist[on-line]. newscientist.com, 2009-08-17. [dostęp 2016-10-16].
- ↑
 Kathrin Altwegg, Hans Balsiger, Akiva Bar-Nun, Jean-Jacques Berthelier, Andre Bieler.Prebiotic chemicals–amino acid and phosphorus–in the coma of comet 67P/Churyumov-Gerasimenko.„Science Advances”. 2 (5), s. e1600285, 2016.DOI:10.1126/sciadv.1600285.
Kathrin Altwegg, Hans Balsiger, Akiva Bar-Nun, Jean-Jacques Berthelier, Andre Bieler.Prebiotic chemicals–amino acid and phosphorus–in the coma of comet 67P/Churyumov-Gerasimenko.„Science Advances”. 2 (5), s. e1600285, 2016.DOI:10.1126/sciadv.1600285.
Bibliografia
[edytuj|edytuj kod]- Nelson D., Cox M.,Lehninger Principles of Biochemistry,wyd. 4, 2005, W.H. Freeman & Co.
- Murray R.K. et al.,Harper’s Ilustrated Biochemistry,wyd. 26, 2003, Lange Medical Books.
- Encyclopedia of Biological Chemistry,Lenarz W.J., Lane M.D. (red.), 2004, Elsevier.
- Berg J.M., Tymoczko J.L., Stryer L.,Biochemistry,wyd. 5, 2002, W.H. Freeman & Co.
Linki zewnętrzne
[edytuj|edytuj kod]- Szlaki metaboliczne glicyny– baza danych Uniwersytetu w Kyoto
- Szlaki metaboliczne glicyny 2– baza szlaków metabolicznych MetaCyc




