Kwas nadchlorowy
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny |
HClO4 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
HOClO3 | ||||||||||||||||||||||
| Masa molowa |
100,46 g/mol | ||||||||||||||||||||||
| Wygląd |
przezroczysta, bezbarwna ciecz[1] | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Inneaniony | |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Pochodne sole | |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego(25 °C, 1000 hPa) | |||||||||||||||||||||||
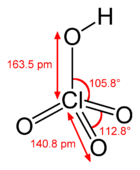
Kwas nadchlorowy,nazwa Stocka:kwas chlorowy(VII),HClO
4–nieorganiczny związek chemiczny,jeden z najsilniejszychkwasów tlenowych.Chlorznajduje się w nim na VIIstopniu utlenienia;jest to najtrwalszy kwas tlenowy tego pierwiastka[2].Jegobezwodnikiemjesttlenek chloru(VII),Cl
2O
7.
Otrzymywanie
[edytuj|edytuj kod]Rozcieńczony kwas nadchlorowy można otrzymać przez działanie stężonymkwasem siarkowymnanadchlorany[2],na przykładnadchloran sodu:
- NaClO
4+ H
2SO
4→NaHSO
4+ HClO
4
Właściwości
[edytuj|edytuj kod]Kwas nadchlorowy to oleista, bezbarwna i bezwonna ciecz, którejgęstośćw warunkach normalnych wynosi 1,76 g/cm³. Miesza się on z wodą bez ograniczeń tworząc z niąazeotropo temperaturze topnienia −18 °C i temperaturze wrzenia 200 °C (zawartośćHClO
4w azeotropie to ok. 72,5%). Czysty kwas topi się w −112 °C i rozkłada się w 150 °C przed osiągnięciem temperatury wrzenia. Łatwo ulega wybuchowemu rozkładowi już w niższych temperaturach w obecności śladów substancji organicznych i większości metali. Stężony kwas nadchlorowy jest silniehigroskopijny.
Kwas nadchlorowy jest silnymutleniaczem.Należy on do najsilniejszych znanych kwasów (jest zaliczany do tzw.superkwasów) i jako taki jest substancją silnie żrącą. JegopKaszacuje się jako −7.
Sole kwasu nadchlorowego tonadchlorany.Z wyjątkiem nadchloranówpotasu,rubidu,cezuiamonusą one bardzo dobrze rozpuszczalne w wodzie.
Zastosowanie
[edytuj|edytuj kod]Niewielką rozpuszczalnośćnadchloranu potasuwykorzystuje się wchemii analitycznej,wytrącając potas kwasem nadchlorowym w postaci trudno rozpuszczalnego związku. Ponadto kwas nadchlorowy jest używany w analizie chemicznej do usuwania materiałów pochodzenia organicznego np. z próbek przeznaczonych do analizy zawartościmetali ciężkich.Spośród soli tego kwasu największe zastosowanie mająnadchloran amonuinadchloran magnezu.
Handlowo dostępny kwas nadchlorowy ma stężenie 60–70%.
Przypisy
[edytuj|edytuj kod]- ↑abcFarmakopea Polska X,Polskie Towarzystwo Farmaceutyczne, Warszawa:Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych,2014, s. 4276,ISBN978-83-63724-47-4.
- ↑abcdPodręczny słownik chemiczny,RomualdHassa(red.),JanuszMrzigod(red.),JanuszNowakowski(red.), Katowice: Videograf II, 2004, s. 210,ISBN83-7183-240-0.
Bibliografia
[edytuj|edytuj kod]- AdamBielański,Podstawy chemii nieorganicznej,t. 2, Warszawa:Wydawnictwo Naukowe PWN,2002, s. 574–578,ISBN83-01-13817-3.