Nikiel
| kobalt← nikiel →miedź | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| srebrzystobiały | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Widmo emisyjneniklu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa, symbol,l.a. |
nikiel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stopień utlenienia |
II,III | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości metaliczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwościtlenków | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan skupienia |
stały | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gęstość |
8908kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia |
1455 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura wrzenia |
2913 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą warunków normalnych (0 °C, 1013,25 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nikiel(Ni,łac.niccolum) –pierwiastek chemicznyoliczbie atomowej28. Jest biało-srebrzystymmetalemo lekkim złotym zabarwieniu. Nikiel należy do grupymetali przejściowych,charakteryzuje się typową dla tej grupy metali twardością iciągliwością.Czysty nikiel wykazuje stosunkowo dużą aktywność chemiczną, która jest szczególnie widoczna kiedy metal jest w postaci proszku[7],co zwiększa powierzchnię, na której zachodzi reakcja. W większych bryłach metalu, w temperaturze pokojowej jest mało aktywny chemicznie, reaguje on powoli zpowietrzemze względu natworzeniesię ochronnej warstwytlenkowejna powierzchni[8].Jest jednak na tyle podatny nautlenianie,że wskorupie ziemskiejnie występuje on wpostaci rodzimej,wyjątkiem sąmeteorytyżelazowo-niklowe, w których występuje w postacistopuz żelazem. Uważa się, że stop żelazowo-niklowy znajduje się wjądrze Ziemi[9].Ze względu na powolne tempo utleniania w temperaturze pokojowej uznaje się go za metal odporny nakorozję.Dawniej stosowany był doplaterowaniażelaza imosiądzustosowanego w aparaturze chemicznej, a także w pewnych stopach utrzymujących połysk, jaknowe srebro.
Nikiel jest jednym z czterech pierwiastków (obokżelaza,kobaltuigadolinu), które sąferromagnetykamiw temperaturze pokojowej.Trwałe magnesywykonane zalniko,zawierające do 26% niklu, są pod względem mocy pomiędzy magnesami trwałymi opartymi nażelazie,a magnesami opartymi nametalach ziem rzadkich.Metal jest głównie używany do produkcji stopów; około 60% światowej produkcji jest używane w produkcjistali nierdzewnej.Inne stopy inadstopystanowią większość pozostałych zastosowań niklu, a tylko ok. 3% światowej produkcji jest wykorzystywana do produkcji związków. Pierwiastek ma wiele niszowych zastosowań, takich jakkatalizatorwhydrogenacji,produkcji soli używanych wgalwanotechniceczy barwieniuceramiki[7].
Właściwości
[edytuj|edytuj kod]Właściwości fizyczne i atomowe
[edytuj|edytuj kod]Nikiel jest srebrzysto-białym metalem z delikatnym złotym odcieniem charakteryzujący się bardzo wysokim połyskiem. Należy dometali przejściowych,który jest twardy iciągliwy.Jest jednym z czterech metali będącychferromagnetykamiw pobliżu temperatury pokojowej (inne tożelazo,kobaltigadolin). Jegotemperatura Curiewynosi 355 °C (powyżej tej temperatury staje sięparamagnetykiem). Komórka sieciowa niklu jest ściennie-centrowanym sześcianem z parametrem sieci przestrzennej na poziomie 0,352 nm, co dajepromień atomowy0,124 nm.Sieć krystalicznajest stabilna do ciśnienia 70 GPa.Ma 29izotopówz przedziału mas 50–78, z których 5 (58, 60, 61, 62, 64) jest trwałych.
Konfiguracja elektronowa
[edytuj|edytuj kod]Atom niklu ma dwie konfiguracje [Ar] 3d84s2i [Ar] 3d94s1,(symbol [Ar] odnosi się dostruktury elektronowejargonu), które są bardzo bliskie siebie energetycznie. Co do jedynej konfiguracji elektronowej niklu toczy się dyskusja, gdyż struktura [Ar] 4s23d8,która może być również zapisana jako [Ar] 3d84s2,jest zgodna zregułą Madelunga (Hunda),która przewiduje, że 4s jest zapełniona przed 3d. Stwierdzenie to wsparte jest wynikami doświadczalnymi, które potwierdzają, że najniższy stan energetyczny atomu niklu występuje przy 3d84s2,a szczególnie przy 3d8(3F,J= 4 poziom). Średnia energia konfiguracji [Ar] 3d94s1jest w rzeczywistości niższa niż średnia energia stanu konfiguracji [Ar] 3d84s2Z tego powodu przyjmuje się stan podstawowy konfiguracji atomu niklu jako [Ar] 3d94s1[10].
Izotopy
[edytuj|edytuj kod]Izotopyniklu posiadają zakresmasy atomowejod (48Ni) do 78 u (78Ni). Naturalnie występujący nikiel składa się z pięciu stabilnych izotopów:58Ni,60Ni,61Ni,62Nii64Ni,z58Ni,który jest najbardziej rozpowszechnionym izotopem niklu (68,077% występowania w naturze). Izotopy niklu cięższe niż 62 u nie mogą być wytworzone na drodzefuzji jądrowejbez utraty energii.Nikiel-62ma najwyższą średniąenergię jądrowąwiązanianukleonuwnuklidzie– 8,7946 MeV/nukleon. Jego energia wiązania jest wyższa niż energie wiązania izotopów żelaza 56 i 58, które błędnie uważa się za najmocniej związane nuklidy[11].
Stabilny izotop Ni-60 jestproduktem rozpaduwygasłego radionukliduFe-60 (czas półtrwania2,6 mln lat). Ponieważ Fe-60 ma długi okres półtrwania, jego obecność w materiale zUkładu Słonecznegomoże tworzyć obserwowalne zmiany w składzie izotopowym Ni-60. Stąd też zawartość Ni-60 w materiale pozaziemskim może dostarczać wskazówek co do genezy i kształtowania się Układu Słonecznego.
Scharakteryzowano 18radioizotopówniklu, spośród których najtrwalszymi są; nikiel-59 o okresie półtrwania 76 tysięcy lat, nikiel-63 – 100,1 lat, i nikiel-56 – 6,077 dnia.Pozostałe radioizotopy nie są trwalsze niż 60 godzin, z czego większość posiada okres półtrwania krótszy niż 30 sekund[12].Radioaktywny nikiel-56 jest produkowany w procesie „spalania” krzemu w gwiazdach oraz późniejsze uwolnienie go wwybuchusupernowej typu Ia.Krzywa blaskutych supernowych w środkowym i końcowym okresie odpowiada rozpadowi poprzezwychwyt elektronuniklu-56 do kobaltu-56 i ostatecznie dożelaza-56.
Nikiel-59 znalazł zastosowanie wgeochemii izotopowej,między innymi dodatowaniaziemskiego wieku meteorytów i określania zawartości pozaziemskiego pyłu w lodzie i osadach. Nuklid Ni-48, odkryty w 1999 roku jest najbogatszym wprotonyciężkim izotopem. Z 28 protonami i 20neutronamiNi-48 jestpodwójnie magicznyi stąd wyjątkowo stabilny[13].
Właściwości chemiczne
[edytuj|edytuj kod]Nikiel w związkach występuje najczęściej na II, rzadziej na IIIstopniu utlenienia.Tworzy szeregzwiązków kompleksowych,takich jakniklocenczyfosfinyikarbonylkiniklu, które znalazły zastosowanie jakokatalizatory.Na kompleksach niklu oparte są katalizatorypolimeryzacjipolietylenuwysokociśnieniowego.
Właściwości biologiczne
[edytuj|edytuj kod]Nikiel jestmikroelementem.Znanych jest osiem[14]enzymówzawierających go wcentrum aktywnym.Jego minimalne, dzienne dobowe spożycie wynosi 0,3 mg.
U niektórych osób kontakt z przedmiotami zawierającymi nikiel prowadzi do stanów zapalnych, w tym doalergii[15].
Historia
[edytuj|edytuj kod]Mimo że nikiel został wyizolowany i sklasyfikowany dopiero w 1751 roku wykazano, że był wykorzystywany od niepamiętnych czasów. Obecność niklu w przedmiotach metalowych była przypadkowa. Wchodzi w skład niektórych wczesnychartefaktachwykonanych zbrązuimiedzi.Najwcześniejsze znalezisko zawierające 2,73% niklu datowane jest na ok. 3500–3100 r. p.n.e. (niektóre źródła wskazują nawet na 4600–4100 r. p.n.e.[16]) i pochodzi z obszaruAntiochii[17].Inne starożytne artefakty, zawierające ponad 9% niklu zostały odnalezione na terenieMohendżo-Daro.Pierwszym znanym artefaktem wykonanym z meteorytu żelazowo-niklowego jest topór Yueh pochodzący z okresudynastii Shang(1600–1046 r. p.n.e.)[18][16].
Prawdopodobnie pierwszym świadomym zastosowaniem niklu było stosowanie go w stopie używanym do biciamonet.Pierwsze monety zawierające nikiel (pak-fong,pai-t'unglub biała miedź – opisana przez Du Halde w 1736) były używane wkrólestwach Chinw okresie ok. 700–220 r. p.n.e. WKrólestwie Greko-Baktryjskimmonety Euthydemus II, Pantaleon i Agathocles z okresu 200–195 r. p.n.e. były bite ze stopu zawierającego 18,5–20,9% Ni, 75,5–77,9% Cu, 1,6–1,7% Fe oraz innych domieszek. Nikiel w monetach pojawił się na nowo po przeszło 2000 lat i stosowany jest do dziś. W historii pojawiają się wzmianki o broni „pochodzącej z nieba”, co potwierdziły badania znalezisk. Znane są XV-wieczne egzemplarzemalajskichkrisówwykonanych zżelaza meteorycznego[19][20][21].Informacja o niklu pojawia się także w dziele „aes album”Libaviusaz 1597 r[17].
- Nikiel w historii
-
Harpun z kłanarwalaz ostrzem z meteorycznego żelaza
-
XIX-wieczne monety wykonane z niklu
Wzmianki o wydobywaniu niklu pochodzą z ok. XVI – XVII wieku odgórnikówsaksońskichz obszaruRudaw.Nazwę zawdzięcza próbom wydobywania i przetwarzanianikielinu(NiAs), uważanego za rudęmiedzi[22].Górnicy za brak miedzi w rudzie i za pogorszenie zdrowia (w wyniku obecnościarsenu) obwiniali złe duchy lub Old Nick'a. Nazywali tę rudękupper icell,kupfernickel,kupper nicklichten,co oznaczało diabelska lub fałszywa miedź[17].Nikiel, mimo że znany był już wcześniej, został odkryty i sklasyfikowany dopiero w 1751 roku przezAxela Fredericka Cronsedta,a nazwa pierwiastkanickelpojawiła się oficjalnie w 1754 w jego dzieleContinuation of Results and Experiments on the Los Cobalt Ore[17][22].Z powodu zanieczyszczenia próbka nie wykazywała ciągliwości (cecha charakterystyczna dla metali), więc Cronstedt zaklasyfikował nikiel dopółmetali[17].Właściwości czystego niklu zostały opisane[23]w 1804 roku przez J.B. Richtera. Pierwiastek został opisany „idealny”, „szlachetny” metal charakteryzujący się doskonałą ciągliwością, twardością i odpornością na korozję[17].Około 1830 roku stopy niklowo-miedziowe były znane pod nazwą „niemieckie srebro” (nowe srebro). Oprócz wyglądu przypominającegosrebrostopy te (o przybliżonym składzie 40% Cu, 32% Ni, 25%Zni 3% Fe) cechowała łatwość wytwarzania i odlewania. Był odporny na matowienie i był tani w produkcji[7].Wzrost wykorzystania niklu nastąpił od 1857, kiedyStany Zjednoczonewprowadziły do obiegu monetę zawierającą 12%; wkrótce inne kraje podążyły tym trendem. Mimo że czysty nikiel był produkowany na skalę przemysłową od 1838 do 1876 roku światowa produkcja niklu utrzymywała się na poziomie poniżej tysiącatonrocznie[7].Zapotrzebowanie gwałtownie wzrosło w latach 1870–1880, kiedy Henri Marbeau weFrancjii James Riley wSzkocjiopracowali dobrej jakości stopy żelazowo-niklowe i stal niklową[24]oraz powstały pierwsze niklowepowłoki galwaniczne.Wzrost wykorzystania niklu w przemyśle nastąpił od lat 90. XIX wieku kiedy stopy stalowo-niklowe były wykorzystywane w pancerzachokrętów[7]. W 1863 naNowej KaledoniiJuliusz Garnierodkrył złoża niklu (jakogarnieryt). Ta niewielka wyspa do 1905 roku była największym producentem niklu na świecie. Od roku 1905 do lat 50. XX wieku rolę tę przejęłaKanadadzięki wydobyciu w obszarzeniecki Sudbury.Nikiel w ilościach powyżej 20 tys. ton rocznie wydobywany jest w 15 krajach na świecie, a łączna roczna produkcja w roku 2016 wyniosła ponad 2,2 mln ton[25].
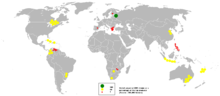
Występowanie
[edytuj|edytuj kod]Występuje w skorupie ziemskiej w ilości ok. 80ppmw postaciminerałówgarnierytipentlandyt.Rudy dzieli się na tlenkowe, siarczkowe i arsenkowe, w zależności od ich składu chemicznego.
W Polsce rudy niklu były wydobywane i przetwarzane wSzklarachdo 1982 roku.
Zastosowanie
[edytuj|edytuj kod]Nikiel wykorzystuje się głównie do pokrywania mniej szlachetnegożelazai stali (elektroliza), gdzie zwiększa wytrzymałość i odporność nakorozję.Stale takie wykorzystuje się w przemyśle samochodowym. Jego stopy z miedzią służą do produkcji monet.
Sieć krystaliczna niklu ma zdolnośćabsorpcjiatomów wodoru. W silnie rozdrobnionym metalu, znanym jakonikiel Raneya,może się zmieścić około 17 razy więcej wodoru niż wynosi jego objętość. Dzięki tej właściwości wykorzystywany jest jakokatalizatorw procesachredukcji,m.in. whydrogenizacji(chemicznym utwardzaniu) tłuszczów. Jest składnikiembaterii niklowo-kadmowych.
Nikiel bywa używany do produkcji oprawek okularów i taniej biżuterii.
Stopy na bazie niklu, żelaza i kobaltu nazywane sąnadstopami.Stosuje się je w przemyśle energetycznym ze względu na żaroodporność i małe pełzanie w wysokich temperaturach.
Uwagi
[edytuj|edytuj kod]- ↑Podana wartość stanowi przybliżoną standardową względną masę atomową (ang.abridged standard atomic weight) publikowaną wraz ze standardową względną masą atomową, która wynosi 58,6934 ± 0,0004. Duże różnice w składzie izotopowym tego pierwiastka w źródłach naturalnych nie pozwalają na podanie wartości masy atomowej z większą dokładnością. Zob.Prohaska i in. 2021 ↓,s. 584.
Przypisy
[edytuj|edytuj kod]- ↑abDavid R.Lide(red.),CRC Handbook of Chemistry and Physics,wyd. 90, Boca Raton: CRC Press, 2009, s.4-23,ISBN978-1-4200-9084-0(ang.).
- ↑nickel,[w:] Classification and Labelling Inventory,Europejska Agencja Chemikaliów[dostęp 2015-04-10](ang.).
- ↑Nickel (nr 266981)(ang.)– karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-10-05].(przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ThomasProhaskai inni,Standard atomic weights of the elements 2021 (IUPAC Technical Report),„Pure and Applied Chemistry”,94 (5), 2021, s. 573–600,DOI:10.1515/pac-2019-0603(ang.).
- ↑abcNickel: radii of atoms and ions.WebElements Periodic Table. [dostęp 2017-03-05].
- ↑Nikiel (nr 266981)– karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-10-05].(przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑abcdeDerek G. E. Kerfoot: Nickel. W:Ullmann's Encyclopedia of Industrial Chemistry.Wyd. 6. Wiley-VCH, grudzień 2002.DOI:10.1002/14356007.a17_157.ISBN978-3-527-30385-4.(ang.).
- ↑The Nickel Industry: Occurrence, Recovery, and Consumption. W: J.R. Davis:ASM Specialty Handbook: Nickel, Cobalt, and Their Alloys.ASM International, 2000.DOI:10.1361/ncta2000p003.ISBN0-87170-685-7.(ang.).
- ↑Geoffrey Brown:The Inaccessible Earth:An Integrated Approach to Geophysics and Geochemistry.Springer, 1993, s. 105.ISBN0-412-48160-X.(ang.).
- ↑Eric R. Scerri:The Periodic Table: Its Story and Its Significance.Oxford University Press, 2006, s. 239.ISBN978-1511398268.(ang.).
- ↑M.P. Fewell.The atomic nuclide with the highest mean binding energy.„American Journal of Physics”. 63 (7), s. 653–658, 1995.DOI:10.1119/1.17828.(ang.).
- ↑G.Audii inni,The Nubase evaluation of nuclear and decay properties,„Nuclear Physics A”, 729 (1), 2003, s. 3–128,DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑P.W.:Twice-magic metal makes its debut.23-10-1999. [dostęp 2017-08-06].(ang.).
- ↑Stephen W.Ragsdale,Nickel-based Enzyme Systems,„Journal of Biological Chemistry”, 284 (28), 2009, s. 18571–18575,DOI:10.1074/jbc.R900020200,PMID:19363030,PMCID:PMC2707248.
- ↑Nickel Allergic Contact Dermatitis (Ni-ACD) Gallery[online], Dermatitis Academy[dostęp 2017-09-02].
- ↑abE. Photos.The Question of Meteoritic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results.„World Archaeology”. 20 (3), s. 403–421, 1989.DOI:10.1080/00438243.1989.9980081.JSTOR:124562.
- ↑abcdefFrank Buller Howard-White:Nickel: An historical review.Methuen & Co., 1963.ISBN0-416-27220-7.(ang.).
- ↑Tim Brocato:sacrifices (Chinese module Virtual Exhibition Project).23 maja 2000. [dostęp 2013-02-02]. [zarchiwizowane ztego adresu].(ang.).
- ↑Edward Frey:The Kris: Mystic Weapon of the Malay World.Wyd. 3.Kuala Lumpur:Oxford University Press, Grudzień 2003, s. 33.(ang.).
- ↑The Kris – Blade of SE Asia.KBS System of Filipino Martial Arts. [dostęp 2013-02-02].(ang.).
- ↑Rozan Yunos, Bandar Seri Begawan:The kris: The traditional Malay weapon.The Brunei Times, 27 lipca 2008. [dostęp 2013-02-02]. [zarchiwizowane ztego adresu(2016-07-04)].(ang.).
- ↑abJohn N. DuPont:Welding Metallurgy and Weldability of Nickel-Base Alloys.Wyd. 1. John Wiley & Sons, Inc., 2009, s. 5.ISBN0-470-08714-5.(ang.).
- ↑J.B. Richter.On absolutely pure nickel. Proof that it is a noble metal.„Neues Allgem. Int. Chem.”. 2, s. 61–72, 1804.
- ↑John B. Burke:Cosmic Debris: Meteorites in History.University of California Press, 1991, s. 236.ISBN978-0-520-07396-8.(ang.).
- ↑Emily K. Schnebele:Nickel: Mineral Commodity Summaries.Wyd. 3. U.S. Geological Survey, Styczeń 2017, s. 114–115.(ang.).
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||





