Reakcja chemiczna
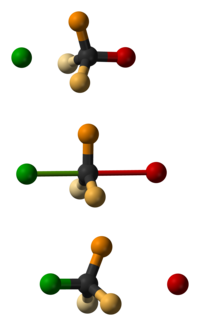
Reakcja chemiczna– każdy proces, w wyniku którego pierwotna substancja zwanasubstratemprzemienia się w inną substancję zwanąproduktem[1][2][3].Abycząsteczkasubstratu zamieniła się w cząsteczkę produktu, konieczne jest rozerwanie przynajmniej jednego z obecnych w niejwiązań chemicznychpomiędzyatomami,bądź też utworzenie się przynajmniej jednego nowego wiązania. Reakcje chemiczne przebiegają z reguły z wydzieleniem lub pochłonięciemenergii cieplnej,promienistej –promieniowania elektromagnetycznego(np. światła, podczerwieni), ewentualnie promieniowania (alfalubbeta) lubelektrycznej[3].Elementem reakcji chemicznej może byćkatalizator,który przyspiesza jej zachodzenie.
Reakcje proste i złożone
[edytuj|edytuj kod]Reakcja prosta to pojedynczy akt zerwania lub powstania jednego wiązania chemicznego. W przyrodzie bardzo rzadko obserwuje się jednak reakcje proste. Można do nich zaliczyć np. rozpad cząsteczek chloru (Cl–Cl) pod wpływempromieniowania ultrafioletowego[potrzebny przypis].
Olbrzymia większość obserwowanych reakcji to reakcje złożone, w których dochodzi jednocześnie do rozpadu jednych wiązań i powstania drugich. Każdą reakcje złożoną można zapisać jako ciąg następujących po sobie reakcji prostych, które w tym przypadku nazywają sięreakcjami elementarnymi.
Np. reakcja międzybromowodoremietylenemCH2=CH2,prowadząca do powstaniabromoetanu(BrCH2–CH3), wiąże się z rozerwaniem wiązania H–Br, zamianąwiązania podwójnegoC=C na wiązanie pojedyncze i powstaniem wiązania C–Br i C–H.
Kompletny zbiór reakcji elementarnych zachodzących podczas reakcji złożonej jest często nazywany jejmechanizmem.
Pojęciereakcje złożoneoznacza też przeciwieństwo reakcji elementarnych (również nazywanych prostymi lub izolowanymi). Wynik wielu reakcji, równocześnie zachodzących w roztworze, zależy od przebiegu wszystkich prostych reakcji cząstkowych. Do tak zdefiniowanych reakcji złożonych zalicza się np.reakcje równoległe,następcze,odwracalne,sprzężoneiłańcuchowe[4].
Rodzaje reakcji złożonych
[edytuj|edytuj kod]Wchemii organicznejprzykładami reakcji złożonych są[potrzebny przypis]:
- addycja(przyłączanie) – w wyniku tej reakcji reagująca cząsteczka ulega powiększeniu oatomlub grupę atomów; np. do cząsteczki etylenu (CH2=CH2) zostaje przyłączona cząsteczkabromowodoru(HBr), w wyniku czego powstaje nowa cząsteczkabromoetanu(BrCH2–CH3);
- substytucja(podstawienie) – w wyniku tej reakcji w cząsteczce następuje wymiana atomu lub ich grupy; jeden atom lub ich grupa odrywa się od cząsteczki, a inny atom lub ich grupa się w to miejsce przyłącza;
- eliminacja(oderwanie) – w wyniku tej reakcji od cząsteczki odrywa się atom lub grupa atomów i nic innego się w to miejsce nie przyłącza;
- przegrupowanie(reakcja wewnętrzna) – przemiana jednego związku chemicznego w inny związek, w wyniku której powstaje nowa cząsteczka, mająca taki sam skład co stara (np. przemianakwasu cyjanowegow izocyjanowy). Polega na rozerwaniu pewnych wiązań chemicznych i utworzeniu innych. Mogą, lecz nie muszą towarzyszyć temu zmiany stopnia utlenienia atomów tworzących cząsteczki substratu.
Wchemii nieorganicznejte same typy reakcji nazywa się czasami inaczej:
| Typ reakcji | Schemat | Przykłady |
|---|---|---|
| Reakcja syntezy | X + Y → XY | |
| N2(g)+ 3H2(g)→ 2NH3(g) | ||
| Reakcja analizy(rozkładu) | XY → X + Y | |
| Reakcja wymiany | X + YA → XA + Y | |
| C(s)+ZnO(s)→CO(g)+Zn(g) | ||
| O2(g)+HgS(s)→SO2(g)+Hg(g) | ||
| Reakcja podwójnej wymiany | XA + YB → XB + YA | |
| NaCl(aq)+AgNO3(aq)→NaNO3(aq)+AgCl(s) |
s – ciało stałe; c – ciecz; g – gaz; aq – roztwór wodny
Zobacz też
[edytuj|edytuj kod]- reakcja jonowa
- reakcja łańcuchowa
- reakcja następcza
- reakcja odwracalna
- reakcje równoległe
- reakcje sprzężone
Przypisy
[edytuj|edytuj kod]- ↑Chemical reaction,[w:]A.D.McNaught,A.Wilkinson,Compendium of Chemical Terminology (Gold Book),S.J. Chalk (akt.),International Union of Pure and Applied Chemistry,wyd. 2, Oxford: Blackwell Scientific Publications, 1997,DOI:10.1351/goldbook.C01033,ISBN0-9678550-9-8(ang.).
- ↑Słownik szkolny CHEMIA: reakcja chemiczna.Warszawa: Wydawnictwa Szkolne i Pedagogiczne, 1993, s. 285.ISBN83-02-04981-6.
- ↑abPojęcie reakcji chemicznej. W: Andrzej Górski:Chemia.T. 1: Budowa i przemiany materii. Warszawa: Państwowe Wydawnictwo Naukowe, 1974, s. 248–251.
- ↑Encyklopedia techniki: Chemia.Warszawa: Wydawnictwa Naukowo-Techniczne, 1993, s. 620.ISBN83-204-1312-5.
