Tritlenek siarki
| |||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
SO3 | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
80,06 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna, lotna ciecz | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego(25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||
Tritlenek siarki(nazwa Stocka:tlenek siarki(VI)),SO
3–nieorganiczny związek chemicznyz grupytlenków kwasowych,w którymsiarkawystępuje na VIstopniu utlenienia.
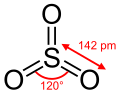
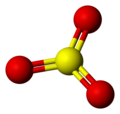
Budowa cząsteczki
[edytuj|edytuj kod]Monomerycznacząsteczkatritlenku siarki w stanie gazowym ma płaską budowętrójkąta równobocznego.DługośćwiązańS−Owynosi 142pm,a kąty pomiędzy wiązaniamiO−S−Owynoszą po 120°[2][1].
Otrzymywanie
[edytuj|edytuj kod]Tritlenek siarki powstaje jako produkt pośredni w procesie otrzymywaniakwasu siarkowegometodą kontaktową poprzezkatalityczneutlenianieSO
2(z uwagi na małąszybkość reakcjipomiędzySO
2itlenemstosuje siękatalizatorw postaciV
2O
5,który zastąpił używaną wcześniejplatynę)[2][7].SO
3nie jest jednak zazwyczaj izolowany, a dalej wykorzystywany do otrzymania pożądanego kwasu[1].
Laboratoryjne metody otrzymywania tego tlenku obejmują odwadnianie kwasu siarkowego przy użyciuP
4O
10:
- 2H
2SO
4+ P
4O
10→ 4HPO
3+ 2SO
3
oraz ogrzewaniedisiarczanu potasu[2]:
- K
2S
2O
7→ K
2SO
4+ SO
3
a także utlenianieSO
2przy użyciuSeO
2:
- 2SO
2+ SeO
2→ 2SO
3+ Se
Właściwości
[edytuj|edytuj kod]Tritlenek siarki jest w warunkach pokojowych bezbarwną cieczą. Może występować w trzech formach: α-SO
3,β-SO
3,γ-SO
3.Poniżej temperatury 16,86 °C tworzy się forma γ jakorombowekryształy przypominającelód,w których cząsteczki tritlenku siarki występują jedynie w postaci cyklicznychtrimerów(SO
3)
3.Pod wpływem niewielkich ilości wilgoci forma γ przekształca się do formy β będąca w rzeczywistości mieszaninąkwasów polisiarkowychHO(SO
2O)
xH(gdziexjest bardzo duże, około 105). Do wytworzenia się formy α (bardziej usieciowanej i przypominającejazbest) także potrzebna jest obecność wilgoci. W stanie gazowym monomeryczne cząsteczkiSO
3występują w równowadze z trimerami[2][1].
Skłonność dopolimeryzacjipowoduje, że sprzedawany tritlenek siarki wzbogacany jest o dodatki hamujące tę reakcję. Są to zazwyczaj m.in. związkiborulubkrzemu(w ilościach ok. 0,03–1,5%)[1].
Tritlenek siarki jest bardzo reaktywny. Reaguje gwałtownie iegzotermiczniez wodą tworząc kwas siarkowy. Ma właściwościutleniające(utlenia m.in.fosfordoP
4O
10) i jest silnymkwasem Lewisa[2].Zhalogenowodoramidaje odpowiedniekwasy halogenosiarkowe(HSO
3X)[1].
StałySO
3ma dość dużąlotność,przez co jego pary mogą tworzyć z wilgociąH
2SO
4[2].
Zastosowanie
[edytuj|edytuj kod]Tritlenek siarki stosuje się do otrzymywania kwasu siarkowego oraz innych związków (m.in. poprzezsulfonowaniezwiązków organicznych,np.alkilobenzenówdokwasów alkilobenzenosulfonowych)[7].Znajduje zastosowanie także przy produkcjimateriałów wybuchowych[8].
Przypisy
[edytuj|edytuj kod]- ↑abcdefghiNorman N.Greenwood,AlanEarnshaw,Chemistry of the Elements,wyd. 2, Oxford–Boston: Butterworth-Heinemann, 1997, s. 703,ISBN0-7506-3365-4(ang.).
- ↑abcdefgAdamBielański,Podstawy chemii nieorganicznej,wyd. 6, t. 2, Warszawa:Wydawnictwo Naukowe PWN,2010, s. 638–641,ISBN978-83-01-16282-5.
- ↑abDavid R.Lide(red.),CRC Handbook of Chemistry and Physics,wyd. 90, Boca Raton: CRC Press, 2009, s.4-93,ISBN978-1-4200-9084-0(ang.).
- ↑abDavid R.Lide(red.),CRC Handbook of Chemistry and Physics,wyd. 90, Boca Raton: CRC Press, 2009, s.6-53,ISBN978-1-4200-9084-0(ang.).
- ↑abTritlenek siarki (nr 227692)– karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2012-10-15].(przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑Sulfur trioxide (nr 227692)(ang.)– karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2012-10-15].(przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑abJohn DavidLee,Zwięzła chemia nieorganiczna,wyd. 4, Warszawa:Wydawnictwo Naukowe PWN,1997, s. 248–249,ISBN83-01-12352-4.
- ↑PradyotPatnaik,Handbook of Inorganic Chemicals,London: McGraw-Hill, 2003, s. 904–906,ISBN0-07-049439-8(ang.).
Linki zewnętrzne
[edytuj|edytuj kod]- Tritlenek siarki,międzynarodowa karta bezpieczeństwa chemicznego,Międzynarodowa Organizacja Pracy(pol.•ang.).