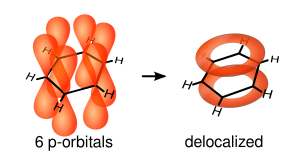Benzen
| |||||||||||||||||||||||||||||||||||||
 benzen w postaci stałej | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C6H6 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
78,11 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd |
przezroczysta[2],bezbarwna ciecz o charakterystycznym zapachu[3] | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki |
naftalen,antracen,naftacen,pentacen,pirydyna,borazyna,benzen Dewara | ||||||||||||||||||||||||||||||||||||
| Pochodne aromatyczne | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego(25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
Benzen–organiczny związek chemicznyz grupyarenów.Jest to najprostszy karbocykliczny, obojętnywęglowodór aromatyczny.Jego nieorganicznymanalogiemjestborazyna.
Budowa cząsteczki
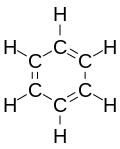
[edytuj|edytuj kod]Struktura Kekulégo
[edytuj|edytuj kod]Problem budowy benzenu interesował chemików już od chwili wyodrębnienia tego związku. W 1865 r. niemiecki chemikFriedrich August Kekuléwysunąłhipotezę,że benzen jestcykloheksatrienemo sześcioczłonowym pierścieniu, w którym pomiędzy atomamiwęglana przemian występują wiązania pojedyncze i podwójne[13]:
Teoria rezonansu chemicznego
[edytuj|edytuj kod]Struktura Kekulégo nie tłumaczyła jednak dlaczego benzen i innezwiązki aromatycznenie posiadają właściwości charakterystycznych dlawęglowodorów nienasyconych,mimo 6elektronówπ w pierścieniu (sekstet elektronowy)[3].Ponadto w miarę gromadzenia się materiału eksperymentalnego okazywało się, że wszystkiewiązaniaC−Cw pierścieniu benzenowym są równocenne. Na podstawie badańspektroskopowychustalono, że cząsteczka benzenu w istocie stanowi pierścień złożony z sześciu atomów węgla połączonych równocennymi wiązaniami o długości 1,39 Å, czyli pośredniej pomiędzy długością wiązania pojedynczego (1,54 Å) i podwójnego (1,34 Å). Struktury uśrednionej nie można zobrazować klasycznymi wiązaniami pojedynczymi i podwójnymi, można jednak przedstawić granicznestruktury rezonansowe:
Mechanika kwantowa
[edytuj|edytuj kod]Zagadnienie płaskiej budowy pierścienia benzenowego dobrze tłumaczykwantowomechanicznametoda orbitali molekularnych.Przyjmuje sięhybrydyzacjęsp² (kąty pomiędzy wiązaniamiH−C−CiC−C−Cwynoszą 120°) dla atomów węgla[3].Zhybrydyzowane orbitale tworzą wiązania σC−CiC−H.Pozostałe orbitale p atomów węgla (o osiach prostopadłych do płaszczyzny cząsteczki) tworzą zdelokalizowanewiązania π.W efekcie 6 elektronów π nie jest przypisane ani do żadnego z atomów węgla, ani do żadnego wiązania węgiel-węgiel, lecz znajduje się w dwóch chmurach nad i pod płaszczyzną pierścienia, których kształt jest zbliżony dotorusa[14][15]:
Otrzymywanie
[edytuj|edytuj kod]Skala laboratoryjna
[edytuj|edytuj kod]- odwodornianiecykloheksanuw temp. 300 °C na katalizatorze (najczęściejplatynaosadzona natlenku glinu)[potrzebny przypis]

- trimeryzacjaacetylenupoprzez ogrzewanie go w obecnościwęgla aktywnego:
- 3C
2H
2→ C
6H
6
Skala przemysłowa
[edytuj|edytuj kod]Do czasówII wojny światowejgłówną metodą otrzymywania benzenu byłaekstrakcjazesmoły pogazowej[3](produkt uboczny wprzemyśle koksowniczymigazowniczym). W latach 50. XX wieku wzrosło zapotrzebowanie na benzen, głównie ze strony przemysłu tworzyw sztucznych i konieczna stała się jego produkcja na wielką skalę zropy naftowej[3].
Obecnie, oprócz ekstrakcji ze smoły pogazowej, stosuje się następujące metody otrzymywania benzenu:
- pirolizalekkich frakcji ropy naftowej zparą wodną(kraking parowy)
- reforminglekkich frakcji ropy naftowej
- dealkilacjatoluenu,polegająca na przepuszczaniu mieszaniny toluenu iwodorunadkatalizatorem(chrom,molibdenlubtlenek platyny) w temperaturze 500–600 °C pod ciśnieniem 40–60 atmosfer (czasem zamiast katalizatora używa się wyższych temperatur):
- C
6H
5CH
3+ H
2→ C
6H
6+ CH
4
Właściwości
[edytuj|edytuj kod]Właściwości fizyczne
[edytuj|edytuj kod]W temperaturze pokojowej benzen jest bezbarwną cieczą o charakterystycznym, ostrym zapachu. Bardzo słabo rozpuszcza się w wodzie, natomiast lepiej wrozpuszczalnikachorganicznych[3].Sam jest dobrym rozpuszczalnikiem dlawosków,tłuszczów,naftalenui innych niepolarnych związków chemicznych.
Właściwości chemiczne
[edytuj|edytuj kod]Pali się kopcącym płomieniem, a jegociepło spalaniawynosi 9470kcal/kg.
Benzen jest związkiem trwałym chemicznie, w przeciwieństwie doalkenównie ulega łatwo reakcjiaddycji.Stosunkowo łatwo natomiast zachodzisubstytucja elektrofilowado pierścienia aromatycznego. Przykładem może być reakcja alkilowania i acylowania, katalizowanakwasami Lewisa,nazywanareakcją Friedla-Craftsa.
Właściwości biologiczne
[edytuj|edytuj kod]W większych ilościach benzen jesttoksyczny.LD50(szczur, doustnie) wynosi 930 mg/kg,LC50(szczur, inhalacja) – 10 000 ppm przez 7 h. Ma silne właściwości rakotwórcze. Po spożyciu powoduje podrażnienieśluzówkiżołądka,mdłości iwymioty.Przy pochłonięciu większych ilości powoduje bóle głowy, drgawki i zgon.
Zastosowanie
[edytuj|edytuj kod]Benzen jest jednym z najważniejszych rozpuszczalników, jak isubstratówwielu związków wsyntezie organicznej,służy m.in. do produkcjitworzyw sztucznych,włókien syntetycznych,barwników,leków,detergentów,pestycydów[3],a także do otrzymywaniaaniliny,fenoluiacetonu(metoda kumenowa) orazbezwodnika maleinowego.
Sam benzen jest ze względu na swoje właściwości toksyczne i rakotwórcze rzadko używany. Był niegdyś masowo stosowany jako rozpuszczalnik dla wielu reakcji prowadzonych w skali przemysłowej – obecnie jednak zastępuje się go innymi rozpuszczalnikami, o ile tylko istnieje taka możliwość.
Historia
[edytuj|edytuj kod]Benzen został po raz pierwszy wyodrębniony przezMichaela Faradayaw 1825 r. ze sprężonegogazu świetlnegobędącego oleistą pozostałością zbierającą się na dnie londyńskich gazowych lamp ulicznych. W 1845 inny angielski chemik,Charles Mansfield,pracując pod kierunkiemAugusta Wilhelma von Hofmanna,wyodrębnił go zesmoły węglowej.Cztery lata później Mansfield rozpoczął produkcję benzenu na skalę przemysłową bazując na tej metodzie. Nazwę „benzen” (benzol) zaproponował w 1843 r. niemiecki chemikJustus von Liebig.
Zagrożenia
[edytuj|edytuj kod]Benzen podejrzewany o toksyczność był już w 1900 roku. Powoduje on zarówno ostre, jak i przewlekłezatrucia.Zazwyczaj do zatrucia dochodzi poprzez wdychanie par przezukład oddechowy,jednak możliwa jest równieżabsorpcjaprzez skórę i wchłanianie wraz z pokarmem. Około 6,4 g/m³ powoduje ostre zatrucie w ciągu godziny inhalacji, zaś dawka 10-krotnie większa powoduje natychmiastowy zgon.
Ostre zatrucie benzenem charakteryzuje się podrażnieniem skóry, rumieniem, odczuciem palenia. Benzen oddziałuje naośrodkowy układ nerwowypowodującsenność,bóleizawroty głowy,utratę przytomności,niewydolność układu oddechowego, a w rezultacie zgon[16].Charakterystycznymi objawami są też: krwawienia z błon śluzowych, szybki i płytki oddech, drżenie kończyn, zaburzenia rytmu serca[16].Przy zatruciu drogą pokarmową dołączają się takżewymiotyidrgawki[16].
Dużo częstsze są zatrucia przewlekłe. Pierwsze objawy są niespecyficzne, są tozmęczenie,ból głowy, utrataapetytu.Dokładniejsze badania wykazują nieprawidłowości w składzie biochemicznym krwi. Najczęściej dochodzi do obniżenia liczbybiałych ciałek krwico powoduje spadek odporności ipłytek krwi.Benzen również działa niszcząco naszpik kostnyi może powodowaćbiałaczkęlubszpiczaka mnogiego[17]. Pary benzenu po dostaniu się do płuc absorbowane są przez krew, z której w dużym stopniu wchłaniane są przeztkanki tłuszczowe.
Niemetabolizowany benzen wydalany jest przez płuca.Metabolizmbenzenu zachodzi przede wszystkim wwątrobie.Najpierw benzen ulegautlenieniuw wyniku działaniaenzymówcytochromu P-450dooksepiny,która jest utrzymywana w stanierównowagi dynamicznejzepoksybenzenem.Epoksybenzen może ulecuwodnieniuw wyniku działania enzymu hydrolazy epoksydowej dając benzeno-trans-dihydro-1,2-diol, następnie związek ten pod wpływem enzymu dehydrogenazy dihydrodiolowej przekształcany jest wkatechol.Oksepina może również reagować poprzez otwarcie pierścienia, dając jako produktaldehyd (E,E)-mukonowyikwas (E,E)-mukonowy.
Niektóre metabolity są odpowiedzialne za działanie toksyczne benzenu. Na przykład główne działanie rakotwórcze wykazują kwasy mukonowe powstające jako metabolity.

- Ogólny schemat metabolizmu benzenu[18]
Uwagi
[edytuj|edytuj kod]- ↑Nazwa nie odzwierciedla rzeczywistego układu wiązań w cząsteczce. Patrz sekcja „Budowa cząsteczki”.
Przypisy
[edytuj|edytuj kod]- ↑abHenri A.Favre,Warren H.Powell,Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013,Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), wyd. 3, Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej,[2017],s. 131.
- ↑Farmakopea Polska X,Polskie Towarzystwo Farmaceutyczne, Warszawa:Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych,2014, s. 4276,ISBN978-83-63724-47-4.
- ↑abcdefgPodręczny słownik chemiczny,RomualdHassa(red.),JanuszMrzigod(red.),JanuszNowakowski(red.), Katowice: Videograf II, 2004, s. 51,ISBN83-7183-240-0.
- ↑abcdeHaynes 2016 ↓,s.3-34.
- ↑Haynes 2016 ↓,s.5-173.
- ↑abcHaynes 2016 ↓,s.5-140.
- ↑abcHaynes 2016 ↓,s.6-67.
- ↑Haynes 2016 ↓,s.6-243.
- ↑Haynes 2016 ↓,s.6-190.
- ↑abcdeHaynes 2016 ↓,s.15-13.
- ↑Benzen,[w:] Classification and Labelling Inventory,Europejska Agencja Chemikaliów[dostęp 2020-05-11](ang.).
- ↑abBenzen (nr 270709)– karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2020-05-11].(przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑AugustKekulé,Untersuchungen über aromatische Verbindungen Ueber die Constitution der aromatischen Verbindungen. I. Ueber die Constitution der aromatischen Verbindungen,„Liebigs Annalen”,137 (2), 1865, s. 129–196,DOI:10.1002/jlac.18661370202(niem.).
- ↑The Bonding in Benzene,[w:]Paula YurkanisBruice,Organic chemistry,Prentice Hall, 2003, s. 267,ISBN978-0-13-140748-0.
- ↑Orbitale w cząsteczce benzenu,[w:]Robert T.Morrison,Robert N.Boyd,Chemia organiczna,t. 1, Warszawa:Państwowe Wydawnictwo Naukowe,1985, s. 388–389,ISBN83-01-04166-8.
- ↑abcFacts About Benzene,[w:] Emergency Preparedness and Response [online], Centers for Disease Control and Prevention[dostęp 2017-07-21](ang.).
- ↑A.Yardley-Jones,D.Anderson,D.V.Parke,The toxicity of benzene and its metabolism and molecular pathology in human risk assessment,„British Journal of Industrial Medicine”, 48 (7), 1991, s. 437–444,PMID:1854646,PMCID:PMC1035396.
- ↑Stephen M.Rappaporti inni,Evidence That Humans Metabolize Benzene via Two Pathways,„Environmental Health Perspectives”, 117 (6), 2009, s. 946–952,DOI:10.1289/ehp.0800510,PMID:19590688,PMCID:PMC2702411.
Bibliografia
[edytuj|edytuj kod]- CRC Handbook of Chemistry and Physics,William M.Haynes(red.), wyd. 97, Boca Raton: CRC Press, 2016,ISBN978-1-4987-5429-3(ang.).
- S.E.Manahan,Toksykologia środowiska. Aspekty chemiczne i biologiczne,Warszawa:Wydawnictwo Naukowe PWN,2006,ISBN83-01-14841-1.