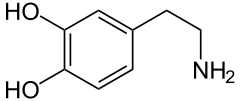
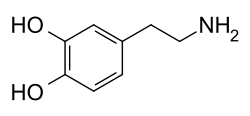
Dopamina
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C8H11NO2 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
153,18 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd |
biały proszek[1] | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego(25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Dopamina(łac.dopaminum) –organiczny związek chemicznyz grupykatecholamin.Ważnyneuroprzekaźniksyntezowany i uwalniany przez dopaminergiczne neuronyośrodkowego układu nerwowego.
Dopamina działa przez swoistereceptory(pięć opisanych podtypów) zlokalizowane w błonach presynaptycznej i postsynaptycznej. Odgrywa odmienną rolę w zależności od miejsca swego działania:
- wukładzie pozapiramidowymjest odpowiedzialna za napęd ruchowy, koordynację oraz napięcie mięśni – wchorobie Parkinsonawystępuje niedobór dopaminy
- w układzie rąbkowym (limbicznym) jest odpowiedzialna za procesy emocjonalne,wyższe czynności psychiczneoraz w znacznie mniejszym stopniu procesy ruchowe
- wpodwzgórzujest związana głównie z regulacją wydzielaniahormonów,zwłaszczaprolaktyny(stąd inną nazwą dopaminy jestprolaktostatyna(ang.prolactin inhibitory hormone)) igonadotropin.
Dopamina jest syntetyzowana także w tkankach obwodowych (kanaliki nerkowe i nerkowe naczynia krwionośne, pęcherzyki płucne, trzustka oraz naczynia krwionośne płuc i serca) i wykazuje tam aktywność autokrynną.
Przypisuje się dopaminie pełnienie funkcji „przekaźnika przyjemności”, co nie jest jednak poparte wiarygodnymi źródłami[5]. Cechą większości substancji uzależniających jest bezpośrednie lub pośrednie nasilenie dopaminergicznej impulsacji wukładzie mezolimbicznym,co przejawia się zwiększonym stężeniem dopaminy w jądrzepółleżącymprzegrody i kory oczodołowo-czołowej[5].Odstawienie substancji narkotycznej wywołuje patologiczne obniżenie stężenia dopaminy w tej strukturze mózgu, co objawia siędysforiąoraz objawami głodu narkotykowego.
Struktura
[edytuj|edytuj kod]Cząsteczka dopaminy zawiera strukturępirokatechiny(pierścieńbenzenowyz przyłączonymi dwoma grupami hydroksylowymi w pozycjiorto) z przyłączoną grupąaminowąpoprzez łańcuchetylowy[6].Dopamina jest najprostszą możliwąkatecholaminądo których należą również neuromediatory takie jakadrenalinainoradrenalina[7].Obecność pierścienia benzenowego z przyłączoną grupą aminową grupuje ją także dopochodnych fenyloetyloaminy– rodziny do której należy wieleśrodków psychoaktywnych[8].
Dopamina należy do zasad organicznych[9].W kwaśnym środowisku dochodzi do uprotonowania grupy aminowej cząsteczki[9].Forma ta umożliwia wysoką rozpuszczalność w wodzie i względną stabilność, lecz może doprowadzić do utlenienia cząsteczki w przypadku ekspozycji na tlen lub inneoksydanty[9].W zasadowym środowisku nie dochodzi do tworzenia formy protonowanej[9].Jest ona słabiej rozpuszczalna i bardziej reaktywna[9].Dla celów leczniczych dopamina podawana jest w postacichlorowodorku(forma uprotonowana) z powodu jej zwiększonej rozpuszczalności i stabilności[9].W formie stałej chlorowodorek dopaminy jest bezbarwnym proszkiem[9].
Biochemia
[edytuj|edytuj kod]Synteza
[edytuj|edytuj kod]
Dopamina jest syntetyzowana głównie wneuronachi komórkachrdzenia nadnerczy[10].Szlak metabolicznysyntezy dopaminy to:
L-Fenyloalanina→ L-Tyrozyna → L-DOPA → Dopamina
Bezpośredni prekursor dopaminy,L-DOPA,może być tworzony pośrednio z aminokwasufenyloalaninylub bezpośrednio ztyrozyny[11].Aminokwasy te znajdują się w niemal każdymbiałku,więc są łatwo dostępne z pożywienia. Chociaż dopamina również znajduje się w pożywieniu to w przeciwieństwie do aminokwasów nie jest zdolna do przekraczaniabariery krew-mózg[12].Z tego powodu musi być syntetyzowana w samym mózgu z prekursorów, aby wykazywać działanieneuroprzekaźnika[12].
L-fenyloalanina jest przekształcana do L-tyrozyny przez enzymhydroksylazę fenyloalaninowąz udziałem cząsteczkowego tlenu itetrahydrobiopterynyjako kofaktorów. L-tyrozyna przechodzi w L-DOPA przy udziale enzymuhydroksylazy tyrozynowejwraz z tlenem, tetrahydrobiopteryną orazżelazem(Fe2+) jakokofaktory[11].Enzymdekarboksylaza aromatycznych L-aminokwasów(dekarboksylaza DOPA) przekształca L-DOPA do dopaminy zfosforanem pirydoksalujako kofaktorem[11].
Dopamina jest prekursorem w syntezienoradrenalinyiadrenaliny[11].Dopamina jest przekształcana do noradrenaliny przy udziale enzymuhydroksylazy dopaminowejprzy udziale tlenu ikwasu askorbinowegojako kofaktorów[11].Adrenalina powstaje z noradrenaliny przy udzialeN-metylotransferazy fenyloetanoloaminowejzS-adenozylometioninąjako kofaktorem[11].
Brak któregokolwiek aminokwasu lub kofaktora w szlaku może upośledzić syntezę dopaminy, noradrenaliny i adrenaliny[11].
Degradacja
[edytuj|edytuj kod]
Dopamina jest rozkładana do nieaktywnychmetabolitówprzez zespół enzymów w kolejności:monoaminooksydaza(MAO),COMT(COMT) idehydrogenaza aldehydowa[13].Oba izoenzymy monoaminoksydazy, MAO-A i MAO-B, mogą skutecznie metabolizować dopaminę[11].Głównym końcowym produktem rozkładu jestkwas homowanilinowy,który nie ma znanej funkcji biologicznej[13].Z krwiobiegu kwas homowanilinowy jestfiltrowanyprzez nerki i wydalany z moczem[13].
W badaniach klinicznych uschizofreników,pomiar poziomu kwasu homowanilinowego wosoczuużywany jest do oszacowania poziomu aktywności dopaminy w mózgu. Trudności z wykorzystaniem tej metody są związane z rozkładem norepinefryny również do kwasu homowanilinowego[14][15].
Chociaż dopamina jest normalnie rozkładana przezoksydoreduktazy,możliwe jest także jejutlenienieprzez bezpośrednią reakcję z tlenem z wytworzeniemchinonóworazwolnych rodników[16].Prędkość przemiany może być zwiększona przez obecność jonów żelaza w środowisku reakcji. Chinony oraz rodniki wytworzone przez autooksydację dopaminy mogą być neurotoksyczne i badania wykazują, że mogą przyczyniać się do utraty komórek wchorobie Parkinsonai innych chorobach[17].
Działanie i funkcje
[edytuj|edytuj kod]Efekty komórkowe
[edytuj|edytuj kod]| Rodzina | Receptor | Gen | Typ białka G | Mechanizm działania |
|---|---|---|---|---|
| D1-podobne | D1 | DRD1 | Gs | Zwiększa poziom wewnątrzkomórkowegocAMP przez aktywacjęcyklazy adenylowej. |
| D5 | DRD5 | |||
| D2-podobne | D2 | DRD2 | Gi | Zmniejsza poziom wewnątrzkomórkowegocAMP przez hamowaniecyklazy adenylowej. |
| D3 | DRD3 | |||
| D4 | DRD4 | |||
| TAAR | TAAR1 | TAAR1 | Gs Gq |
Zwiększa poziom wewnątrzkomórkowegocAMP i wewnątrzkomórkowego stężenia wapnia. |
Dopamina wywołuje efekty poprzez przyłączanie się do odpowiednichreceptorówpowierzchniowych komórki[10].U ssaków zidentyfikowano pięćreceptorów dopaminowychod D1do D5[10].Wszystkie z nich sąreceptorami metabotropowymisprzężonymi z białkiem G,co oznacza, że działają poprzez system przekaźników drugorzędowych[20].Receptory te można podzielić na dwie rodziny: D1-podobne i D2-podobne[10].Dla receptorów zlokalizowanych na neuronach w układzie nerwowym aktywacja D1-podobnych może powodować pobudzenie (przez otwarciekanałów sodowych) lub inhibicję (przez otwarciekanałów potasowych); z kolei efekt aktywacji receptorów D2-podobnych to z regułyinhibicjadocelowego neuronu[20].W związku z tym dopamina nie jest przekaźnikiem hamującym, bądź pobudzającym, ponieważ efekt na neuron będzie zależał od typów receptorów obecnych na jego błonie wywołujących wzrost bądź spadek poziomu drugiego przekaźnika (cAMP)[20].Receptory D1są najliczniejszymi receptorami w układzie nerwowym ludzi, następne są receptory D2,natomiast pozostałe (D3, D4, D5) występują znacznie rzadziej[20].
Przechowywanie, uwalnianie i wychwyt zwrotny
[edytuj|edytuj kod]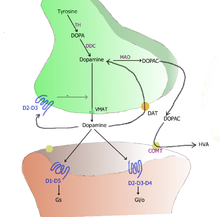
TH:hydroksylaza tyrozynowa
DOPA:L-DOPA
DAT: transporter dopaminy
DDC:Dekarboksylaza aromatycznych L-aminokwasów
VMAT: pęcherzykowy transporter monoaminowy
MAO:oksydaza monoaminowa
COMT:katecholo-O-metylotransferaza
HVA:kwas homowanilinowy
W mózgu dopamina funkcjonuje jakoneuroprzekaźnikineuromodulatori jest kontrolowana przez zespół mechanizmów powszechnych dlaneurotransmiterów monoaminowych[10].Po syntezie, dopamina jest transportowana zcytozoluwpęcherzykachsynaptycznych przez białko nośników substancji rozpuszczonych (SLC) – pęcherzykowy transporter monoaminowy, VMAT2[21].Dopamina jest przechowywana w tych pęcherzykach do momentu wydzielenia doszczeliny synaptycznej.W większości przypadkówegzocytozaprzekaźnika jest powodowana przezpotencjał czynnościowy,ale może być też spowodowana przez aktywację wewnątrzkomórkowego receptora TAAR1 (ang. trace amine-associated receptor)[19].TAAR1 posiada wysokie powinowactwo do dopaminy, agonistów TAAR1 (pochodne 2-fenyloetyloaminy, tryptamina) oraz pochodnych amfetaminy i rozmieszczony jest wzdłuż błony presynaptycznej neuronów[19].Aktywacja TAAR1 uruchamia przekaźnictwo komórkowe włączając w to aktywację kinazy białkowej A i C, których działanie doprowadza do wypompowania dopaminy z komórki i internalizację transportera dopaminy, co skutkuje zmniejszeniemwychwytu zwrotnego.Równocześnie agonisty receptora TAAR1 zmniejszają liczbę wyrzutów dopaminy z komórki[19][22].
W synapsie dopamina przyłącza się i aktywuje receptory dopaminowe[23].Mogą to być postsynaptyczne receptory zlokalizowane nadendrytachlub autoreceptory zlokalizowane na błonie neuronu presynaptycznego[10][23].Kiedy w neuronie postsynaptycznym wywołany jest potencjał czynnościowy, cząsteczka dopaminy szybko odłącza się od receptora, następnie jest transportowana z powrotem do neuronu presynaptycznego przez wychwyt zwrotny przy udziale transportera dopaminowego lub przez błonowy transporter monoamin (PMAT)[24].Gdy dopamina jest już w cytozolu, może zostać rozłożona przezoksydazę monoaminowąlub ponownie wykorzystana poprzez zapakowanie do pęcherzyków przez białko VMAT2[21].
W mózgu zewnątrzkomórkowy poziom dopaminy jest regulowany przez dwa mechanizmy: toniczną i fazową transmisję[25].Fazowe uwalnianie dopaminy, jak większość transmiterów, jest powodowane potencjałem czynnościowym neuronów produkujących dopaminę[25].Toniczna transmisja dopaminy pojawia się, gdy małe jej ilości są wydzielane bez obecności potencjału czynnościowego neuronu presynaptycznego[25].Toniczna transmisja jest regulowana przez różne czynniki, włączając w to aktywność innych neuronów i wychwyt zwrotny neuroprzekaźnika[25].
Układ nerwowy
[edytuj|edytuj kod]
VTA –pole brzuszne nakrywki
Działając w mózgu, dopamina odgrywa ważną rolę w kontroli motorycznej, układzie nagrody,motywacji,czuwaniu,wzmocnieniu,procesach poznawczych (uwaga, pamięć, myślenie, rozwiązywanie problemów), a także takich funkcjach jaklaktacja,orgazmoraznudności.
Neurony dopaminergiczne (produkujące dopaminę) są stosunkowo nieliczne – całkowicie około 400 tysięcy w ludzkim mózgu[26],a ichciała komórkowesą zgrupowane w kilku niewielkich obszarach w mózgu[27].Pomimo tego ichaksonyłączą się z wieloma innymi strukturami mózgu wywołując na nie znaczny wpływ[27].Grupy neuronów dopaminergicznych zostały po raz pierwszy zobrazowane w 1964 przez Annica Dahlström i Kjell Fuxe, którzy oznakowali je literą „A” („aminergic “)[28].Grupy od A1 do A7 zawierają neurotransmiternoradrenalinę,natomiast od A8 do A14 dopaminę. Rejony zawierające grupy neuronów dopaminergicznych toistota czarna(A8 i A9),pole brzuszne nakrywki(A10), tylna częśćpodwzgórza(A11),jądro łukowate(A12),warstwa niepewna(A13) ijądro okołokomorowe(A14)[28].
Istota czarnato częśćśródmózgowia,która wchodzi w składjąder podstawnych.Składa się z dwóch części – wewnętrznej (część zbita) i zewnętrznej (część siatkowata). Neurony dopaminergiczne znajdują się głównie w części zbitej (A8) i jej okolicach (A9)[27].U ludzi aksony neuronów dopaminergicznych rzutują się z części zbitej doprążkowiatworzącszlak nigrostriatalny,który odgrywa znaczną rolę w kontroli funkcji motorycznych i nauki nowych umiejętności manualnych[29].Neurony te są szczególnie narażone na uszkodzenia, a kiedy znaczna ich liczba umrze dochodzi doparkinsonizmu[30].
Pole brzuszne nakrywkirównież znajduje się w śródmózgowiu. Większa część aksonów neuronów rzutuje się dokory przedczołowejprzezszlak mezokortykalnyoraz mniejsza część dojądra półleżącegoprzezszlak mezolimbiczny.Oba te szlaki są razem nazywane rzutowaniem mezokortykolimbicznym[27][29].Odgrywają one główną rolę w układzie nagrody i innych aspektach motywacji. Pole brzuszne nakrywki wysyła także połączenia dopaminergiczne dociała migdałowatego,zakrętu obręczy,hipokampaiopuszki węchowej[27][29].
Tylna częśćpodwzgórzaposiada neurony dopaminergiczne rzutujące się dordzenia kręgowego,ale ich funkcja nie jest poznana[31].Istnieją przesłanki, że zaburzenia w tym rejonie odgrywają rolę wzespole niespokojnych nóg,chorobie w której ludzie mają problemy ze snem z powodu nieodpartej potrzeby poruszania częściami ciała, zwłaszcza nogami[31].
Jądro łukowateijądro okołokomorowepodwzgórza posiadają neurony dopaminergiczne, które tworząszlak guzowo-lejkowy,który biegnie do przysadki i reguluje wydzielanieprolaktyny[32].Dopamina jest głównym inhibitorem wydzielania prolaktyny z przedniego płataprzysadki mózgowej,w przypadku jej braku prolaktyna jest wydzielana w sposób ciągły[32].Dopamina produkowana przez neurony w jądrze łukowatym jest wydzielana do sieci wrotnej przysadki, która ją zaopatruje odżywczo[32].Z powodu regulacji wydzielania prolaktyny dopamina jest nazywana także prolaktostatyną[32].Zaburzenia upośledzające wydzielanie dopaminy do przysadki jak ucisk lub uszkodzenie lejka przysadki albo stosowanie leków antydopaminergicznych (rezerpina,metoklopramid) może doprowadzić dohiperprolaktynemii[32].
Warstwa niepewnaznajdująca się wniskowzgórzurzutuje się do kilku obszarów w podwzgórzu i uczestniczy w kontroli wydzielaniagonadoliberyny,koniecznej do rozwoju męskich i żeńskichnarządów rozrodczych[32].
Dodatkowa grupa neuronów wydzielających dopaminę znajduje się wsiatkówceoka[33].Są to komórki amakrynowe o krótkich wypustkach, szczególnie aktywne podczas dnia, a w nocy tracą aktywność[33].Dopamina w siatkówce wzmacnia aktywnośćczopków,natomiast zmniejszapręcików[33].W rezultacie zwiększa wrażliwość na kolory i ostrość, gdy jest jasno kosztem zmniejszonej wrażliwości przy ograniczonym świetle[33].
Jądra podstawne
[edytuj|edytuj kod]
Największym i najważniejszym źródłem dopaminy w mózgach kręgowców sąistota czarnaipole brzuszne nakrywki[27].Obie struktury są blisko ze sobą związane i podobne w funkcjach[27].Największą strukturą jąder podstawnych jestprążkowie[34].Istota czarna wysyła włókna dopaminergiczne do grzbietowego prążkowia, podczas gdy pole brzuszne nakrywki wysyła je do brzusznego prążkowia[27].
Najpopularniejsza hipoteza funkcji jąder podstawnych zakłada, że odgrywają one główną rolę w wyborze ruchu[35].Oznacza to, że kiedy człowiek lub zwierzę jest w sytuacji, w której kilka różnych zachowań jest możliwych, aktywność w jądrach podstawnych determinuje, która zostanie wykonana poprzez uwolnienie jej spod działania hamującego, podczas gdy konkurencyjny ruch jest dalej hamowany[36].
Jądra podstawne mogą być podzielone na kilka części, z których każda jest zaangażowana w kontrolowaniu poszczególnych typów akcji[37].Brzuszny sektor jąder podstawnych (zawierający brzuszne prążkowie i pole nakrywkowe brzuszne) jest najwyżej w hierarchii wybierając działania na poziomie całego organizmu[36].Sektor grzbietowy (zawierający grzbietowe prążkowie i istotę czarną) działa na niższym poziomie, wybierając konkretne mięśnie i ruchy do realizacji danych zachowań[37].
Dopamina przyczynia się do procesu wyboru ruchu na co najmniej dwa sposoby. Ustala ona próg dla inicjacji ruchu[35].Im wyższy poziom aktywności dopaminy tym niższe wymagania do wywołania danego ruchu[35].W konsekwencji wysoki poziom dopaminy prowadzi do wysokich poziomów aktywności motorycznych i impulsywnych zachowań; niski poziom prowadzi dotorporui spowolnionych reakcji[35].Wchorobie Parkinsona,gdzie poziom dopaminy w istocie czarnej jest znacznie zmniejszony jest związany ze sztywnością i problemem z inicjacją ruchów. Aczkolwiek kiedy ludzie z tą chorobą są wystawieni na silny bodziec jak np. poważne zagrożenie, ich reakcje mogą być równie energiczne co zdrowych osób[38].Substancje zwiększające stężenie dopaminy, takie jakkokainalubamfetamina,mogą powodowaćpobudzenie psychoruchoweistereotypię[39].
Drugą ważną funkcją dopaminy jest udział w utrwalaniu sygnału[35].Kiedy akcja jest związana ze wzrostem poziomu dopaminy, jądra podstawne są modyfikowane w ten sposób, że podobny bodziec w przyszłości jest łatwiej wyzwalany[35].Jest to przykładwarunkowania instrumentalnego,gdzie dopamina pełni rolę sygnału związanego z nagrodą[36].
Układ nagrody
[edytuj|edytuj kod]
Nagroda jest to atrakcyjna właściwość źródła bodźca nagradzającego[40].Bodziec nagradzający to taki, który wywołujezachowanie apetytywne(poszukujące, zmierzające do zaspokojenia danej potrzeby) i decyzję czy należy użyć lub wykorzystać daną nagrodę[40].Przyjemność,nauka(warunkowanie klasyczneiinstrumentalne) oraz zachowanie apetytywne są trzema głównymi funkcjami nagrody[40].Przyjemność zawiera w sobie definicję nagrody; jakkolwiek, podczas gdy wszystkie przyjemne bodźce są nagradzające to nie wszystkie bodźce nagradzające są przyjemne (np. nagrody zewnętrzne jak pieniądze)[40][41].Motywacjaipożądaniewywoływane przez bodziec nagradzający powodują zachowanie apetytywne, podczas gdy przyjemny element nagród pochodzi odzachowania konsumacyjnego,które odzwierciedla wykorzystanie nagrody[40].Neuropsychologiczny model, który rozróżnia te dwa składniki nagradzającego bodźca to model „przypisywania bodźcom wartości zachęcającej” (ang. incentive salience)[42],gdzie „chcenie”, pożądanie, poszukiwanie odpowiada zachowaniu apetetywnemu, podczas gdy lubienie lub przyjemność odpowiada zachowaniu konsumacyjnemu[40][43][44].U ludzi uzależnionych „chcenie” staje się rozłączne z „lubieniem”; pragnienie zażycia uzależniającej substancji wzrasta, podczas gdy przyjemność otrzymywana z jej spożycia spada[43].
W mózgu dopamina pełni częściowo funkcję „ogólnego sygnału nagrody”, gdzie wstępna faza odpowiedzi dopaminowej na bodziec nagradzający koduje informacje o wartości i kontekście nagrody[40].Dopamina pełni funkcję sygnału „przewidywania nagrody”, który określa stopień w którym wartość nagrody jest niespodziewana[40].Nawiązując do hipotezy Wolframa Schultza, nagrody, które są spodziewane nie powodują drugiej fazy odpowiedzi dopaminowej w konkretnych neuronach dopaminergicznych[40].Jednakże nagrody, które są niespodziewane lub większe niż oczekiwano, powodują krótkotrwały wzrost dopaminy w synapsach, natomiast utrata spodziewanej nagrody powoduje spadek uwalniania dopaminy poniżej wyjściowego poziomu[40].
Badania mózgów zwierząt z użyciem mikroelektrod pokazują, że neurony dopaminergiczne w polu brzusznym nakrywki i istocie czarnej są silnie aktywowane przez różne wydarzenia nagradzające[40].Te neurony czułe na nagrodę pełnią kluczową rolę w rozpoznaniu nagrody i służą jako główny składnik układu nagrody[43][45][46].Funkcja dopaminy różni się w zależności od połączeń aksonalnych z pola brzusznego nakrywki (VTA) i istocie czarnej; na przykład, połączenie VTA-część zewnętrznajądra półleżącegoprzypisuje bodźcom wartość zachęcającą; połączenie VTA-kora oczodołowo-czołowaaktualizuje wartości różnych celów zgodnie z nadaną im wartością; połączenie VTA-ciało migdałowatei VTA-hipokampuczestniczy w utrwalaniu wspomnień związanych z nagrodą, a połączenia VTA-część wewnętrzna jądro półleżącego i istota czarna-grzbietoweprążkowiesą zaangażowane w nauce odpowiedzi ruchowych ułatwiających wykorzystanie bodźców nagradzających[43][47].Niektóre aktywności połączeń VTA są także związane z przewidywaniem nagrody[43][47].
Dopamina pełni główną rolę w pożądaniu związanym z zachowaniem apetytywnym w odpowiedzi na bodziec nagradzający, jednakże nie jest w prosty sposób związana ze zjawiskiem przyjemności podczas zachowania konsumacyjnego[41].Przekaźnictwo dopaminy jest związane z niektórymi, ale nie wszystkimi aspektami przyjemności, ponieważ ośrodki przyjemności znajdują się zarówno w układzie dopaminowym (np.jądro półleżące), jak i poza nim (np.gałka blada brzusznaijądro okołoramieniowe)[41][44][48].Bezpośrednia elektrostymulacjaszlaków dopaminergicznychza pomocą elektrod umieszczonych w mózgu jest odbierana jako przyjemna i wiele typów zwierząt wykazuje chęć do jej doświadczenia[49].Leki przeciwpsychotyczneużywane do leczeniapsychozyobniżają poziom dopaminy i często wywołują anhedonię[50].Wiele czynności związanych z przyjemnością (seks, jedzenie) wywołuje wzrost uwalniania dopaminy[51].Wszystkie substancje uzależniające bezpośrednio lub pośrednio wpływają na przekaźnictwo dopaminy w jądrze półleżącym powodując wzrost pożądania substancji uzależniającej[43][49].Zwierzęta u których układ dopaminowy w polu brzusznym nakrywki został inaktywowany nie szukają jedzenia i zostawione same sobie głodują aż do śmierci, ale jeśli jedzenie zostanie umieszczone w ich ustach zjedzą je i wykazują ekspresję wskazującą na odczuwaną przyjemność[52].
Poza układem nerwowym
[edytuj|edytuj kod]Dopamina nie przekraczabariery krew-mózg,więc jej synteza i funkcje w obszarach peryferyjnych są w znacznym stopniu niezależne od syntezy i działania w mózgu[12].Znaczna ilość dopaminy krąży we krwi, ale jej funkcje nie są do końca znane[13].Poziom dopaminy w osoczu krwi jest porównywalny do poziomuadrenaliny,ale u ludzi ponad 95% dopaminy w osoczu jest w formie siarczanu dopaminy, połączenia tworzonego przez sulfotransferazę 1A3/A4[13].Znaczna część siarczanu dopaminy jest produkowana wkrezceotaczającej częściukładu trawiennego[13].Jej produkcja jest uważana za mechanizm detoksykujący dopaminę spożytą z jedzenia lub wytworzoną w procesach trawiennych – poziom w osoczu zwykle rośnie ponad pięćdziesięciokrotnie po posiłku[13].Siarczan dopaminy nie posiada żadnej znanej funkcji biologicznej i jest wydalany z moczem[13].
Małe ilości wolnej dopaminy we krwi mogą być wytworzone przezwspółczulny układ nerwowy,układ trawienny lub możliwie inne narządy[13].Może ona działać na receptory dopaminowe w tkankach peryferyjnych, być metabolizowana lub przekształcana donoradrenalinyprzez enzymhydroksylazę dopaminową,który jest uwalniany do krwi przezrdzeń nadnerczy[13].Niektóre receptory dopaminowe są umieszczone w ścianie tętnic, gdzie działająwazodylatacyjniei jako inhibitory wydzielania noradrenaliny[53].Te odpowiedzi mogą być aktywowane przez dopaminę uwalnianą zkłębka szyjnegow odpowiedzi na niski poziom tlenu. Nie wiadomo czy receptory dopaminowe w tętnicach pełnią inne funkcje biologiczne[53].
W układzie immunologicznym dopamina działa poprzez receptory obecne na komórkach odpornościowych, zwłaszczalimfocytach[54].Dodatkowo, dopamina może być syntezowana i uwalniana w samych komórkach immunologicznych[54].Główny jej efekt na limfocyty polega na zmniejszeniu ich aktywności. Znaczenie tej funkcji nie jest do końca znane, ale podejrzewa się możliwe interakcje pomiędzy układem nerwowym, a immunologicznym, co może być przyczyną niektórychchorób autoimmunologicznych[55].
Nerkowy układ dopaminergiczny zlokalizowany jest w komórkachnefronóww nerce, gdzie obecne są wszystkie podtypy receptorów dopaminowych[56].Dopamina jest syntetyzowana w komórkach kanalików i wydzielana domoczu pierwotnego.Jej działanie obejmuje zwiększenie ukrwienia nerek, zwiększającfiltrację kłębuszkowąi wydzielanie sodu do moczu. Stąd upośledzenie działania tego systemu może doprowadzić do retencji sodu i rozwojunadciśnienia.Zaburzenia wydzielania dopaminy mogą też skutkowaćobrzękamii powstaniemstresu oksydacyjnego[57].Przyczyną zaburzeń działania tego systemu mogą być czynniki genetyczne lub wysokie ciśnienie krwi[58].
Wtrzustce,jej egzokrynowa część wydziela dodwunastnicyenzymy trawienne, a także inne substancje włączając w to dopaminę[59].Przypuszcza się, że jej funkcja polega na ochronie błony śluzowej jelit od uszkodzeń, a także na zmniejszeniu motoryki przewodu pokarmowego[59].
Wyspy trzustkowestanowią endokrynową część trzustki, które syntetyzują i wydzielają hormony do krwiobiegu[59].Komórki betaw wyspach syntetyzująceinsulinęzawierają receptory dopaminowe, których aktywacja zmniejsza ilość wydzielanej insuliny[59].Źródło dopaminy w trzustce nie jest znane – może pochodzić z przepływającej krwi albo może być syntetyzowana miejscowo przez inne typy komórek trzustki[59].
Użycie medyczne
[edytuj|edytuj kod]Dopamina jest także stosowana jako lek, w postaci kroplówek, w zapobieganiu ostrej niewydolności nerek (zwiększa perfuzję nerkową), a w większych dawkach podwyższa ciśnienie tętnicze i działa dodatnio na siłę skurczu mięśnia sercowego i z tego względu jest stosowana wewstrząsie septycznym,kardiogennym,pourazowym,po operacjach kardiochirurgicznych oraz w zaostrzeniu przewlekłej niewydolności krążenia. Na układ krążenia działa w sposób złożony. Przez swoiste receptory D1już w małych dawkach rozszerza naczynia (głównie nerkowe – korzystny efekt w leczeniu wstrząsu hipowolemicznego i kardiogennego). W większych dawkach działa przez receptory β1-adrenergiczne na czynność serca. Największe dawki (powyżej 10 μg/kg m.c./min.) pobudzają receptory α1-adrenergiczne prowadząc do skurczu naczyń krwionośnych i zwiększenia oporów obwodowych. Dożylnie najczęściej stosuje się dopaminę w leczeniu niektórych postaci i faz wstrząsów w dawce 2–5 μg/kg m.c./min. Nie przekraczabariery krew-mózg,dlatego nie można wywołać uczucia euforii poprzez bezpośrednie podanie dopaminy (głównie dlatego wparkinsonizmiestosuje sięlewodopę).
Patofizjologia
[edytuj|edytuj kod]Dopamina pełni ważną rolę w przebiegu niektórych chorób, między innymi choroby Parkinsona, schizofrenii, oraz w uzależnieniach i ADHD.
Choroba Parkinsona
[edytuj|edytuj kod]Choroba Parkinsonato zaburzenie charakteryzujące się między innymi sztywnością mięśni, spowolnieniem ruchów i drżeniem kończyn w stanie spoczynku. W późniejszym stadium prowadzi dodemencjii ostatecznie śmierci. Główne objawy są spowodowane niedoborem dopaminy. Przyczyną jej braku jest obumarcie komórek ją wydzielających wistocie czarnej śródmózgowia.Są one szczególnie podatne na uszkodzenia. Czynnikami ich zniszczenia mogą być częstewstrząśnienia mózgu,zapalenie mózgulub zatrucia niektórymi substancjami. Prowadzi to do parkinsonizmu, czyli zespołu objawów choroby Parkinsona. W istocie jednak większość przypadków choroby Parkinsona jestidiopatyczna,co oznacza, że nie jest znana przyczyna śmierci komórek.
Najbardziej powszechnym leczeniem parkinsonizmu jest podawanie lewodopy, będącej metabolicznymprekursoremdopaminy. Nie powoduje to odzyskania utraconych komórek, ale pobudza pozostałe do produkcji większej ilości dopaminy, dzięki czemu rekompensuje to ich ubytek. W zaawansowanym stadium rozwoju choroby leczenie przestaje działać, ponieważ utrata komórek jest na tyle duża, że pozostałe komórki nie nadążają z produkcją dopaminy pomimo podawania lewodopy. Na tym etapie mechanizmy regulującemetabolizmw tych komórkach pracując ponad normę stają się nieregularne prowadząc dozespołu dysregulacji dopaminowej,który powoduje naprzemienne stany hiperaktywności iparaliżu[60].
ADHD
[edytuj|edytuj kod]Jedną z przyczynADHDsą zaburzenia w układzie dopaminergicznym i nieprawidłowe działanie receptorów i transporterów dopaminy[61]Najbardziej efektywne środki do leczenia ADHD tostymulanty(np.metylofenidat,amfetamina), których działanie opiera się na podniesieniu poziomu dopaminy w mózgu[62].
Uzależnienia
[edytuj|edytuj kod]Różne środki uzależniające powodują wzrost aktywności układu dopaminergicznego. Przy kokainie,metamfetaminiei podobnych stymulantach zwiększenie aktywności układu dopaminergicznego wydaje się być głównym powodem uzależnienia. Kiedy wzrasta poziom dopaminy na jakiś czas, zmniejsza się wrażliwość receptorów dopaminowych. W konsekwencji potrzebna jest zwiększona dawka substancji, aby osiągnąć ten sam efekt, aukład nagrodyw mózgu jest mniej aktywny niż zazwyczaj w przypadku odstąpienia od zażywania tej substancji. Mechanizm ten powoduje u osób uzależnionych stałe zwiększanie dawek, aby zaspokoić potrzeby organizmu.
Potencjałuzależniającystymulantów silnie zależy od wzrostu poziomu dopaminy, jaki powodują, a szczególnie od szybkości, z jaką działają. Najbardziej uzależniające substancje, w tymkokainaw formiecrack,podnoszą poziom dopaminy w ciągu kilku sekund od zażycia. W ich przypadku wystarczy tylko kilka dawek, aby wystąpiły objawy uzależnienia u niektórych ludzi.
Leczenie uzależnienia od stymulantów jest ciężkie, ponieważ nawet w przypadku niezażywania substancji potrzeba długiego czasu, aby zmalała chęć do jej zażycia – a nawet jeśli już zniknęła, to może niespodziewanie powrócić, gdy dana osoba znajdzie się w sytuacji związanej z braniem substancji psychoaktywnych.
Ból
[edytuj|edytuj kod]Dopamina odgrywa rolę w przetwarzaniu bólu na wielu poziomach ośrodkowego układu nerwowego, do których zalicza się:rdzeń kręgowy,istota szara okołowodociągowa,wzgórze,jądra podstawne,zakręt obręczy.Anomalie w neurotransmisji dopaminy wykazane zostały w bolesnych chorobach takich jakfibromialgia,zespół niespokojnych nógizespół piekących ust[63].Przeciwbólowe właściwości dopaminy są wynikiem aktywacji receptora dopaminowego D2;wyjątkiem od tego jest istota szara okołowodociągowa, w której aktywacja receptora dopaminowego D1osłabia ból prawdopodobnie poprzez aktywacjęneuronówodpowiedzialnych za inhibicję przekazywania impulsów bólu[64].
Nudności
[edytuj|edytuj kod]Nudności i wymioty są związane z aktywacją strefy chemoreceptorowej wpniu mózgu.W miejscu tym znajduje się duża ilość receptorów dopaminowych D2.W związku z tym substancje aktywujące receptory D2często powodują nudności. Wliczają się do nich leki na chorobę Parkinsona i inneagonistyreceptorów dopaminowych, na przykładapomorfina.W wielu przypadkachantagonistyreceptorów D2,między innymimetoklopramid,są używane jakoleki przeciwwymiotne.
Psychoza
[edytuj|edytuj kod]Anormalnie wysoka neurotransmisja dopaminy związana jest zpsychoząischizofrenią[65].Jakkolwiek badania wiążące schizofrenię z metabolizmem dopaminy w mózgu wahały się od kontrowersyjnych do negatywnych ze względu na ten sam poziomkwasu homowanilinowego(metabolit dopaminy) wpłynie mózgowo-rdzeniowymzarówno dla schizofreników, jak i grupy kontrolnej[66].U niektórych schizofreników odkryta została zwiększona aktywnośćukładu dopaminergicznego,zwłaszcza szlaku mezolimbicznego, a u niektórych zmniejszona szlaku mezokortykalnego.
Leki przeciwpsychotycznesą zwykle antagonistami receptorów dopaminowych, zmniejszając ilość dopaminy w receptorach, a przez to znosząc efekty jej wysokiej ilości. Leki przeciwpsychotyczne pierwszej generacji działają zazwyczaj na receptory D2[67],podczas gdy leki drugiej generacji działają także na receptory D1,D3i D4chociaż ogólnie mają niższe powinowactwo do receptorów dopaminowych[68][69].Kokaina, amfetamina, metamfetamina i podobne substancje, które zwiększają poziom dopaminy ponad dziesięciokrotnie[70],mogą chwilowo spowodować psychozę, co wspiera jej związek z dopaminą[71]– aczkolwiek wiele substancji niewpływających na poziom dopaminy również może wywołać ostrą i chroniczną psychozę.
Depresja
[edytuj|edytuj kod]Dysregulacja układu dopaminergicznego związana jest też zzaburzeniami depresyjnymi[72].U osób z depresją badania wykazały zmniejszoną ilośćtyrozyny– prekursoru dopaminy wosoczu krwiipłynie mózgowo-rdzeniowym[73][74].W innych badaniach u osób z depresją odkryto zmniejszoną ilośćkwasu homowanilinowegobędącym głównym metabolitem dopaminy w płynie mózgowo-rdzeniowym[75].Wykazano, że wieleleków przeciwdepresyjnychzwiększa stężenie dopaminy wkorze przedczołoweju szczurów[76].Podobnieterapia elektrowstrząsowazwiększyła poziom dopaminy wprążkowiuu badanych szczurów[77].
Wykazano niski potencjał przyłączania się dopaminy do receptorów D2u osób cierpiących nafobię społeczną.Uczeni spekulują na temat prawdopodobnej patologicznie niższej aktywności układu dopaminergicznego wobec aktywności układu współczulnego u socjofobów[78][79].
Jedną z przyczynzespołu Tourette’ajest zaburzenie dozowania ilości dopaminy.
Zobacz też
[edytuj|edytuj kod]Przypisy
[edytuj|edytuj kod]- ↑Dopamina, chlorowodorek (nr H8502)– karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑abcDopamine,[w:]DrugBank[online],University of Alberta,DB00988(ang.).
- ↑Dopamine,[w:]PubChem[online],United States National Library of Medicine,CID: 681(ang.).
- ↑Dopamine,[w:] ChemIDplus [online],United States National Library of Medicine[dostęp 2012-08-03](ang.).
- ↑abWojciech Kostowski, Zbigniew S. Herman:Farmakologia – podstawy farmakoterapii: podręcznik dla studentów medycyny i lekarzy.Wyd. 3 poprawione i uzupełnione. Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 1569.ISBN83-200-3352-7.
- ↑Dopamine.PubChem.(ang.).
- ↑catecholamine,[w:]Encyclopædia Britannica[dostęp 2022-09-30](ang.).
- ↑Phenylethylamine.ChemicalLand21.(ang.).
- ↑abcdefgDopamine Hydrochloride.„Analytical Profiles of Drug Substances”. 11, s. 257–272, 1982.(ang.).
- ↑abcdefChapter 1: Historical overview: Introduction to the dopamine receptors. W:The Dopamine Receptors.Springer, 2009, s. 1–22.ISBN1-60327-333-6.(ang.).
- ↑abcdefghChapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines. W:Biochemistry of Biogenic Amines.Springer, 2013, s. 1–35.ISBN1-4684-3171-4.(ang.).
- ↑abcSymptomatic pharmacological therapy in Parkinson’s disease. W:Parkinson’s Disease.London: Royal College of Physicians, 2006, s. 59–100.ISBN1-86016-283-5.(ang.).
- ↑abcdefghijGraemeEisenhofer,Irwin J.Kopin,David S.Goldstein,Catecholamine metabolism: a contemporary view with implications for physiology and medicine,„Pharmacological Reviews”, 56 (3), 2004, s. 331–349,DOI:10.1124/pr.56.3.1,PMID:15317907(ang.).
- ↑F.Amin,M.Davidson,K.L.Davis,Homovanillic acid measurement in clinical research: a review of methodology,„Schizophrenia Bulletin”, 18 (1), 1992, s. 123–148,DOI:10.1093/schbul/18.1.123,PMID:1553492(ang.).
- ↑F.Amini inni,Assessment of the Central Dopaminergic Index of Plasma HVA in Schizophrenia,„Schizophrenia Bulletin”, 21 (1), 1995, s. 53–66,DOI:10.1093/schbul/21.1.53,PMID:7770741(ang.).
- ↑Intraneuronal dopamine-quinone synthesis: a review.„Neurotoxicity Research”. 1 (3), s. 181–195, 2000.DOI:10.1007/BF03033289.PMID:12835101.(ang.).
- ↑IkukoMiyazaki,MasatoAsanuma,Dopaminergic neuron-specific oxidative stress caused by dopamine itself,„Acta Medica Okayama”, 62 (3), 2008, s. 141–150,DOI:10.18926/AMO/30942,PMID:18596830(ang.).
- ↑Dopamine: Biological activity.International Union of Basic and Clinical Pharmacology.(ang.).
- ↑abcdDavid K.Grandy,Gregory M.Miller,Jun-XuLi,„TAARgeting Addiction” --The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference,„Drug and Alcohol Dependence”, 159, 2016, s. 9–16,DOI:10.1016/j.drugalcdep.2015.11.014,PMID:26644139,PMCID:PMC4724540(ang.).
- ↑abcdChapter 6: Dopamine receptor signalling: intracellular pathways to behavior. W:The Dopamine Receptors.Springer, 2009, s. 137–174.ISBN1-60327-333-6.(ang.).
- ↑abLee E.Eideni inni,The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine,„Pflugers Archiv: European Journal of Physiology”, 447 (5), 2004, s. 636–640,DOI:10.1007/s00424-003-1100-5,PMID:12827358(ang.).
- ↑Gregory M.Miller,The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity,„Journal of Neurochemistry”, 116 (2), 2011, s. 164–176,DOI:10.1111/j.1471-4159.2010.07109.x,PMID:21073468,PMCID:PMC3005101(ang.).
- ↑abJean-MartinBeaulieu,Raul R.Gainetdinov,The physiology, signaling, and pharmacology of dopamine receptors,„Pharmacological Reviews”, 63 (1), 2011, s. 182–217,DOI:10.1124/pr.110.002642,PMID:21303898(ang.).
- ↑Gonzalo E.Torres,Raul R.Gainetdinov,Marc G.Caron,Plasma membrane monoamine transporters: structure, regulation and function,„Nature Reviews. Neuroscience”, 4 (1), 2003, s. 13–25,DOI:10.1038/nrn1008,PMID:12511858(ang.).
- ↑abcdM.E.Rice,J.C.Patel,S.J.Cragg,Dopamine release in the basal ganglia,„Neuroscience”, 198, 2011, s. 112–137,DOI:10.1016/j.neuroscience.2011.08.066,PMID:21939738,PMCID:PMC3357127(ang.).
- ↑WolframSchultz,Multiple dopamine functions at different time courses,„Annual Review of Neuroscience”, 30, 2007, s. 259–288,DOI:10.1146/annurev.neuro.28.061604.135722,PMID:17600522(ang.).
- ↑abcdefghAndersBjörklund,Stephen B.Dunnett,Dopamine neuron systems in the brain: an update,„Trends in Neurosciences”, 30 (5), 2007, s. 194–202,DOI:10.1016/j.tins.2007.03.006,PMID:17408759(ang.).
- ↑abA. Dahlström, K. Fuxe.Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons.„Acta Physiologica Scandinavica”. 62 (Suppl. 232), s. 1–55, 1964.PMID:14229500.(ang.).
- ↑abcChapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin. W:Molecular Neuropharmacology: A Foundation for Clinical Neuroscience.Wyd. 2nd. New York: McGraw-Hill Medical, 2009, s.147–148, 154–157.ISBN0-07-148127-3.(ang.).
- ↑Chadwick W.Christine,Michael J.Aminoff,Clinical differentiation of parkinsonian syndromes: prognostic and therapeutic relevance,„The American Journal of Medicine”, 117 (6), 2004, s. 412–419,DOI:10.1016/j.amjmed.2004.03.032,PMID:15380498(ang.).
- ↑abDopamine and the spinal cord in restless legs syndrome: does spinal cord physiology reveal a basis for augmentation?.„Sleep Medicine Reviews”. 10 (3), s. 185–196, 2006.DOI:10.1016/j.smrv.2006.01.004.PMID:16762808.(ang.).
- ↑abcdefN.Ben-Jonathan,R.Hnasko,Dopamine as a prolactin (PRL) inhibitor,„Endocrine Reviews”, 22 (6), 2001, s. 724–763,DOI:10.1210/edrv.22.6.0451,PMID:11739329(ang.).
- ↑abcdPaulWitkovsky,Dopamine and retinal function,„Documenta Ophthalmologica. Advances in Ophthalmology”, 108 (1), 2004, s. 17–40,DOI:10.1023/B:DOOP.0000019487.88486.0a,PMID:15104164(ang.).
- ↑Basal Ganglia and the Striatal Motor System. W:Neuroanatomy (Board Review Series).Wyd. 4th. Baltimore: Wulters Kluwer & Lippincott Wiliams & Wilkins, 2008, s.274–281.ISBN0-7817-7245-1.(ang.).
- ↑abcdefV.S.Chakravarthy,DennyJoseph,Raju S.Bapi,What do the basal ganglia do? A modeling perspective,„Biological Cybernetics”, 103 (3), 2010, s. 237–253,DOI:10.1007/s00422-010-0401-y,PMID:20644953(ang.).
- ↑abcW ten sposób jądra podstawne są odpowiedzialne za rozpoczęcie ruchu, ale nie determinują w szczegółach jak zostanie on wykonanyStan B.Floresco,The nucleus accumbens: an interface between cognition, emotion, and action,„Annual Review of Psychology”, 66, 2015, s. 25–52,DOI:10.1146/annurev-psych-010213-115159,PMID:25251489(ang.).
- ↑abBernard WBalleinei inni,Hierarchical control of goal-directed action in the cortical–basal ganglia network,„Current Opinion in Behavioral Sciences”, 5, 2015, s. 1–7,DOI:10.1016/j.cobeha.2015.06.001(ang.).
- ↑J.Jankovic,Parkinson’s disease: clinical features and diagnosis,„Journal of Neurology, Neurosurgery, and Psychiatry”, 79 (4), 2008, s. 368–376,DOI:10.1136/jnnp.2007.131045,PMID:18344392(ang.).
- ↑TommyPattij,Louk J.M.J.Vanderschuren,The neuropharmacology of impulsive behaviour,„Trends in Pharmacological Sciences”, 29 (4), 2008, s. 192–199,DOI:10.1016/j.tips.2008.01.002,PMID:18304658.
- ↑abcdefghijkWolframSchultz,Neuronal Reward and Decision Signals: From Theories to Data,„Physiological Reviews”, 95 (3), 2015, s. 853–951,DOI:10.1152/physrev.00023.2014,PMID:26109341,PMCID:PMC4491543[dostęp 2015-09-24],Cytat: Rewards are crucial objects that induce learning, approach behavior, choices, and emotions. Whereas emotions are difficult to investigate in animals, the learning function is mediated by neuronal reward prediction error signals which implement basic constructs of reinforcement learning theory. These signals are found in dopamine neurons, which emit a global reward signal to striatum and frontal cortex, and in specific neurons in triatum, amygdala, and frontal cortex projecting to select neuronal populations... FIGURE 12. Reward components inducing the two phasic dopamine response components. The initial component (blue) detects the event before having identified its value. It increases with sensory impact (physical salience), novelty (novelty/surprise salience), generalization to rewarded stimuli, and reward context. This component is coded as temporal event prediction error (389). The second component (red) codes reward value (as reward prediction error)... The salience of rewards derives from three principal factors, namely, their physical intensity and impact (physical salience), their novelty and surprise (novelty/surprise salience), and their general motivational impact shared with punishers (motivational salience). A separate form not included in this scheme, incentive salience, primarily addresses dopamine function in addiction and refers only to approach behavior (as opposed to learning)(ang.).
- ↑abcT.E.Robinson,K.C.Berridge,The neural basis of drug craving: an incentive-sensitization theory of addiction,„Brain Research. Brain Research Reviews”, 18 (3), 1993, s. 247–291,DOI:10.1016/0165-0173(93)90013-p,PMID:8401595(ang.).
- ↑Jason S.Wright,JaakPanksepp,An Evolutionary Framework to Understand Foraging, Wanting, and Desire: The Neuropsychology of the SEEKING System,„Neuropsychoanalysis”, 14 (1), 2012, s. 5–39,DOI:10.1080/15294145.2012.10773683(ang.).
- ↑abcdefMolecular Neuropharmacology: A Foundation for Clinical Neuroscience.Wyd. 2nd. New York: McGraw-Hill Medical, 2009, s.147–148, 366–367, 375–376.ISBN978-0-07-148127-4.Cytat: VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience ( “wanting” ) on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards....
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner....
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc.... If motivational drive is described in terms of wanting, and hedonic evaluation in terms of liking, it appears that wanting can be dissociated from liking and that dopamine may influence these phenomena differently. Differences between wanting and liking are confirmed in reports by human addicts, who state that their desire for drugs (wanting) increases with continued use even when pleasure (liking) decreases because of tolerance..(ang.). - ↑abKent C.Berridge,Terry E.Robinson,J. WayneAldridge,Dissecting components of reward: ‘liking’, ‘wanting’, and learning,„Current Opinion in Pharmacology”, 9 (1), 2009, s. 65–73,DOI:10.1016/j.coph.2008.12.014,PMID:19162544,PMCID:PMC2756052,Cytat: Conversely, amplification of ‘wanting’ without ‘liking’ has been produced by the activation of dopamine systems by amphetamine or similar catecholamine-activating drugs given systemically or microinjected directly into the nucleus accumbens, or by genetic mutation that raises extracellular levels of dopamine (via knockdown of dopamine transporters in the synapse) in mesocorticolimbic circuits, and by the near-permanent sensitization of mesocorticolimbic-dopamine-related systems by repeated administration of high-doses of addictive drugs (Figure 3–Figure 5) [39•,40•,61•,66]. We have proposed that in susceptible individuals the neural sensitization of incentive salience by drugs of abuse may generate compulsive ‘wanting’ to take more drugs, whether or not the same drugs are correspondingly ‘liked’, and thus contribute to addiction [39•,40•,42] (Figure 5).(ang.).
- ↑Ethan S.Bromberg-Martin,MasayukiMatsumoto,OkihideHikosaka,Dopamine in motivational control: rewarding, aversive, and alerting,„Neuron”, 68 (5), 2010, s. 815–834,DOI:10.1016/j.neuron.2010.11.022,PMID:21144997,PMCID:PMC3032992(ang.).
- ↑L.M.Yageri inni,The ins and outs of the striatum: role in drug addiction,„Neuroscience”, 301, 2015, s. 529–541,DOI:10.1016/j.neuroscience.2015.06.033,PMID:26116518,PMCID:PMC4523218(ang.).
- ↑abMichael P.Saddorisi inni,Differential Dopamine Release Dynamics in the Nucleus Accumbens Core and Shell Reveal Complementary Signals for Error Prediction and Incentive Motivation,„The Journal of Neuroscience: The Official Journal of the Society for Neuroscience”, 35 (33), 2015, s. 11572–11582,DOI:10.1523/JNEUROSCI.2344-15.2015,PMID:26290234,PMCID:PMC4540796,Cytat: Here, we have found that real-time dopamine release within the nucleus accumbens (a primary target of midbrain dopamine neurons) strikingly varies between core and shell subregions. In the core, dopamine dynamics are consistent with learning-based theories (such as reward prediction error) whereas in the shell, dopamine is consistent with motivation-based theories (e.g., incentive salience).(ang.).
- ↑Kent C.Berridge,Morten L.Kringelbach,Pleasure systems in the brain,„Neuron”, 86 (3), 2015, s. 646–664,DOI:10.1016/j.neuron.2015.02.018,PMID:25950633,PMCID:PMC4425246(ang.).
- ↑abR.A.Wise,Addictive drugs and brain stimulation reward,„Annual Review of Neuroscience”, 19, 1996, s. 319–340,DOI:10.1146/annurev.ne.19.030196.001535,PMID:8833446(ang.).
- ↑Roy A.Wise,Dopamine and reward: the anhedonia hypothesis 30 years on,„Neurotoxicity Research”, 14 (2–3), 2008, s. 169–183,DOI:10.1007/BF03033808,PMID:19073424,PMCID:PMC3155128(ang.).
- ↑OscarArias-Carrión,ErnstPŏppel,Dopamine, learning, and reward-seeking behavior,„Acta Neurobiologiae Experimentalis”, 67 (4), 2007, s. 481–488,PMID:18320725(ang.).
- ↑J.D.Salamonei inni,Nucleus accumbens dopamine and the regulation of effort in food-seeking behavior: implications for studies of natural motivation, psychiatry, and drug abuse,„The Journal of Pharmacology and Experimental Therapeutics”, 305 (1), 2003, s. 1–8,DOI:10.1124/jpet.102.035063,PMID:12649346(ang.).
- ↑abC.Missalei inni,Dopamine receptors: from structure to function,„Physiological Reviews”, 78 (1), 1998, s. 189–225,DOI:10.1152/physrev.1998.78.1.189,PMID:9457173(ang.).
- ↑abFrancesca R.Buttarellii inni,The dopaminergic system in peripheral blood lymphocytes: from physiology to pharmacology and potential applications to neuropsychiatric disorders,„Current Neuropharmacology”, 9 (2), 2011, s. 278–288,DOI:10.2174/157015911795596612,PMID:22131937,PMCID:PMC3131719(ang.).
- ↑ChandraniSarkari inni,The immunoregulatory role of dopamine: an update,„Brain, Behavior, and Immunity”, 24 (4), 2010, s. 525–528,DOI:10.1016/j.bbi.2009.10.015,PMID:19896530,PMCID:PMC2856781(ang.).
- ↑TahirHussain,Mustafa F.Lokhandwala,Renal dopamine receptors and hypertension,„Experimental Biology and Medicine”, 228 (2), 2003, s. 134–142,DOI:10.1177/153537020322800202,PMID:12563019(ang.).
- ↑Marcelo RobertoChoii inni,Renal dopaminergic system: Pathophysiological implications and clinical perspectives,„World Journal of Nephrology”, 4 (2), 2015, s. 196–212,DOI:10.5527/wjn.v4.i2.196,PMID:25949933,PMCID:PMC4419129[dostęp 2016-01-15](ang.).
- ↑R.M.Carey,Theodore Cooper Lecture: Renal dopamine system: paracrine regulator of sodium homeostasis and blood pressure,„Hypertension”, 38 (3), 2001, s. 297–302,DOI:10.1161/hy0901.096422,PMID:11566894(ang.).
- ↑abcdeBlancaRubí,PierreMaechler,Minireview: new roles for peripheral dopamine on metabolic control and tumor growth: let’s seek the balance,„Endocrinology”, 151 (12), 2010, s. 5570–5581,DOI:10.1210/en.2010-0745,PMID:21047943(ang.).
- ↑Merims D, Giladi N.Dopamine dysregulation syndrome, addiction and behavioral changes in Parkinson’s disease.„Parkinsonism & Related Disorders”. 14 (4), s. 273–280, 2008.DOI:10.1016/j.parkreldis.2007.09.007.PMID:17988927.
- ↑JingWui inni,Role of dopamine receptors in ADHD: a systematic meta-analysis,„Molecular Neurobiology”, 45 (3), 2012, s. 605–620,DOI:10.1007/s12035-012-8278-5,PMID:22610946.
- ↑Craig W.Berridge,David M.Devilbiss,Psychostimulants as cognitive enhancers: the prefrontal cortex, catecholamines, and attention-deficit/hyperactivity disorder,„Biological Psychiatry”, 69 (12), 2011, e101–111,DOI:10.1016/j.biopsych.2010.06.023,PMID:20875636,PMCID:PMC3012746.
- ↑S.K.Jääskeläineni inni,Role of the dopaminergic system in chronic pain – a fluorodopa-PET study,„Pain”, 90 (3), 2001, s. 257–260,DOI:10.1016/S0304-3959(00)00409-7,PMID:11207397.
- ↑Patrick B.Wood,Role of central dopamine in pain and analgesia,„Expert Review of Neurotherapeutics”, 8 (5), 2008, s. 781–797,DOI:10.1586/14737175.8.5.781,PMID:18457535.
- ↑Disruption of gene interaction linked to schizophrenia.St. Jude Children’s Research Hospital. [dostęp 2006-07-06].(ang.).
- ↑J.W.Maasi inni,Schizophrenia, Psychosis, and Cerebral Spinal Fluid Homovanillic Acid Concentrations,„Schizophrenia Bulletin”, 23 (1), 1997, s. 147–154,DOI:10.1093/schbul/23.1.147,PMID:9050120(ang.).
- ↑Dopamine Receptor Blockade: Antipsychotic Drugs[online], williams.edu[dostęp 2017-11-22].
- ↑Dopamine and antipsychotic drug action revisited | The British Journal of Psychiatry[online], bjp.rcpsych.org[dostęp 2017-11-22](ang.).
- ↑M.J.Durcani inni,Is clozapine selective for the dopamine D4 receptor?,„Life Sciences”, 57 (18), 1995, PL275–283,DOI:10.1016/0024-3205(95)02151-8,PMID:7475902(ang.).
- ↑Methamphetamine 101.
- ↑J.A.Lieberman,J.M.Kane,J.Alvir,Provocative tests with psychostimulant drugs in schizophrenia,„Psychopharmacology”, 91 (4), 1987, s. 415–433,DOI:10.1007/BF00216006,PMID:2884687(ang.).
- ↑Varsha J.Galani,Digvijay G.Rana,Depression and antidepressants with dopamine hypothesis-A review,„International Journal of Pharmaceutical Frontier Research”, 1 (2), 2011, s. 45–60(ang.).
- ↑O.Benkerti inni,Altered tyrosine daytime plasma levels in endogenous depressive patients,„Archives of General Psychiatry”,25 (4), 1971, s. 359–363,DOI:10.1001/archpsyc.1971.01750160071013,PMID:5116991(ang.).
- ↑W Birkmayer, Linauer W, Storung D.Tyrosin and tryptophan- metabolisms in depression patients.„Arch Psychiar Nervenkr”. 213, s. 377–387, 1970.(ang.).
- ↑M.B.Bowers,G.R.Heninger,F.Gerbode,Cerebrospinal fluid 5-hydroxyindoleacetic acid and homovanillic acid in psychiatric patients,„International Journal of Neuropharmacology”, 8 (3), 1969, s. 255–262,DOI:10.1016/0028-3908(69)90046-x(ang.).
- ↑Jeffrey N.Carlsoni inni,Chronic antidepressant drug treatment reduces turning behavior and increases dopamine levels in the medial prefrontal cortex,„Brain Research”, 707 (1), 1996, s. 122–126,DOI:10.1016/0006-8993(95)01341-5(ang.).
- ↑G.G.Nomikosi inni,Acute effects of bupropion on extracellular dopamine concentrations in rat striatum and nucleus accumbens studied by in vivo microdialysis,„Neuropsychopharmacology”, 2 (4), 1989, s. 273–279,PMID:2482026(ang.).
- ↑Artykuł grupy psychiatrów amerykańskich na temat potencjału przyłączania się dopaminy do receptorów D2https://ajp.psychiatryonline.org/doi/full/10.1176/appi.ajp.157.3.457
- ↑F.R.Schneieri inni,Low dopamine D(2) receptor binding potential in social phobia,„The American Journal of Psychiatry”,157 (3), 2000, s. 457–459,DOI:10.1176/appi.ajp.157.3.457,PMID:10698826.